腹膜透析相关性腹膜炎的致病菌及药敏试验分析*
刘 静,高玉伟,王兴华,胡秀红,崔红蕊,徐保振,杨洪娟,王 涛
河北医科大学第一医院肾内科,河北石家庄 050030
2023年2月WANG等[1]研究表明,2009-2010年我国慢性肾脏病(CKD)患病率为10.8%,2018-2019年CKD患病率为8.2%,农村和城市地区CKD患病率分别为8.6%和7.9%;成人CKD患者达8 200万人,其中CKD 4~5期患病率达1.8%[2]。虽然CKD患病率较10年前有所下降,但每年约有2%的患者进入终末期肾脏病(ESKD),大多数ESKD患者需接受肾脏替代治疗,包括血液透析(HD)和腹膜透析(PD)。与HD比较,PD能够缓慢、持续地清除患者体内过多的液体和毒素,可降低血流动力学不稳定的风险,延缓残余肾的功能,还可降低肝炎、梅毒、艾滋病等传染病发生风险。近年来,接受PD治疗的患者日益增加,据中国研究数据服务平台统计,2021年我国PD患者数已超过12.6万例,新增患者数达23 699例[3]。腹膜透析相关性腹膜炎(PDAP)是PD患者最常见的严重并发症,不仅可增加患者痛苦,还是导致患者PD技术失败、永久性转HD及死亡的重要原因之一,防治PDAP对降低发病率和病死率至关重要。国际腹膜透析协会(ISPD)于2022年发布了新版腹膜炎防治指南[4],腹膜炎的发生风险每年不超过0.40次,单位时间内无腹膜炎的患者百分比应>80%,国内大型PD中心的腹膜炎发生率为0.175~0.198次/患者年[5],《中国腹膜透析管理现状白皮书》[2]指出,仍有近1/4的医院没有掌握腹膜炎并发症的治疗及处理方法,亟待进一步提高。本研究对本院2017年1月至2023年2月发生PDAP的69例患者的临床资料进行回顾性分析,探讨其致病菌及预后转归情况,以期为后续防治PDAP提供依据,现报道如下。
1 资料与方法
1.1一般资料 回顾性选取2017年1月至2023年2月本院收治的69例PDAP患者的临床资料,其中男44例(63.77%),女25例(36.23%);平均年龄(51.67±23.65)岁;原发病:慢性肾小球肾炎22例(31.88%),糖尿病肾病13例(18.84%),高血压18例(26.09%),多囊肾5例(7.25%),其他11例(15.94%)。本研究经本院医学伦理委员会审核批准(S00203)。参照文献[4]中PDAP定义,PDAP应至少符合以下条件中的2项:(1)患者腹痛和(或)PD透出液浑浊;(2)透出液(留腹时间>2 h)白细胞计数(WBC)>100×106/L,多个核细胞比例>50%;(3)透出液微生物培养阳性。
1.2方法
1.2.1治疗方法 当患者告知有腹膜炎相关症状时,如透出液浑浊、腹痛或发热则收集患者透出液,对透出液进行细胞计数、鉴别、革兰染色和微生物培养。PDAP确诊后应立即予以经验性抗感染治疗[本院初始治疗方案为第1代头孢菌素(头孢唑啉1 g/d)+第3代头孢菌素(头孢他啶1 g/d),覆盖革兰阳性菌和革兰阴性菌,夜间留腹8~12 h,一旦知晓抗菌药物治疗结果和敏感性,及时调整抗菌药物治疗方案,抗菌药物疗程为2~3周]。
1.2.2细菌培养及药敏试验 对疑似感染患者入院时采用无菌技术用一次性注射器抽取透出液标本(留腹时间>2 h)5~10 mL接种于BACT/ALERT®培养瓶,透出液标本采用法国生物梅里埃BacTALERT+3D血培养仪、VITEK 2 Compact全自动微生物分析仪进行细菌鉴定,K-B纸片法进行细菌药敏试验。
1.3腹膜炎相关定义 治愈定义为抗菌药物足疗程治疗后腹膜炎症状完全缓解,透出液WBC<100×106/L,透出液微生物培养阴性。其中经抗菌药物治疗5 d内腹膜炎症状缓解,透出液WBC<100×106/L,定义为早期缓解。治疗失败包括拔管HD过渡、拔管转永久HD及腹膜炎相关死亡。拔管HD过渡定义为因难治性腹膜炎拔管后经临时HD过渡,后重新置管并成功规律PD;拔管转永久HD定义为因难治性腹膜炎拔管后转永久HD;腹膜炎相关死亡定义为患者因活动性腹膜炎死亡或因腹膜炎住院期间死亡或在腹膜炎发生4周内出现的死亡[1]。
1.4统计学处理 采用SPSS19.0统计软件进行数据分析处理。计数资料以例数或百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1PDAP患者病原菌分布情况 对69例患者PD透出液进行培养,共培养出病原菌43例,阳性率为62.32%,43例病原菌中革兰阳性菌23例(53.49%),革兰阴性菌17例(39.53%),真菌3例(6.98%)。革兰阳性菌以表皮葡萄球菌(10例)为主,其次为金黄色葡萄球菌(4例)及溶血性葡萄球菌(3例);革兰阴性菌以大肠埃希菌(7例)为主,其次为铜绿假单胞菌(3例),肺炎克雷伯菌(3例);真菌3例中白色假丝酵母菌、近平滑假丝酵母菌、光滑念珠菌各1例。见图1。
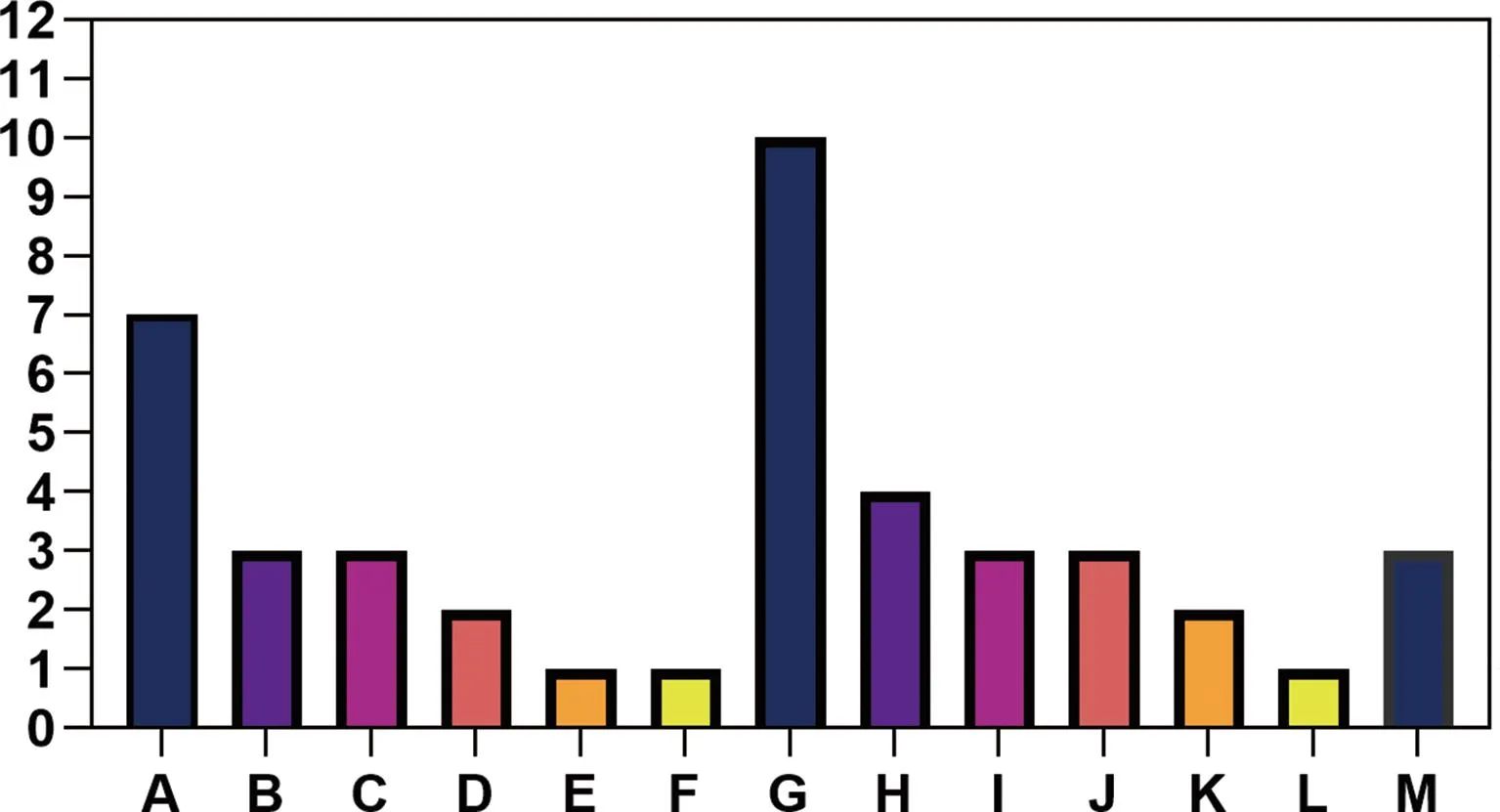
注:A为大肠埃希菌;B为铜绿假单胞菌;C为肺炎克雷伯菌;D为鲍曼不动杆菌;E为枯草芽孢杆菌;F为嗜麦芽窄食单胞菌;G为表皮葡萄球菌;H为金黄色葡萄球菌;I为溶血葡萄球菌;J为唾液链球菌;K为缓症链球菌;L为头状葡萄球菌;M为真菌。
2.2PDAP患者病原菌感染原因 43例病原菌感染原因包括肠道感染18例(41.86%),换液操作不规范11例(25.58%),呼吸道感染8例(18.60%),原因不明6例(13.95%)。
2.3药敏试验结果 革兰阳性菌对万古霉素、利奈唑胺、替加环素、替考拉宁、莫西沙星均敏感,对克林霉素(52.17%)、红霉素(56.52%)、阿莫西林/克拉维酸(60.87%)、青霉素G(78.26%)耐药;革兰阴性菌对美罗培南、亚胺培南、黏菌素均敏感,对阿莫西林/克拉维酸(47.06%)、头孢呋辛(47.06%)、头孢唑啉(52.94%)、氨苄西林(82.35%)耐药。见表1、2。真菌对氟康唑、伏立康唑、两性霉素B和卡泊芬净均敏感。

表1 23株革兰阳性菌药敏试验结果[n(%)]
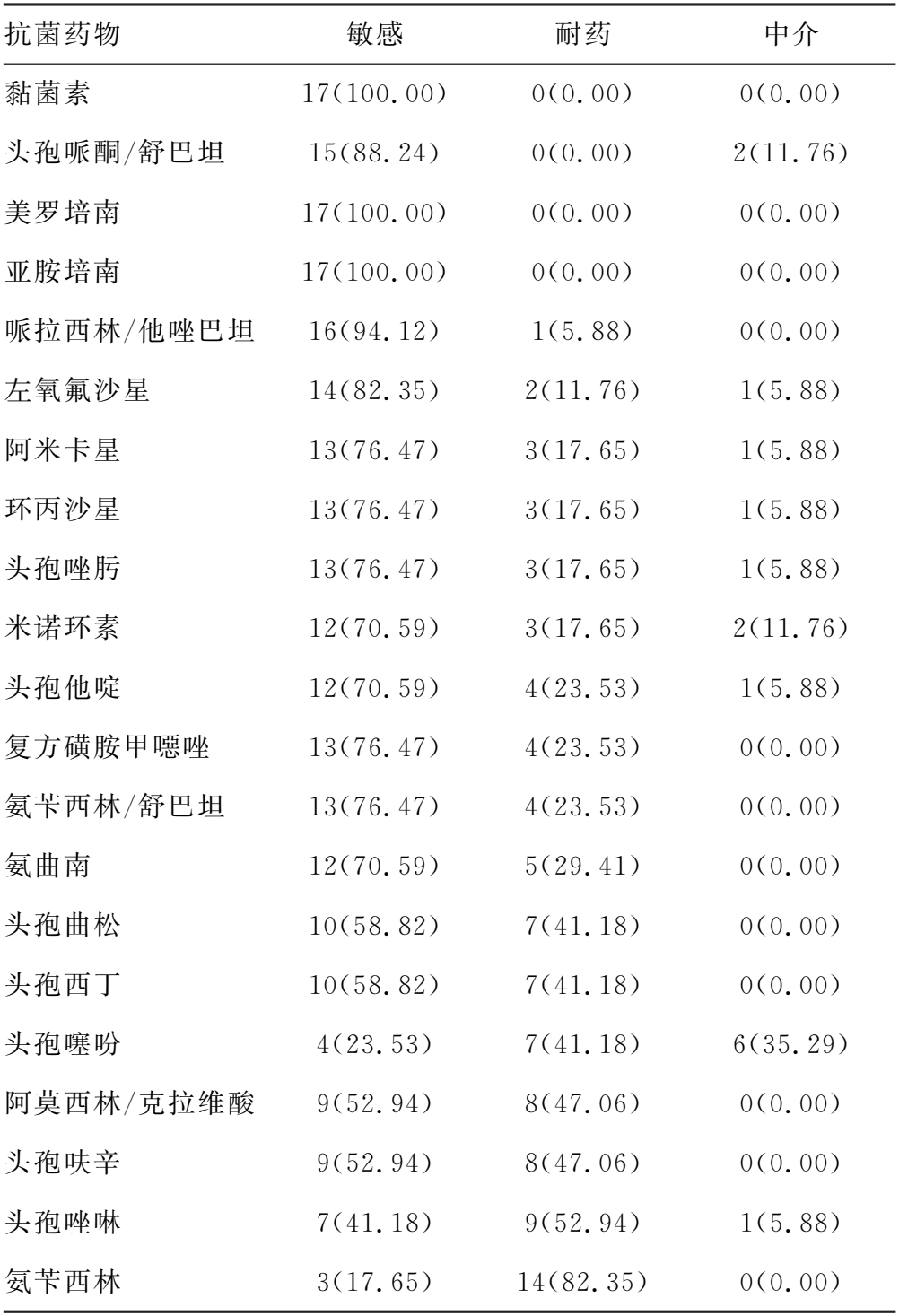
表2 17株革兰阴性菌药敏试验结果[n(%)]
2.4PDAP患者预后情况 69例PDAP患者共治愈53例(76.81%),退出14例(20.29%),死亡2例(2.90%),退出患者均拔管转HD。革兰阳性菌PDAP患者治愈率明显高于真菌性PDAP,差异有统计学意义(P<0.05);革兰阳性菌PDAP患者治愈率与革兰阴性菌和培养阴性PDAP患者比较,差异均无统计学意义(P>0.05)。真菌性PDAP患者退出率明显高于革兰阳性菌、革兰阴性菌及培养阴性的PDAP患者,差异均有统计学意义(P<0.05)。见表3。

表3 不同致病菌引起的PDAP转归比较[n(%)]
3 讨 论
PDAP是PD最常见的并发症之一,是导致PD技术失败、死亡的重要原因之一,目前多项研究提示,PDAP的致病菌以革兰阳性菌为主[6-9],与本研究结果一致,但近年来革兰阴性菌感染率有所上升[10]。刘美君等[11]通过对814例PDAP的多中心回顾性研究显示,近3年来混合菌感染在整体PDAP中的占比较以往升高,合并糖尿病、混合真菌感染或混合铜绿假单胞菌感染是混合菌PDAP治疗失败的独立危险因素,表明在抗菌药物耐药背景下PDAP的临床特点及治疗策略更加复杂。
本研究汇总2017年1月至2023年2月本院69例PDAP患者的病历资料,总体PDAP发生率低于ISPD规定的0.4次/年,细菌培养阳性率为62.32%,低于2022年ISPD要求的80.00%[12],可能与患者居家自行购买抗菌药物有关,导致细菌培养阳性率低于ISPD的要求。本院导致PDAP最常见的致病菌为革兰阳性菌,占53.49%,以表皮葡萄球菌、金黄色葡萄球菌及溶血性葡萄球菌为主,葡萄球菌属占比较高,主要以凝固酶阴性葡萄球菌为主,与HARMANJEET等[13]研究结果一致。葡萄球菌主要存在于皮肤、黏膜表面,通过接触污染,感染途径包括换液操作不戴口罩(或)不洗手、居家环境不合格、换液操作依从性差、聚维酮碘帽重复使用、PD液包装破损、连接管路破损等,加强患者无菌培训可降低PDAP发生率,培训内容包括了解PD基础知识、正确手卫生、无菌换液操作流程、导管出口处的护理、正确识别导管出口处和隧道感染等[14]。有学者指出,对年龄<55岁、教育程度低和PD时间<18个月或>36个月的PD患者进行操作再培训可有效降低PDAP发生率[15]。
本研究中革兰阴性菌占39.53%,以大肠埃希菌为主,主要与胃肠炎、严重便秘等有关,与HSU等[16]研究结果一致。督促患者纠正不良生活习惯、避免不洁饮食、纠正便秘、加强营养、避免滥用抗菌药物等意义重大;近年来,革兰阴性菌所致腹膜炎呈上升趋势(15.0%~47.8%)[17-18],革兰阴性菌腹膜炎所致的透析管拔管率(40.4%)和住院率(62.9%)明显高于革兰阳性菌腹膜炎的19.6%和41.2%,4周内病死率明显增高,分别为21.3%、9.8%[19],应予以高度重视。在革兰阴性菌中鲍曼不动杆菌腹膜炎在PD患者中报道也越来越多,占PDAP总数的2.3%~10.7%[20],原因包括高龄、贫血、低蛋白血症、低钾血症、糖尿病等[21]。随着抗菌药物使用日趋频繁,多重耐药菌和广泛耐药菌比例也明显增加,多重耐药鲍曼不动杆菌感染率也日益增加,给PDAP的治疗带来困难。田秀娟等[22]通过回顾性分析本院10例鲍曼不动杆菌PDAP患者的临床资料发现,鲍曼不动杆菌PDAP多由导管连接系统机械障碍或肠源性感染所致,通过无菌规范操作、随访和积极有效的抗感染治疗可降低PD患者鲍曼不动杆菌腹膜炎发生率和病死率。本研究回顾性分析本院鲍曼不动杆菌感染2例患者的临床资料均为糖尿病肾病患者,存在严重低蛋白血症、贫血、营养不良,并发症较多,发病时剧烈腹痛,透出液明显浑浊,絮状物增多,对抗菌药物治疗反应性差,治疗疗程长,平均3周左右,最终1例拔管,1例死亡。鲍曼不动杆菌腹膜炎患者症状严重,治疗疗程长,拔管率及病死率高,一旦确诊应积极使用碳青霉烯类或第3代头孢菌素类抗菌药物进行抗感染治疗[23],疗效不佳者应尽早拔管。
真菌性腹膜炎相对少见,病死率较高,且治疗方法相对有限,存在更高的死亡风险及更低的治愈率[24],文献[25]报道其发病率为3%~6%,病死率高达20%~30%。2022年ISPD指南推荐在抗菌药物治疗期间使用口服制霉菌素(50万单位,4次/天)或氟康唑(200 mg,每48小时1次)以预防真菌性腹膜炎[4]。低钾血症[26]、低蛋白血症[27]、肠道功能紊乱、肠道菌群失调、肠道微生物跨壁转移[28]是真菌性腹膜炎的危险因素;导管拔除联合抗真菌治疗是真菌性腹膜炎的基础治疗,早期拔除导管可有效改善生存率[29]。有研究提示,在通过革兰染色或培养发现真菌后应立即拔管,不鼓励长期使用抗真菌药物治疗后再评估是否拔管[30]。拔管后持续应用抗真菌药物治疗10 d至2周,等待腹膜症状完全消退后至少2周才能尝试重新置管[31]。本院3例真菌性腹膜炎患者均有抗菌药物使用史,确诊后拔管转HD,并给予抗真菌药物治疗2~3周,预后良好。有研究表明,在PD患者接受抗菌药物治疗的同时加用制霉菌素或氟康唑治疗,有助于降低真菌性腹膜炎发生率[6]。
有研究表明,低蛋白血症、维生素D不足、抑郁、连接方式、低钾血症、抗菌药物使用时间长、操作不当、出口定植和感染、暴露于宠物等是发生腹膜炎可干预的危险因素[32]。PD患者一旦发生PDAP,应尽早开始经验性抗感染治疗,2022年ISPD指南[4]建议:(1)采集到微生物标本后应尽快开展经验性抗感染治疗;(2)抗菌药物的选择应根据医疗机构的实际情况,且覆盖革兰阳性菌和革兰阴性菌;(3)革兰阳性菌感染使用第1代头孢菌素或万古霉素治疗,革兰阴性菌感染使用第3代头孢菌素或氨基糖苷类抗菌药物治疗;(4)头孢吡肟单药治疗可能是一种可接受的经验性抗菌药物治疗方案。本院近5年的初始治疗方案为第1代头孢菌素(头孢唑啉1 g/d)+第3代头孢菌素(头孢他啶1 g/d),覆盖革兰阳性和革兰阴性菌,夜间留腹8~12 h。本研究药敏试验结果显示,革兰阳性菌对头孢唑啉的耐药率达30.43%,对克林霉素(52.17%)、红霉素(56.52%)、阿莫西林/克拉维酸(60.87%)、青霉素G(78.26%)均耐药;对万古霉素、利奈唑胺、替考拉宁、替加环素、莫西沙星均高度敏感,提示本院头孢唑啉已不适合作为治疗革兰阳性菌感染的经验性用药,推荐将万古霉素作为本院革兰阳性菌腹膜炎的经验性用药,但需注意导致耐万古霉素肠球菌的风险。HSU等[16]通过一项前瞻性5年队列研究共分离出254种微生物,其中革兰阳性菌最常见(40.8%),其次是革兰阴性菌(36.0%,大肠埃希菌是最常见的革兰阴性菌),真菌占1.9%,分枝杆菌占1.6%。有效的标准化多学科透析前教育可延长PD患者腹膜炎第一次发作时间,降低腹膜炎发生率,与患者年龄、性别、合并糖尿病、合并高血压、教育状况和PD模式无关,减少腹膜炎的发生和随后的死亡。林建雄等[33]指出,应用持续质量改进能有效降低PD第1年革兰阳性菌腹膜炎发生率,对患者进行规范的培训考核、严密的随访监督和再教育非常重要。正规操作及保持环境卫生是减少腹膜炎发生的重要环节。
综上所述,PDAP是PD严重的并发症之一,与患者病死率相关,近年来,由于抗菌药物的广泛应用,导致耐药菌株逐年增加,细菌谱不断发生变化。为降低PDAP的发生率,需进一步提高PDAP的诊断和治疗能力,加强健康宣教,完善随访、再培训机制,根据细菌培养及药敏试验结果选择敏感、有效的抗菌药物,遵从但不盲从ISPD指南,定期评估医院致病菌谱及初始治疗方案,尽可能减少耐药菌株产生。

