疫苗中铝佐剂含量高效液相色谱检测方法的建立及验证
邵天舒,李潇,李玉立,赵璇,梅婕,何欢,李文东
北京市药品检验研究院国家药品监督管理局创新药物安全研究与评价重点实验室,北京 102206
铝佐剂是目前人类疫苗中应用最为广泛的佐剂,其使用已有80 余年的历史。现行《中国药典》三部(2020版)收载的54个疫苗品种中,有18个含佐剂的疫苗,使用的均为铝佐剂,主要包括氢氧化铝和磷酸铝。铝佐剂通过储存库效应与免疫刺激效应等机制增强疫苗诱导免疫反应的能力[1-5]。但铝佐剂亦存在一定的安全性隐患,包括疼痛、硬结、肿胀等局部不良反应以及导致神经系统损害、引发巨噬细胞肌筋膜炎等潜在风险[6-7]。为此,各国法规均对疫苗中铝含量做出了规定:WHO 推荐的疫苗中铝佐剂含量为不超过1.25 mg/剂;美国FDA批准的疫苗中铝含量均不高于0.85 mg/剂;《欧洲药典》规定为不超过1.25 mg/剂[8];《中国药典》三部(2020 版)各论规定铝含量最高为0.62 mg/剂(甲型肝炎疫苗1.0 mL成人剂量)[9]。
现行《中国药典》收录的含铝佐剂疫苗中铝含量测定均参照通则3106“氢氧化铝(或磷酸铝)测定法”,依据过量的EDTA 与铝离子发生反应,再用锌滴定液滴定剩余的EDTA,根据锌滴定液的消耗量计算出供试品的铝含量[9]。该方法操作步骤多、耗时长,各步骤均需人工操作,无法采用自动化设备替代。滴定终点需肉眼观察颜色变化(由亮黄色变为橙色),变色不明显,且存在颜色随放置而加深的现象,影响实验结果准确性和重现性。此外,该方法对样品的消耗量大,一般需合并5 ~10 剂疫苗,部分铝含量较低的呼吸道病毒疫苗需合并20 剂,特别是在重大传染性疾病发生期间,既消耗了宝贵的疫苗资源,又大大增加了开启样品瓶所需时间,不利于生产企业及批签发检验机构的快速测定,且无法实现单支样品的铝含量测定。
本研究利用金属铝离子(Al3+)与3 个8-羟基喹啉分子可形成金属配合物8-羟基喹啉铝,后者可在激发光380 nm、发射光520 nm 左右波长处产生强烈荧光[10],且在苯基-乙基柱上有所保留的特性,建立了将疫苗样品中的铝胶体经磷酸溶解后,与8-羟基喹啉衍生化反应,再采用高效液相色谱(high performance liquid chromatography,HPLC)测定的方法,并对该方法进行验证,旨在为相关质量标准的提升提供参考。
1 材料与方法
1.1 标准品及样品 铝(Al)单元素标准溶液(批号:20DB184,质量浓度:100 µg/mL)为国家有色金属及电子产品分析测试中心制备;甲型肝炎灭活疫苗(批号分别为202011071、202011072、202011073)、重组乙型肝炎疫苗(批号分别为20211XC24、20211XC25、20210YB50)、吸附无细胞百白破联合疫苗(批号分别为A20201142、A20201143、A20201144)和肠道病毒71 型灭活疫苗(批号分别为202012022、202012023、202012024)分别为国内A、B、C、D企业生产。
1.2 主要试剂及仪器 8-羟基喹啉(分析纯)购自上海Alfa Aesar 公司(批号:10135427);氢氧化铝固体购自美国Sigma-Aldrich 公司(批号:MKCM1237);乙腈(色谱级)购自德国Merck 公司;磷酸、乙酸铵、抗坏血酸均为市售分析纯;岛津20AT 高效液相色谱仪(配备RF20A 型荧光检测器)购自日本岛津公司;苯基-乙基色谱柱[Luna 5u Phenyl-Hexyl(250 mm ×4.6 mm)]购自美国Phenomenex 公司;Milli-Q 型超纯水机购自美国Millipore公司。
1.3 溶液的制备 标准品溶液:分别精密量取铝标准液50、100、200、400、800µL,置聚四氟乙烯离心管中,加超纯水750、700、600、400、0 µL,混匀,制成铝浓度分别为6.25、12.5、25、50、100µg/mL的系列标准品溶液;样品溶液:精密量取各批次样品60µL,置聚四氟乙烯离心管中,加超纯水740 µL,混匀;8-羟基喹啉乙腈溶液:取8-羟基喹啉3 g,加乙腈1 000 mL溶解。
1.4 溶液的前处理 分别向上述装有标准品、样品溶液的离心管中精密加入磷酸溶液(取磷酸6 mL 加水稀释至100 mL)120µL,轻轻振荡混匀,置70 ℃水浴加热1 h,取出放冷至室温。精密量取上述溶液0.1 mL,加入衍生试剂[取0.2 mol/L乙酸铵-8-羟基喹啉乙腈溶液(60∶40)10 mL,加入50%氢氧化钠水溶液30µL,混匀]0.9 mL,混匀后进样。
1.5 色谱条件 采用Luna 5u Phenyl-Hexyl 色谱柱(250 mm×4.6 mm);流动相为0.2 mol/L乙酸铵-8-羟基喹啉乙腈溶液(60∶40),并加入终浓度为20 mg/L的抗坏血酸。荧光检测器激发波长380 nm,发射波长520 nm,流动相流速为1.0 mL/min,柱温40 ℃,进样量50µL,等度洗脱。
1.6 方法的验证
1.6.1 专属性 分别取标准品溶液、样品溶液、PBS缓冲液、本底(未添加铝佐剂疫苗原液)溶液、本底添加标准品溶液,按1.4 项条件进行前处理,再按1.5项色谱条件进样,记录色谱图,验证方法的专属性。
1.6.2 线性范围 取系列标准品溶液,分别按1.5项色谱条件进行检测,以铝元素浓度为横坐标,峰面积为纵坐标绘制标准曲线,进行线性回归,计算相关系数(r)。
1.6.3 准确性 精密称取氢氧化铝固体84.44 mg,置200 mL 量瓶中,加超纯水至刻度,摇匀,作为回收率测定用标准品溶液,按《中国药典》四部(2020 版)通则3106测定其中铝含量为0.107 1 mg/mL。分别精密量取甲型肝炎灭活疫苗(批号:202011071)、重组乙型肝炎疫苗(批号:20211XC24)、吸附无细胞百白破联合疫苗(批号:A20201142)和肠道病毒71型灭活疫苗(批号:202012022)各60 µL,每种疫苗取9 份,按表1 加入低、中、高3 个浓度的回收率测定用标准品溶液(中浓度与样品铝含量水平相当),每个浓度各3 份,并加入超纯水补足体积800µL,按1.5 项色谱条件检测,按下式计算加标样品回收率及相对标准偏差(relative standard deviation,RSD)。

表1 各回收率测试溶液的配制Tab.1 Constitution of recovery test solution
回收率(%)=(铝含量实测值-样品本底含铝量)/加入铝标准品量×100%
1.6.4 重复性 分别取甲型肝炎灭活疫苗(批号:2020-11071)、重组乙型肝炎疫苗(批号:20211XC24)、吸附无细胞百白破联合疫苗(批号:A20201142)和肠道病毒71 型灭活疫苗(批号:202012022)样品各6 份,按1.4项条件进行前处理,再按1.5项色谱条件进样测定,计算铝含量的RSD,验证方法的重复性。
1.6.5 稳定性 分别取甲型肝炎灭活疫苗(批号:2020-11071)、重组乙型肝炎疫苗(批号:20211XC24)、吸附无细胞百白破联合疫苗(批号:A20201142)和肠道病毒71 型灭活疫苗(批号:202012022)样品,按1.4项条件进行前处理后,于室温分别放置0、2、4、6、8 h,按1.5 项色谱条件进样测定,计算铝含量的RSD,验证方法的稳定性。
1.6.6 耐用性 在±5%范围改变流动相中乙酸铵溶液与8-羟基喹啉乙腈溶液的比例,即采用65∶35 和55∶45比例,保持其他条件不变,分别取甲型肝炎灭活疫苗(批号:202011071)、重组乙型肝炎疫苗(批号:20211XC24)、吸附无细胞百白破联合疫苗(批号:A20201142)和肠道病毒71 型灭活疫苗(批号:202012022)测定铝含量,与拟定方法(60∶40 比例)测得结果进行比较。
1.7 方法的初步应用 分别取4 种共12 批次疫苗,每批10 支,混合后采用建立的方法对铝含量进行测定。同时采用《中国药典》三部(2020 版)通则3106的滴定方法进行测定,并比较两种方法的检测结果。另分别取混合前的10 支吸附无细胞百白破联合疫苗(批号:A20201142)及10 支重组乙型肝炎疫苗(批号:20211XC24),采用建立的HPLC 法对单支疫苗的铝含量进行测定。
1.8 数据采集及分析 采用岛津Labsolutions CS 工作站进行数据采集、分析及绘图。
2 结果
2.1 方法的验证
2.1.1 专属性 标准品溶液、样品溶液和本底添加标准品溶液中衍生化产物8-羟基喹啉铝的保留时间均约为14.3 min,无其他色谱峰出现;本底溶液和PBS 缓冲液中均未见色谱峰。见图1。表明该方法专属性良好。
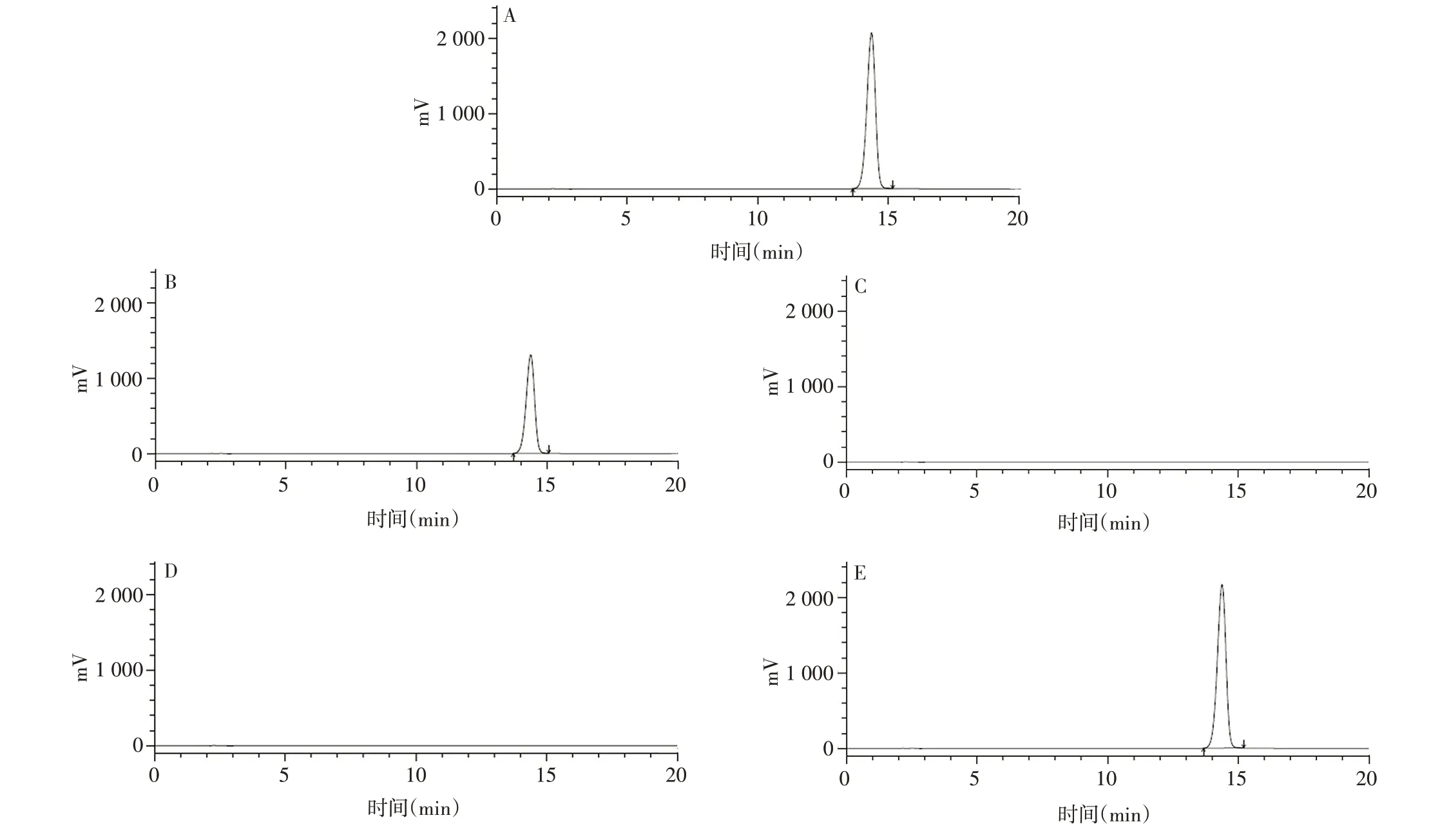
图1 标准品溶液(A)、样品溶液(B)、本底溶液(C)、PBS缓冲液(D)、本底添加标准品溶液(E)的色谱图Fig.1 Chromatograms of standard solution(A),sample solution(B),substrate solution(C),PBS buffer(D),substrate solution spiked with standard(E)
2.1.2 线性范围 铝元素标准品在6.25 ~100µg/mL范围内,回归方程为y=868209x+1883504,r=0.999 6,线性关系良好,见图2。现行药典收载的含铝佐剂疫苗铝含量经适当稀释后均可被该范围覆盖。
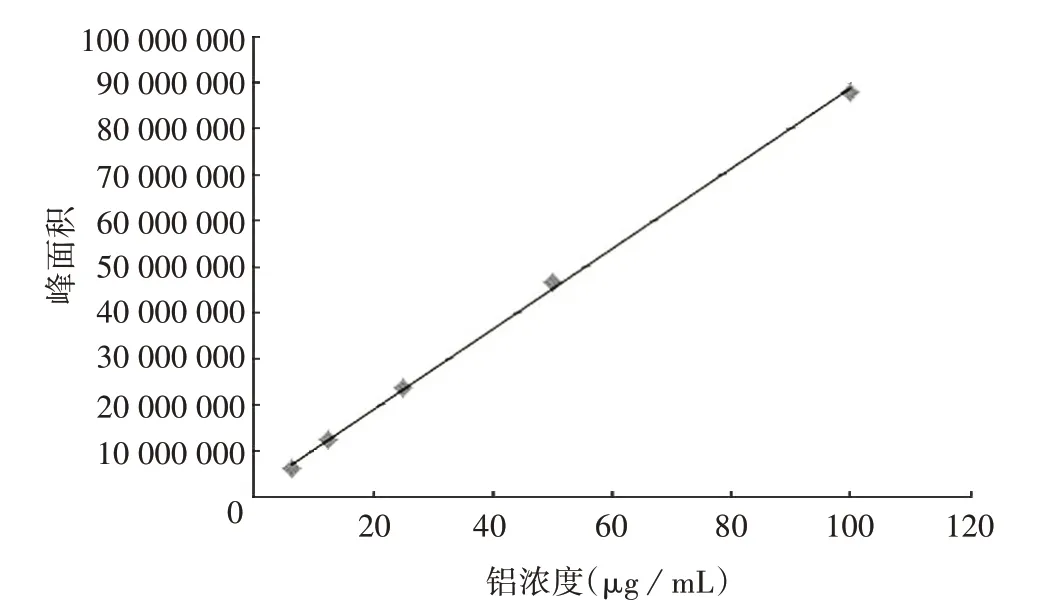
图2 标准曲线Fig.2 Standard curve
2.1.3 准确性 甲型肝炎灭活疫苗、重组乙型肝炎疫苗、吸附无细胞百白破联合疫苗和肠道病毒71型灭活疫苗中铝含量的平均加样回收率分别为98.32%、100.85%、101.09%和99.31%,RSD分别为0.55%、1.09%、0.97%和0.60%,见表2。表明该方法准确性良好。
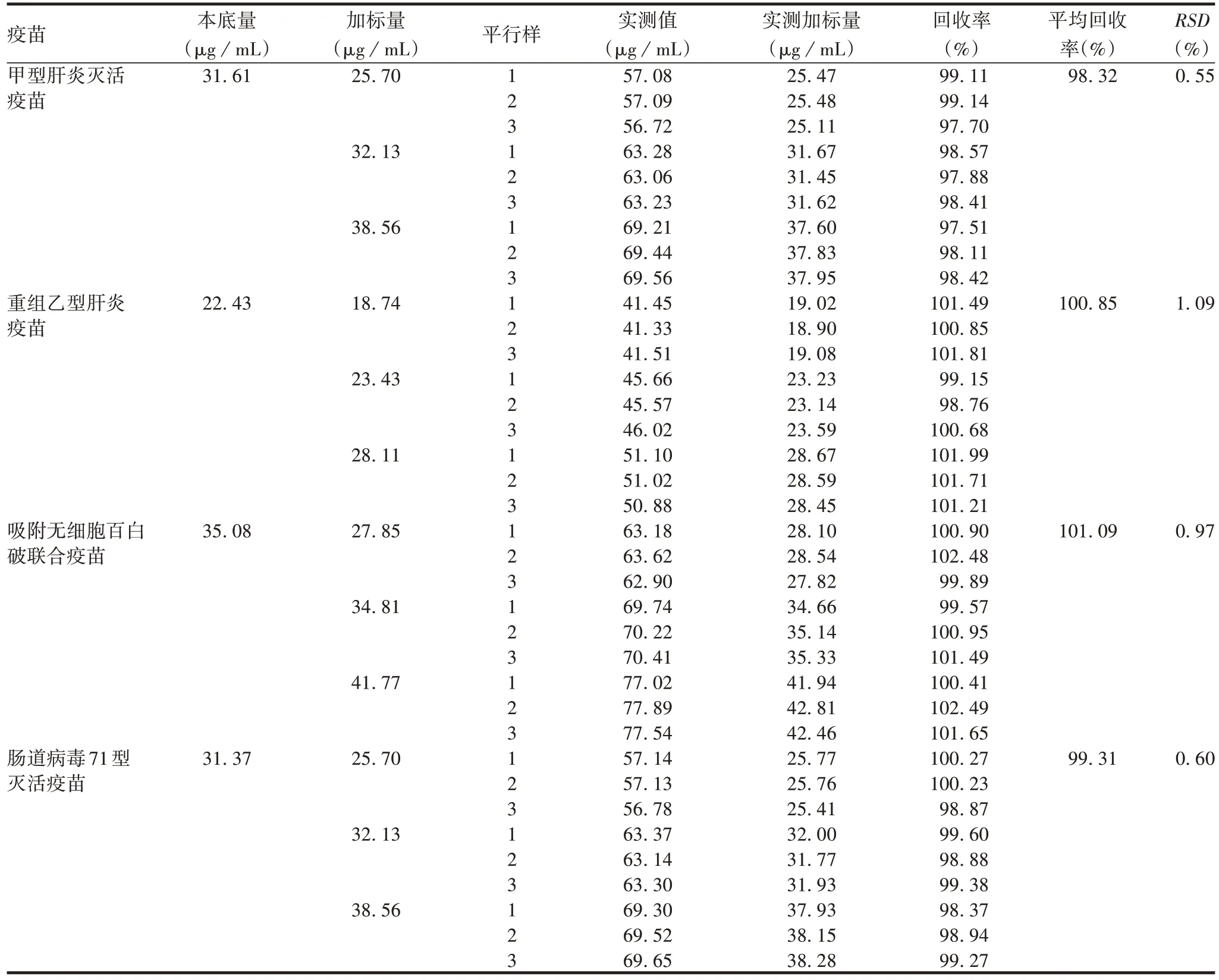
表2 4种疫苗铝含量的加样回收率Tab.2 Spike recoveries of aluminium content in four kinds of vaccines
2.1.4 重复性 甲型肝炎灭活疫苗、重组乙型肝炎疫苗、吸附无细胞百白破联合疫苗和肠道病毒71型灭活疫苗6份样品铝含量测定结果的RSD分别为1.09%、1.42%、0.97%和1.30%,表明该方法重复性良好。2.1.5 稳定性 甲型肝炎灭活疫苗、重组乙型肝炎疫苗、吸附无细胞百白破联合疫苗和肠道病毒71 型灭活疫苗样品溶液于室温放置0、2、4、6、8 h,铝含量测定结果的RSD分别为0.82%、0.73%、0.40%和0.48%,表明样品溶液配制后8 h内稳定。
2.1.6 耐用性 流动相中乙酸铵溶液与8-羟基喹啉乙腈溶液比例在±5%范围改变时,8-羟基喹啉铝的保留时间在(14.3 ± 1.2)min 波动,4 种疫苗铝含量测定结果波动范围均不超过2%。
2.2 方法的应用 采用建立的HPLC 法测定4 种共12 批疫苗中铝含量,结果均符合各相应疫苗品种质量标准的规定。HPLC 法测定结果与《中国药典》三部(2020 版)通则3106 滴定方法测定结果的RSD不超过2.0%;而通过对混合前的10 支疫苗分别采用HPLC 法测定单支铝含量发现,尽管各支样品中的铝含量均符合相应的质量标准规定,但结果存在一定波动,个别单支样品与混合测得铝含量偏差略大,可达5.0%以上。见表3和表4。
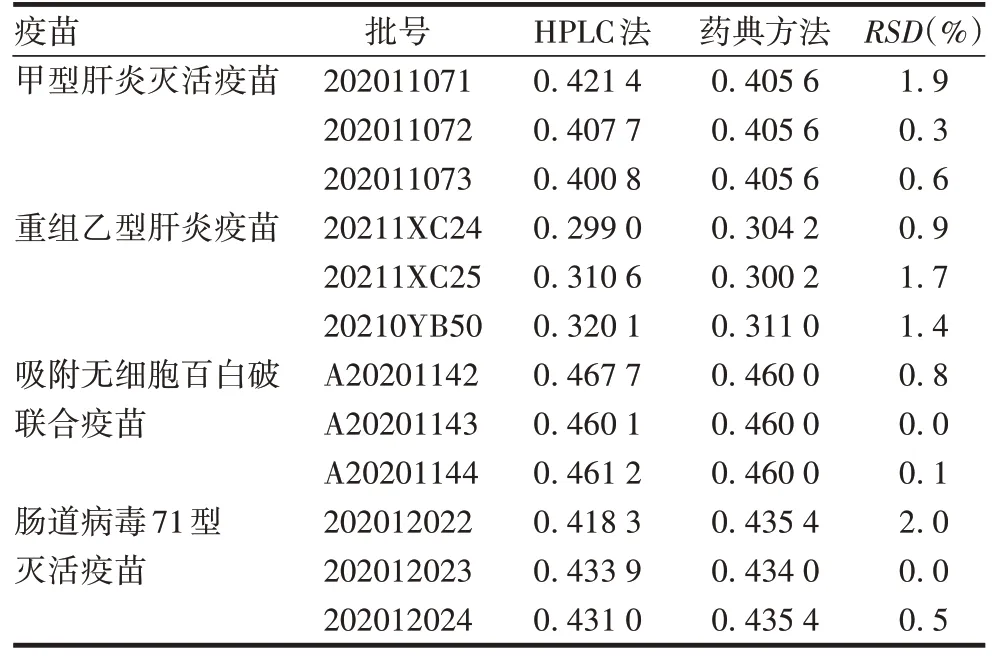
表3 HPLC 法与《中国药典》传统方法检测混合样品中铝含量结果的比较(mg/mL)Tab.3 Comparison of aluminium content results in blended sample detected by HPLC method and traditional method from Chinese Pharmacopeia(mg/mL)
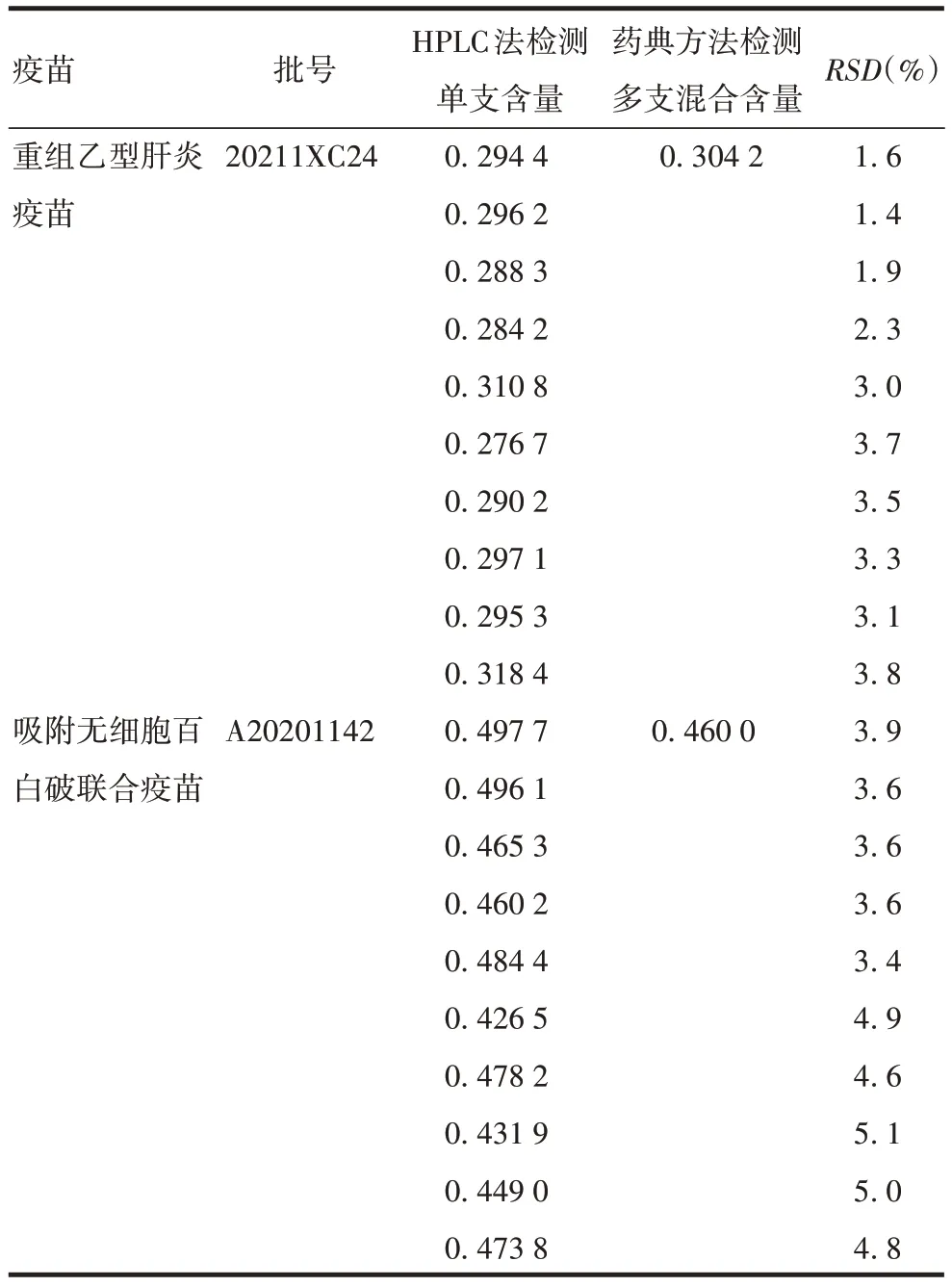
表4 HPLC 法检测单支样品与《中国药典》传统方法检测多支混合样品中铝含量结果的比较(mg/mL)Tab.4 Comparison of aluminium content results of individual sample detected by HPLC method and blended sample detected by traditional method from Chinese Pharmacopeia(mg/mL)
3 讨论
《日本药典》在附录中对采用羟基喹啉衍生测定静脉营养输液产品中的微量铝有所表述[11]。但在实验过程中我们发现,8-羟基喹啉溶液久置,羟基易发生氧化,即新鲜配制的流动相及衍生试剂(未添加抗坏血酸)为亮黄色,但随着室温放置,颜色逐渐变浅。这种氧化作用对其与铝离子的螯合反应存在一定影响,表现为荧光检测器上的峰随之变小。这就要求流动相必须临用新配制,不能使用太久,给大批量连续测定样品造成了一定的不便。为此,本研究向流动相中添加了终浓度为20 mg/L的抗坏血酸以抑制8-羟基喹啉氧化,结果表明,采用添加了抗坏血酸的流动相及衍生试剂,1 周内其颜色可保持基本稳定,同一样品1 周前后测定其峰面积也无明显变化,避免了大批量长时间样品测定期间反复多次配制流动相的繁琐操作。此外,由于8-羟基喹啉与铝的螯合反应需在近中性pH 条件下实现[12],而本实验的样品前处理过程加入磷酸,反应液呈酸性,若直接按《日本药典》方法进行衍生反应,标准曲线的线性关系较差。为此,本研究在衍生试剂中加入一定量的氢氧化钠调节pH,使其近中性,则线性明显改善。
由于铝佐剂在疫苗中呈不溶的颗粒状态,无法直接测定,将其充分溶解使之形成铝离子是准确测定其含量的重要条件。为此,本研究尝试同一样品加入磷酸溶液后采用不同的孵育温度(50、60、70、80 ℃)及保温时间(0.5、1、1.5 h),发现在70 ℃、1 h条件下,测得峰面积可达最大值,此后再升高温度或延长保温时间,峰面积基本不变,因此确定70 ℃、1 h为最适孵育条件。
目前疫苗中铝含量测定方法,除《中国药典》的滴定法外,还有《美国药典》NF2021“<1235>人用疫苗通则”中收载的原子吸收分光光度法[13]和文献报道的衍生化-紫外分光光度法[14]。前者需购置专门的原子吸收分光光度计且需安置气瓶、气路、排风等设施,对实验室安全要求亦较高;而后者则需对样品进行200 ℃、60 min干烤,操作上存在一定的不便,且紫外分光光度计通常不具备自动进样器,大批量样品仍需逐一手动测定。另外,如电感耦合等离子体质谱(inductively coupled plasma-mass spectrometry,ICP-MS)、液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)等更先进的方法,由于仪器昂贵且主要应用于痕量铝残留的测定而不适用。本研究建立的方法使用的HPLC 仪器为疫苗生产企业和检验检测机构通常具备的常规分析仪器,且样品前处理也仅需70 ℃保温,使用普通水浴锅或培养箱即可实现,大批量样品测定时,仅需检验人员对样品完成前处理后即可由仪器自动进样完成,自动化程度较高。特别是在某些传染性疾病大流行,急需大批量疫苗保障供应的特定时期,可明显加快成品铝含量测定的检测速度,降低检验人员劳动强度,减少疫苗成品消耗量,更有效地实现疫苗的保质保供。4种疫苗各批次样品多支混合后测定结果与《中国药典》三部(2020版)滴定方法结果之间的RSD不超过2%,表明该方法与《中国药典》三部(2020版)方法所得结果的一致性较好;而单支样品与多支混合样品测定结果之间的偏差则有所增大,表明同一批次各支样品铝含量存在一定差异。由于本研究建立的方法可实现单支样品中铝含量的测定,也为生产过程中监控半成品分装提供了手段。此外,基于目前部分HPLC仪的自动进样器已具备在线衍生化功能,我们将在本研究的基础上,进一步尝试采用自动进样器在线衍生功能实现样品与衍生试剂的反应,以进一步提高检测效率。

