靶向沉默CXCL5对喉鳞状细胞癌AMC-HN-8细胞生物学功能的影响及其调控分析
谢晓丹,韩瑞,卜倩倩,李梦璐,张亚楠,黄赛亚,皇甫辉
山西医科大学第一临床医学院,山西 太原 030000
喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是头颈部肿瘤中常见的恶性肿瘤之一,占我国耳鼻咽喉部恶性肿瘤的7.9%~35%,列头颈部恶性肿瘤的第3 位[1]。近40 年来,LSCC 发病率明显增加,发病年龄以40 ~60 岁最多,吸烟和饮酒可协同增高患LSCC 的危险性[1-2]。临床治疗目前主要采取以手术为主的多学科综合治疗[3],但多数LSCC 患者就诊时已失去最佳手术时机。LSCC 细胞与其他恶性肿瘤细胞一样,具有无限繁殖、易转移、耐药等特点,手术治疗后存在较大的复发及放化疗耐受风险。因此,在LSCC 早期诊断及寻找新的治疗靶点成为研究的重点领域。
趋化因子是一种趋化性细胞因子,可调节免疫细胞在炎症刺激下进入受损或病变器官的迁移[4-5]。根据其N-末端半胱氨酸残基的不同,可分为4 个主要亚家族:CXCL、CC、C和CX3C。CXCL5属于趋化因子家族中的一员,其基因定位于4号染色体q13-q21部位,CXCR2 是其特异性受体,CXCL5 可结合CXCR2介导血管增生,也可影响肿瘤的增殖及转移[6-8]。CXCL5在多种癌症中表达上调并参与肿瘤进展,但CXCL5在LSCC中的作用及机制尚不清楚。
因此,本研究在LSCC组织及细胞中验证了CXCL5的表达情况,通过靶向沉默CXCL5后分析对其生物学功能的影响,并通过TCGA 数据库分析CXCL5基因在LSCC 发展过程中涉及的免疫浸润分析、互作基因等,以期为LSCC 的早期诊断、靶向治疗等提供新方法。
1 材料与方法
1.1 资料从TCGA(http://cancergenome.nih.gov/)数据库中下载头颈鳞癌(head-neck squamous cell carcinoma,HNSC)的CXCL5基因RNA-seq 数据,保留发病部位为喉部(larynx)或喉咽部(hypopharynx)部位的样本。
1.2 样本及细胞 选取2019 年1 月—2020 年12 月山西医科大学第一医院60 例病理科手术切除的LSCC 及相应癌旁组织样本,所有样本经病理学诊断均确诊为LSCC,本研究获得山西省伦理委员会批准(2018044);LSCC 细胞系AM-HN-8 和293T 人胚肾上皮细胞由山西省耳鼻咽喉重点实验室提供。
1.3 主要试剂及仪器 DAB 显色试剂盒、羊血清、增强酶标山羊抗兔IgG 聚合物购自北京中杉金桥生物技术有限公司;兔抗CXCL5单抗(EP13083)购自美国Abcam公司;逆转录试剂盒购自北京全式金生物技术有限公司;CCK8试剂盒购自美国APExBIO 生物技术有限公司;Transwell试剂盒购自美国Corning公司;流式细胞仪(ACEA NovoCyte3130)购自美国艾森公司。
1.4 TCGA 数据库分析CXCL5 在LSCC 中的表达 TCGA 数据库中下载得到肿瘤组织样本119 份、癌旁组织样本44 份,利用limma 包对二者进行差异表达分析,差异基因筛选条件为[log2(fold change)]>0.5&adj.P.Val <0.05。
1.5 细胞培养 用含5%胎牛血清、1%青链霉素、1%谷氨酰胺的DMEM培养基,于37 ℃,5%CO2恒温培养箱内培养人LSCC细胞AMC-HN-8。
1.6 LSCC 组织中CXCL5 蛋白表达水平的检测 采用免疫组织化学染色法。将石蜡包埋的组织切片常规脱蜡,二甲苯、乙醇梯度脱水;抗原经高温高压EDTA 修复后,切片浸入新鲜配置的3%H2O2甲醇溶液,室温避光孵育10 min;加入封闭液(羊血清),室温孵育20 min;加入兔抗CXCL5单抗(1∶100稀释),4 ℃湿盒孵育过夜;加入增强酶标山羊抗兔IgG 聚合物(1∶100 稀释),室温孵育60 min;DAB 显色,复染封片。胞浆内有棕色颗粒判定为阳性细胞,计数阳性细胞率,<10%为0分,10%~25%为1分,26%~50%为2 分,51% ~75%为3 分,>75%为4 分;染色强度根据德国免疫反应评分评估,无染色为0 分,淡黄色为1 分,棕黄色为2 分,褐色为3 分;两评分乘积为CXCL5的最终免疫组化染色得分。最终得分标准以阳性细胞率>50%、染色强度为棕黄色及褐色为高表达组;以阳性细胞率≤50%、染色强度为淡黄色以下为低表达组。
1.7 AMC-HN-8细胞中CXCL5mRNA转录水平的检测 采用qPCR 法。待AMC-HN-8 细胞呈指数生长后收集细胞沉淀,根据Trizol 试剂说明书,提取细胞中总RNA,反转录后合成cDNA 第一链,以其为模板,以293T 细胞为对照组,18S 为内参,qPCR 法进行定量分析。试验重复3次。CXCL5上游引物序列为:5'-ATCAGTAATCTGCAAGTGTTCG-3',下游引物序列为:5'-CAAGACAAATTTCCTTCCCGTT-3';18S 上游引物序列为:5'-CCTGGATACCGCAGCTAGGA-3',下游引物序列为:5'-GCGGCGCAATACGAATGCCCC-3'。引物由生工生物工程(上海)股份有限公司合成。qPCR反应条件:95 ℃10 s,60 ℃30 s,95 ℃15 s,共40个循环。采用2-ΔΔCt法计算目的基因mRNA相对表达量。
1.8 siRNA敲降后的细胞功能试验
1.8.1 siRNA 敲降效率检测 由上海吉玛制药技术有限公司特异性合成3 组siRNA:siRNA-1(CXCL5-homo-438)、siRNA-2(CXCL5-homo-253)、siRNA-3(CXCL5-homo-307),并设空白对照(NC)组。将各组siRNA 分别转染AMC-HN-8 细胞,进行qPCR 检测。试验重复3 次。筛选出敲降效率较好的2 组siRNA进行后续试验。
1.8.2 细胞增殖试验 采用CCK8 试剂盒检测细胞增殖能力。将转染后各组细胞计数,加至96 孔板中,每孔8 000 ~10 000 个,置37 ℃,5% CO2细胞培养箱培养;细胞贴壁后,收集0、24、48、72 h 细胞,上酶标仪,于450 nm 波长处读取吸光度值。试验重复3次。
1.8.3 Transwell 细胞侵袭试验 取各组转染24 h 细胞,提前饥饿处理8 h;计数并调整细胞数为1 × 106个,用1 mL 无血清培养基重悬,上室(提前稀释Matrigel 基质胶,置37 ℃培养箱使胶凝固)加入200µL 细胞悬液,下室加入600 µL 含25%胎牛血清的培养基,37 ℃,5%CO2细胞培养箱培养2 ~3 d;4%多聚甲醛固定,0.1%结晶紫染色。试验重复3 次。显微镜下统计穿过小室的细胞数量,并计算相对倍数。
1.8.4 Transwell 细胞迁移试验 取各组转染24 h 细胞,提前饥饿处理8 h;计数并调整细胞数为5 × 105个,并用1 mL 无血清培养基重悬,上室加入200 µL细胞悬液,下室加入600µL 含25%胎牛血清的培养基,37 ℃,5%CO2细胞培养箱培养1 ~2 d;4%多聚甲醛固定,0.1%结晶紫染色。试验重复3 次。显微镜下统计穿过小室的细胞数量,并计算相对倍数。
1.8.5 细胞周期试验 将敲降效率较高的2条siRNA及NC 组细胞均转染48 h 后,1 000×g离心5 min,收集细胞,沉淀用预冷的75%乙醇混匀,4 ℃固定过夜;次日1 000×g离心5 min,收集细胞沉淀,PBS重悬细胞;加入300µL染色液(染色缓冲液∶PI∶RNaseA=50∶1∶1)重悬细胞,37 ℃避光孵育30 min;上流式细胞仪(488 nm波长处)进行检测。试验重复3次。
1.8.6 细胞凋亡试验 将敲降效率较高的2条siRNA及NC组各组细胞均转染48 h后,1 000×g离心5 min,收集细胞,预冷PBS 混匀,离心收集细胞沉淀,用1×Binding Buffer 结合缓冲液重悬细胞后,调整细胞浓度至(1 ~5)×106个/mL;将500µL细胞悬液与5µL Annexin V FITC混匀,室温避光孵育5 min;加入10µL PI,混匀,室温孵育30 min;上流式细胞仪(488 nm 波长处)进行检测。试验重复3次。
1.9CXCL5免疫细胞浸润分析及其共表达网络富集分析 使用ssGSEA 方法进一步对高低表达的2组样本进行免疫细胞浸润分析,利用R软件对该2组样本进行ssGSEA 分析,推算浸润免疫细胞的比例,再采用wilcox.test检验进行相关性分析。在LSCC 中计算CXCL5基因与其他基因之间的pearson相关性,筛选|cor| >0.6 &P<0.05 的关系对构建CXCL5的共表达网络,并进行基于GO和KEGG的富集分析。
1.10 统计学分析 采用SPSS 23.0 软件对实验数据进行统计学分析,正态分布性数据以均数±标准差表示,数据比较采用t检验;采用GraphPad Prism 软件对实验数据进行绘图及统计分析,以P<0.05 为差异有统计学意义。
2 结果
2.1CXCL5在LSCC组织中表达上调量的改变
2.1.1CXCL5基因在LSCC 组织中的表达 TCGA 数据库分析显示,CXCL5基因在LSCC 组织中表达上调,与癌旁组织相比,差异有统计学意义(t=2.830,P<0.01),见图1。
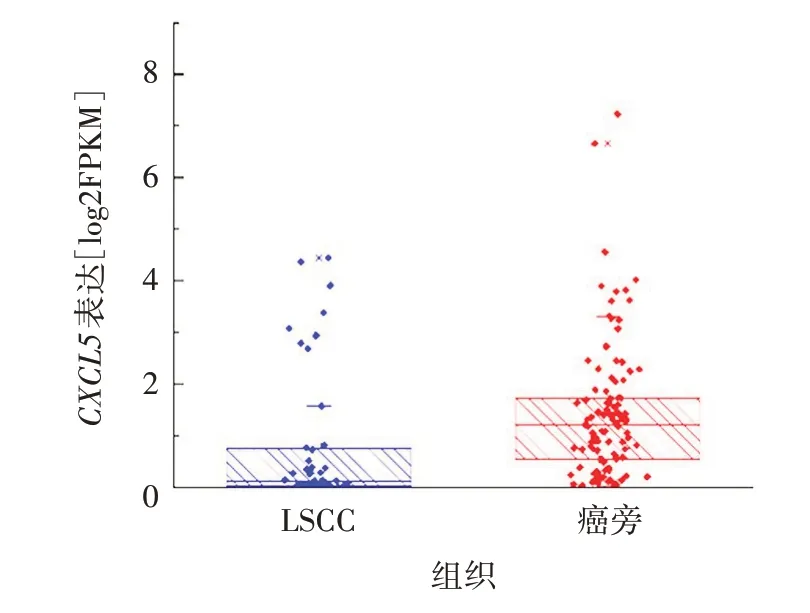
图1 CXCL5在正常组织和LSCC组织中表达的箱线图Fig.1 Box diagram of CXCL5 expression in normal tissue and LSCC tissue
2.1.2 CXCL5 蛋白在LSCC 组织中的表达 CXCL5蛋白阳性染色为棕色颗粒样,主要定位于细胞浆,见图2。在相同判定标准下,LSCC 组织阳性染色得分明显高于癌旁组织,差异有统计学意义(P<0.001),见表1。表明CXCL5在LSCC组织中高表达。
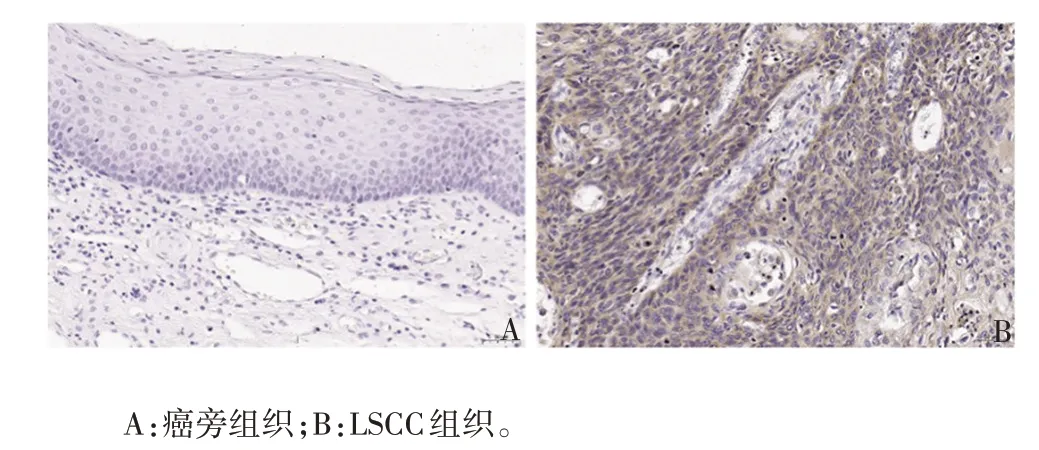
图2 免疫组织化学染色法观察CXCL5 蛋白在人LSCC组织中的表达(×200)Fig. 2 Expression of CXCL5 protein in human LSCC tissues observed by immunohistochemical staining(×200)
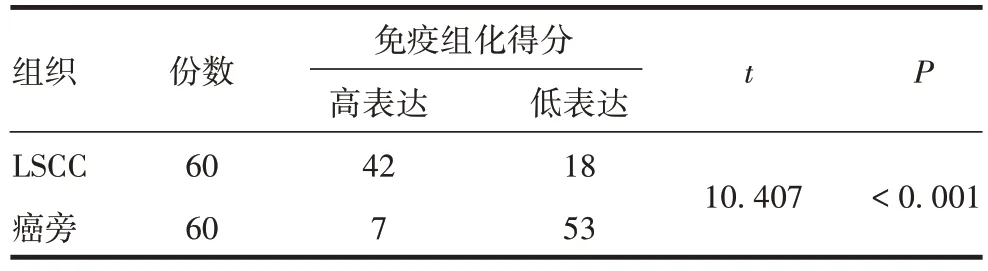
表1 免疫组织化学染色法评分表Tab.1 Scoring table of immunohistochemical staining
2.1.3 LSCC 细胞中CXCL5mRNA 表达水平 LSCC细胞中CXCL5mRNA 转录水平显著高于对照组(t=5.490,P<0.01),见表2。
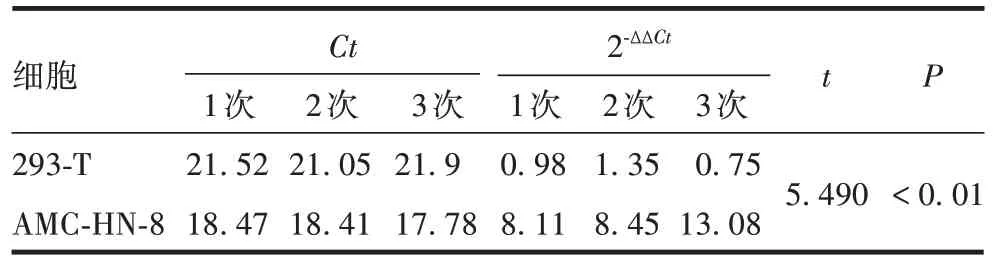
表2 LSCC细胞中CXCL5 mRNA转录水平的定量分析Tab.2 Quantitative analysis of CXCL5 mRNA expression in LSCC cells
2.2 细胞功能试验
2.2.1 3条siRNA敲降效率CXCL5-homo-438、CXCL5-homo-253、CXCL5-homo-307 组转染后的细胞表达量分别为0.502±0.045、0.3275±0.169、0.6497±0.034,与NC组(1.001±0.066)相比,差异有统计学意义(P<0.01),表明siRNA-1和siRNA-2敲降效率较好,见图3。选择siRNA-1和siRNA-2进行后续试验。

图3 qPCR法检测转染siRNA后细胞的表达水平Fig.3 Detection of expression level in cells transfected with siRNA by qPCR
2.2.2 siRNA 干扰CXCL5对LSCC 细胞增殖活性的影响CXCL5-homo-438、CXCL5-homo-253 组细胞各时间段增殖速度均慢于NC组(P<0.05),见图4。
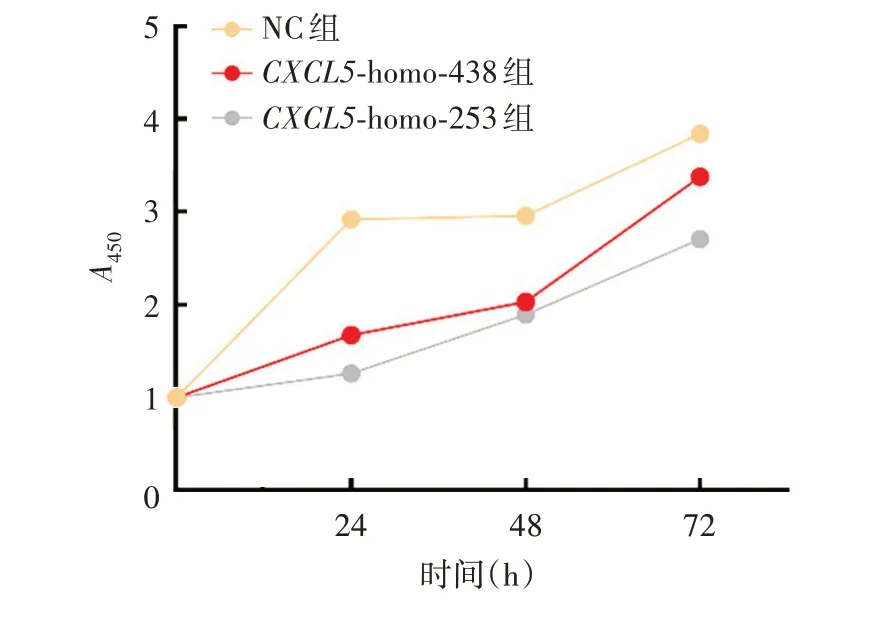
图4 CCK-8试验检测敲降CXCL5后对LSCC 细胞增殖的影响Fig.4 Detection of effect of CXCL5 knock-down on proliferation of LSCC cells by CCK-8 assay
2.2.3 siRNA 干扰CXCL5对LSCC 细胞侵袭的影响CXCL5-homo-438、CXCL5-homo-253 组穿过Transwell小室的细胞数分别为NC组的(0.283±0.033)、(0.528±0.043)倍(P<0.001),相比于NC 组的细胞数减少,可知CXCL5具有促进LSCC 细胞侵袭的能力,见图5和图6。
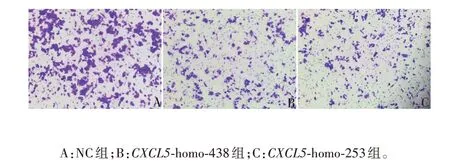
图5 Transwell试验检测敲降CXCL5后对LSCC细胞侵袭能力的影响(免疫组织化学染色,×100)Fig.5 Detection of effect of CXCL5 knock-down on invasive ability of LSCC cells by Transwell test(immunohistochemical staining,×100)
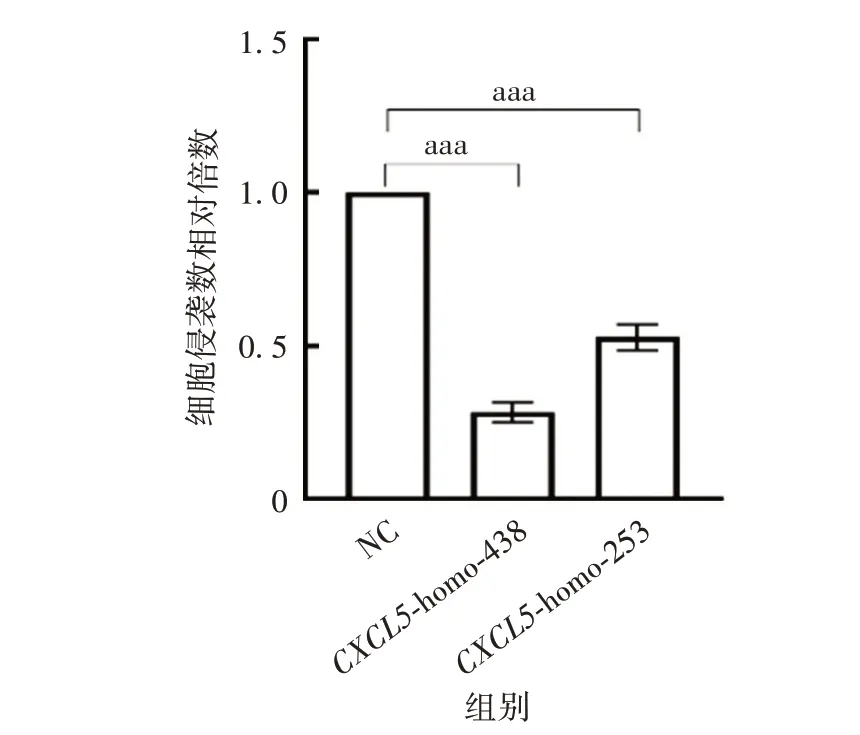
图6 敲降CXCL5后LSCC细胞侵袭能力的变化Fig.6 Changes of invasion ability of LSCC cells after knocking down CXCL5
2.2.4 siRNA 干扰CXCL5对LSCC 细胞迁移的影响CXCL5-homo-438、CXCL5-homo-253 组穿过Transwell小室的细胞数分别为NC组的(0.276±0.048)、(0.481±0.020)倍(P<0.001),相比于NC 组的细胞数减少,可知CXCL5具有促进LSCC 细胞迁移的能力,见图7和图8。
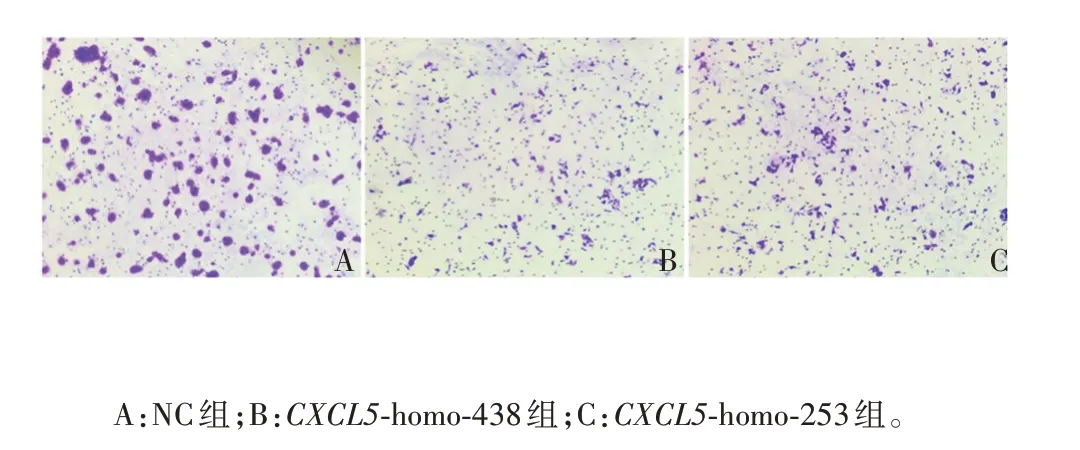
图7 Transwell试验检测敲降CXCL5后对LSCC细胞迁移能力的影响(免疫组织化学染色,×100)Fig.7 Detection of effect of CXCL5 knock-down on migration ability of LSCC cells by Transwell test(immunohistochemical staining,×100)
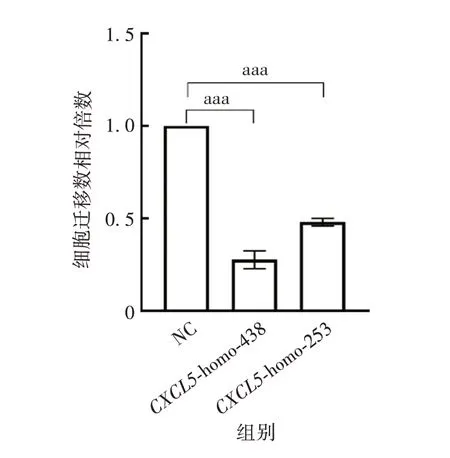
图8 敲降CXCL5后LSCC细胞迁移能力的变化Fig.8 Changes of migration ability of LSCC cells after knocking down CXCL5
2.2.5 siRNA 干扰CXCL5对LSCC 细胞周期的影响CXCL5-homo-438 组的GO/G1、S、G2/M 期所占比例分别为(57.357 ± 0.793)%、(27.833 ± 1.372)%、(14.810±0.754)%;CXCL5-homo-253组的GO/G1、S、G2/M 期所占比例分别为(55.877 ± 0.533)%、(33.907±1.589)%、(10.217±1.056)%;NC 组GO/G1、S、G2/M期所占比例分别为(42.457±0.810)%、(49.807±0.595)%、(7.560±0.472)%。表明CXCL5主要通过G1期对LSCC细胞进行周期阻滞,2个干扰组与对照组相比,差异均有统计意义(P<0.01)。见图9。
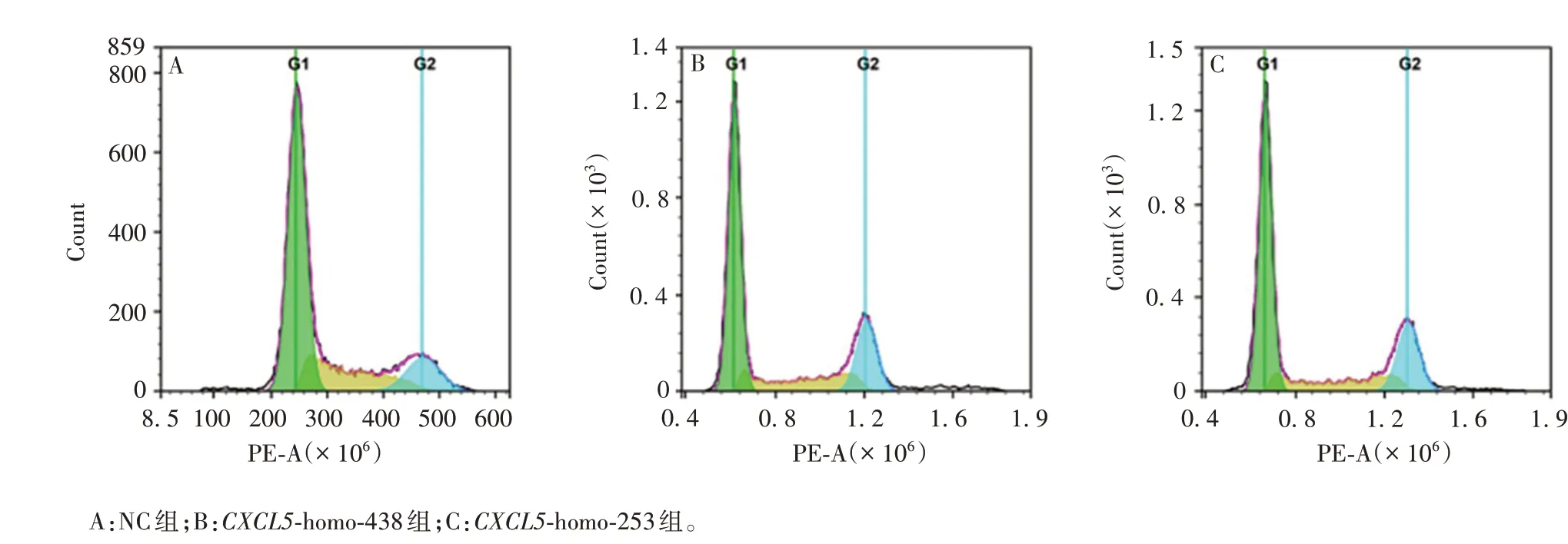
图9 流式细胞仪检测敲降CXCL5后对LSCC细胞周期的影响Fig.9 Detection of effect of CXCL5 knock-down on cell cycle of LSCC cells by flow cytometry
2.2.6 siRNA 干扰CXCL5对LSCC 细胞凋亡的影响CXCL5-homo-438、CXCL5-homo-253、NC 组的凋亡率分别为(6.110±1.533)%、(6.657±1.671)%、(2.903±0.768)%。表明CXCL5可促进LSCC 细胞凋亡,2 个干扰组与对照组相比,差异均有统计意义(P<0.05)。见图10。

图10 流式细胞仪检测敲降CXCL5后对LSCC细胞凋亡的影响Fig.10 Detection of effect of CXCL5 knock-down on apop-tosis of LSCC cells by flow cytometry
2.3CXCL5免疫细胞浸润分析及其共表达网络ssGSEA 分析发现,仅有DC(t= -2.215,P<0.05)、中性粒细胞(neutrophils)(t=-3.136,P<0.01)、NK(t= 2.485,P<0.05)和Th17(t= -3.186,P<0.01)免疫细胞评分在高低表达2 组样本间存在差异,见图11。获得与CXCL5相关的20 个基因,见图12。GO 富集分析显示,共富集到调节细胞因子分泌(regulation of cytokine secretion)、白细胞迁移(leukocyte migration)、趋化因子——介导的信号通路(chemokine-mediated signaling pathway)、趋化因子应激性(response to chemokine)、中性粒细胞趋化性(neutrophil chemotaxis)等免疫相关通路。KEGG 富集分析显示,共富集到病毒蛋白与细胞因子及细胞因子受体的相互作用(viral protein interaction with cytokine and cytokine receptor)通路、趋化因子信号通路(chemo kine signaling pathway)、细胞因子受体相互作用(cytokine-cytokine receptor interaction)通路。见图13 和图14。
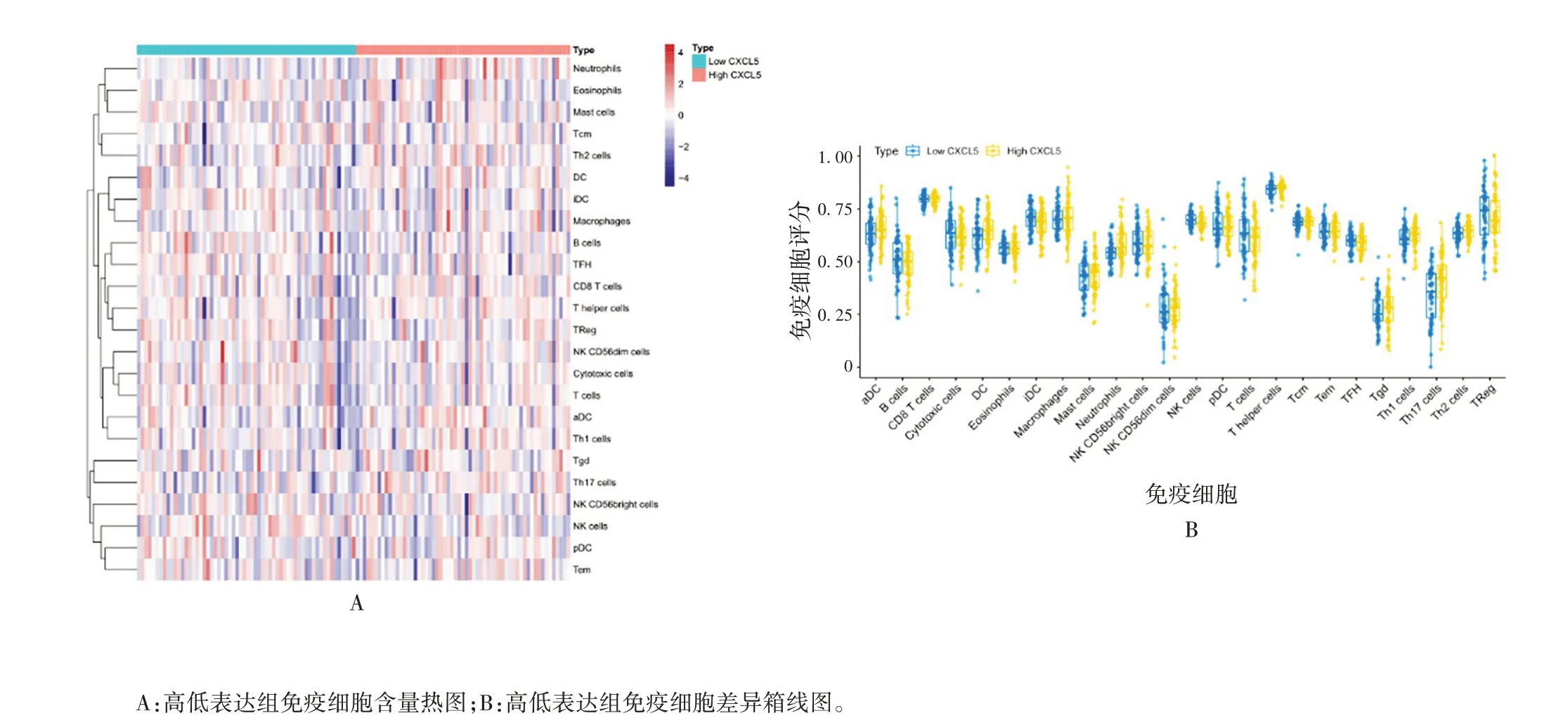
图11 免疫细胞浸润分析Fig.11 Immune cell infiltration analysis
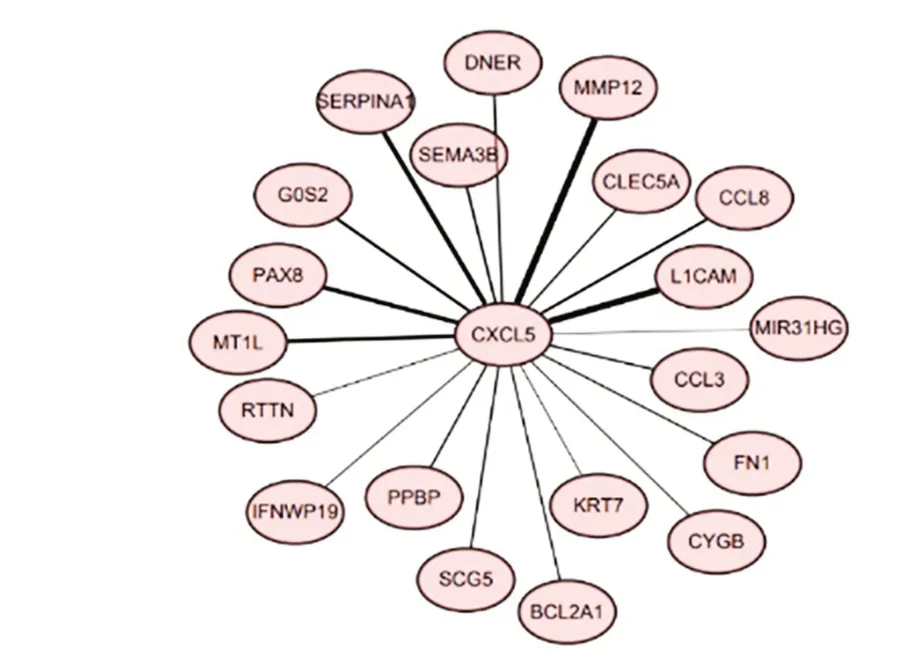
图12 CXCL5共表达网络Fig.12 CXCL5 co-expression network
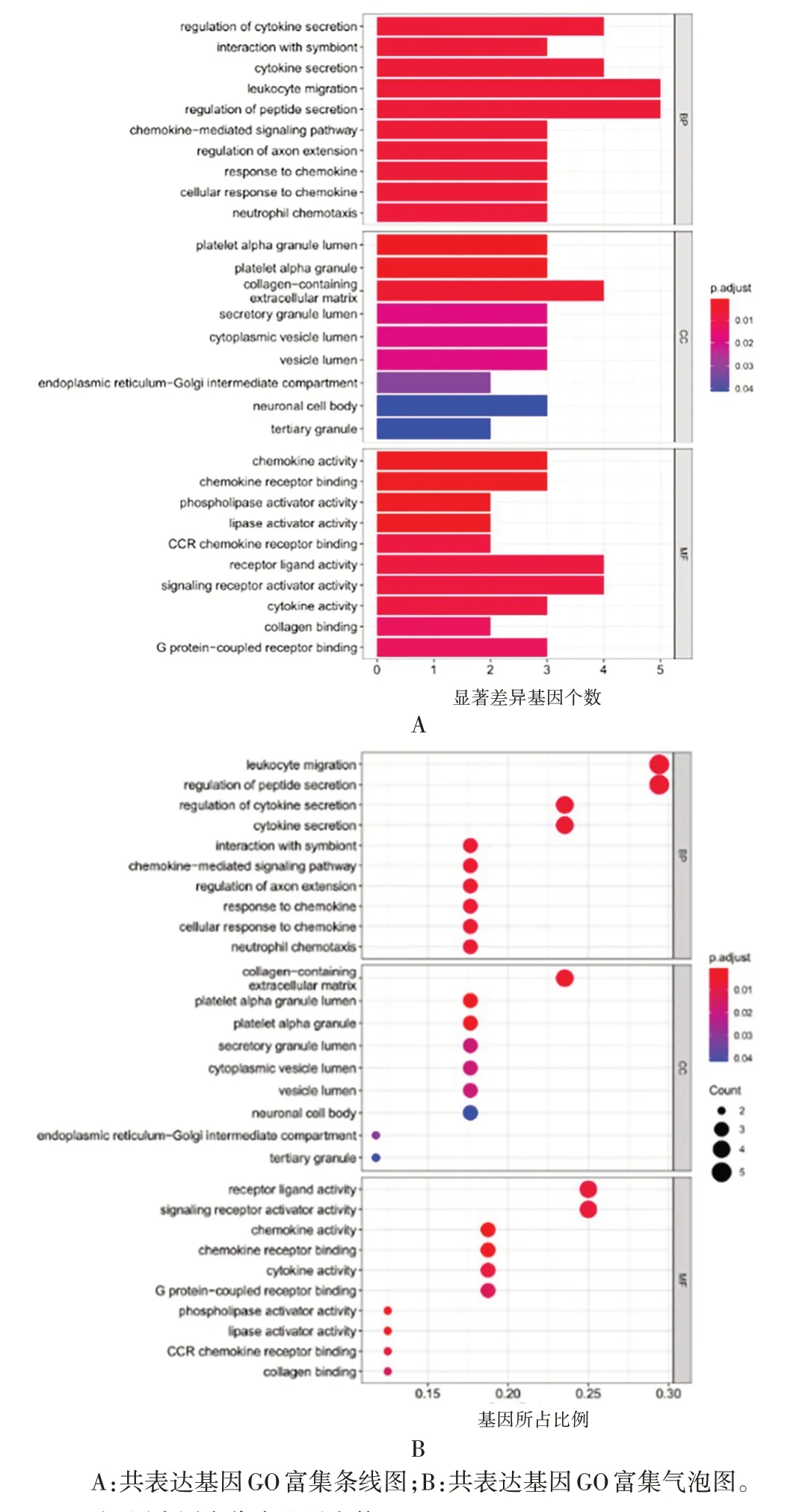
图13 共表达基因GO富集分析Fig.13 GO enrichment analysis of co-expressed genes
3 讨论
LSCC 是严重威胁人类健康的一类恶性肿瘤,近年来LSCC 的治疗取得了显著的进展,手术仍是其治疗的主要手段,包括生物治疗在内的综合治疗已成为可行的选择[2]。但目前LSCC 的发病机制仍不十分明确,尚无明确的靶向治疗靶点。
本研究通过LSCC 组织免疫组织化学试验验证,与癌旁组织相比,CXCL5在LSCC 组织中的表达量增高,与TCGA数据库分析一致。通过qPCR检测,与正常293T 细胞相比,CXCL5在LSCC 细胞系AMC-HN-8中的表达量也明显上调。在体外试验中,通过转染siRNA分析可知,CXCL5可促进LSCC 的增殖、侵袭及迁移,表明与胃癌、胰腺癌等恶性肿瘤一样,CXCL5可能会成为LSCC潜在的治疗靶点之一。
CXCL5 在许多癌症的发生发展中起重要作用。大量研究表明,在结直肠癌[9]、胃癌[10-11]、肝癌[12]、胰腺癌[13]、乳腺癌[14]、前列腺癌[15]、膀胱癌[16-17]、肺癌[18]、宫颈癌[19]、胆管癌[20]等恶性肿瘤组织中均高表达,并与肿瘤的侵袭、转移及不良预后密切相关。有报道表明,在膀胱癌细胞系T24 中下调CXCL5的表达后,可通过Snail、PI3K-AKT 和ERK1/2 信号通路显著减少细胞增殖及迁移[16]。在肝癌中,ERK1/2、p38、MAPK 和JNK 通路的激活参与了CXCL5 诱导的肝癌细胞迁移及侵袭的调控(ERK1/2 信号通路可能在发挥更主要的作用),同时在肝癌细胞系MHCC97H中,通过siRNA下调CXCL5的表达可显著抑制细胞侵袭及迁移[12]。这与本研究结果一致,靶向沉默CXCL5的表达可抑制肿瘤细胞的增殖、侵袭及迁移。
有文献报道,CXCL5/CXCR2生物轴在促进肿瘤细胞的增殖、侵袭和迁移等肿瘤生物学中发挥重要作用[8]。CXCL5可结合CXCR2介导多种细胞包括中性粒细胞等招募以及肿瘤细胞迁移及转移[21]。在结直肠癌中,CXCL5/CXCR2轴被发现通过激活ERK/Elk-1/Snail和AKT/GSK3β/β-catenin通路,从而增强结直肠癌细胞的迁移及侵袭能力,沉默Snail 和/β-catenin信号通路可减弱CXCL5/CXCR2体外增强细胞迁移及侵袭能力[9,22]。在鼻咽癌中,CXCL5/CXCR2 轴可通过激活ERK/GSK-3β/Snail 信号通路促进肿瘤细胞迁移及侵袭[21]。但CXCL5/CXCR2生物轴在LSCC 细胞迁移及侵袭中的确切作用及其潜在机制尚不清楚,需进一步研究。
本研究通过数据库对CXCL5的互作基因分析发现,人巨噬细胞金属弹性蛋白(human macrophage metalloelastase,MMP12)与CXCL5互相影响最大,MMP12能广泛分解细胞外基质和血管壁成分,促进LSCC 转移[23],提示CXCL5对LSCC发展的影响可能是一个复杂的生物学过程。
此外,肿瘤的发生发展与肿瘤微环境(tumor microenvironment,TME)相关。肿瘤通过TME 导致机体对肿瘤的免疫监视及免疫耐受失衡,减弱抗肿瘤免疫反应,维持增殖、逃避细胞凋亡以及保持炎性环境和血管生成等特征,从而促进肿瘤生长[24-25],而且肿瘤细胞的侵袭及迁移也是通过TME中的信号通路启动和维持的。本研究通过分析发现,CXCL5在LSCC中的免疫浸润与DC、Neutrophils、NK 和Th17 免疫细胞相关。有文献报道,免疫细胞可沿着CXCL5浓度梯度向肿瘤TME 迁移[26],表明CXCL5 可能通过改变TME导致机体对肿瘤免疫监视的逃避过程。
肿瘤的发生、发展还与TME 中的血管生成密切相关,过表达的血管内皮生长因子(vascular endothelial growth factor,VEGF)诱导生成的丰富的血管为肿瘤组织的快速生长提供了更多的血液[11]。多项研究发现,CXCL5/CXCR2 生物轴在肿瘤血管生成中起重要作用,因CXCL5[属于ELR+CXC 类趋化因子,是含有ELR 基因序列(Glu-Leu-Arg,谷氨酸-亮氨酸-精氨酸)的一种亚型(CXC趋化因子家族又可分为ELR+和ELR-组,ELR+CXC类趋化因子被认为可促进血管生成[6-8])]及其唯一已知的功能性受体CXCR2 在促血管生成、迁移、侵袭中发挥作用,CXCL5 通过激活CXCR2促进血管生成,因此有效阻断CXCL5/CXCR2通路可减少肿瘤的血液供应,从而减缓疾病进程[27]。
CXCL5 作为化疗药物的辅助剂,可提高药物疗效,目前受到广泛关注[27]。有文献报道,在肺癌中,中和CXCL5可提高酪氨酸激酶抑制剂吉非替尼疗效,而不会增加相关副作用[28]。CXCR2 抑制剂可提高横纹肌肉瘤免疫治疗的有效性[29]。阻断CXCR2 可降低结直肠癌进展,并增加对铂类抗癌药物的敏感性[30]。抑制CXCR2 还可减少粒细胞向原发肿瘤区域的聚集,从而调节胰腺管癌的进展[31]。表明CXCL5及其受体CXCR2 在肿瘤恶性进展中具有重要作用,并且有可能成为肿瘤的潜在治疗靶点。
随着越来越多的研究揭示CXCL5与肿瘤的相关性,其相应的信号旁路也逐渐明确。由于CXCL5 高表达可促进LSCC 增殖、侵袭及迁移,因此CXCL5 可能成为预测LSCC 发展的新指标及其治疗的潜在靶点及策略。

