人程序性死亡受体配体1免疫球蛋白可变区结构域基因酵母双杂交诱饵质粒的构建及其自激活检测
刘鹏,彭岳
广西中医药大学基础医学院医学创新综合实验室,广西 南宁 530200
目前研究和应用最广泛的抑制性免疫检查点信号通路为程序性细胞死亡受体-1(programmed cell death protein-1,PD-1)/程序性死亡受体配体-1(programmed cell death ligand-1,PD-L1)和细胞毒T淋巴细胞相关抗原-4(cytotoxic T-lymphocyte antigen-4,CTLA-4),其中PD-1/PD-L1 信号通路是最典型的代表。PD-1又称CD279,基因全长867 bp,位于人2号染色体长臂3 区7 带第3 亚带,PD-1 蛋白是1 个由288 个氨基酸组成的Ⅰ型跨膜糖蛋白,从N-端至C-端依次为信号肽、N-端胞外免疫球蛋白可变区(immunoglobulin variable region,IgV)样结构域、1 个约20 个氨基酸组成的茎、跨膜区域和1 个包含酪氨酸信号基序的C-端胞质尾部[6]。PD-1 除了在激活的T 淋巴细胞表达外,还在胸腺的双阴性(CD4-、CD8-)T 细胞、激活的自然杀伤T 细胞、活化的B 细胞、活化的单核细胞和未成熟的朗格汉斯细胞上呈低水平表达,是一种重要的免疫反应抑制分子[7]。PD-1 有两种已知配体:PD-L1(又称CD274和B7-H1)和PD-L2(又称CD273和B7-DC)[8]。其中PD-L1 是华人科学家陈列平团队在肿瘤微环境中率先发现的,在癌细胞上高度表达的一种免疫球蛋白样分子[9],属于Ⅰ型跨膜糖蛋白,与PD-1具有相似结构,也具有信号肽、N-端胞外IgV 和IgC 样结构域、疏水跨膜区域和C-端胞质尾部[10]。PD-L1 通过IgV 结构域与肿瘤浸润环境中的淋巴细胞上高表达的PD-1 结合后,诱导T 细胞凋亡、功能丧失和耗竭,从而抑制肿瘤抗原特异性CD8+T 细胞的活化、增殖和抗癌功能,实现肿瘤免疫逃逸[11-12]。
目前靶向PD-1/PD-L1 信号通路的免疫检查点抑制剂已在多个癌种中展现出显著临床疗效。现阶段国内外已上市的PD-1/PD-L1 抑制剂均为大分子抗体药物,具有特异性强、毒副作用低等优势,但也有其固有劣势,如研发成本高、批量生产难度大、组织渗透性差等弊端。近年来,越来越多的多肽类药物被开发为免疫检查点抑制剂应用于临床。因此,本研究构建了人PD-L1 IgV 结构域酵母双杂交诱饵质粒,并进行毒性和自激活检测,同时进行与课题组已构建的肽适体骨架蛋白——人硫氧还蛋白(human thioredoxin,hTrx,11.91 kD)酵母双杂交猎物质粒之间相互作用的检测,为后续从以hTrx 为骨架的肽适体文库中筛选出能靶向结合PD-L1 IgV 的特异肽适体奠定基础。
1 材料与方法
1.1 质粒、菌株及细胞 酵母双杂交诱饵质粒pGADT7-T、pGBKT7-53 及载体pGADT7、pGBKT7 均购自陕西普因特生物工程有限公司;pENTER-PD-L1质粒购自山东维真生物科技有限公司;pGADT7-hTrx质粒、E.coliDH5α 感受态细胞为本实验室保存;Y187 感受态细胞、Y2HGold 感受态细胞购自陕西普因特生物工程有限公司。
1.2 主要试剂及仪器 限制性内切酶EcoRⅠ、SalⅠ、BamHⅠ、T4 DNA 连接酶购自NEB(北京)有限公司;DNA marker DSTM5000、Pfu Mix、高纯度质粒小量提取试剂盒、PCR 产物及DNA 片段纯化试剂盒购自广州东盛生物科技有限公司;C-Myc-Tag 兔源单克隆抗体、GAPDH 兔源单克隆抗体、HRP Goat anti-rabbit IgG 抗体购自武汉爱博泰克(ABclonal)生物科技有限公司;YPDA 培养基购自北京索莱宝科技有限公司;TureColor 双色预染蛋白marker(常规范围)、SanPrep 柱式PCR 产物纯化试剂盒购自生工生物工程(上海)股份有限公司;YT-015 Minute™总蛋白提取试剂盒(酵母、细菌、微藻等厚胞壁微生物)购自英文特生物技术(北京)有限公司;BCA 蛋白浓度测定试剂盒、DAB 辣根过氧化物酶显色试剂盒购自上海碧云天生物技术公司;SD/-Trp、SD/-Leu、SD/-Trp/-Leu、X-α-Gal、金担子素A(aureo-basidin A,AbA)、Carrier DNA、YPD Plus Medium、酵母转化PEG/LiAC混合液、0.9%氯化钠溶液(无菌)购自陕西普因特生物工程有限公司;XY-SH-150-Ⅲ型智能生化培养箱购自上海昕仪仪器仪表有限公司;THZ-300C 型恒温摇床(可制冷)购自上海一恒科技有限公司;T100TM Thermal Cycler 梯度PCR 仪、GelDoc XR + 凝胶成像系统购自美国BIO-RAD 公司;5418 型台式离心机购自德国Eppendorf公司;EPS300型电泳仪、Tanon 5200全自动化学发光图像分析系统购自上海天能科技有限公司;NanoDropTMOne/OneC 型超微量核酸蛋白浓度测定仪购自美国Nanodrop公司。
1.3 PD-L1生物信息学分析 使用SignalP-6.0(https://services.healthtech.dtu.dk/service.php?SignalP)预测PD-L1蛋白信号肽[13];TMHMM 2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测PDL1 蛋白跨膜结构域[14];SMART(http://smart.emblheidelberg.de/)预测PD-L1 结构域[15];并用DOG 2.0绘制蛋白质功能结构域示意图[16];使用NetNGlyc 1.0 Server(https://services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)查找PD-L1 蛋白糖基化位点[17];NetPhos3.1 Server 查找PD-L1 蛋白磷酸化位点[18];ITASSER(https://zhanggroup.org/I-TASSER/)预测PD-L1、PD-1蛋白三维结构[19];HAD-DOCK2.2(http://milou.science.uu.nl/services/HA-DDOCK2.2/)预测PD-L1 与PD-1 结合模式[20],并利用PyMOL1.7.0 程序对复合物作用机制进行解析并绘制对接模型图。
1.4 酵母双杂交重组pGBKT7-PD-L1 IgV诱饵质粒构建 根据NCBI GenBank 中公布的人PD-L1 CDS序列(NM_014143)设计扩增PD-L1 IgV结构域的引物。上游引物:5'-CGGAATTCATGCCCAAGGACCTATATGTGG-3'(斜体部分为保护碱基,下划线部分为EcoRⅠ酶切位点),下游引物:5'-ACGCGTCGACTTAATTGACTTTCACAGTAATTCGC-3'(斜体部分为保护碱基,下划线部分为SalⅠ酶切位点),扩增片段大小为330 bp。引物由生工生物工程(上海)股份有限公司合成。以pENTER-PD-L1质粒为模板,使用高保真DNA 聚合酶Pfu Mix PCR 扩增目的基因。反应体系:2×Pfu Mix 25µL,上下游引物(10µmol/L)各1µL,模板质粒(50 ng/µL)1µL,ddH2O 22µL,反应总体积为50µL。反应条件:94 ℃预变性3 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min,共30 个循环;72 ℃再延伸5 min。1%琼脂糖凝胶电泳鉴定后,使用SanPrep 柱式PCR 产物纯化试剂盒回收纯化,NanoDropTMOne/OneC 型超微量核酸蛋白浓度测定仪检测纯度和浓度。
将纯化回收的PCR 产物和酵母双杂交诱饵载体pGBKT7 分别经EcoRⅠ和SalⅠ双酶切,胶回收载体片段与目的片段,按1∶3摩尔比混合,T4 DNA连接酶4 ℃酶连过夜;42 ℃热激法转入E.coliDH5α 化学感受态细胞,涂布至含终浓度50µg/mL卡那霉素的LB固体平板上,37 ℃培养过夜;挑取单菌落,利用载体引物[BD-F:5'-CATCATCGGAAGAGAGTAGT-3',BDR:5'-GAAAGCAACCTGACCTACAG-3';由生工生物工程(上海)股份有限公司合成]进行PCR验证,并进行1%琼脂糖凝胶电泳鉴定。挑取阳性克隆子,接种至含终浓度50 µg/mL 卡那霉素的LB 液体培养基中,37 ℃振荡培养过夜;提取质粒,送生工生物工程(上海)股份有限公司测序。
1.5 酵母双杂交重组pGBKT7-PD-L1 IgV诱饵质粒的转化 将100 ng pGBKT7、pGBKT7-PD-L1 IgV分别加至预冷的1.5 mL EP 管中,加入5 µL carrier DNA(沸水浴变性5 min,冰浴快速处理2 min),混匀,加入100 µL Y2HGold 感受态细胞,混匀,加入500 µL PEG/LiAc缓冲液,混匀,30 ℃孵育30 min,每隔10 min上下颠倒6 ~8 次混合;加入20 µL DMSO,混匀,42 ℃水浴15 min,每隔5 min 上下颠倒6 ~8 次混合;10 000 ×g离心15 min;弃上清液,加入1 mL YPD Plus 液体培养基重悬细胞,30 ℃,200 r/min 振荡培养60 min;10 000×g离心15 s;弃上清液,加入1 mL 0.9% NaCl 溶液重悬细胞;取菌液200 µL,涂布至100 mm SD/-Trp 平板上,30 ℃培养3 ~5 d,直至长出2 mm左右单菌落。
1.6 重组阳性克隆子的菌落PCR鉴定 PCR管中加入25µL无菌超纯水,用无菌枪头蘸取SD/-Trp平板上少量新鲜酵母菌斑,数量不可过多,以免抑制PCR反应,水浴煮沸5 min;取1µL 作为PCR 模板,用Taq DNA聚合酶进行PCR扩增,扩增体系为12µL:超纯水4µL,PCR混合物6µL,载体上下游引物(10µmol/L)各0.5µL,菌液模板1µL。掌型离心机瞬时离心10 s混匀后,进行PCR。反应程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃再延伸5 min。1%琼脂糖凝胶电泳鉴定PCR产物。
目前,我国大多数的乡村旅游建设是由政府主导,尤其是在各种扶持政策文件下,得到当地乡镇政府的极大重视,为乡村旅游发展提供了基础保证,但仅靠政府力量并不足够,需要整合行业协会、企业、志愿者、村民等共同形成管理机构,统一规范管理。如借鉴“法兰西最美丽村庄”协会的经营模式,建立严谨的组织结构和管理机制,让本村的干部、提供资助的社团或企业以及部分有经验的并有一定学历的服务行业从业者组成执行代表团,共同参与建设,更多地赋权给对本地区概况极其了解且有一定学历背景的本地村民及有权威性的协会部门或企业,共同参与标准的制订与考核,平衡各相关者的利益,达到利益均衡才是可持续发展的根本动力。
1.7 诱饵蛋白PD-L1 IgV 表达的Western blot 分析按照YT-015 Minute™总蛋白提取试剂盒(酵母,细菌、微藻等厚胞壁微生物)说明书提取酵母总蛋白:挑取SD/-Trp平板上的酵母菌至20 mL SD/-Trp液体培养基中,30 ℃,180 r/min 培养18 ~24 h,至A600为0.8 ~1.0;于1.5 mL 离心管中离心收集菌体,菌体湿体积约30µL,加入1 mL 无菌超纯水重悬菌体,室温,12 000 ×g离心2 min;洗涤菌体,弃上清,取80 ~90 mg 蛋白提取粉,加入20 µL 变性缓冲液,研磨棒反复研磨2 min;加入150 ~200µL缓冲液,再研磨约30 s;涡旋振荡10 s;室温,12 000×g离心3 min;将上清液转移至新的EP 管,即为酵母总蛋白。用BCA 蛋白浓度测定试剂盒检测浓度,控制上样量为25µg,经12%SDS-PAGE分离蛋白;采用湿法转膜至PVDF 膜,封闭液室温封闭2 h;加入C-Myc Tag 兔源单克隆抗体(1∶1 000稀释),4 ℃孵育过夜;加入HRP Goat anti-rabbit IgG(1∶2 000 稀释),室温孵育2 h;DAB 试剂盒显色。内参为GAPDH 兔源单克隆抗体(1∶1 000稀释),转化酵母双杂交诱饵质粒pGBKT7的酵母Y2HGold为阴性对照。
1.8 诱饵蛋白PD-L1 IgV毒性和自我激活及其与hTrx相互作用的检测 分别转化pGBKT7空载体、pGBKT7-PD-L1 IgV质粒至Y2HGold 酵母感受态细胞中,分别挑取重组质粒转化子、空载体转化子于5 mL SD/-Trp液体培养基中,30 ℃,200 r/min 培养24 h,至A600为0.8 ~1.0;用生理盐水稀释至1×10-4,取100µL涂布SD/-Trp、SD/-Trp/X-α-Gal、SD/-Trp/X-α-Gal/AbA或SD/-Leu固体培养基上,30 ℃培养4 d;观察菌落生长情况,对比菌落大小、颜色及数量。
采用滴板法检测诱饵蛋白PD-L1 IgV 与hTrx 自我激活及相互作用。分别按照Y2HGold/pGBKT7-PD-L1IgV+Y187/pGADT7-hTrx、Y2HGold/pGBKT7-PD-L1 IgV+ Y187/pGADT7、Y2HGold/pGBKT7 +Y187/pGADT7-hTrx组合接种至2 × YPDA 培养基中,漩涡混匀,30 ℃,180 r/min 共培养12 ~16 h;设Y2HGold/pGBKT7-53 + Y187/pGADT7-T 为阳性对照,Y2HGold/pGBKT7 + Y187/pGADT7 为阴性对照,漩涡仪混匀,30 ℃180 r/min 培养12 ~16 h;测A600值,进行10倍稀释(100、10-1、10-2、10-3共4个梯度),每个稀释度取10µL,滴加至SD/-Trp/-Leu和SD/-Trp/-Leu/X-α-Gal/AbA 平板上,30 ℃培养3 ~5 d;拍照。
1.9 数据采集及分析 采用GelDoc XR+凝胶成像系统及Tanon 5200 全自动化学发光图像分析系统进行数据采集及分析。
2 结果
2.1 PD-L1 生物信息学分析 SignalP-6.0 预测结果显示,PD-L1 蛋白N-端1 ~18 号氨基酸(MRIFAVFIFMTYWHLLNA)为信号肽;TMHMM 2.0 预测结果显示,PD-L1 蛋白C-端239 ~261 号氨基酸(THLVILGAILLCLGVALTFIFRL)为跨膜结构域,C-端262 ~290 号氨基酸区域位于胞质内;SMART 预测结果显示,PD-L1 24 ~131号氨基酸为免疫球蛋白功能区域IgV,139 ~227 号氨基酸为IgC 结构域,239 ~261 号氨基酸为跨膜结构域,与TMHMM 2.0 预测结果一致;综上结果用DOG 2.0 绘制蛋白质功能结构域示意图,见图1A;NetNGlyc1.0 查找到PD-L1 蛋白糖基化位点为35、192、200、219 号氨基酸;NetPhos3.1 查找到PD-L1 存在30 个可能的磷酸化位点,其中苏氨酸磷酸化位点16个,酪氨酸磷酸化位点6个,丝氨酸磷酸化位点8 个;I-TASSER 预测获得PD-L1 和PD-1蛋白全长的三维结构,用于HADDOCK 进行分子对接,获得最佳对接模式,使用PyMOL1.7.0 程序进行解析,结果显示,PD-L1 IgV 结构域的113 ~126 氨基酸(RCMISYGGADYKRI)是与PD-1结合的核心区域,PD-1 的V64、N66、Y68、Q75、T76、K78、I126、L128、A132、I134 和E136 是其与PD-L1 结合的关键氨基酸位点,见图1B。
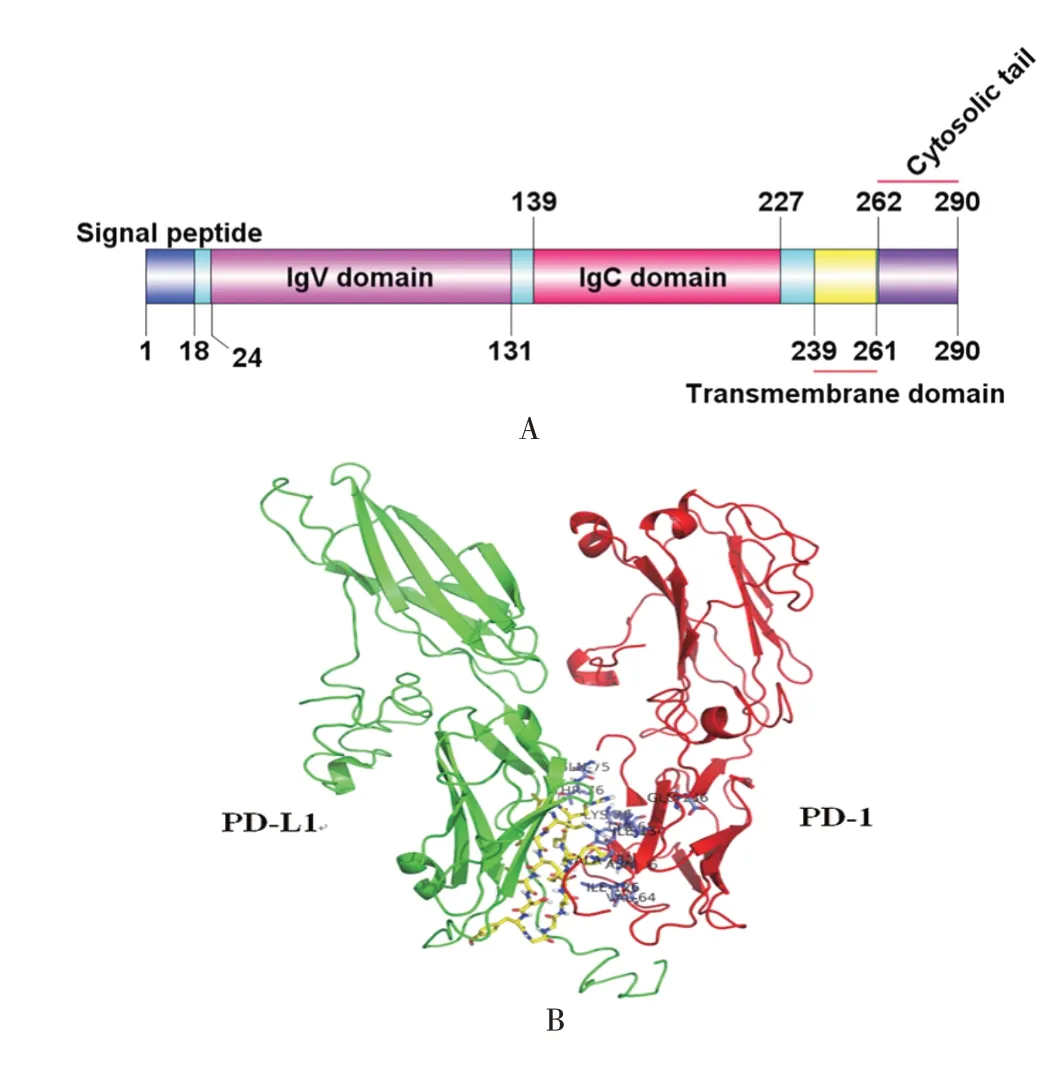
图1 PD-L1 结构模式图(A)及其与PD-1 分子对接模型图(B)Fig.1 Pattern diagram of PD-L1 structure(A)and its docking model diagram with PD-1 molecule(B)
2.2 酵母双杂交重组pGBKT7-PD-L1 IgV诱饵质粒的鉴定PD-L1 IgV基因扩增产物经1.0%琼脂糖凝胶电泳分析,可见约330 bp的特异条带,大小与预期相符,见图2。PCR 产物经纯化试剂盒回收纯化,NanoDropTMOne/OneC 型超微量核酸蛋白浓度测定仪检测其浓度为56.1 ng/µL,A260/A280为1.88,可用于下游双酶切试验,构建至pGBKT7 载体上,见图3。将纯化回收的PD-L1 IgVPCR 产物和pGBKT7 载体分别经EcoRⅠ和SalⅠ双酶切及纯化回收,目的片段浓度为42.9 ng/µL,A260/A280为1.89,载体浓度为49.5 ng/µL,A260/A280为1.91,转化DH5α 感受态细胞,涂板,菌落PCR产物经1%琼脂糖凝胶电泳分析,可见732 bp 的重组片段,大小与预期一致,见图4。提取阳性克隆子质粒测序鉴定结果与预期序列一致,见图5。
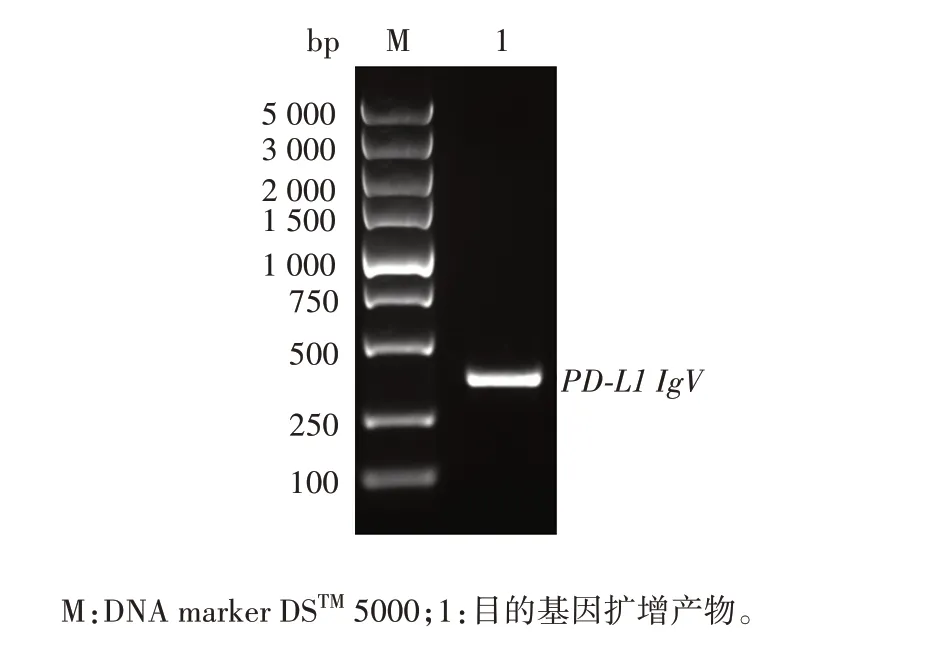
图2 PD-L1 IgV基因PCR扩增产物电泳图Fig.2 Electrophoretic map of PD-L1 IgV gene PCR amplification products
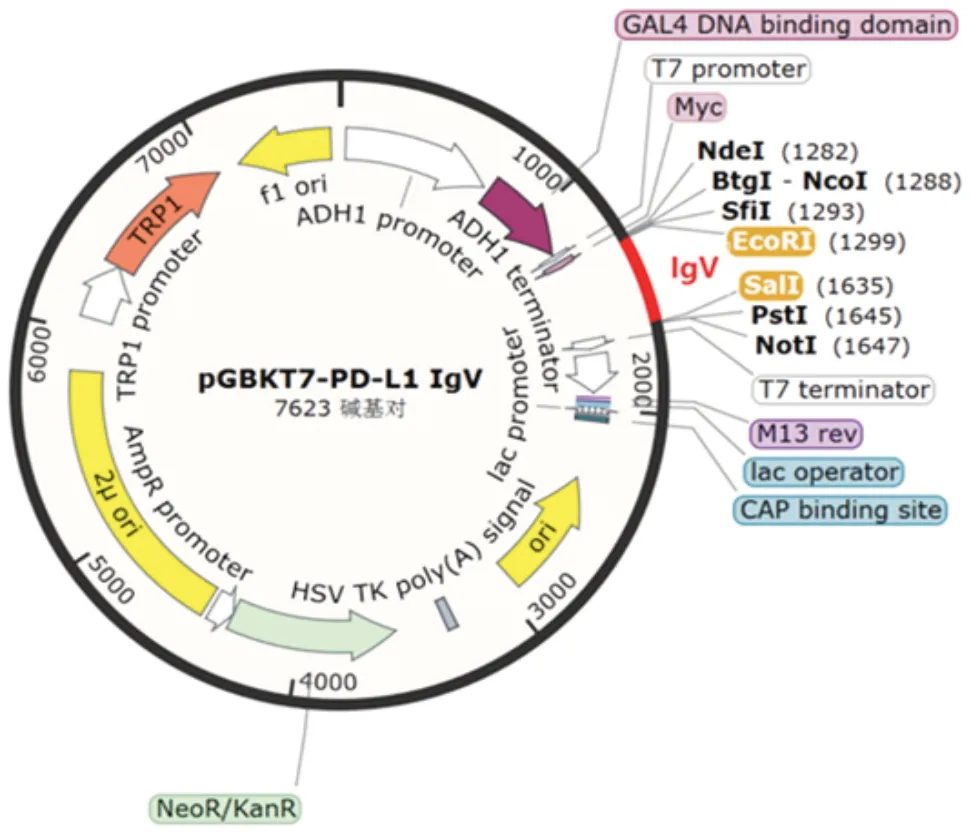
图3 酵母双杂交重组pGBKT7-PD-L1 IgV诱饵质粒图谱Fig.3 The map of yeast two-hybrid recombinant pGBKT7-PD-L1 IgV bait plasmid
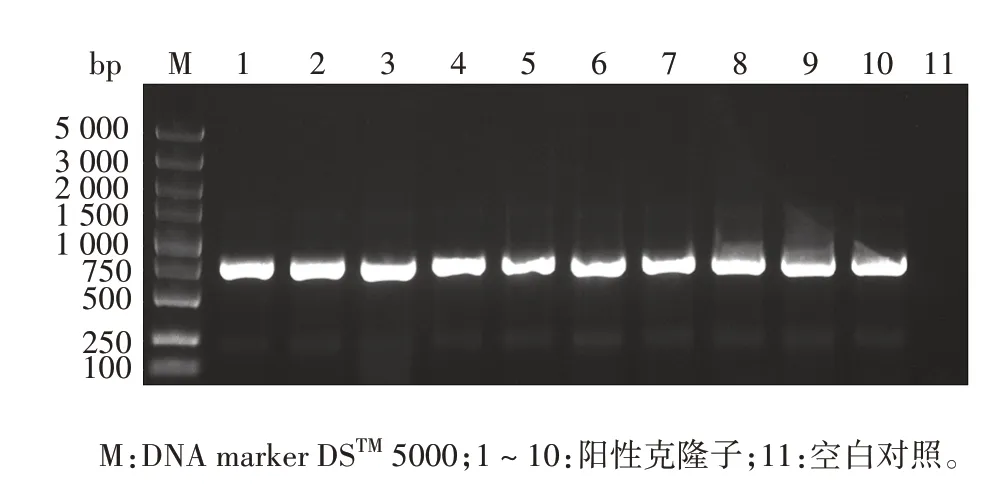
图4 含重组质粒pGBKT7-PD-L1 IgV 的阳性克隆子菌落PCR筛选Fig.4 PCR screening of positive clones of recombinant plasmid pGBKT7-PD-L1 IgV

图5 酵母双杂交重组pGBKT7-PD-L1 IgV 诱饵质粒测序图谱Fig.5 Sequencing map of yeast two-hybrid recombinant pGBKT7-PD-L1 IgV bait plasmid
2.3 酵母双杂交重组pGBKT7-PD-L1 IgV诱饵质粒转化产物的鉴定 菌落PCR 鉴定结果显示,导入空载体pGBKT7 的Y2HGold 酵母PCR 产物理论大小为402 bp,导入质粒pGBKT7-PD-L1 IgV的Y2HGold 酵母PCR 产物理论大小为732 bp,均与预期相符,见图6。表明质粒已成功导入Y2HGold酵母。
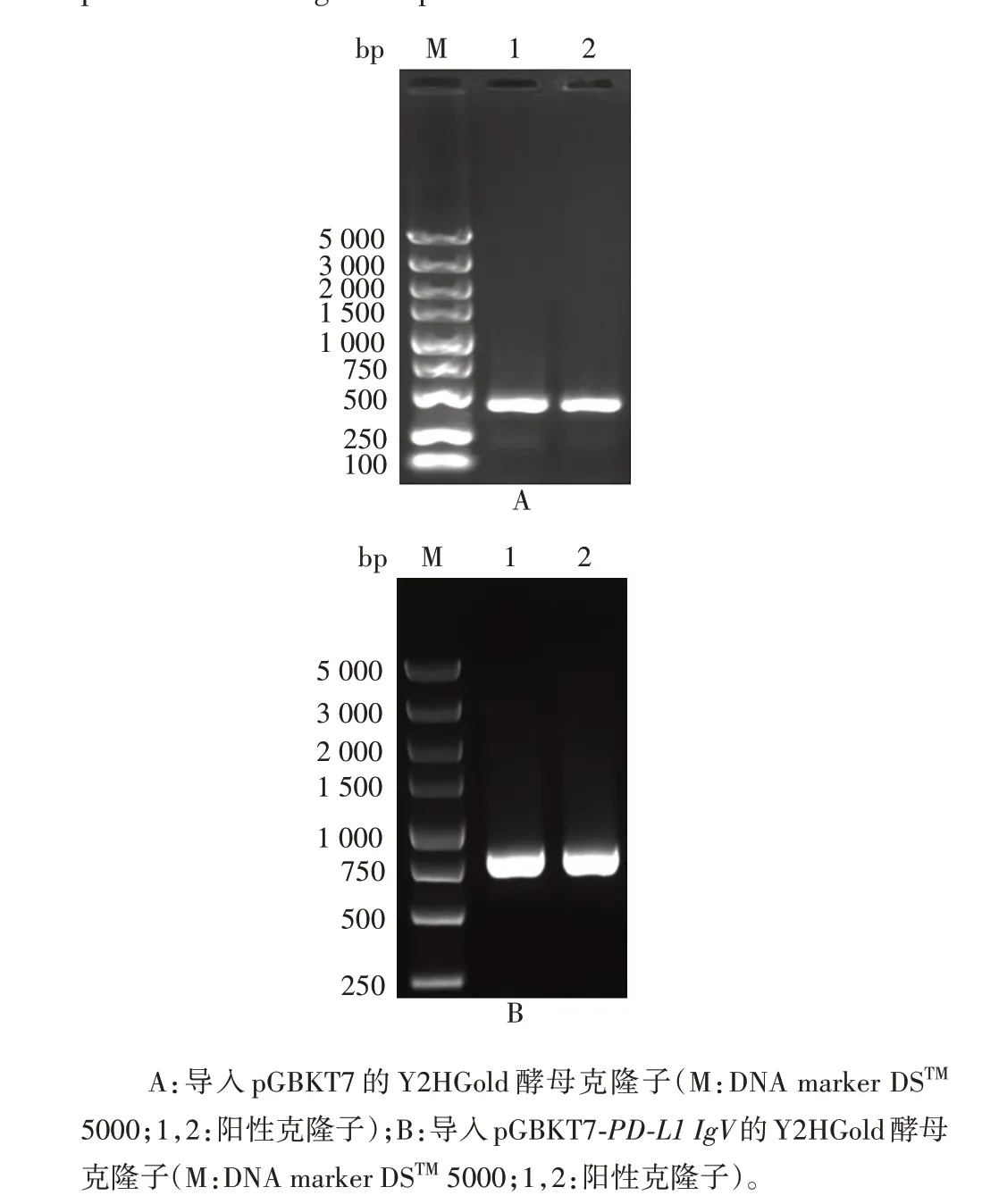
图6 酵母菌落PCR筛选阳性克隆子Fig.6 Screening of positive clones by yeast colony PCR
2.4 诱饵蛋白PD-L1 IgV 的鉴定 12% SDS-PAGE分析显示,在相对分子质量约14 400 处可见特异条带,大小与PD-L1 IgV 理论值(14 950)相符;Western blot分析显示,在相对分子质量约14 400处可见明显目的条带,大小与预期相符。见图7。表明诱饵蛋白PD-L1 IgV在Y2HGold酵母中能够稳定表达。
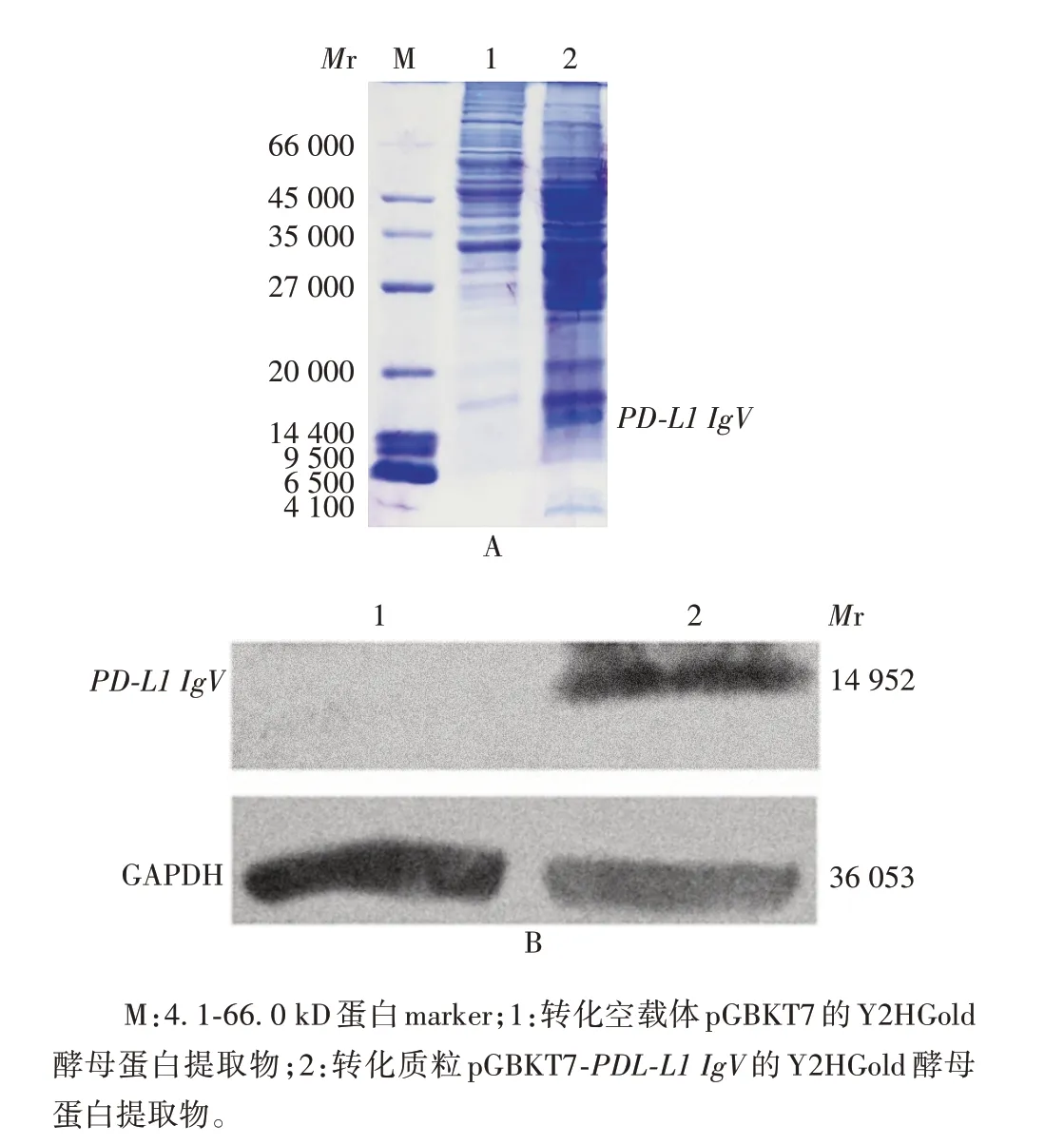
图7 SDS-PAGE(A)和Western blot 法(B)鉴定诱饵蛋白PD-L1 IgV的表达Fig. 7 Analysis of the expression of bait protein PD-L1 IgV by SDS-PAGE(A)and Western blot(B)
2.5 PD-L1 IgV 蛋白毒性和自我激活效应及其与hTrx 互作情况 空载体pGBKT7、质粒pGBKT7-PDL1 IgV转化Y2HGold酵母感受态细胞涂布SD/-Trp、SD/-Trp/X-α-Gal、SD/-Trp/X-α-Gal/AbA平板培养3 ~5 d后,结果显示,两者在SD/-Trp、SD/-Trp/X-α-Gal平板上生长良好,菌落大小、数量一致,呈白色,在SD/-Trp/X-α-Gal/AbA平板上两者均不生长,见图8。表明PD-L1 IgV 蛋白对酵母无毒性,且无自我激活效应。采用滴板法检测诱饵蛋白PD-L1 IgV与hTrx自我激活与相互作用,结果显示,所有实验组在SD/-Trp/-Leu平板上生长良好,仅阳性对照组可在SD/-Trp/-Leu/X-α-Gal/AbA平板上生长且呈蓝色,见图9。表明诱饵蛋白PD-L1 IgV、猎物蛋白hTrx不存在自我激活现象,且两者之间也不存在相互作用。
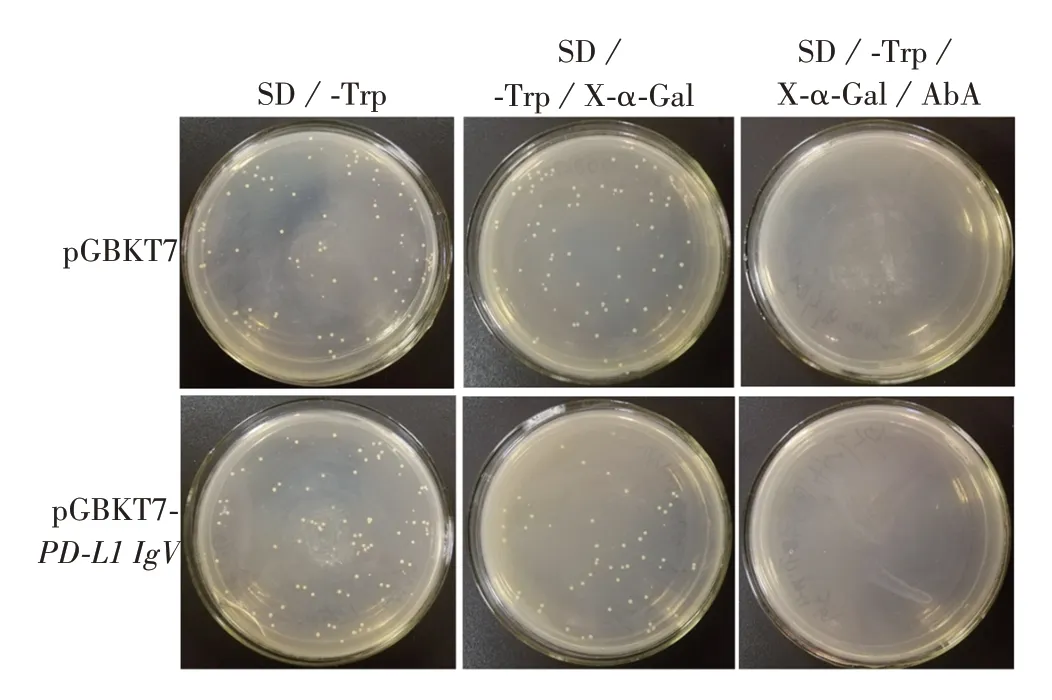
图8 PD-L1 IgV蛋白毒性及自我激活检测Fig.8 Detection of PD-L1IgV protein toxicity and self-activation
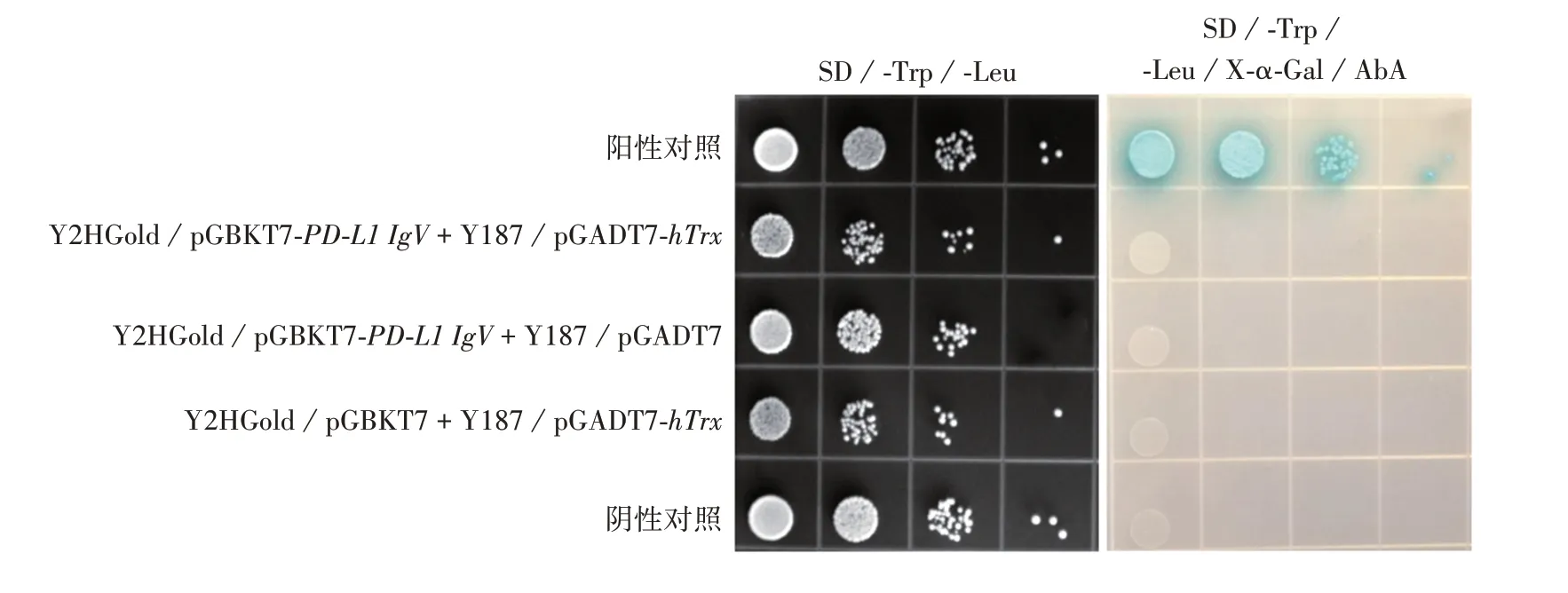
图9 PD-L1 IgV蛋白和hTrx相互作用检测Fig.9 Detection of interaction between PD-L1 Igv protein and hTrx
3 讨论
通过靶向阻断PD-1/PD-L1 信号通路,重新激活T 细胞,已成为当前肿瘤免疫治疗焦点。本研究选择PD-1/PD-L1 信号通路中的PD-L1 进行了生物信息学分析,其中IgV 结构域是与PD-1 结合的关键区域,克隆构建的PD-L1 IgV酵母双杂交诱饵质粒,在酵母Y2HGold 中可稳定表达,无细胞毒性和自我激活作用,且与hTrx之间无相互作用。
PD-L1基因全长873 bp,定位于人9 号染色体短臂2 区4 带第1 亚带,胞内合成的新生肽通过N-端信号肽(MRIFAVFIFMTYWHLLNA)引导,经内质网和高尔基体糖基化等修饰后成熟,通过细胞分泌途径转运至肿瘤细胞表面。PD-L1 是一种跨膜糖蛋白,具有免疫球蛋白样结构域IgV、IgC,以及跨膜结构域和约30个氨基酸长度的胞质尾巴[21-22]。越来越多的证据表明,PD-L1 35、192、200、219 号氨基酸高度N-糖基化有助于PD-L1蛋白的稳定性及其与PD-1相互作用,促使肿瘤细胞免疫逃避[23-24]。PD-L1可在不同的丝氨酸/苏氨酸/酪氨酸位点发生磷酸化修饰,影响其稳定性和功能,可见对PD-L1 的修饰机制研究,将为提高靶向阻断PD-1/PD-L1 信号通路的有效性提供新的策略,从而进一步提高肿瘤免疫治疗效果[25]。PD-L1 通过其IgV 结构域与PD-1 相互作用,其中IgV 113 ~126 号氨基酸(RCMISYGGADYKRI)是与PD-1相互作用的核心区域,因此该区域常常成为小分子或者肽类抑制剂的靶区域[26-27]。综合生物信息分析及相关文献报道,本研究克隆构建了人PD-L1 IgV结构域酵母双杂交诱饵质粒,并成功转入酵母Y2HGold 细胞中,菌落PCR 直接检测阳性克隆子,其产物均为特异目标条带,表明质粒成功转化至酵母细胞中,对阳性克隆子进行培养,提取总蛋白,Western blot 分析表明,PD-L1 IgV 可在Y2HGold酵母细胞中稳定表达。
肽适体是一种小的组合蛋白质,由两部分组成:骨架蛋白以及在骨架蛋白上以环状嵌入的一段由5 ~20 个随机氨基酸残基组成的可变肽。常见的肽适体骨架蛋白有hTrx、细菌硫氧还蛋白、金黄色葡萄球菌核糖核酸酶SNase 等,其中hTrx 已被证实可在酵母细胞中作为GAL4转录因子激活域(GAL4 activation domain,Gal4 AD)融合蛋白表达[28-29]。肽适体类似于抗体,又称类抗体,既有类似抗体的高亲和力和特异性,又具有低毒和低免疫原性,尺寸小,在胞内可溶表达,生产更快、更容易、成本更低,在抗肿瘤、抗菌、抗病毒等重要疾病的防治方面展现出广泛的应用前景[30]。酵母双杂交技术常用于筛选靶向结合某些关键蛋白的特异肽适体,干扰靶蛋白的生物学功能。1989 年,FIELDS 等利用酿酒酵母GAL4 转录激活因子的特性,首次建立了酵母双杂交系统,已成为发现蛋白质相互作用的重要研究方法。GAL4 转录因子由功能上相互独立的2 个结构域组成:N-末端结构域能识别结合上游激活序列(upstreaming activating sequence,UAS),又称为DNA 结合域(DNA-binding domain,DNA-BD);C-末端结构域又称激活结构域(activation domain,AD)是激活转录所必需的,启动UAS 下游基因转录。酵母双杂交系统由3 部分组成:与BD融合的蛋白表达载体pGBKT7,被表达的蛋白称诱饵蛋白(bait),与AD 融合的蛋白表达载体pGADT7,被其表达的蛋白称靶蛋白或猎物蛋白(prey),以及带有报告基因的宿主菌株,如Y2HGold 酵母菌株,其报告基因为AbAr(AbA 缺陷,可显著降低假阳性和背景)、HIS3(组氨酸缺陷)、ADE2(腺嘌呤缺陷你)和MEL1(X-α-gal 缺陷)。Y187 酵母菌株报告基因为lacZ(β-半乳糖苷酶缺陷)、MEL1(X-α-gal缺陷)。同时pGBKT7质粒具有卡那霉素抗性和色氨酸(Trp)营养标记基因,pGADT7质粒具有氨苄青霉素抗性和亮氨酸(Leu)营养标记基因,用于质粒的鉴定与分离。一般BD 和AD 单独存在不能激活转录,融合蛋白时需要检测蛋白对宿主菌种毒性及自我激活能力,可显著降低酵母双杂交假阳性概率。当诱饵蛋白和猎物蛋白发生相互作用时,BD 与AD 才会相互接近,形成完整的GAL4转录因子,激活下游报告基因的表达[31-32]。本研究通过将pGBKT7 及其衍生质粒转入Y2HGold 酵母感受态细胞,pGADT 及其衍生质粒转入Y187酵母感受态细胞,复苏后分别涂布SD/-Trp、SD/-Leu,使用AUR1-C和MEL1报告基因检测PDL1 IgV 和hTrx 毒性及自我激活效应,以及两者之间是否有相互作用,在后续肽适体筛选中将会显著降低假阳性概率。
综上所述,本研究成功构建了人PD-L1 IgV酵母双杂交诱饵质粒,并检测出PD-L1 IgV 对酵母细胞无毒性且无自我激活效应,且与hTrx 无相互作用。后续可利用hTrx 为骨架蛋白构建肽适体文库,用于筛选能与PD-L1 IgV 特异结合的肽适体,开发靶向抑制PD-1/PD-L1信号通路的抗肿瘤肽适体药物。

