结核分枝杆菌分子伴侣Acr2蛋白的原核表达及其功能分析
张宗欣,赵纪元,孙红宾
郑州轻工业大学食品与生物工程学院,河南 郑州 450002
根据世界卫生组织发布的2020 年全球结核病报告,2019 年全球新诊断并报告的结核病患者约710万,每年至少有100万儿童患结核病,其中约20万死亡病例,结核病仍是威胁全球人类健康的重要公共卫生问题之一[1-2]。目前,感染多重耐药结核杆菌人数的持续增加及结核分枝杆菌(Mycobacterium tuber-culosis,Mtb)在人体内休眠期的延长均给结核病的治疗带来极大挑战[3-4]。寻找新靶点以开发新的抗结核药物成为急需解决的问题。
热休克蛋白(heat shock proteins,HSPs)是一类广泛存在于原核和真核生物中的热应激蛋白,根据其同源程度和相对分子质量,可分为HSP110、HSP90、HSP70、HSP60 及小分子热休克蛋白(small HSPs,sHSPs)[5-6]。Mtb中的sHSPs高度保守,且可显著增强机体抗Mtb感染的细胞免疫应答能力[7]。Mtb 在不同应激状态下可高表达两类sHSPs:一类为hspX基因编码的Acr1蛋白(又称Hsp16.3、16 ku抗原或HspX),另一类为acr2基因编码的Acr2 蛋白[8],这两类蛋白具有相似的sHSPs 特征,均含有保守的α-晶体结构域(α-crystalline domain,ACD),该结构域可形成大的寡聚复合物,且在体外具有不依赖ATP的伴侣功能[9-10]。据报道,ACD 与Mtb 长期潜伏在人体内导致的持续感染有关[11]。在缺氧或存在一氧化氮的条件下,可诱导Mtb 表达Hsp16.3 蛋白[12-13];在热休克、氧化应激和巨噬细胞摄取条件下,可诱导Mtb 表达Acr2 蛋白,且在体外具有分子伴侣活性[14-16]。Acr2 蛋白表达调控在Mtb 的发病机制中发挥重要作用,其上调可显著提高机体抗Mtb 感染的细胞免疫应答能力,降低Mtb 在感染期间的存活率[7]。大多数蛋白在高温下变性并发生热聚集,如作为测定sHSPs分子伴侣功能的底物,包括柠檬酸合成酶(citrate synthase,CS)、胰岛素和苹果酸激酶(malate dehydrogenase,MDH)等[17]。本研究通过E.coli表达系统表达Acr2,经Ni-NTA 层析及SuperdexTM200 10/300 GL 凝胶过滤层析后,采用底物结合试验检测其在体外的分子伴侣活性,以期为制备具有天然活性的结核杆菌蛋白抗原提供新策略。
1 材料与方法
1.1 质粒及菌株 重组质粒pET-28a-Acr2由郑州轻工业大学食品与生物工程学院蛋白纯化实验室构建(经南京金斯瑞生物科技有限公司测序鉴定,证明构建正确);感受态E.coliBL21(DE3)购自生工生物工程(上海)股份有限公司。
1.2 主要试剂及仪器 MDH购自美国Sigma公司;IPTG、硫酸卡那霉素(Kan)、DTT、Ni-NTA 树脂及其他化学试剂均购自生工生物工程(上海)股份有限公司;天然Acr2蛋白由郑州轻工业大学食品与生物工程学院蛋白纯化实验室制备;凝血酶购自北京索莱宝科技有限公司;SuperdexTM200 10/300 GL 凝胶过滤层析柱购自美国GE Healthcare 公司;圆二色谱仪购自英国Chirascan公司。
1.3 Acr2 的表达及纯化 将重组质粒pET-28a-Acr2转化感受态E.coliBL21(DE3),当A600达0.6 时,加入IPTG 至终浓度为1 mmo/L,37 ℃诱导4 h;于4 ℃,2 920×g离心15 min,收集重组菌,用裂解缓冲液A(25 mmo/L Tris-HCl,500 mmo/L NaCl,1%甘油,10 mmo/L 咪唑,1 mmo/L PMSF,pH 8.0)重悬,经高压破菌仪裂解细胞后,4 ℃,7 592×g离心30 min;取上清,经Ni-NTA 层析柱纯化,依次采用含30、80、150、250、350、500 mmol/L 咪唑的缓冲液A 进行梯度洗脱。收集含有目标蛋白洗脱液,置缓冲液B(50 mmo/L 磷酸缓冲液,100 mmo/L NaCl,pH 7.0)中,于4 ℃浓缩透析过夜至2.5 mL;用凝血酶切除His标签,经缓冲液B预平衡的SuperdexTM200 10/300 GL凝胶过滤层析柱进一步纯化,纯化样品经超滤离心管超滤浓缩至500µL,紫外吸收光谱法检测蛋白浓度。取各步骤样品,经还原型16.5%SDS-PAGE分析。
1.4 变性对Acr2蛋白二级结构影响的检测
1.4.1 Acr2 的变性及复性 将纯化Acr2 蛋白样品按1∶1 的体积分数溶于缓冲液B,100 ℃温浴15 min(热变性),立即置于冰上冷却5 min。另将纯化Acr2蛋白按1∶1 的体积分数溶于8 mol/L 尿素中,37 ℃温浴4 h(化学变性);置200 倍体积缓冲液B 中透析12 h,去除变性剂。
1.4.2 圆二色性光谱法 将Acr2 蛋白热变性、化学变性及其复性样品分别用缓冲液B 稀释至浓度为0.5 mg/mL,采用圆二色谱仪于200~260 nm 光谱范围内进行扫描,间隔时间为0.1 min,扫描速率为100 nm/min。
1.4.3 非还原型SDS-PAGE 分析 将Acr2 蛋白两种变性后的复性样品,以Tris-甘氨酸为缓冲系统,于4 ℃进行非还原型6%SDS-PAGE分析。
1.5 Acr2 蛋白体外分子伴侣活性检测 采用底物结合试验。将MDH(13.4 µmol/L)分别与天然Acr2蛋白和两种变性后复性的Acr2蛋白(50µmol/L)混合,置25和48 ℃温控水浴中孵育2 h;于4 ℃,7 008×g离心5 min,取上清,对其进行分子排阻色谱分析(size exclusion chromatography,SEC),即上样至预填充柱SuperdexTM200 10/300 GL,流动相为50 mmol/L 磷酸盐缓冲液(含100 mmol/L NaCl,pH 7.0),流速为0.5 mL/min,温度为4 ℃。收集各峰样品,进行还原型16.5%SDS-PAGE分析。
1.6 数据采集及分析 应用UNICRONTM7 软件进行数据采集及分析,Origin 8.0 软件作图。
2 结果
2.1 Acr2 蛋白纯化产物的鉴定 80、150、250、350、500 mmol/L咪唑缓冲液洗脱样品中的His-Acr2蛋白相对分子质量约23 000,大小与预期相符,且纯度较高,见图1。His-Acr2 蛋白经SuperdexTM200 10/300 GL 凝胶过滤层析柱纯化后,于7 mL体积处被洗脱出来,相对分子质量约为232 000,与理论值相差较大,表明Acr2在溶液中以多聚体形式存在,见图2。目的峰蛋白纯度达90%以上,浓度约为2 mg/mL,见图3。
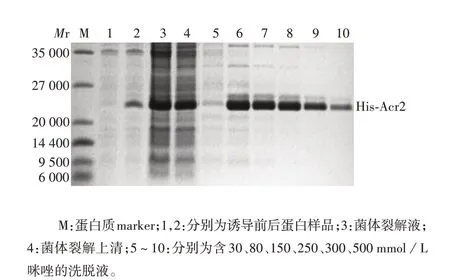
图1 Ni-NTA 层析柱纯化His-Acr2 蛋白的还原型SDSPAGE分析Fig. 1 Reduced SDS-PAGE analysis of His-Acr2 protein purified by Ni-NTA chromatographic column

图2 Acr2蛋白凝胶过滤层析纯化图谱Fig.2 Profile of Acr2 protein purified by gel filtration chromatography
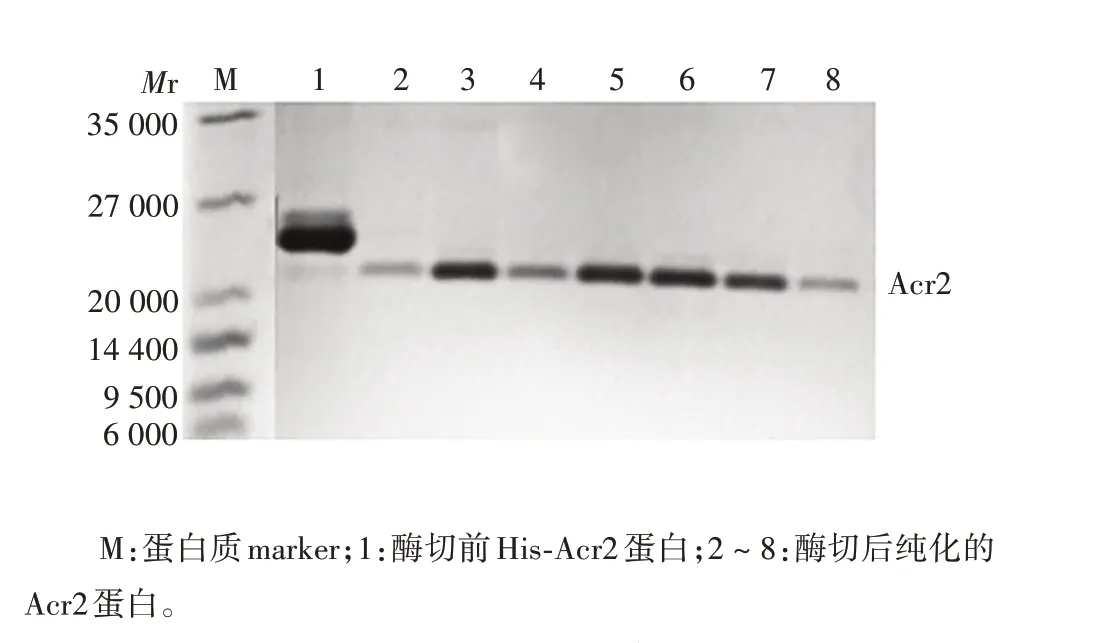
图3 凝胶过滤层析纯化Acr2 蛋白的还原型SDS-PAGE分析Fig. 3 Reduced SDS-PAGE analysis of Acr2 protein purified by gel filtration chromatography
2.2 变性对Acr2二级结构的影响
2.2.1 圆二色性光谱法 热变性及化学变性的Acr2的圆二色性光谱显示,其不再是以β 折叠为核心的特征光谱,表明两种变性条件可导致Acr2 蛋白天然的二级结构丧失,两种复性蛋白的圆二色性光谱与天然Acr2 蛋白一致,表明变性后复性的Acr2 蛋白可恢复其原来的二级结构。见图4。
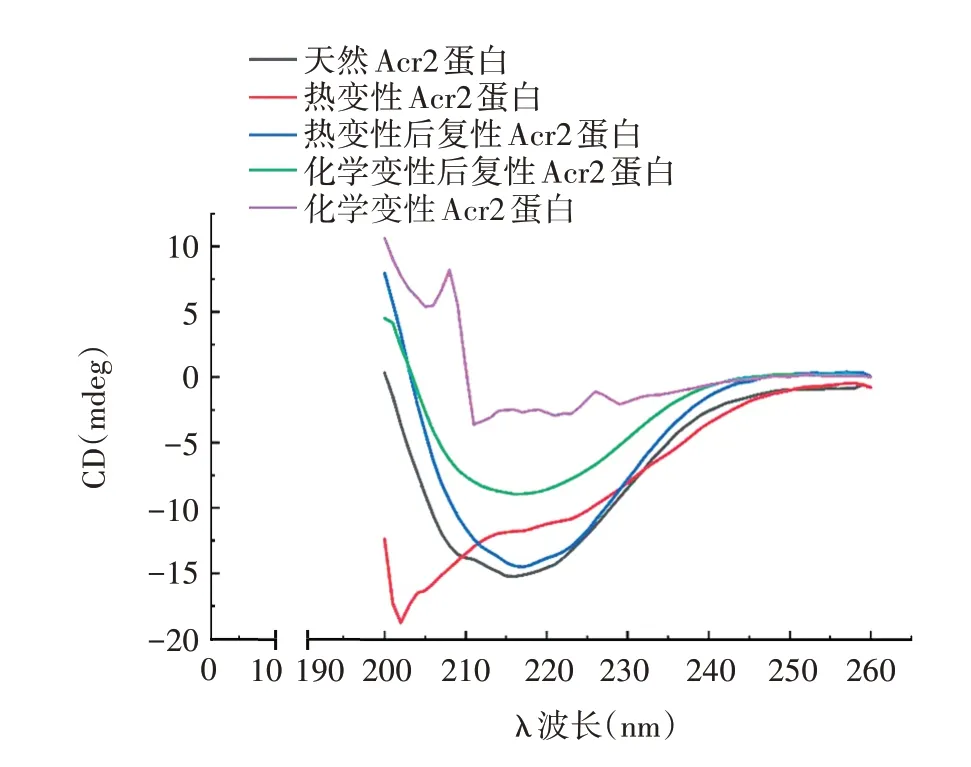
图4 Acr2蛋白的圆二色性光谱分析Fig.4 Circular dichroism spectroscopy analysis of Acr2 protein
2.2.2 非变性SDS-PAGE 分析 两种复性Acr2 蛋白经非还原型6%SDS-PAGE 分析,可见目的蛋白与天然Acr2 蛋白大小一致,见图5。表明Acr2 的二级结构在变性条件下发生的变化是完全可逆的。
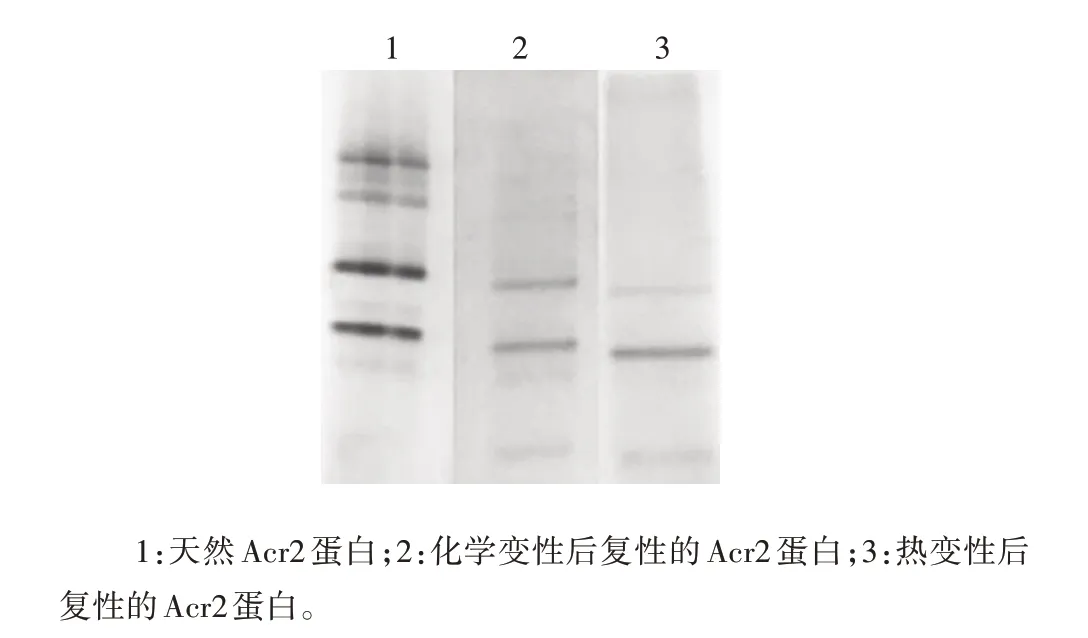
图5 Acr2蛋白的非还原型SDS-PAGE分析Fig.5 Non-reduced SDS-PAGE analysis of Acr2 protein
2.3 Acr2蛋白的体外分子伴侣活性
2.3.1 天然Acr2 蛋白 将天然Acr2 蛋白与MDH 48 ℃混合,经SEC 色谱分析,于体积8.5 mL 处可见1个清晰的峰(峰1),该峰由MDH 和天然Acr2 蛋白组成,峰2 和峰3 由天然Acr2 蛋白组成,峰4 由MDH组成;经25 ℃混合后,于体积14.5 mL处可见1个清晰的峰(峰4),该峰由MDH 组成,峰1、峰2 和峰3 由天然Acr2 蛋白组成。经还原型16. 5% SDS-PAGE 分析,可见4 个洗脱峰对应的条带大小与理论值均相符。见图6 和图7。表明天然的Acr2 蛋白可与MDH 在高温条件下形成复合物,防止MDH形成热聚集。

图7 天然Acr2蛋白与MDH混合物(25 ℃)的鉴定Fig. 7 Identification of mixture of natural Acr2 protein and MDH(25 ℃)
2.3.2 复性Acr2 蛋白 将两种复性Acr2 蛋白与MDH 48 ℃混合,经SEC 色谱分析,于体积8.5 mL 处可见1个清晰的峰(峰1),该峰由MDH和两种复性Acr2蛋白组成,峰2 和峰3 由两种复性Acr2 蛋白组成,峰4由MDH 组成;经25 ℃混合后,于体积14.5 mL处可见1 个清晰的峰(峰4),该峰由MDH 组成,峰1、峰2和峰3 为两种复性Acr2 蛋白组成。经还原型16.5%SDS-PAGE 分析,可见4 个洗脱峰对应条带的大小与理论值相符。见图8~11。表明变复性后的Acr2 蛋白具有体外分子伴侣活性。
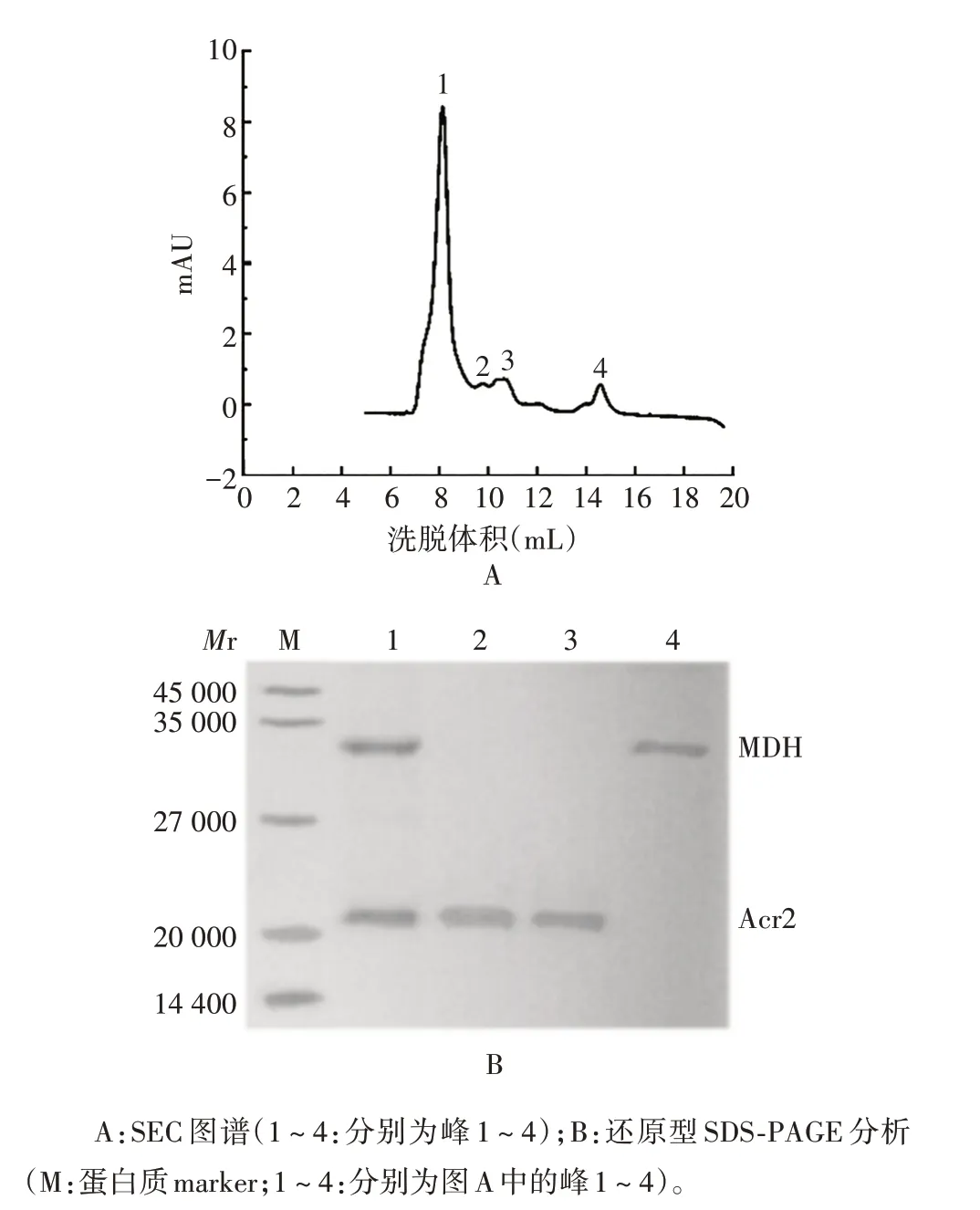
图8 热变性-复性Acr2蛋白与MDH混合物(48 ℃)的鉴定Fig.8 Identification of mixture of Acr2 protein and MDH after thermal denaturation-renaturation(48 ℃)
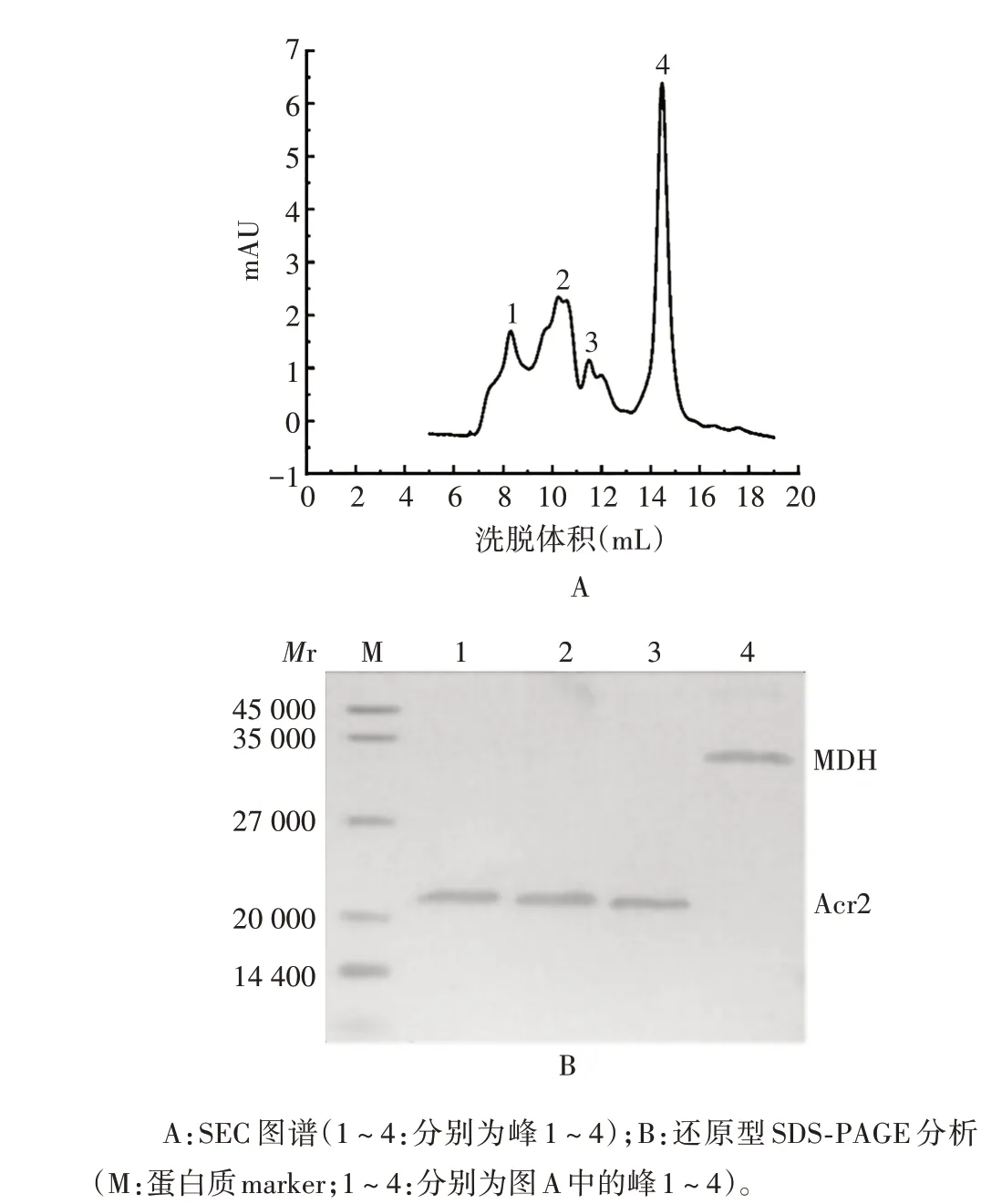
图9 热变性-复性Acr2蛋白与MDH混合物(25 ℃)的鉴定Fig.9 Identification of mixture of Acr2 protein and MDH after thermal denaturation-renaturation(25 ℃)
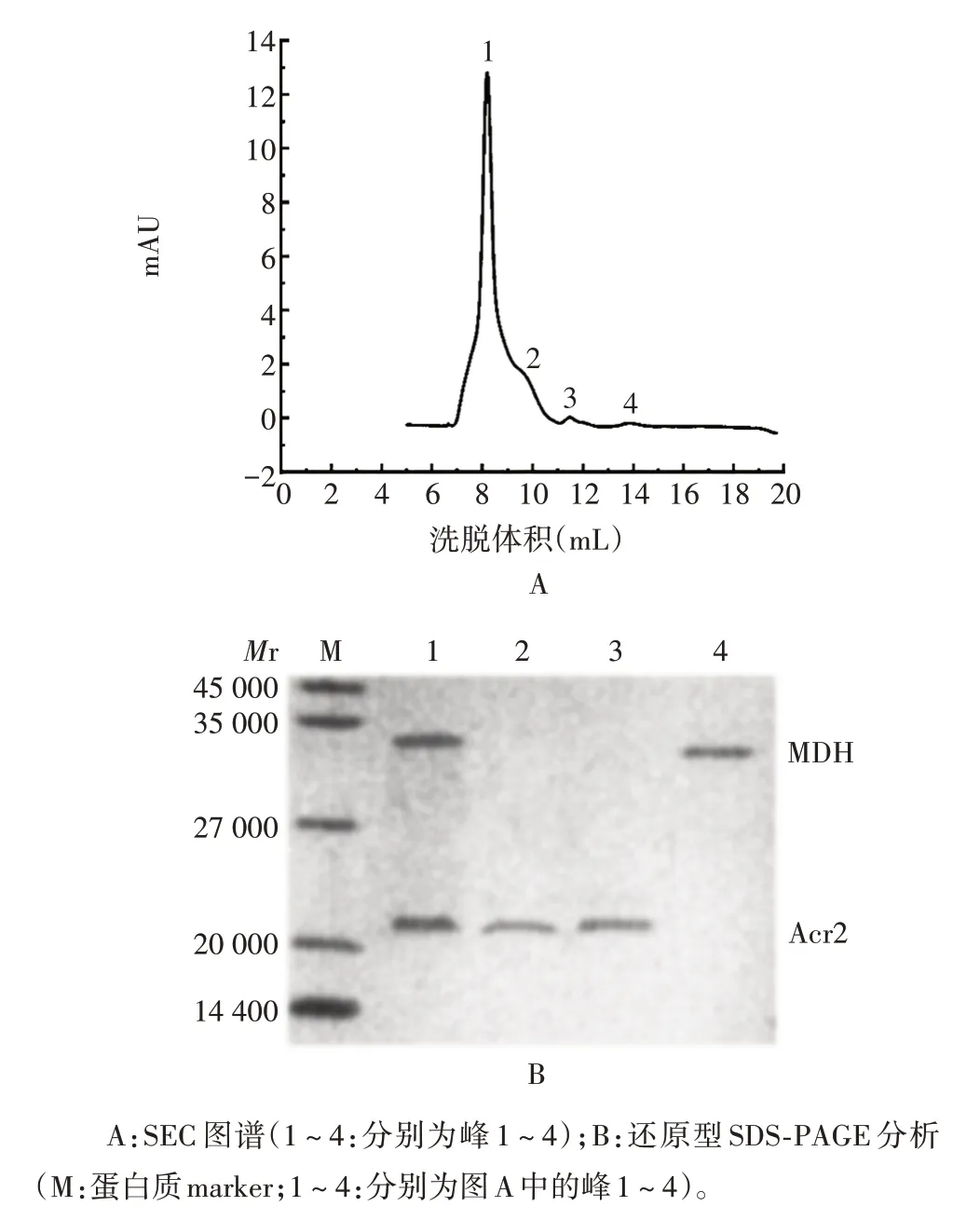
图10 化学变性-复性Acr2蛋白与MDH混合物(48 ℃)的鉴定Fig. 10 Identification of mixture of Acr2 protein and MDH after chemical denaturation-renaturation(48 ℃)
3 讨论
Mtb是引发结核病的病原体,可潜伏在肺部巨噬细胞达数十年,且在该状态下,Mtb 的复制与机体的免疫系统应答处于动态平衡状态,导致结核病较难根治[18]。Mtb 感染早期采取的一种免疫逃逸策略是为了延缓吞噬体的成熟及免疫识别。研究发现,Acr2 的早期表达不仅可保护处于潜伏状态的Mtb 免受体内环境的攻击,还可使Mtb 暴露于免疫应答之中。因此Acr2 可能成为新型抗结核病药物的理想靶点[19]。
本研究在E.coli中成功表达了重组蛋白Acr2,经纯化获得了较高纯度的蛋白。通过洗脱峰色谱图发现,相对分子质量与理论值差异较大,推断Acr2蛋白具有多聚性,形成相对分子质量较大的多聚体。由于SDS-PAGE 具有解聚性,使Acr2 蛋白在电泳图中的相对分子质量与其单体大小相符。热变性和化学变性是使蛋白变性的最常用方法。二级结构大多以β-折叠为核心是sHSPs 家族成员的典型特征之一,Acr2蛋白分别经高温加热和高浓度尿素两种途径变性,复性过程在无其他辅助蛋白参与下,通过自发再折叠和再组装,可恢复至其二级结构的天然构象,这对维持Acr2蛋白的生物学活性和功能十分重要。本研究结果表明,由于Acr2 蛋白自身所具有的聚合特性,经变性-复性后的Acr2蛋白可在48 ℃热激条件下与变性的MDH 形成稳定的复合物。根据Acr2 蛋白的多聚性使Acr2 蛋白及其与MDH 形成的复合物出峰位置与单体蛋白的出峰位置差异较大,SDS-PAGE的解聚性使电泳图中Acr2蛋白及其复合物的蛋白条带均显示以单体形式存在。表明经变性-复性后的Acr2蛋白在体外也能与底物结合发挥其分子伴侣活性。本研究制备的Mtb 分子伴侣Acr2 蛋白有望作为有效诊断Mtb 潜伏感染的靶标蛋白,对治疗人类Mtb 潜伏期感染药物的研发具有重要意义。

