超声波辅助制备蓝莓花青素微胶囊的工艺研究
翁 霞,孔 月
(1.鞍山师范学院 化学与生命科学学院,辽宁 鞍山 114007;2.辽宁省天然产物活性分子开发及利用重点实验室,辽宁 鞍山 114007)
蓝莓(VacciniumSpp.)是杜鹃花科越橘属植物,又称笃斯越橘.蓝莓果实营养丰富,富含花青素、多酚、超氧化物歧化酶等活性成分[1].花青素具有抗氧化、保护视力、保护心血管、增强免疫力等生理功能,开发利用价值高,在食品、医药、化妆品等领域有巨大的应用前景[2-3].但是蓝莓花青素不稳定,在加工过程中易受pH、温度、浓度、酶、光照、氧气、金属离子等条件影响,因此,如何提高花青素的稳定性成为花青素应用领域的关键问题.
微胶囊技术具有保护敏感成分、阻碍物质间的相互作用及延长贮藏时间等优点[4-5].壁材的选择往往是依据微胶囊产品的最终用途、包埋芯材类型以及具体制备方法来确定[6].GUO等[7]以海藻酸钠-果胶包裹紫玉米和蓝莓提取物,包埋处理明显降低了花青素色苷的光降解率.CAI等[8]以羟甲基淀粉复合黄原胶为壁材包埋蓝莓花青素,发现可以提高蓝莓花青素稳定性.DA ROSA等[9]以麦芽糖糊精和玉蜀黍为壁材,采用喷雾干燥法制备蓝莓花青素微胶囊,提高了花青素的稳定性.贺博[10]以羧甲基壳聚糖为壁材,研究蓝莓花色苷纳米微胶囊的制备及其性能,虽然稳定性和释放率均有所提高,但包埋率相对较低,仅为61.8%.王学瑛等[11]以壳聚糖、海藻酸钠和多聚磷酸钠为复合壁材,采用复凝聚-真空冷冻干燥技术等优化工艺制备蓝莓花青素微胶囊并将其应用于卷烟中,虽然花青素微胶囊对卷烟感官质量改善效果较为明显,但微胶囊包埋率相对不高,为76.36%.
鉴于以上研究,本文采用装置简单、耗资较少的锐孔法制备微胶囊,以提高包埋率.以蓝莓花青素的包埋率为指标,通过单因素试验、正交试验、四因素二次回归正交旋转组合实验等方法,比较分析单一海藻酸钠及其与黄原胶、果胶、羧甲基纤维素钠、β-环状糊精等复合壁材对不同浓度蓝莓花青素粗提原液包埋效果的影响,筛选出最适的壁材、固化剂及蓝莓花青素胶囊的制备工艺,为蓝莓花青素微胶囊生产提供理论依据.
1 材料与方法
1.1 材料与试剂
蓝莓(新鲜市售蓝莓,果实饱满圆润、大小均匀,果皮颜色在深紫色和蓝黑色之间并呈白雾状,无虫害,无虫咬).
无水柠檬酸、乳酸钙、氯化钙、海藻酸钠、β-环状糊精、果胶、羧甲基纤维素钠(河南万邦实业有限公司),黄原胶(河南明瑞食品添加剂有限公司),以上试剂均为食品级.
1.2 仪器与设备
T6新世纪紫外-可见分光光度计,北京普析通用仪器有限责任公司;BCD-190TMPK冰箱,海尔智家股份有限公司;FA1104型电子天平,上海良平仪器仪表有限公司;2200TH数控超声清洗器,上海安谱实验科技股份有限公司;SHZ-DⅢ循环水式真空泵,巩义市予华仪器有限公司;DZKW-12-2电热恒温水浴锅,北京市永光明医疗仪器有限公司;80-2电动离心机,常州市江南实验仪器厂;1.0 mL注射器,上海凯乐输液器厂.
1.3 方法
1.3.1 蓝莓花青素粗提原液提取 准确称取10.00 g于-18 ℃速冻3 h后的蓝莓鲜果,40 kHz、20 ℃、10 min进行超声波解冻[12],解冻后研磨,按1∶10料液比加入15%柠檬酸,50 ℃恒温水浴浸提1 h后,4 000 r/min离心10 min得上层清液,即为蓝莓花青素粗提原液.
1.3.2 蓝莓花青素微胶囊制备 取10.0 mL蓝莓花青素粗提原液与一定浓度乳酸钙溶液,按体积比1∶7配制成芯材溶液.用1.0 mL注射器吸取一定比例混合壁材溶液滴入一定浓度芯材溶液,按一定超声辅助条件进行包埋[13],参考文献[14]方法略作修改后计算包埋率:
(1)
式(1)中,W为蓝莓花青素微胶囊的包埋率,A1为原液稀释10倍的吸光度值,A2为包埋后样液稀释10倍的吸光度值.
1.3.3 蓝莓花青素微胶囊制备条件优化
(1)单因素实验.选择花青素粗提原液浓度、乳酸钙浓度、乳酸钙体积、花青素粗提原液体积、壁材浓度、壁材体积、超声温度、超声时间和超声功率9个因素进行单因素实验.各单因素变量分别为花青素粗提原液浓度(20%、40%、60%、80%、100%的花青素粗提原液),乳酸钙浓度(3.0%、4.0%、5.0%、6.0%、7.0%),花青素粗提原液体积(6.0、7.0、8.0、9.0、10.0 mL),花青素体积(1.0、2.0、3.0、4.0、5.0 mL),壁材浓度(0.6%、0.7%、0.8%、0.9%、1.0%),壁材体积(1.0、2.0、3.0、4.0、5.0 mL),超声温度(20、25、30、35、40 ℃),超声时间(5、10、15、20、25、30、35 min)和超声功率(40、50、60、70、80 kHz).
(2)正交实验.按单因素所得最佳条件,选择花青素粗提原液体积A、 花青素粗提原液浓度B、乳酸钙体积C、乳酸钙浓度D 4个因素,以包埋率为评价指标,设计L9(34)正交实验.
(3)响应面设计实验.按单因素所得最佳条件,选择花青素粗提原液体积A、花青素粗提原液浓度B、乳酸钙体积C、乳酸钙浓度D为考察因素,以包埋率为响应值,采用响应面法优化蓝莓花青素微胶囊制备工艺.
2 结果与分析
2.1 蓝莓花青素粗提原液浓度的确定
由图1可知,花青素粗提原液浓度会影响包埋效果.混合壁材海藻酸钠+β-环状糊精、海藻酸钠+果胶对不同浓度花青素粗提原液包埋效果要好于混合壁材海藻酸钠+黄原胶、海藻酸钠+羧甲基纤维素钠和单一海藻酸钠壁材,且后两种混合壁材包埋率较单一壁材包埋率低.相比其他混合壁材,海藻酸钠+β-环状糊精更为优越.当20%花青素粗提原液作芯材时,混合壁材海藻酸钠+β-环状糊精和单一壁材海藻酸钠的包埋率分别为 84.93%、81.86%;当40%花青素粗提原液作芯材时,混合壁材海藻酸钠+果胶的包埋率较其他浓度的花青素粗提原液要高,达81.89%.因此,在进行包埋比较时,采用海藻酸钠、海藻酸钠+β-环状糊精作壁材时,选择20%花青素粗提原液作芯材;采用海藻酸钠+果胶作壁材时,选择40%花青素粗提原液作芯材.
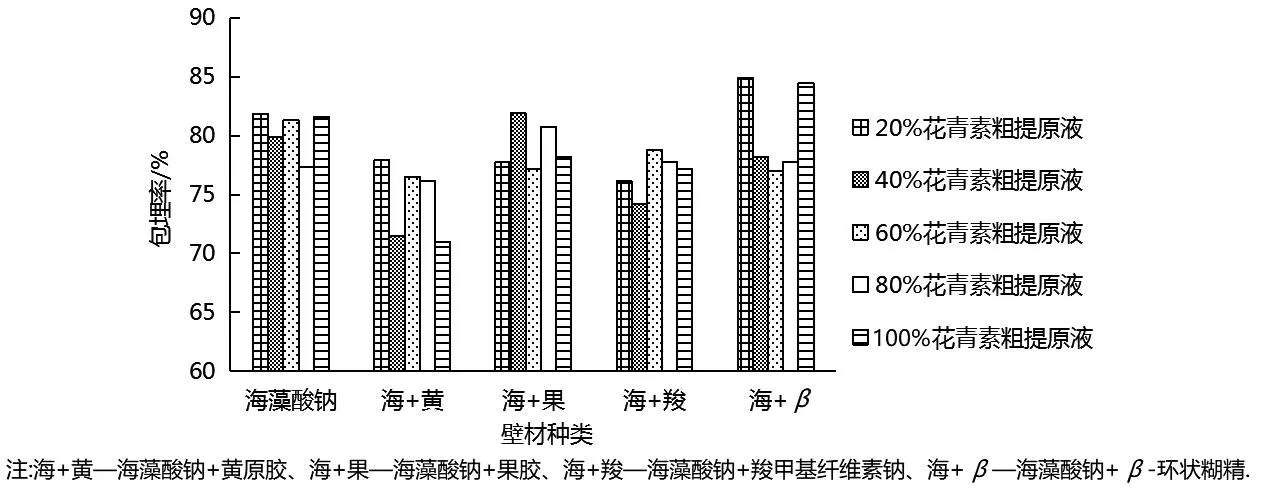
图1 蓝莓花青素粗提原液浓度的确定
2.2 乳酸钙浓度的确定
由图2可知,包埋率随乳酸钙浓度增加而提高,乳酸钙浓度5.0%时包埋率较其他浓度时要高,海藻酸钠、海藻酸钠+β-环状糊精、海藻酸钠+果胶作为壁材时包埋率依次为85.97%、86.70%、86.34%;之后,花青素包埋率随乳酸钙浓度增加开始下降,由于乳酸钙与海藻酸钠反应生成海藻酸钙膜包裹住花青素,乳酸钙浓度过高或过低,都会使Ca2+选择性取代海藻酸钠中Na+,导致微胶囊内部分布不均匀,使包埋率下降[15].因此,选择5.0%乳酸钙进行包埋.
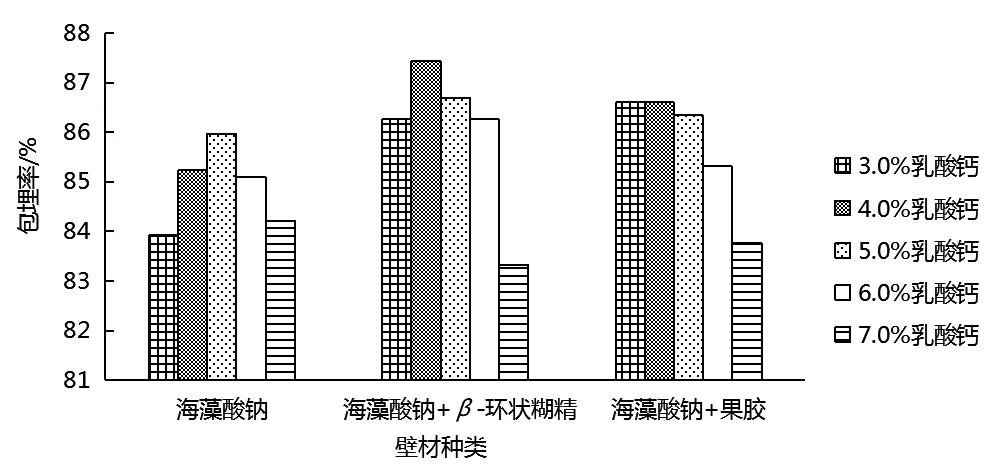
图2 乳酸钙浓度的确定
2.3 乳酸钙体积的确定
由图3可知,包埋率随着乳酸钙用量的增加而提高,但乳酸钙用量过大会导致微胶囊硬度变小,可能由于乳酸钙用量越大整个体系酸性越强而导致花青素受到破坏.海藻酸钠、海藻酸钠+β-环状糊精、海藻酸钠+果胶3种壁材的乳酸钙用量在8.0 mL时,包埋率高,包埋效果好,包埋率分别为82.73%、80.91%、78.34%.因此,选择乳酸钙用量8.0 mL进行包埋.
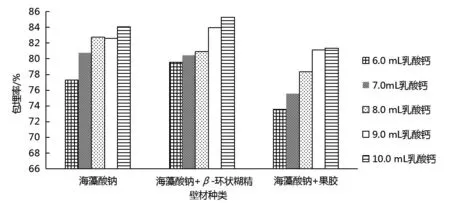
图3 乳酸钙体积的确定
2.4 花青素粗提原液体积的确定
由图4可知,20%花青素粗提原液作芯材、海藻酸钠和海藻酸钠+β-环状糊精作壁材时,花青素用量越少包埋率越高,依次为85.90%、82.72%;40%花青素粗提原液作芯材、海藻酸钠+果胶作壁材时,花青素用量越少包埋率越高,为87.80%.不管用哪个条件的壁材还是芯材,包埋后的微胶囊颜色都较浅,只有花青素体积为2.0 mL时,包埋颜色深、硬度大且包埋率大.因此,选择2.0 mL花青素粗提原液进行包埋.

图4 花青素粗提原液体积的确定
2.5 壁材浓度的确定
由图5可知,0.8%、0.9%海藻酸钠作壁材时,包埋率分别为81.44%、80.66%,包埋效果没有明显区别.海藻酸钠+β-环状糊精作壁材在浓度0.9%时包埋率达83.46%,海藻酸钠+果胶作壁材在浓度0.8%时包埋率达84.45%,可见,海藻酸钠+果胶混合壁材比单一海藻酸钠、海藻酸钠+β-环状糊精混合壁材包埋效果要好.当海藻酸钠浓度超过0.8%时,包埋率显著下降,可能是因为浓度过大导致溶液黏度过大,流变特性变差,这一结果与文献[16]中制备的微胶囊海藻酸钠浓度影响规律基本一致,因此,选择0.8%海藻酸钠+果胶作为壁材进行包埋.
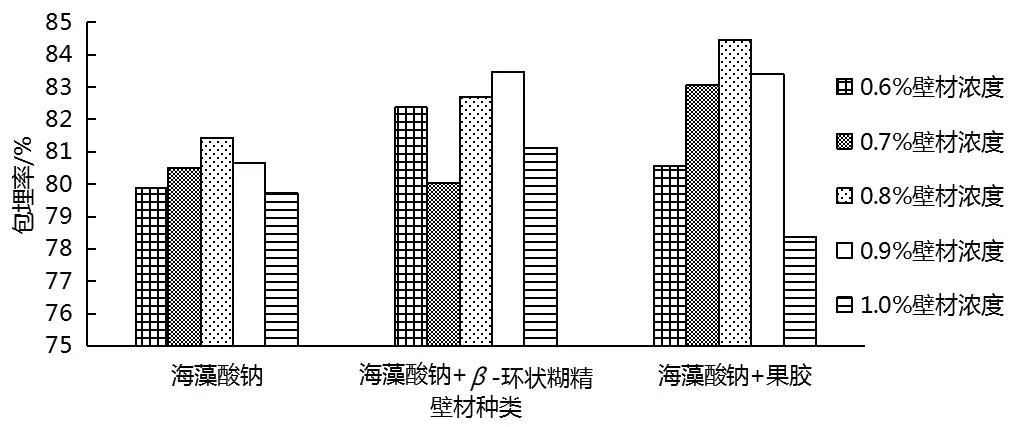
图5 壁材浓度的确定
2.6 壁材体积的确定
由图6可知,当混合壁材体积固定在5.0 mL时,随着海藻酸钠体积增加,包埋率先增加后降低.当海藻酸钠体积在4.0 mL时,果胶复合壁材包埋率高于β-环状糊精复合壁材,此时包埋率为81.12%,因此,以下实验均选择海藻酸钠+果胶作为壁材进行包埋.
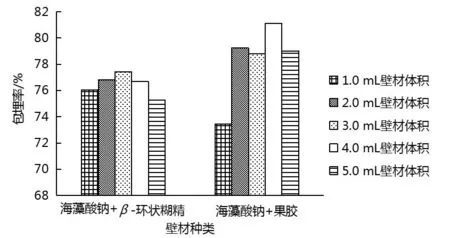
图6 壁材体积的确定
2.7 超声温度的确定
由图7可知,随着超声温度的升高,包埋率变化有所不同.超声温度在25 ℃时,包埋率比20 ℃和30 ℃要高,但仍没有35 ℃时高.超声温度在35 ℃时,包埋率达80.14%,因此,选择超声温度35 ℃进行包埋.
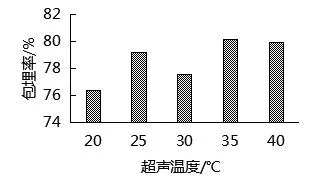
图7 超声温度的确定
2.8 超声时间的确定
由图8可知,当超声时间增加时,微胶囊的包埋率先增加后降低,在超声波辅助包埋条件下,芯材进入壁材中形成空腔,使芯材被包埋.由于包埋反应放热,当超声波辅助包埋时间增加时,超声波热效应能引起体系温度升高,在一定程度上会使包埋反应向反方向进行,进而影响微胶囊的包埋率.当超声时间为30 min时,包埋率为83.92%,因此,选择超声时间30 min进行包埋.
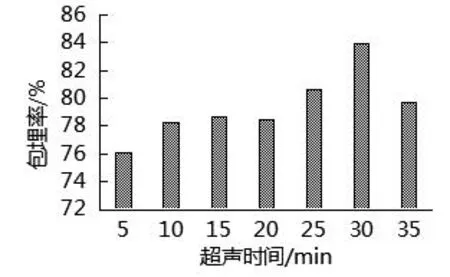
图8 超声时间的确定
2.9 超声功率的确定
由图9可知,当超声功率增加时,微胶囊包埋率普遍较低,可能是超声功率较高使机械剪切力太强破坏了芯材体系,导致包埋率较低,这与文献[17]转速对双包埋原花青素微胶囊化效果的影响一致.在超声功率40 kHz时,包埋率最高为82.56%,因此,选择超声功率40 kHz进行包埋.
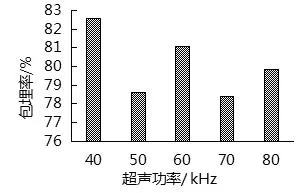
图9 超声功率的确定
2.10 正交实验结果
根据单因素实验结果,固定壁材浓度0.8%、壁材体积4.0 mL、超声温度35 ℃、超声时间30 min、超声功率40 kHz,选择A(花青素粗提原液体积,1.0、2.0、3.0 mL)、B(花青素粗提原液浓度,20%、40%、60%)、C(乳酸钙体积,7.0、8.0、9.0 mL)、D(乳酸钙浓度,4.0%、5.0%、6.0%)4个因素,以包埋率为评价指标,设计L9(34)正交实验,因素水平见表1,实验结果见表2、表3.

表1 因素水平表
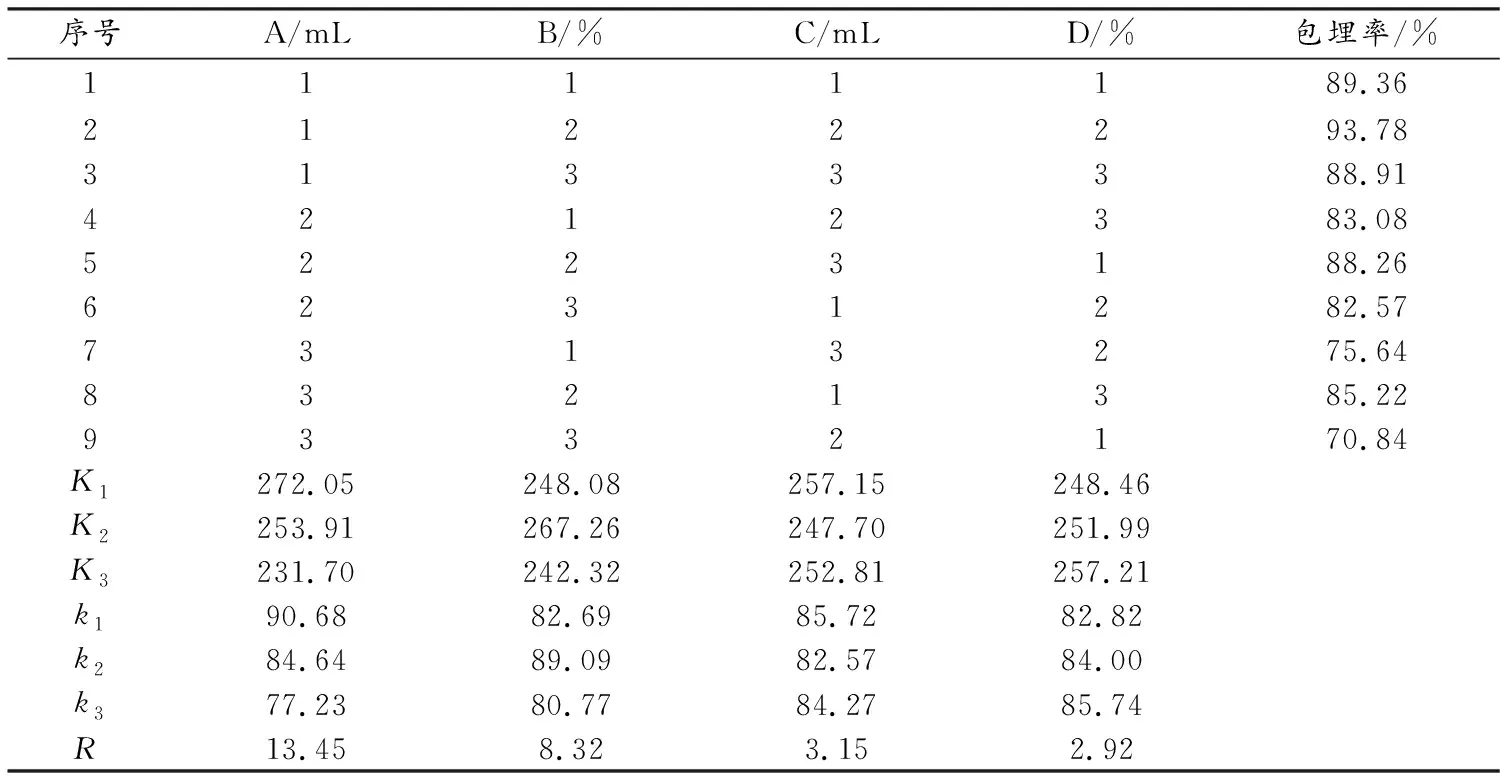
表2 正交实验结果
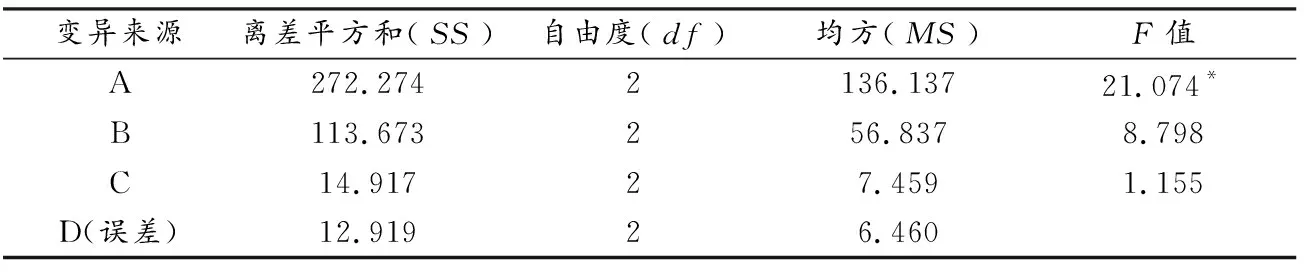
表3 方差分析
由表2可知,各因素对微胶囊包埋率影响的顺序为A>B>C>D,极差分析可知最佳工艺条件为A1B2C1D3,即花青素粗提原液体积1.0 mL、花青素粗提原液浓度40%、乳酸钙体积7.0 mL、乳酸钙浓度6.0%.
由表3可知,因素A对包埋率有显著影响,因素B、因素C、因素D对包埋率没有影响.按各因素F值大小顺序排列:A>B>C>D,与直观分析结果一致.
2.11 验证实验结果
将正交表里包埋率最高的组合、正交直观分析最优组合、单因素最佳组合(A1B2C2D2、A1B2C1D3、A2B2C2D2)进行验证实验,包埋率分别为92.52%、84.57%、81.54%.虽然前一个组合包埋率较高,但是微胶囊颜色较浅,而正交直观分析最优组合与单因素最佳组合包埋颜色接近,因此,最终采用正交直观分析最优组合进行包埋.
2.12 响应面二次回归正交旋转实验结果
因素E壁材浓度、F壁材体积、G超声温度、H超声时间、I超声功率经单因素多次重复实验验证,无显著性差异,因此,以下实验选择A花青素粗提原液体积、B花青素粗提原液浓度、C乳酸钙体积、D乳酸钙浓度,以包埋率(y)为评价指标,设计L36(54)响应面二次回归正交旋转实验,因素编码见表4,实验结果见表5、表6、表7.

表4 因素编码
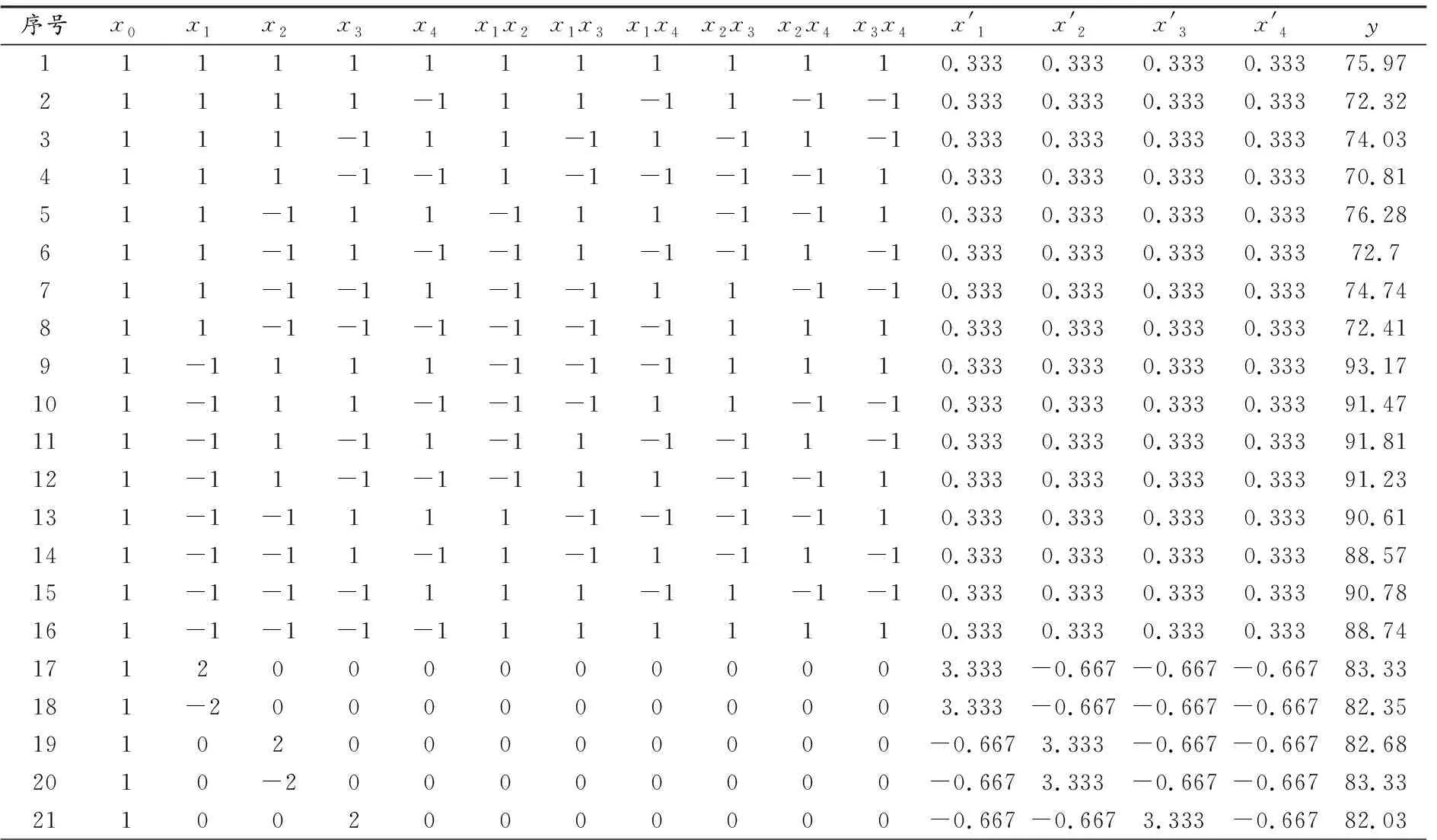
表5 二次回归正交旋转实验结果
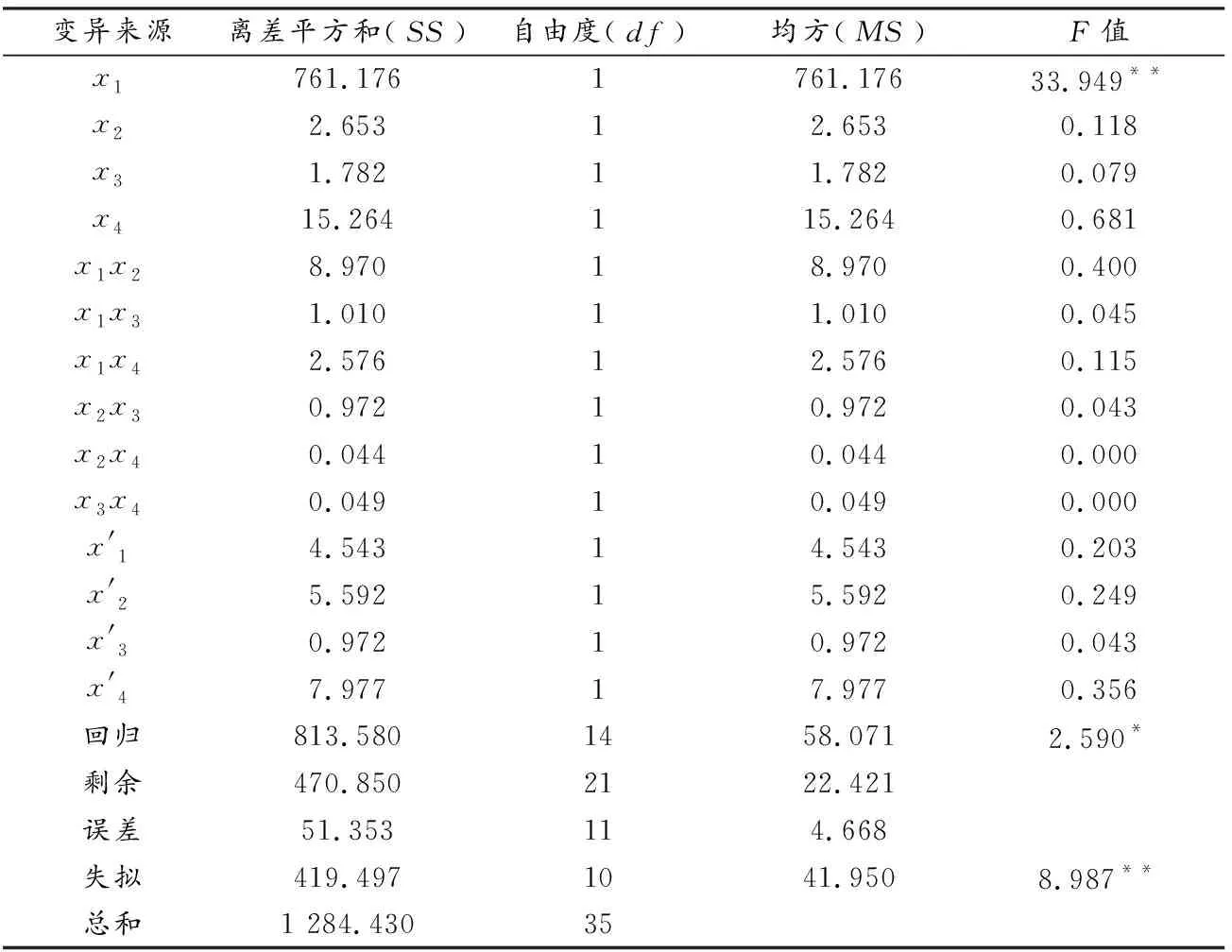
表6 方差分析

表7 简化后回归方程的方差分析表
由表6可知,采用二次回归正交旋转组合设计进行实验,得到初步拟合回归方程
y=81.886-5.632x1+0.195x2+0.273x3+0.798x4-0.749x1x2+0.251x1x3+0.401x1x4+
回归方程关系显著,证明实验结果有效,但只有x1因素达到显著水平,其余因素均不显著.二次正交旋转组合设计的回归方程虽然有意义,但失拟效果极显著,所以拟合度不好,因此,剔除不显著因素重新进行二次显著性检验,见表7.
由表7可知,剔除不显著因素后,x1的回归系数极显著,回归方程极显著,拟合度极显著.虽然剔除不显著因素后方程的拟合度有明显改善,但是拟合度仍较差,因此,只用此模型预测最佳包埋条件.剔除不显著因素后的回归方程为y=81.886-5.632x1,预测蓝莓花青素体积在1.0~2.0 mL时包埋率较高,与单因素实验、正交实验所得最佳花青素粗提原液体积完全一致.
3 结论
锐孔法制备蓝莓花青素微胶囊,避免了外界条件对花青素的破坏,提高了蓝莓花青素的稳定性.以包埋率为评价指标,通过单因素实验和正交实验优化锐孔法制备蓝莓花青素微胶囊制备最佳工艺为:以1.0 mL 40%花青素粗提原液与7.0 mL 6.0%乳酸钙为芯材、4.0 mL 0.8%海藻酸钠+果胶为壁材,在超声功率40 kHz、超声温度35 ℃、超声时间30 min条件下制备微胶囊,包埋率达84.57%,球状效果好,颜色鲜艳.通过四因素二次回归正交旋转组合设计进行实验,得到回归方程y=81.886-5.632x1,预测蓝莓花青素粗提原液体积在1.0~2.0 mL时包埋率较高.研究发现,超声波辅助能够促进和提高蓝莓花青素的包埋率,但影响并不显著;混合壁材与单一壁材包埋比较,包埋率提高并不明显;将花青素粗提原液与乳酸钙组成混合芯材溶液,比先加芯材溶液后加入乳酸钙包埋效果好.以后的研究中将对纯化后的蓝莓花青素溶液进行微胶囊化处理,以期得到更高的包埋率,提高蓝莓花青素的稳定性,为蓝莓花青素的开发应用提供一定的技术支持.

