导航模板注射锂基生物玻璃水凝胶修复股骨头坏死的效应研究
马桥桥,吴泽睿,查国春,郭开今,蒋守海,张传开*
(1.徐州仁慈医院关节外科,江苏 徐州 221000;2.徐州医科大学附属医院关节外科,江苏 徐州 221000)
股骨头坏死(osteonecrosis of the femoral head,ONFH)是一种涉及骨细胞坏死的骨关节疾病,表现为骨细胞和骨髓成分进行性死亡,引起股骨头塌陷,最终发展为髋关节炎,导致髋关节疼痛和功能丧失,严重影响患者生活质量[1-2]。据统计,中国至少有超800万人罹患股骨头坏死,而全球范围内股骨头坏死患者每年增加3~5万,且多数为中青年患者[3]。由于修复坏死骨难度大、高致残率以及一些患者需长期使用激素,股骨头坏死一直受到广泛关注[4]。对于发展为骨塌陷或是骨关节炎的股骨头坏死患者,可能需要实施全髋关节置换术(total hip arthroplasty,THA),但中青年患者更希望避免或是推迟这种手术。因此,早期治疗股骨头坏死十分必要[5]。
基于生物材料的工具在骨重建方面具有广阔的应用前景。然而,目前只有少数生物材料是专门为激素引起股骨头坏死设计。据报道,聚醚醚酮或钛棒等材料在改性后表现出良好的骨再生性能[6-7]。然而,有效物质用完后,其原有的生物惰性就会暴露出来。例如,钛棒产生的磨屑会导致骨溶解。因此,理想的生物材料在修复坏死骨细胞后也应该能够顺利降解。介孔生物玻璃纳米颗粒(mesoporous bioglass nanoparticles,MBN)因其独特的工艺、更大的比表面积、更高的载药量和更好的释放性能,多年来一直是人们关注的焦点[8]。因此,它适合作为药物输送载体或生物注射材料。通过调整比例和添加元素,可以制备出不同性能的MBN,以达到不同的效果[9]。然而,MBN是一种刚性修复材料,无法协调骨再生。此外,由于其物理特性,它不能固定和聚集在缺陷中。因此,对MBN进行修饰和性能优化,可能会更有利于股骨头坏死区的骨修复。
近年来,治疗性离子锌、钙、镁、锂等金属离子被作为生物材料的组成部分受到人们的关注,因为它们对成骨有积极作用。众所周知,锂(Li)是人类营养中一种重要的微量营养素,是治疗双相情感障碍的一线药物。先前的研究表明,氯化锂(LiCl)促进成骨,加速骨折愈合时间。Huang等[10]将LiCl应用于骨质疏松模型,证明LiCl有利于骨髓间充质干细胞的增殖,并通过调节自噬促进成骨。Peng等[11]发现,适当添加锂可以增强细胞附着并刺激成骨。Geng等[12-13]的研究已经证明,LiCl可能通过抑制破骨细胞分化和促进成骨来促进界面骨整合,以及具有调节纳米钛颗粒刺激的巨噬细胞极化和促进成骨方面的作用。然而,到目前为止,关于锂对血管生成分化潜能的影响以及具体机制,人们还知之甚少。此外,金属离子与MBN结合的方式、结合浓度的选择以及释放金属离子的稳定性还有待进一步探索,因为低浓度无效,而高浓度可能引起中毒。
利用3D打印技术制作股骨头坏死病灶区导航模板,可以精确定位骨坏死区域,有效清除坏死病灶[14]。甲基丙烯酰化明胶(gelatin methacryloyl,GelMA)是一种半天然合成水凝胶,具有成熟的合成技术[15],其高度的生物相容性和丰富的孔隙使细胞和血管能够更自由地附着和发育[16-17]。甲基丙烯酰的接枝使得GelMA能够光固化并具有可塑性和缓释能力[18-19]。在本研究中,笔者制备了一种可注射锂基生物玻璃水凝胶(GelMA and Li-mesoporous bioglass,GM/M-Li),并利用3D打印导航模板精确注入GM/M-Li填充坏死病灶区,为促进股骨头坏死的骨修复,提供了一种新的策略,现报告如下。
1 资料与方法
1.1 时间及设计 2019年9月至2022年3月,前瞻性随机对照研究。
1.2 材料与准备
1.2.1 锂基介孔生物玻璃(Li-mesoporous bioglass,M-Li)的合成 根据文献合成了MBN[20],按照说明合成M-Li[21]。以十六烷基三甲基溴化铵为模板剂,在60 ℃下将7.092 g三羟甲基氨基甲烷盐酸盐粉末溶于250 mL去离子水中,然后将1.5 g十六烷基三甲基溴化铵与溶液混合。当溶液搅拌至澄清后,向溶液中滴加10.8 mL正硅酸乙酯、0.9 mL磷酸三乙酯、2.45 g四水合硝酸钙[Ca(NO3)2·4H2O]和0.125 g LiCl,温和搅拌约30 min。之后将溶液猛烈搅拌16 h,直到它变成乳白色。收集沉淀物,用无水乙醇和去离子水轮流洗涤3次,离心后沉淀在60 ℃烘箱中干燥24 h,最后将固体研碎并在650 ℃空气中煅烧3 h,设置温度每分钟上升2 ℃。结束后将得到的M-Li粉末收集在试管中备用。
1.2.2 水凝胶的制备 以苯基-2,4,6-三甲基苯甲酰膦酸锂(LAP)为光引发剂。简单地说,在5 mg LAP中加入20 mL磷酸盐缓冲液,在50 ℃下搅拌,直至透明,远离光线。然后,在50 ℃下,将50 mg冻干的GelMA加入1 mL LAP溶液中,持续搅拌,与溶液合成预聚体。待溶液完全溶解后,在紫外光(EFL-ls-1600-405,苏州,中国)照射5~10 s。在预聚物溶液中加入3%(w/v终值)的MBN或M-Li粉末,混合均匀,然后在紫外光下曝光5~10 s,得到生物水凝胶(GM/M)和GM/M-Li。
1.2.3 M-Li的表征 为了分析M-Li样品的形貌,分别进行扫描电镜(scanning electron microscope,SEM)、透射电镜(transmission electron microscope,TEM)观察M-Li,此外,采用小角X射线衍射(small angle X-ray diffraction,SA-XRD)对Cu源进行结构分析。
1.2.4 GelMA、GM/M和GM/M-Li水凝胶的表征 为了观察GelMA、GM/M和GM/M-Li水凝胶的微观结构形态,在12.5 kV电压下制备样品并进行SEM分析。利用傅里叶红外光谱(学研会科研平台,郑州,中国)发现GelMA、GM/M和GM/M-Li水凝胶中的键变化(对样品和背景进行32次扫描,4 cm-1分辨率,波长范围为400~4 000 cm-1)。
1.2.5 测试压缩模量及稳定性 将水凝胶制成直径为9 mm、厚度为3 mm的圆盘,用机械试验机(上海恒仪精密仪器有限公司,中国)以1 mm/min的下降速率进行测量。在37 ℃下,用流变应力6 000流变仪(Thermo Scientific)对水凝胶进行流变学测试,以分析水凝胶的稳定性。
1.2.6 离子释放试验 将水凝胶制成直径9 mm、厚度3 mm的圆盘。然后将模拟体液(士诺达生物科技有限公司,安徽,中国)在37 ℃下,匀速摇床上浸泡7、14、21和35 d。最后在每个时间点收集上清液,通过BioTek(仑昌硕生物科技有限公司,中国)检测。
1.2.7 细胞培养物制备 RAW 264.7细胞购自中国科学院上海细胞库。从兔体内分离骨髓间充质干细胞。骨髓间充质干细胞在α-MEM中培养,均加入10%胎牛血清和1%青霉素/链霉素,在37 ℃、5% CO2下的气氛中培养。在细胞培养工作之前,纳米颗粒在紫外灯下乙醇中消毒一夜,然后用消毒过的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤。
1.2.8 细胞活力和增殖评价 采用Live/Dead染色法(Invitrogen公司,美国)检测各组水凝胶的细胞活力。简单地说,用不同组的水凝胶提取物将骨髓间充质干细胞(1.0×104个细胞/孔)接种在爬行细胞上。培养1 d后,去除培养基,用活/死染色试剂盒避光染色,然后用荧光显微镜(蔡司,德国)观察样品。
1.2.9 细胞增殖实验 细胞增殖实验(cell counting kit-8,CCK-8)试剂(新赛美生物科技有限公司,苏州,中国)用于本研究。将骨髓间充质干细胞(5×103个/孔)接种于96孔板(100 μL/孔)。第1、3和5天,更换为100 μL新鲜培养基(含10% CCK-8溶液),在37 ℃、5% CO2下孵育。2 h后,平板用酶标仪(Biotek,USA)在450 nm光密度下进行验证。
1.3 方法
1.3.1 细胞形态及免疫荧光染色 骨髓间充质干细胞(每孔2×104个细胞)接种在水凝胶盒上,在37 ℃、5% CO2下孵育3 d。到达时间点时,样品在4%多聚甲醛(paraformaldehyde,PFA)的冰上固定1 h。之后去除固定物并洗涤,然后用不同浓度的乙醇溶液(30%、50%、70%、80%、90%、95%和100%)脱水,每个15 min。随后用CO2临界点干燥仪干燥约2 h,喷金45 s。最后通过SEM采集图像。
1.3.2 罗丹明染色 将骨髓间充质干细胞(1×104个/孔)接种于24孔板中不同组的水凝胶提取物中。孵育12 h和48 h后,温和洗涤样品,随后在冰上加4% PFA 30 min。然后去除固定物,加入0.1% Triton X-100(Sigma-Aldrich,USA)10 min。PBS洗涤3次后,将罗丹明(翌圣科技有限公司,上海,中国)按1︰500的比例溶于PBS中,温和添加到孔中。37 ℃孵育1 h后,用4’,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)对细胞核进行染色,样品用荧光显微镜采集(蔡司,德国)。
1.3.3 碱性磷酸酶活性 用碱性磷酸酶(alkaline phosphatase,ALP)测定试剂盒(碧云天生物技术,上海,中国)测定成骨能力。将不同组的骨髓间充质干细胞(1×104个细胞/孔)接种在24孔板上。7 d后,在4% PFA中洗涤3次并固定后,加入ALP染色液(300 μL/孔),避光至少30 min。最后在光学显微镜下观察阳性细胞。
1.3.4 成骨矿化分析 磷酸钙是评价成骨特性的关键因素。因此,本研究使用茜素红S(alizarin red S,ARS)染色试剂盒(塞叶,广州,中国)进行验证。将不同组的骨髓间充质干细胞(1×104个/孔)以水凝胶的方式接种在24孔板上。培养21 d后,分别洗3次,4% PFA固定30 min,每孔加入ARS染色液,室温下保证细胞完全覆盖约1 h。然后,细胞被清洗几次以充分去除染料。用光学显微镜观察得到钙结节。为了定量ARS染色,每孔加入5%过氯酸,在吸光度(optical density,OD)490 nm处测量。
1.3.5 血管生成评价 为了观察水凝胶的血管生成能力,使用生长因子降低的基质凝胶(100 μL/孔,康宁,美国)。播种细胞前,每孔加入60 μL基质,37 ℃孵育30 min成胶。然后用水凝胶提取液将人脐静脉血管内皮细胞(human umbilical vein,HUVECs)(3.5×104个/孔)接种到每孔中。在37 ℃、5% CO2下孵育后,用光学显微镜在0、3和6 h观察并采集,结果通过Image J进行分析。
1.3.6 迁移实验 将GelMA、GM/M或GM/M-Li水凝胶提取物置于下腔,而将200 μL HUVECs悬液(2.5×105个/mL)置于上腔,在37 ℃、5% CO2下孵育。培养16 h后,取出小室,用棉签小心去除膜上部,在4% PFA中固定20 min。然后用0.1%的结晶紫溶液(索莱宝,北京,中国)对细胞染色并在显微镜下观察。用Image J对结果进行量化。
1.3.7 划痕实验 划痕实验是评价血管生成的一种方法。简而言之,将HUVECs(4×105个/孔)接种到6孔板中,在37 ℃、5% CO2下孵育。当细胞90%融合后,用200 μL移液管尖端在细胞层形成划痕。用无菌PBS冲洗3次以清除细胞碎片,用含GelMA、GM/M或GM/M-Li水凝胶提取物的0.5%血清替换培养基。在0、12和24 h,使用倒置显微镜捕捉图像。用Image J计算相应的数据(即迁移区域)。
1.3.8 体外抗炎评价 体外采用RAW 264.7细胞观察Li+对炎症反应的影响。简单地说,将1×104的RAW 264.7细胞接种到24孔板中,在37 ℃、5% CO2下孵育。培养12 h后,用100 ng mL-1的脂多糖(lipopolysaccharide,LPS)和25%葡萄糖(高糖)诱导细胞再培养12 h。然后,细胞固定0.5 h,然后用0.1% Triton X-100(Sigma-Aldrich,美国)固定10 min。然后,一抗一氧化氮合酶(M1标记物)和Arg1(M2标记物)用F4/80与细胞孵育,在4 ℃保存过夜。第2天,用PBS冲洗3次后,避光加入二抗。孵育1 h后,充分洗涤细胞后加入DAPI。荧光显微镜拍摄图片。
1.3.9 实时聚合酶链反应定量分析 向6孔板细胞中加入1 mL Trizol,裂解5 min。(1)装入1.5 mL EP管,加入200 μL氯仿,充分摇匀,冰上静置10 min;(2)12 000转/min,4 ℃离心15 min;(3)小心吸取透明上清液,转移至新EP管,加入等量异丙醇,轻轻混匀,冰上静置10 min;(4)12 000转/min,4 ℃离心15 min;(5)弃上清,擦净内壁液体,配置75%乙醇-焦碳酸二乙酯水,冲洗核糖核酸(ribonucleic acid,RNA)沉淀,12 000转/min,4 ℃离心15 min;(6)弃上清,加入20 μL焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)吹匀,测RNA浓度;(7)将样品测得的RNA浓度按1 μg总量进行配平,加入100 μL DEPC水逆转录,获得互补mRNA的脱氧核糖核酸分子(complementary DNA,cDNA)。将所获得的cDNA按照,2 μL cDNA、5 μL SYBR qPCR master mix、1 μL Primer 1+Primer 2、2 μL双氧水配置扩增体系后上机。
1.3.10 GelMA、GM/M和GM/M-Li水凝胶条件培养基的制备 收集水凝胶条件培养基进一步诱导骨生成和血管生成。简单地说,RAW264.7细胞(每孔4×105个细胞)在含有10%胎牛血清的6孔板上,在培养基中,在37 ℃、5% CO2下培养。孵育12 h后,用100 ng/mL的LPS诱导培养基12 h。最后,分别收集不同组的上清液,在无菌环境下过滤,去除凝胶和细胞碎片。滤液保存在-80 ℃,用于培养骨髓间充质干细胞和HUVECs。
1.3.11 动物模型 动物方案经医院动物伦理委员会(伦理号202103A481)批准。所有动物均养在单独的笼子里,温度25 ℃,湿度55%。为建立股骨头坏死兔模型,参照文献造模方法[22-23],为降低造模死亡率,对造模方式进行改良。使用LPS联合用甲波尼龙琥珀酸钠(MP,辉瑞制药,500 mg)。首先,前3天每天1次于动物臀中肌肌注(50 mg/kg)。第4天行兔耳缘静脉注射LPS,20 μg/kg剂量。造模时间6~8周。通过病理组织学及Micro-CT检测空骨陷窝率、骨细胞凋亡率、股骨头囊性变等指标评价股骨头坏死情况。
1.3.12 3D打印导航模板的制作及水凝胶的注射 对成功造模股骨头坏死的兔模型进行股骨头及股骨近端micro-CT扫描并3D打印,根据3D打印模型及病灶区域,制作病灶区导航模板(见图1);在导航模板的定位下精确清除股骨头坏死的病灶区,完成病灶清理后,向内分别注入GelMA、GM/M和GM/M-Li水凝胶填充缺损,并用骨蜡覆盖骨皮质缺损窗。同时采用正常大白兔作为正常对照,股骨头坏死模型未手术组作为阳性对照,各实验组左侧股骨头为自身对照。
1.3.13 水凝胶作用评价 水凝胶植入8周后,处死动物行组织学、骨计量学、分子生物学等途径进行分析。采用micro-CT对兔股骨头微观结构进行分析,获得的2D和3D图像评价新骨形成。组织学采用苏木素伊红(hematoxylin eosin,HE)染色及免疫荧光染色分析骨坏死程度、骨小梁结构、成骨细胞、脂肪情况;动物处死前第14天和第7天使用钙黄绿素肌注进行骨荧光标记。
1.3.14 组织学染色 术后2、4和8周,取股骨(每组6根右侧股骨头),在10%福尔马林中固定至少48 h进行组织学分析,然后用10%乙二胺四乙酸脱钙1个月。然后,将骨切割后嵌入特定位置,并切成6 μm厚的切片。常规HE和Masson染色观察标本在光学显微镜下的形态学变化。
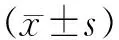
2 结 果
2.1 MBN和水凝胶的表征 将MBN溶于GelMA溶液制备了GM/M和GM/M-Li水凝胶,并在405 nm波长的紫外光照射下进行光交联(见图2a)。通过SEM观察到GelMA、GM/M和GM/M-Li水凝胶的多孔海绵状结构没有太大差异,说明这类合成方法可能不会对结构产生影响。利用TEM发现,合成的生物玻璃呈现了均匀地球形结构,且尺寸均<100 nm,可以证明其为纳米颗粒(见图2b)。
a 水凝胶光交联前后的方案 b 3种水凝胶SEM图像和M-Li的TEM纳米颗粒形貌
黏度和可塑性对于植入和修复至关重要,例如帮助组织连接和细胞附着。另外,可注射性是原位用药的一种重要又简便的方法,因此通过直接观察和流变性试验对水凝胶进行了评估(见图2c)。可见,水凝胶性能稳定,但GM/M-Li水凝胶具有较高的储能模量,证明其具有更好的可塑性。此外,这种水凝胶可以画出想要的形状,比如心形或“ABC”。总体而言,这些特点有利于将手术创伤降至最低,这意味着患者将更快地康复。
采用傅里叶变换红外光谱(fourier transform infrared spectroscopy,FTIR)检测GelMA、GM/M和GM/MLi水凝胶中键是否发生改变。1 080、1 240和1 630 cm-1处的峰分别代表Si-O-Si键、P-O键和C=O键(见图2d)。有趣的是,FTIR显示GelMA、GM/M和GM/M-li之间没有明显的变化。然后用SA-XRD测定了纳米颗粒的孔径。MBN和M-Li纳米颗粒均在2 ℃(0.361)处出现峰值,对应孔径为24 nm(见图2e)。
水凝胶的溶胀度、含水率和直径具有关键的参考意义,反映了水凝胶的稳定性,决定了是否会对局部组织的修复形成干扰。与GelMA和GM/M相比,GM/M-Li水凝胶的重量和直径能在较短时间内达到平衡,证明了其良好的稳定性(见图2f~2k)。
2.2 离子释放实验和矿化实验 GM/M-Li水凝胶中Si4+和Li+离子成功释放,有利于骨修复(见图2l~2m)。如上所述,随着离子释放,表面形成羟基磷灰石层(hydroxyapatite,HA),增强了细胞、组织和骨骼之间的连接,这些因素对骨骼重建至关重要。为此,对M-Li和GM/M-Li水凝胶的矿化潜力做了相关研究。第7天用SEM-X射线能谱观察M-Li和GM/M-Li水凝胶,发现M-Li表面完全被有序的沉积物覆盖(见图3),GM/M-Li水凝胶表面呈花椰菜状团聚分布(见图4),证明M-Li和GM/M-Li水凝胶有效促进了矿化。

图3 M-Li表面完全被有序的沉积物覆盖
2.3 细胞增殖实验 用CCK-8法研究了细胞在水凝胶上的增殖情况。结果表明,GM/M和GM/M-Li5水凝胶具有最佳的生物相容性以促进细胞生长(见图5)。因此,在随后的所有实验中,选择了5% LiCl来制备GM/M-Li水凝胶。

图5 骨髓间充质干细胞在不同浓度锂的水凝胶下的细胞增殖结果
2.4 细胞骨架染色 将骨髓间充质干细胞种在GelMA、GM/M和GM/M-Li水凝胶上,在12 h和48 h分别对细胞进行骨架染色,结果发现,12 h的细胞形态在各组之间差异无统计学意义;但在培养48 h后,GM/M-Li水凝胶在细胞数量和铺展面积都优于其他组(见图6)。

图6 不同材料骨髓间充质干细胞骨架phalloidin(红色)和DAPI(蓝色)染色(×50 μm)
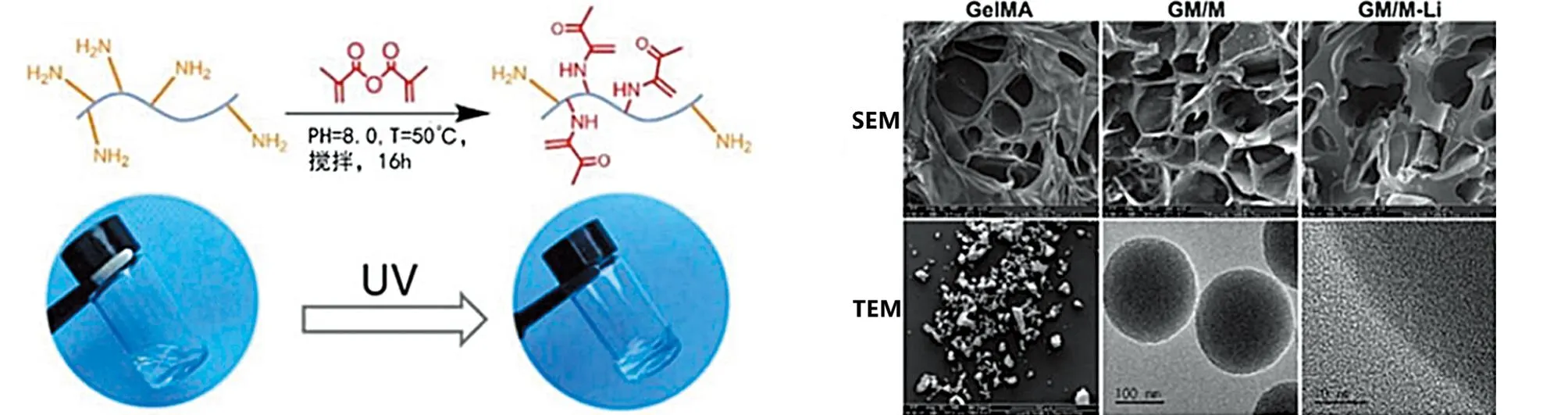
2.5 活/死染色 将骨髓间充质干细胞培养在不同材料上,3 d后对其进行活/死染色。结果显示,在培养3 d后,3种材料均未见明显死细胞,表明这些材料对细胞均无明显毒性作用(见图7)。
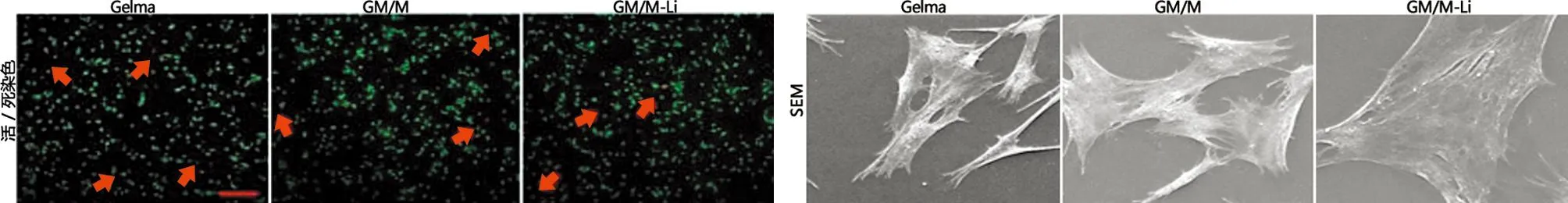
图7 水凝胶提取物中培养的骨髓间充质干细胞的活细胞(绿色)和死细胞(红色箭头)(×200 μm)
2.6 扫描电镜下细胞形态 将骨髓间充质干细胞种在水凝胶表面,利用SEM检测。结果清晰地展示了三组水凝胶在同一尺寸下,GM/M-Li水凝胶上的细胞铺展地更大,伪足更多,而其他两组细胞皱缩,铺展不佳,这与图6结果相吻合,证明GM/M-Li水凝胶具有更好的生物相容性,有利于体内组织和细胞生长(见图8)。
2.7 水凝胶成骨能力评价
2.7.1 成骨相关染色评价 水凝胶能否在原位缺损处诱导成骨至关重要。因此,研究了这些水凝胶的潜在成骨能力。首先,在不同水凝胶表面培养骨髓间充质干细胞,以检测作为早期成骨分化标志的ALP活性。可以看到,在第7天的ALP染色,GelMA和GM/M-Li水凝胶中ALP表达均明显上调,且GM/M-Li水凝胶表达水平明显更高。笔者也检测了ALP活力,表明了GM/M-Li水凝胶的ALP活力更高。此外,在诱导了21 d骨髓间充质干细胞后,进行了ARS染色,也观察到了类似的结果(见图9a~9c)。GelMA和GM/M水凝胶中钙结节小而少,而GM/M-Li水凝胶钙结节明显增多,表明其显著的成骨能力。
a 培养7 d的ALP染色和21 d的ARS染色(×200 μm) b ALP活性的定量评价 c OD值(490 nm)下ARS的定量
利用了免疫荧光染色对诱导3 d后的骨髓间充质干细胞进行Runt相关转录因子(Runt-related transcription factor 2,Runx2)和骨钙素(osteocalcin,OCN)染色来评价成骨能力。前者位于成骨分化早期指标,表达在细胞核内;后者位于质膜上,在骨代谢调节中起重要作用。GM/M-Li水凝胶显著上调Runx2和OCN的表达,优于GelMA和GM/M水凝胶(见图9d),证明GM/M-Li水凝胶中的Li+进一步促进了骨髓间充质干细胞的成骨分化。
2.7.2 成骨相关蛋白和基因表达 利用蛋白印记(western blotting,WB)和反转录酶-聚合酶链锁反应(reverse transcription-polymerase chain reaction,RT-PCR)技术,验证OCN、Runx2和Osterix成骨相关蛋白和基因来揭示其成骨能力。结果表明,与GelMA和GM/M组相比,GM/M-Li组OCN、Runx2和Osterix的蛋白表达明显上调,表明GM/M-Li水凝胶的成骨能力最优(见图10)。同样,PCR的结果得到了类似结论(见图11)。综上所述,GM/M-Li水凝胶具有良好的体外促成骨能力。

图10 OCN、Osterix和Runx2蛋白的WB
2.8 成血管能力评价 利用划痕实验评价体外成血管能力。半定量分析显示,GM/M-Li水凝胶在12 h和24 h的迁移速度较快。随后进行血管形成实验,发现6 h后,GM/M-Li水凝胶显著促进HUVEC管状、结节和分支的形成,这与GelMA和GM/M组形成鲜明对比,表明水凝胶释放的Li+具有优异的血管生成能力。在Transwell实验中,GM/M-Li水凝胶组有更多的细胞转移到膜另一侧,而其他组几乎没有细胞(见图12a~12f)。同时,研究血管生成相关蛋白血管内皮生长因子(vascular endothelial growth factor,VEGF),验证GM/M-Li水凝胶突出的血管生成生物活性(见图12g~12h)。结果表明,GM/M-Li水凝胶释放的Li+有积极的促血管再生的作用。
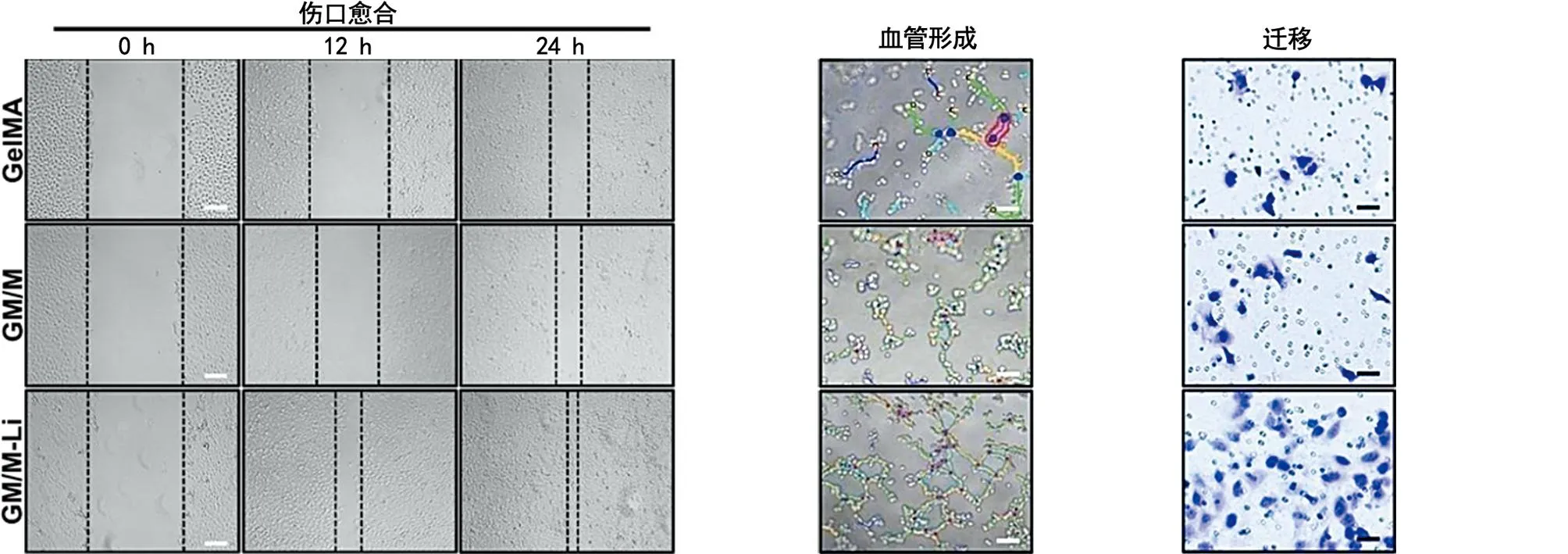
a 伤口愈合(×200 μm) b 血管形成(×100 μm) c 迁移试验(×100 μm)
2.9 水凝胶成脂抑脂能力评价 使用3T3-L1前体脂肪细胞评价脂肪生成和抑制能力。通过油红O染色发现,GM/M-Li水凝胶显著抑制了3T3-L1前体脂肪细胞的成脂分化,脂滴数量相较于其他两组数量明显减少,表明Li+有良好的抑制脂肪生成的能力(见图13)。
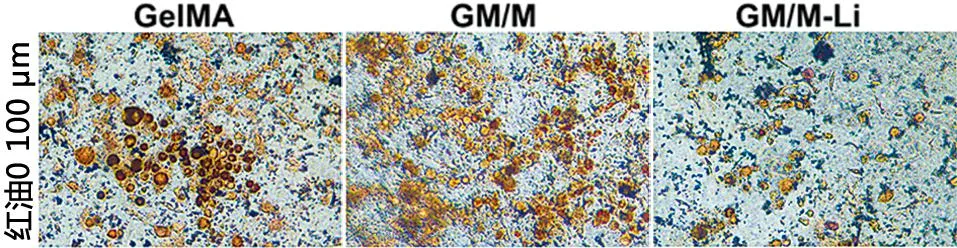
图13 不同水凝胶对3T3-L1细胞抑制脂肪生成能力评价(×100 μm)
2.10 水凝胶植入对体内骨重建影响的评价
2.10.1 兔股骨头HE染色 GM/M-Li水凝胶在体内是否具有令人满意的效果还有待进一步研究。因此,对不同组的水凝胶在体内的应用进行了评价。对兔股骨头组织行HE染色,发现模型组相较于对照组,骨小梁结构丢失,脂滴增加。在GM/M-Li水凝胶的干预后显著减少了股骨头脂滴、核固缩(见图14)。
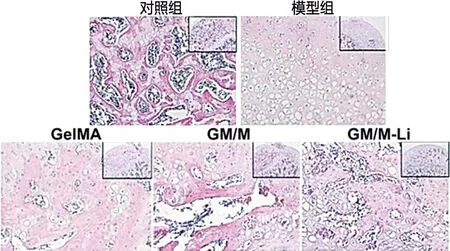
图14 股骨头坏死对照组、模型组及治疗组的HE染色(×100 μm)
2.10.2 兔股骨头免疫组织荧光染色 通过组织免疫荧光染色对股骨头坏死的成骨成血管进行研究。结果发现,GM/M-Li水凝胶有效促进了Runx2成骨指标和成骨表达。对骨组织进行钙黄绿素/茜素红荧光双标,发现GM/M和GM/M-Li水凝胶均有明显成骨表现,证明GM/M和GM/M-Li水凝胶均有良好促成骨能力。另外,GM/M-Li水凝胶在Li+的作用下,成血管指标CD31的表达上升,表明其有效促进血管新生,而这有助于股骨头坏死的骨重建(见图15)。综上所述,认为GM/M-Li水凝胶在成骨、成血管方面有良好表现。
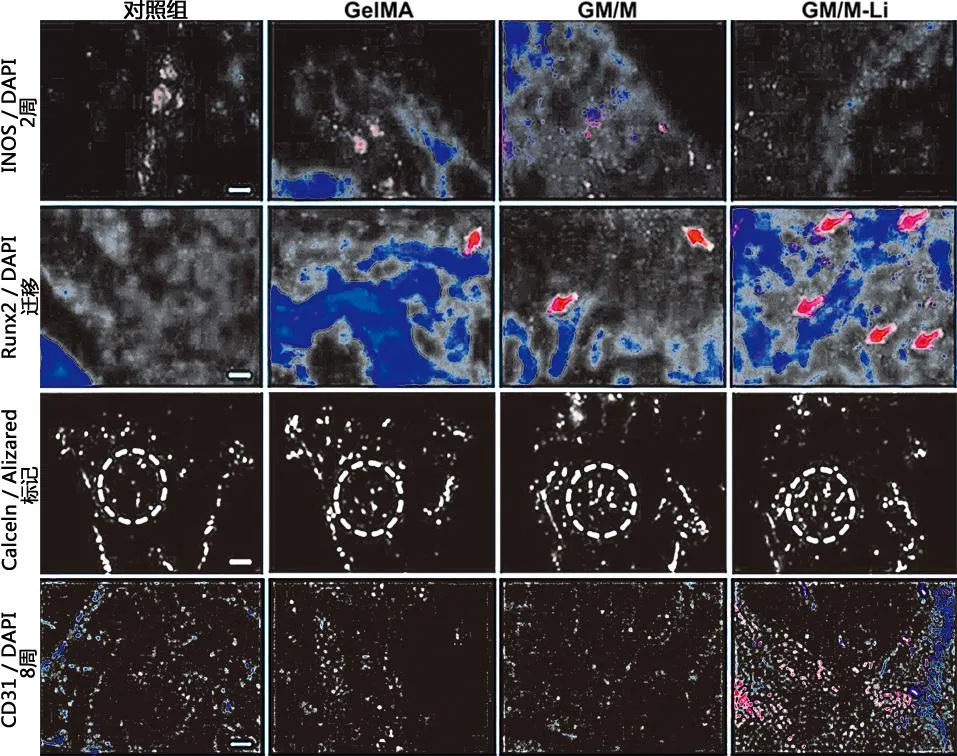
图15 股骨头坏死对照组及治疗组组织荧光染色(×50 nm)
3 讨 论
股骨头坏死是一种机制复杂的疾病,表现为进行性的骨细胞坏死和修复,最终可能导致髋关节炎和股骨头塌陷。由于股骨头坏死的骨修复能力下降,血管再生能力差,往往坏死速度大于修复速度[24]。
股骨头坏死常见原因之一是糖皮质激素导致,尽管糖皮质激素(glucocorticoids,GCs)诱导的股骨头坏死的确切机制仍不明确,但研究人员发现,脂质代谢紊乱学说及相关信号通路的激活抑制是GCs介导股骨头坏死的主要发病机制之一[1,22]。骨髓间充质干细胞具有自我更新和分化能力,在正常骨代谢中起着重要作用[25]。研究人员在兔子模型中使用了大量GCs后,发现骨髓间充质干细胞的活性降低,趋向于分化为成脂细胞而非成骨细胞,导致脂质累积在细胞内。同时在GCs的作用下,体内血清总胆固醇、甘油三酯水平升高,导致脂肪分布异常,最终造成骨内压的升高,压迫股骨头微循环而减少其血供,导致股骨头坏死[26]。同理,酗酒会导致肝细胞损伤和甘油三酯合成增多,肝细胞线粒体受损,引起脂质代谢紊乱,血液中的游离脂质增加,最后脂滴的堆积促进了股骨头微循环发生脂肪栓塞,最终引起股骨头坏死[27]。Wnt/β-catenin经典通路是决定成骨与成脂平衡的分子开关。当Wnt信号存在时,Wnt信号和卷曲蛋白结合,激活经典Wnt信号通路,通过抑制糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK-3β)活性抑制了β-catenin磷酸化,使其在胞质内大量聚集,继而入核表达,诱导成骨分化[28]。研究发现,GCs可能作用于Wnt信号通路,激活GSK-3β,抑制β-catenin的活化和入核表达,最终减少成骨分化[29]。因此,促进骨髓间充质干细胞分化为成骨细胞、恢复股骨头血供,在预防股骨头坏死中显得尤为必要。
骨骼是坚固和可再生的器官。单纯的骨折或缺陷可以由身体自己修复,但股骨头坏死由于其微环境失衡,修复能力有限[30]。因此,本研究研究了加速骨重建的水凝胶生物材料。生物材料应该具有良好的生物相容性。理想的生物材料放置在体内意味着“内”与“外”的兼容、互惠互利,而不是引发致命的排斥反应。Pluharova等[31]曾报道,在酰胺基团和钙离子之间存在离子-偶极相互作用。因此,笔者利用这种作用结合了MBA和GelMA。MBN具有海绵状结构,为细胞交互提供了空间,便于新陈代谢、信号传递和营养运输。同时,稳定的HA层对骨形成是必不可少的,因为它证明了MBN与微环境的联系。本研究发现,尽管GelMA和GM/M水凝胶无明显的毒性,但基于此特性在GM/M-Li水凝胶上的生长表现更佳。
众所周知,骨骼是一种高度血管化的器官。在许多情况下,由于缺乏血管化,会导致骨再生失败。文献表明,成骨-血管偶联对完整的骨再生很重要[32-33]。本研究验证了GM/M-Li水凝胶在体外成骨和血管生成中的作用,发现GM/M-Li水凝胶的表现令人满意。然而,在股骨头坏死情况下,血管再生和成骨能力会大打折扣。因此,股骨头坏死下的骨重建是一项具有挑战性的工作。
股骨头坏死时,成骨-成脂能力平衡破坏,前体脂肪细胞多向成脂分化而非成骨分化,导致骨组织减少发生塌陷。因此,笔者在体外模拟了GM/M-Li水凝胶抑制3T3-L1前体脂肪细胞分化为脂肪细胞能力的实验。实验发现,成脂细胞数量相对GelMA和GM/M水凝胶有所减少,证明了GM/M-Li水凝胶释放的Li+有一定抑脂作用。然而,体外与体内环境完全不同。因此,为了进一步研究,本研究建立了股骨头坏死的兔模型,利用3D打印导航模板技术清理死骨后注射水凝胶进行治疗。通过对兔股骨头组织HE染色、免疫组化染色发现,GM/M-Li水凝胶有效促进了成骨与成血管。既往研究已经使用含有重组骨形态发生蛋白2、锶或铜介孔生物玻璃达到促成骨目的[20-21,34-36];然而,在股骨头坏死环境下,基础炎症水平的升高、脂肪代谢紊乱等因素可能会限制生物材料的成骨和血管生成能力。因此,为骨再生创造合适的微环境是必要的。本研究用锂修饰了介孔生物玻璃。与已报道的改性介孔生物玻璃相比,GM/M-Li水凝胶除了具有成骨的双重作用,还有助于股骨头坏死的骨修复。
在过去的几十年里,研究人员建立了许多动物模型,包括小鼠、大鼠、兔子、狗和猪。每种动物模型都有自己的优点和局限性,根据其独特的特点,设计了基于不同动物模型的各种研究。兔子模型是最常用的动物模型之一,兔子在组织学、形态学、血流动力学等方面与人有相似之处[37],大/小鼠股骨头较小,不利于导航模板水凝胶注入,因此本研究选择了大白兔作为实验动物模型。
尽管GM/M-Li水凝胶的骨组织仍未完全修复,未能获得最佳数据,但这些结果仍表明GM/M-Li水凝胶具有促进骨再生和新生血管生成,同时调节骨髓间充质干细胞向成骨细胞分化,降低激素性股骨头坏死的破坏程度。在未来,笔者还将改进不同浓度锂离子以及其他促骨生成金属与水凝胶结合疗效。同时继续研究水凝胶与干细胞、生长因子、慢病毒等相互之间的结合作用以及精确度和控释问题,进一步研究探索长期骨重建中组织的功能修复和再生能力。

