骨质疏松性椎体压缩骨折保守治疗失败的危险因素分析
徐晨,董亮,冀家琛,万清明,韩进,黄小强
(1.西安医学院,陕西 西安 710068;2.西安交通大学附属红会医院脊柱外科,陕西 西安 710054;3.西安市第五医院骨科,陕西 西安 710082)
骨质疏松症是一种全身性骨疾病,由于各种原因导致骨密度(bone mineral density,BMD)和骨质量下降,骨的微观结构被破坏,导致脆性骨折的风险增加[1]。中国是世界上老年人口最多、增长最快的国家。据预测,骨质疏松症人口将从目前的0.6亿增至2050年的1.2亿以上[2]。由于骨质疏松症的影响,椎体在轻微外伤甚至没有明显外伤的情况下即可发生骨质疏松性椎体压缩骨折(osteoporotic vertebral compression fracture,OVCF),主要表现为腰背部疼痛、活动能力受限,严重降低患者生活质量[3]。
目前对OVCF的最佳治疗方法尚无统一共识,最被广泛接受和临床应用的治疗方法是保守治疗和微创椎体增强术[4]。大多数骨质疏松性椎体压缩骨折通过保守治疗可以愈合,恢复日常活动能力[5]。但少数患者即使经过严格保守治疗,疼痛减轻的效果也并不明显[6]。考虑到OVCF的患者大多为老年人,延长治疗时间可能会导致与行动不便和卧床休息相关的不良后果,因此对有保守治疗失败风险的患者进行早期、有针对性的手术干预可以减少患者痛苦、避免卧床相关并发症和降低医疗费用[7]。因此,笔者采用回顾性病例对照研究,选择2019年1月至2021年12月于西安交通大学附属红会医院接受保守治疗的OVCF患者,探讨保守治疗失败的危险因素,以期为临床提供参考,现报告如下。
1 资料与方法
1.1 一般资料 纳入标准:(1)患者年龄≥60岁;(2)BMD T值≤-2.5;(3)OVCF诊断持续时间≤2周;(4)随访时间≥6个月。排除标准:(1)因恶性肿瘤等因素导致的病理性骨折;(2)感染;(3)有明显外伤史;(4)OVCF引起的神经损伤、椎体后方附件和/或韧带复合体损伤。
根据上述纳入与排除标准,本研究共纳入150例患者,男48例,女102例;年龄60~94岁,平均(71.6±6.4)岁。
1.2 治疗与分组 所有患者均接受镇痛药、卧床休息、短期胸腰椎支具佩戴和严格正规抗骨质疏松的保守治疗方案[8]。不要求患者严格卧床休息,疼痛减轻或可以忍受时,患者可以在支具保护下逐渐活动[9-10]。保守治疗期间预防卧床休息相关并发症,积极咳痰(主动咳嗽、拍背促痰),肢体肌肉主动和被动收缩(15 min/h),睡眠时抬起双腿(高于心脏水平),预防压疮(至少每2小时翻身1次),保证每天足够的水摄入量,每晚用温水冲洗会阴。
OVCF的患者大多为老年人,长期卧床会导致骨量进一步流失、坠积性肺炎、深静脉血栓等一系列并发症,先前多项研究[6,11]也表明保守治疗3周无效的患者行椎体增强术具有可行性,因此本研究将3周作为保守治疗是否有效的时间节点。使用疼痛视觉模拟评分(visual analogue scale,VAS)评估严格正规保守治疗3周后患者的疼痛严重程度,VAS≥4分定义疼痛缓解不佳,疼痛缓解不佳的患者将接受椎体增强术。如果患者疼痛控制良好,能够耐受保守治疗,则接受长期保守治疗。根据疼痛缓解程度将患者分为保守治疗有效组和无效组[12]。有效组92例患者,男31例,女61例;年龄60~84岁,平均(69.5±5.3)岁;无效组58例患者,男17例,女41例;年龄62~94岁,平均(74.9±6.5)岁。无效组中3例患者要求延长保守治疗时间,2例患者因不能耐受手术而未接受手术治疗,其余患者均接受手术治疗。
1.3 观察指标 收集所有患者的一般资料,包括年龄、性别、身体质量指数(body mass index,BMI)、BMD以及是否合并糖尿病、高血压、抑郁症;影像学资料:骨折动态活动(有/无),核磁共振(MRI)T2加权像(T2WI)矢状位的局部高信号或弥漫性低信号改变。根据中国肥胖问题工作组建议,将患者分为超重组(BMI≥24.0 kg/m2)和非超重组(BMI<24.0 kg/m2)。存在骨折动态活动定义为当患者站立或坐姿(处于负重位置)脊柱侧位X线片和仰卧位(处于非负重位)脊柱侧位X线片之间椎体高度发生可测量的变化[13]。
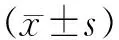
2 结 果
有效组的年龄和BMD T值明显低于无效组(P<0.05,见表1)。两组超重、骨折动态活动度、MRI-T2WI局部高信号或弥漫性低信号发生率比较,差异有统计学意义(P<0.05)。两组之间的性别、高血压、糖尿病、抑郁症比较,差异无统计学意义(P>0.05,见表1)。
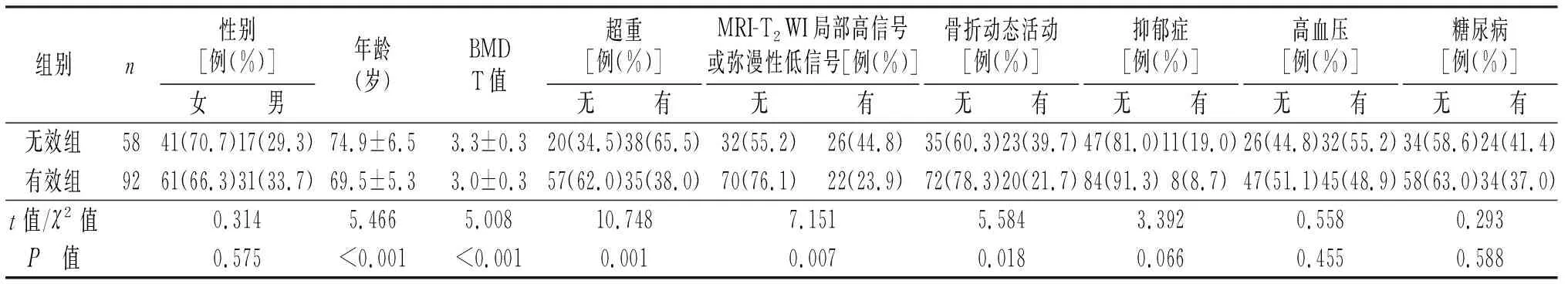
表1 OVCF保守治疗失败的相关因素分析
将具有统计学意义的各项指标纳入多因素Logistic模型分析。由于抑郁症的P值为0.066,非常接近0.05的检验阈值,为了尽可能全面的反映各因素之间的关联,我们也将抑郁症纳入了最后的多因素检验模型。结果显示年龄、BMD、超重、骨折动态活动度、MRI-T2WI局部高信号或弥漫性低信号、抑郁症是保守治疗无效的独立危险因素(P<0.05,见表2)。
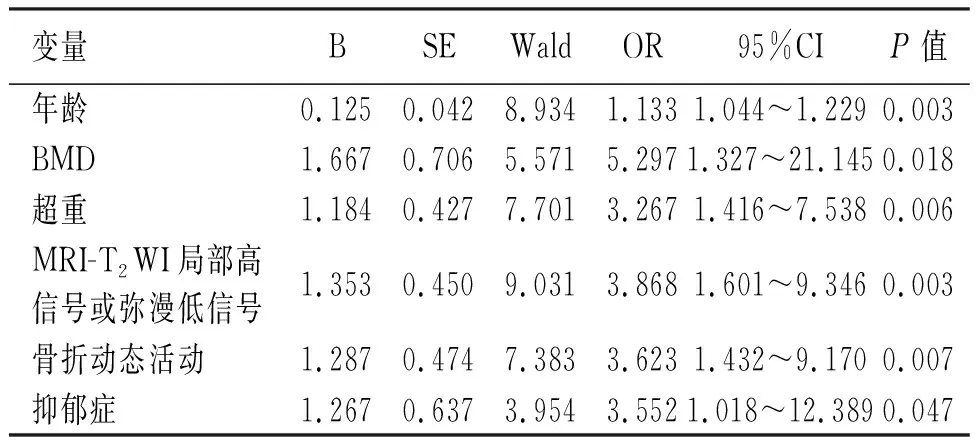
表2 OVCF保守治疗失败多因素Logistic回归分析
将年龄、BMD纳入ROC曲线分析显示,年龄的AUC为0.740(95% CI:0.657~0.824,P<0.001),临界值为72.5岁。BMD的AUC为0.723(95%CI:0.639~0.807,P<0.001),临界值为-3.3。基于这两个指标,预测模型的AUC为0.784(95%CI:0.708~0.860,P<0.001,见表3)。
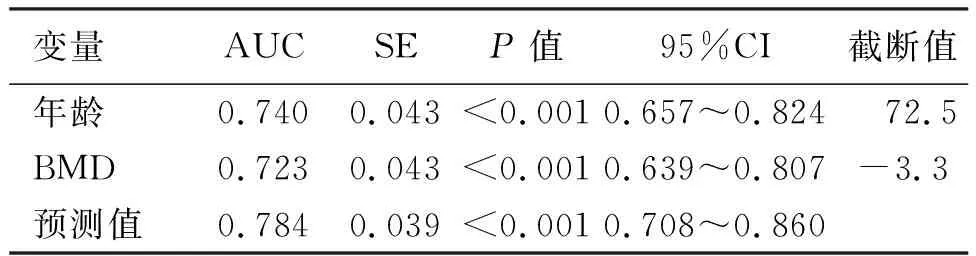
表3 OVCF保守治疗失败相关因素ROC分析
3 讨 论
在全球老龄化的背景下,我国OVCF患者增长迅速。OVCF相关的疼痛通常可以在经过几周适当的保守治疗后缓解,目前一线的治疗方式主要包括卧床休息、药物镇痛、佩戴支具、抗骨质疏松[14]。患者保守治疗的目标是减轻疼痛、保持随后进行日常生活活动的能力,并减少过渡到手术的患者数量[15]。本研究150例OVCF患者经过保守治疗后有92例疼痛明显减轻,治疗的有效率为61.3%,这与之前的一些研究相似[6,16]。
本研究发现年龄>72.5岁、BMD<-3.3、超重以及合并抑郁症是保守治疗无效的高危因素。先前研究证实,高龄是保守治疗中严重椎体塌陷和形成较大后凸角的重要危险因素[5],老年患者更可能无法接受OVCF的保守治疗。年龄是影响骨质疏松症程度的重要因素,由于骨吸收与骨形成比率增加及女性雌激素缺乏,骨丢失量随着年龄的增长而增加。老年患者的BMD较低,这类患者的椎体压缩程度往往更重,压缩程度大意味着脊椎的结构损伤更严重、疼痛更明显。此外,严重的骨质疏松症通常也会导致疼痛。肥胖可能与保守治疗中使用支具佩戴依从性差有关,因为肥胖患者很难安装支具,并且肥胖患者更可能出现多种不利于骨折愈合的情况,包括糖尿病、血管疾病等。有研究表明合并抑郁症与疼痛改善及功能恢复存在明显的负相关[17],这与本研究结果一致,并且疼痛和行动不便会影响患者的社交能力,进一步加重抑郁症状。
MRI具有组织分辨率高、多方位成像、多序列成像的特点,提供信息全面。MRI可以检测到在X线片和CT检查中不明显的骨折,减少漏诊率,还可以明确区分新鲜骨折及畸形愈合的陈旧性骨折,因此MRI在临床中已经成为诊断OVCF不可缺少的检查。MRI还可以提供预后信息,Funayama的研究[15]证实MRI-T2WI矢状位的局部高信号或弥漫性低信号改变是保守治疗6个月后延迟愈合和骨不连风险增加的高危因素。本研究结果显示经过保守治疗3周后疼痛减轻不显著、疗效欠佳的OVCF患者中有MRI-T2WI不良信号改变的发生率明显更高。MRI-T2WI不良信号变化可能是因为局部骨小梁破坏严重或者广泛损伤导致椎体不稳定性增加,引起疼痛加重[18]。最近的一项研究发现对存在MRI-T2WI不良信号改变的患者,早期椎体增强术干预比保守治疗更能减轻患者疼痛和改善日常活动[19]。
OVCF患者动态X线片中椎体楔形变化的差异与患者腰背部的疼痛相关,骨折动态活动对诊断疼痛的椎体高度敏感[20]。回归分析表明存在骨折动态活动是保守治疗无效的独立危险因素。伤椎的动态活动可以导致动态应力和累积损伤,从而引起更多的血管损伤和骨坏死[5]。此外,OVCF患者通常小关节会产生疼痛,骨折动态活动可能会加剧这种疼痛。对有动态活动的椎体可以通过手术灌注骨水泥有效填补腔隙,产生牢固的界面固定作用,消除碎裂骨小梁的微动,实现较好的镇痛效果。
本研究存在一些局限性。首先,本研究为单中心回顾性研究,样本量及随访时间有限,尚需前瞻性、多中心、更大样本量研究以提供更有说服力的数据;此外,由于对保守治疗有效性的定义标准尚未达成共识以及每个患者对疼痛的耐受性可能不同,保守治疗有效性的定义在很大程度上取决于患者的自我感知。
本研究提示OVCF患者保守治疗具有较高的无效发生率,年龄>72.5岁、BMD T值<-3.3、超重、MRI-T2WI矢状位的局部高信号或弥漫性低信号改变、存在骨折动态活动度以及合并抑郁症是保守治疗无效的独立危险因素,存在上述因素时,应考虑早期采取合适的治疗方案。

