同铁不同性:FeSO4·7H2O和(NH4)2Fe(SO4)2·6H2O
——硫酸亚铁铵制备的改进实验
贾艳媛,荣融,马嘉琪,郭硕
内蒙古大学化学化工学院,呼和浩特 010021
硫酸亚铁铵的制备实验是大学无机化学实验中重要的一节,绝大多数无机化学实验教材中主要关注点在于制备过程的操作上[1],而对实验中硫酸亚铁以及制得的复盐硫酸亚铁铵的组成,制得晶体的形态结构、内部构造,二者稳定性的差异等更深层次的问题没有进行探究。我们对内蒙古大学2021级化学专业已做完该实验的学生做了关于本实验的问卷调查,结果显示:19.8%的学生在高中已经学过该实验,46.7%的学生在实验后仍不确定(NH4)2Fe(SO4)2·6H2O与FeSO4·7H2O中结晶水的存在形式,74.26%的学生不明确二者在固体以及溶液状态下对空气的稳定性。这说明目前现有的关于硫酸亚铁铵的制备实验在揭示硫酸亚铁、硫酸亚铁铵的结晶水形式及其晶体结构、稳定性方面仍有很大的改进空间。
基于以上调研,我们对硫酸亚铁铵的制备实验进行了创新和改进,在保持原有制备实验的基础上[2],将重点扩展到了硫酸亚铁与硫酸亚铁铵的结构和稳定性的对比上。首先,在实验原理中,补充了硫酸亚铁、硫酸亚铁铵的单晶结构、氢键、晶格能等相关知识,使学生清晰地认识二者在晶态时Fe2+以及结晶水的存在形式,让学生从本质上直观地理解晶态下硫酸亚铁铵比硫酸亚铁稳定的原因。在实验设计中,基于原有硫酸亚铁铵的制备实验,向其中引入制得硫酸亚铁晶体的步骤,巧妙便捷地设计了对比晶态下的硫酸亚铁、硫酸亚铁铵在空气中的稳定性的实验,同时结合开放式设计,鼓励学生自主设计实验室“绿宝石”的制作流程。通过对比实验,不仅引导学生思考二者稳定性不同的原因,还启发学生自主探究晶体的生长、设计与性质的比较等,增加了实验的高阶性、挑战度与趣味性。同时,在本实验中,引入了显微镜技术,让学生更直观地了解二者晶体形态的不同。在实验内容中,还设计了制作实验室人工“晶体雪”和“透明奶皮”的趣味实验,以便更清晰地观察硫酸亚铁铵晶膜的形成和晶体的析出[3],增强了实验的趣味性(图1)。
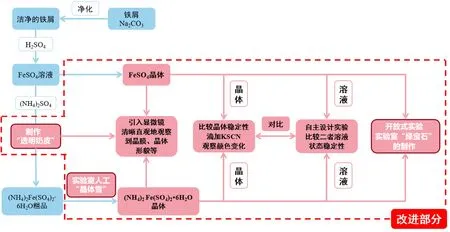
图1 传统实验与改进实验的关系图
设计和改进的实验可让学生在了解熟悉复盐制备的同时,更加理解硫酸亚铁和硫酸亚铁铵稳定性的差别及原因,并推广到简单盐和复盐的差别;掌握其晶体形态、内部结构、氢键、晶格能等相关知识;学会显微镜的相关运用。本实验操作简单,实验中制得的晶体在稳定性对比中有明显的颜色变化,“透明奶皮”“晶体雪”和实验室“绿宝石”的制作集化学知识与化学之美于一身,能够在很大程度上激发学生学习化学、深入思考并进行实验探究的兴趣和热情。改进实验兼具趣味性、创新性、高阶性与挑战性,极大地激发了学生对科学研究的兴趣,培养了学生的创新能力及科研思维,实现了教学目标的达成[4]。
1 实验部分
1.1 实验原理
1.1.1 简单盐与复盐的区别与联系
无机盐包括简单盐和复盐,其中,只由一种金属离子和一种酸根离子组成的晶态化合物称为简单盐,两种或两种以上简单盐类组成的晶态化合物则称为复盐。复盐溶于水所得溶液的性质与组成其简单盐的混合溶液没有区别,复盐因晶格能较大比组成它的简单盐稳定,复盐的溶解度比组成它的简单盐的溶解度小。
1.1.2 晶体结构对比
由单晶结构对比可知(图2),FeSO4·7H2O和(NH4)2Fe(SO4)2·6H2O中Fe2+配位数均为6,配体均为水,前者结晶水的存在形式为6个配位水和1个游离水,后者结晶水的存在形式为6个配位水。从单晶结构可知(图3),(NH4)2Fe(SO4)2·6H2O晶体正负电荷分布更加紧密,氢键更多,(NH4)2Fe(SO4)2·6H2O的晶格能更大,复盐在晶体状态的稳定性更强。
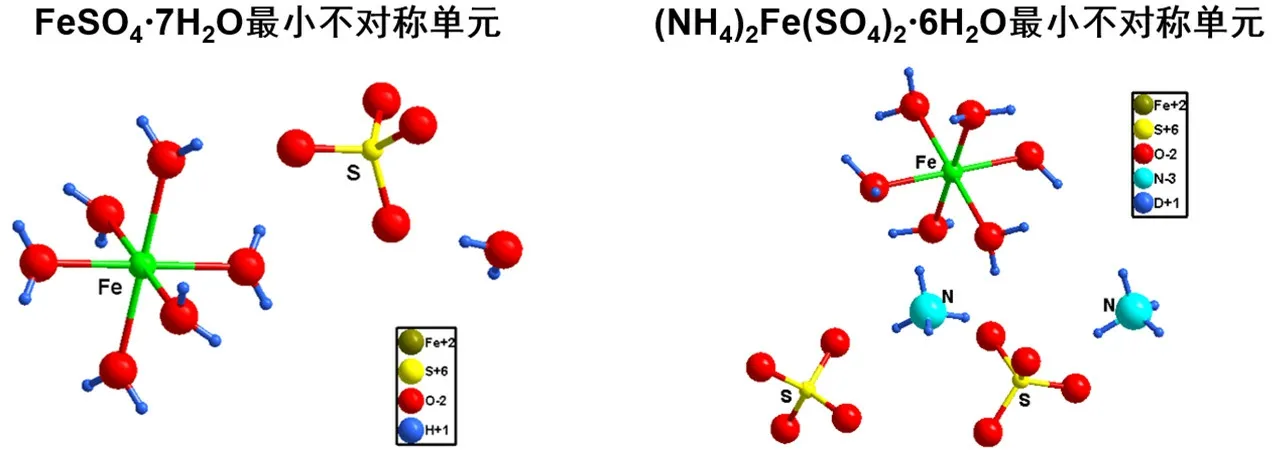
图2 FeSO4·7H2O和(NH4)2Fe(SO4)2·6H2O最小不对称单元结构示意图
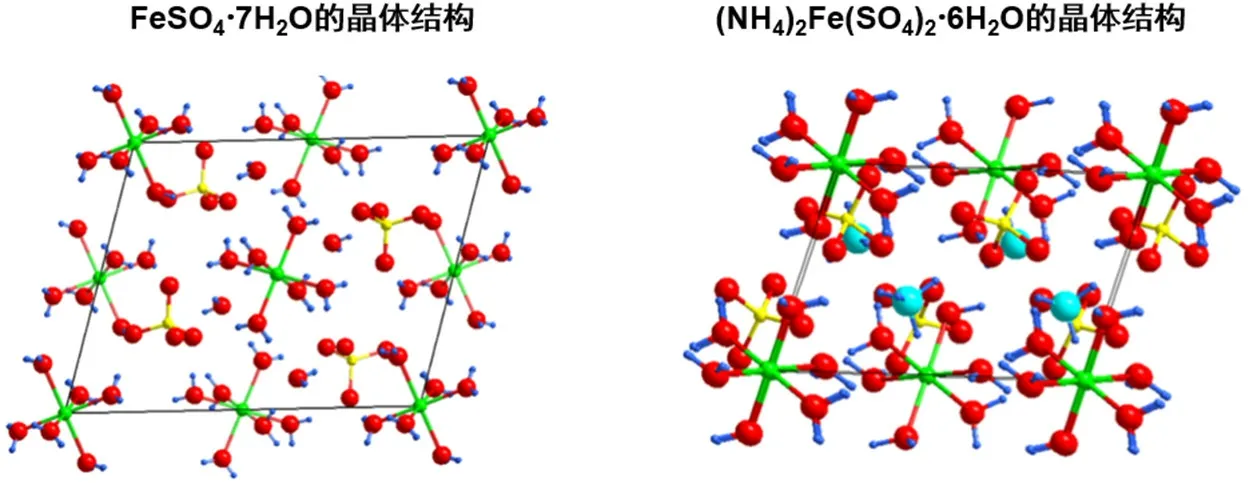
图3 FeSO4·7H2O和(NH4)2Fe(SO4)2·6H2O的晶体结构(1个晶胞)示意图
1.1.3 硫酸亚铁与硫酸亚铁铵的制备
硫酸亚铁是一种简单盐,俗称“绿矾”,为浅绿色晶体,在干燥空气中易风化,可溶于水,几乎不溶于无氧乙醇。
硫酸亚铁铵是一种复盐,为浅绿色单斜晶体。在空气中比一般亚铁盐稳定,不易被氧化,溶于水但不溶于无氧乙醇,是实验室中常用的亚铁试剂。
根据硫酸铵、硫酸亚铁和硫酸亚铁铵在水中的溶解度数据可知,在0-60 °C范围内,易从等物质的量的(NH4)2SO4和FeSO4的浓混合溶液中制得复盐。
固体复盐中的Fe(II)较稳定,但其溶液中的Fe(II)容易被氧化:
为防止Fe2+的氧化,在制备硫酸亚铁铵时,溶液必须保持一定的酸度。
1.2 试剂或材料
铁屑,Na2CO3(质量分数10%),(NH4)2SO4(s),H2SO4(3 mol·L-1),H2SO4(6 mol·L-1),除氧乙醇(体积分数95%),KSCN (0.03 mol·L-1)。
1.3 仪器和表征方法
1.3.1 仪器信息
三目体式显微镜WYT-ET,电加热板,电热恒温水浴锅,分析天平,托盘天平,抽滤瓶,蒸发皿,点滴板,滴管,25 mL容量瓶,滤纸,称量纸。
1.3.2 表征方法
采用三目体式显微镜WYT-ET观察合成的晶膜与晶体的微观形态进行表征。
1.4 实验步骤/方法
1.4.1 铁屑的净化
由于机械加工过程得到的废铁屑油污较多,可通过碱煮的方法去除。取8.4 g铁屑于锥形瓶内,加入30 mL Na2CO3,小火加热10 min并不断搅拌,用倾析法除去碱液,用水洗净。
1.4.2 硫酸亚铁的制备
往盛有铁屑的锥形瓶中加入50 mL H2SO4(3 mol·L-1),水浴加热(在通风橱中进行),并经常取出锥形瓶振荡和适当补充少量水分,直到反应基本完全为止。再加入2 mL (6 mol·L-1)的H2SO4溶液,趁热减压过滤,所得滤液(FeSO4溶液)一半转移至蒸发皿内,剩余静置得到硫酸亚铁晶体。
1.4.3 硫酸亚铁铵的制备——“透明奶皮”的形成
称取7.2 g (NH4)2SO4固体,加入蒸发皿内,水浴加热,搅拌至(NH4)2SO4完全溶解,继续蒸发浓缩至表面有小晶粒出现时用手机拍摄,直到完全形成“透明奶皮”为止,在显微镜下观察“透明奶皮”的纹理。冷却至室温,减压过滤,用无氧乙醇多次洗涤,制得硫酸亚铁铵粗品。
1.4.4 硫酸亚铁铵晶体的重结晶——实验室人工“晶体雪”的形成
对硫酸亚铁铵粗品进行重结晶精制。称量所得晶体的质量,并按每克晶体加1.2 mL水的比例加入相应量蒸馏水,于60 °C下水浴加热,直至完全溶化。向烧杯中滴加除氧乙醇,观察发现晶体逐渐析出并落下,状如雪花飘下,用手机录制“晶体雪”的形成全程。
1.4.5 硫酸亚铁与硫酸亚铁铵的晶体稳定性的对比
对相同质量的硫酸亚铁和硫酸亚铁铵晶体在空气中的稳定性进行比较[5]。取新制的硫酸亚铁与硫酸亚铁铵晶体,分别抽干并取0.5 g,置于两个蒸发皿中。将蒸发皿置于加热板上,在60 °C下加热,15 min后,各滴加2滴适当浓度的KSCN溶液,观察现象,记录于表1。
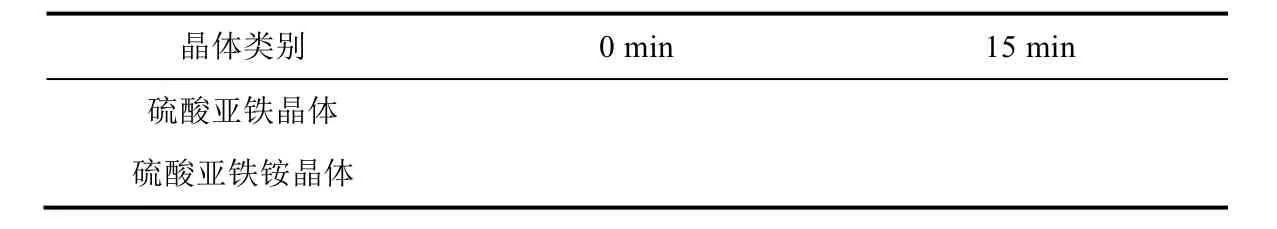
表1 硫酸亚铁和硫酸亚铁铵晶体的颜色变化记录表
1.4.6 显微镜观察晶体形状
(1) 利用显微镜观察对比硫酸亚铁与硫酸亚铁铵的晶体外形,初步认识晶体形状与晶体结构的关系,并探索晶体在宏观与微观的不同。
(2) 开放式设计并制作实验室“绿宝石”,即硫酸亚铁及硫酸亚铁铵单晶的培养,利用显微镜观察并选择合适的晶种,学生自主对晶体生长、尺寸、形状的不同进行设计。
1.5 注意事项
(1) 硫酸亚铁的制备过程所得滤液(FeSO4溶液)应当保持一定酸度,防止Fe2+的氧化,以便后续硫酸亚铁和硫酸亚铁铵晶体的制备。
(2) 为保证后续对比实验的准确性,对硫酸亚铁和硫酸亚铁铵晶体的纯度要求极高,具体方法为:两种晶体结晶后,多次用除氧乙醇对其抽滤洗涤并抽干。
(3) 实验过程中一定保证晶体的酸度一致与干燥,否则容易导致对比实验的失败。
(4) 为保证对比实验的成功,KSCN溶液的浓度及用量应根据不同实验室的制备情况进行微调。
2 结果与讨论
2.1 硫酸亚铁和硫酸亚铁铵的制备
依据上述实验步骤,成功制得蓝绿色的硫酸亚铁晶体与淡蓝绿色的硫酸亚铁铵晶体(图4)。
2.2 硫酸亚铁铵制备过程的拍摄及观察——“透明奶皮”的制作
用手机拍摄硫酸亚铁铵晶膜的形成过程,通过视频快放同学们可清晰地观察到整张晶膜从晶种到晶膜的形成过程,溶液上先析出单个的晶核,再逐渐连结成片,最终一个一个的平面拼接成了完美的晶膜,图5为视频截图。用显微镜观察晶膜表面的纹理和晶种的排布(图6)。

图5 晶膜的产生
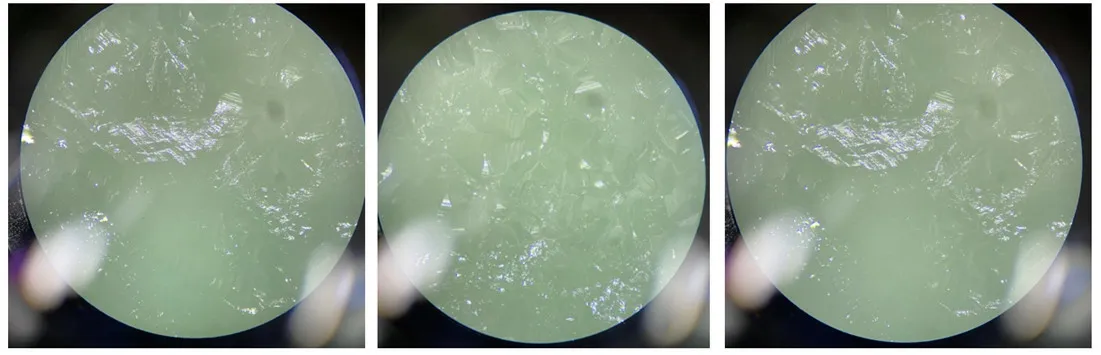
图6 显微镜下观察晶膜
2.3 硫酸亚铁铵的重结晶——实验室人工“晶体雪”
为了提纯硫酸亚铁铵,对晶体粗品进行重结晶,将其再次溶解,向热的饱和溶液中滴加无氧乙醇,溶液分层,上层呈白色、下层呈浅蓝绿色。晶体逐渐析出并落下,且随时间增加,单位时间内晶体下落的数目增多,状如雪花飘下。晶体下落多少随时间的变化由视频记录,图7为视频截图。

图7 实验室人工“晶体雪”
同时,学生可自主设计、改变滴加无氧乙醇的量及速率快慢,以调节晶体析出的快慢和大小,观察得到:加入无氧乙醇的量越多,析出晶体的速率也越快,“雪花”也越大。晶体下落多少随时间的变化由视频记录,图8为加入不同量的无氧乙醇的截图对比结果。

图8 无氧乙醇的量对实验室人工“晶体雪”大小的影响
2.4 硫酸亚铁与硫酸亚铁铵晶体在空气中稳定性的研究及结果
将蒸发皿加热15 min后,硫酸亚铁晶体颜色逐渐由淡蓝绿色变成白色,晶体光泽逐渐消失,表现为易风化,在白色固体上面滴加2滴0.01 mol·L-1KSCN溶液,出现深棕色;硫酸亚铁铵晶体没有明显的变化,晶体表面滴加2滴0.01 mol·L-1KSCN溶液,出现浅黄绿色(图9)。

图9 滴加KSCN前后晶体颜色变化
实验现象说明:晶态下的(NH4)2Fe(SO4)2·6H2O比FeSO4·7H2O更稳定。
2.5 显微镜观察晶体形状
2.5.1 硫酸亚铁晶体和硫酸亚铁铵晶体结构的观察及对比
通过以上对比实验可以看出(NH4)2Fe(SO4)2·6H2O和FeSO4·7H2O的性质不同,在显微镜下也可以清晰地看到两种晶体的不同晶型(图10),其中FeSO4·7H2O为多面体(图10a、10b),(NH4)2Fe(SO4)2·6H2O为长条状(图10c、10d)。通过对晶体的形貌观察以及原理中对二者微观结构的了解,可初步探究晶体形态与结构间的联系,引导学生对后续配位化学、结构化学的学习打下基础。

图10 显微镜下的晶体形态
2.5.2 实验室“绿宝石”的开放式设计
学生可自主利用显微镜观察并选择合适大小的硫酸亚铁或硫酸亚铁铵晶种,通过对晶体生长、尺寸、形状的不同进行设计,制得实验室“绿宝石”(图11)。激发学生后续对晶体物理化学性质的探究潜能。

图11 实验室“绿宝石”
3 特点/特色/创新性说明
(1) 原理上引入单晶结构;
(2) 内容上增加不同状态下稳定性的对比实验;
(3) 显微镜技术与现代通讯技术相结合的趣味实验;
(4) 本实验已在本校的大学生创新训练项目中进行了多次尝试,并在第三届全国大学生化学实验创新设计大赛(华北赛区)上进行了实践。
4 结语
立足于经典的硫酸亚铁铵制备实验,深入探究了晶态硫酸亚铁和硫酸亚铁铵稳定性的不同及原因,提升了实验的层次和深度,在此基础上设计了实验室人工“晶体雪”“透明奶皮”和实验室“绿宝石”的趣味性实验。实验改进后,内容丰富、涉及面广、综合性强,涵盖了简单无机盐、复盐、氧化性、氢键、晶体结构、晶格能等多方面的知识点。同时,实验的时间分配更合理,将时间均匀分配在制备操作和对硫酸亚铁和硫酸亚铁铵的稳定性对比的理论研究上,提高了实验的效率。此外,我们使用了对比与开放式教学方法,激起学生发现问题、提出问题、思考问题的兴趣,丰富了实验教学环节,更培养了学生的探索精神。以丰富鲜明的实验现象激发学生学习兴趣、调动学生主动学习的积极性,达到拓宽学生思维、提高学生综合能力、培养学生创新意识及实践能力的目的。

