醒脑解郁方灌胃对大鼠卒中后抑郁的治疗作用及机制
彭涛,杨一帆,2,王海霞,李雨,王涛,闫咏梅,2
1 陕西中医药大学第一临床医学院,陕西咸阳 712046;2 陕西中医药大学附属医院脑病医院;3 陕西省人民医院神经内二科
卒中后抑郁(PSD)是常见的卒中后精神心理疾病,流行病学调查发现,约55%的卒中患者在发病后5 年内并发PSD[1]。与无情感障碍的卒中患者相比,PSD 患者的病死率显著升高,且易诱发自杀倾向,严重影响患者的生活质量,不利于神经功能的恢复,并增加家庭及社会的负担。PSD 的病理机制复杂,是神经生物学和心理学机制共同作用的结果,这些机制包括神经再生、突触的可塑性、神经元凋亡、炎症反应、神经内分泌失调、遗传易感性以及家庭心理因素等[2]。下丘脑—垂体—肾上腺(HPA)轴介导的神经内分泌调节是维持机体内环境及精神活动稳态的关键[3]。当经历应激事件时,HPA 轴被激活,下丘脑和垂体大量释放促肾上腺皮质激素释放激素(CRH)、血清促肾上腺皮质激素(ACTH)和糖皮质激素(GC)[4],在ACTH 和GC 的参与和调控下,进一步生成皮质醇(CORT);ACTH、CORT 合成后被血液输送到全身各个组织和器官中,而糖皮质激素受体(GR)则与下丘脑释放的CRH、ACTH 结合,发挥相应的调节作用。这些激素水平升高造成HPA 轴功能紊乱,从而参与抑郁症的发生。中医学认为,机体气血郁滞、津液不通而发为郁证。陕西名中医闫咏梅教授将PSD 分为阴证和阳证,阴证多为痰瘀互结证,阳证多为郁火脾虚证,以此立法,自拟醒脑解郁方。长期临床实践表明,该方能够显著改善抑郁情绪及神经功能损伤[5]。2022 年11 月—2023 年5 月,我们通过观察醒脑解郁方对PSD 大鼠抑郁状态及HPA 轴相关激素的影响,探讨其防治PSD 的神经内分泌机制。
1 材料与方法
1.1 材料
1.1.1 动物 雄性SD 大鼠SPF 级60 只,体质量(240 ± 20)g,由西安交通大学医学院实验动物中心提供,饲养于陕西中医药大学国医大师研究院动物房。动物合格证号SCXK(陕)2018-001。饲养条件:温度(22 ± 2)℃,湿度50% ± 10%,按时通风,干燥垫料及自由饮水,适应性喂养1周。
1.1.2 药品 醒脑解郁方组成:石菖蒲12 g,巴戟天10 g,柴胡12 g,合欢皮15 g,丹参30 g,远志12 g,姜黄10 g。中药饮片购自陕西中医药大学附属医院中药房。将饮片加入蒸馏水煎煮,滤出药液,然后加热浓缩。根据人体用药剂量101 g/60 kg,以换算系数6.25 计算大鼠用药剂量为10.5 g/kg,分别将中药液浓缩至1.05、2.10 g/mL,4 ℃保存备用。将盐酸氟西汀胶囊(20 mg/粒,苏州礼来制药有限公司)加入生理盐水,配制成浓度为0.208 mg/mL的药液,4 ℃保存备用。
1.1.3 主要试剂与仪器 ACTH、CORT ELISA 检测试剂盒(南京建成生物),2%戊巴比妥钠、二甲苯、水溶性伊红Y(上海国药集团),BCA 试剂盒、RIPA裂解液(上海碧云天),TTC 染色液、4%多聚甲醛溶液(武汉赛维尔生物),苏木素(美国Sigma),PVDF膜(德国MilliPore),CRH 多克隆抗体、GR 多克隆抗体(武汉博士德),β-action(美国Affinity),兔多抗CRH、兔多抗GR(武汉三鹰生物),HRP 标记羊抗兔二抗(上海碧云天)。酶标仪(美国Thermo),电子天平(常州幸运电子),光学显微镜(上海仪圆光学),电泳仪(北京六一)。
1.2 动物分组与造模 采用随机数字表法将大鼠分为正常对照组、PSD 组、氟西汀组、醒脑解郁方低剂量组、醒脑解郁方高剂量组,每组各12 只。采用大脑中动脉栓塞(MCAO)联合慢性不可预知温和刺激(CUMS)制备PSD 模型,按照Willner 法稍微改进。正常对照组不做处理,其他4 组采用线栓法制备MCAO 模型。大鼠禁食24 h后,麻醉固定,沿颈部正中纵向切开,充分暴露大鼠右侧颈总动脉和分叉。将颈外动脉、颈内动脉分离,结扎颈总动脉和颈外动脉,在颈总动脉近心端用眼科剪剪开一小口,将线栓插入18~20 mm,直至有阻力时说明进入大脑中动脉,固定线栓。1 h后拔出线栓,结扎颈内动脉,缝合伤口,待麻醉复苏后放回原笼中继续饲养。术后连续3 d 给予青霉素肌内注射预防感染。术后24 h 内采用Longa 5 分法进行神经功能评定,0 分:正常,无神经功能损伤;1 分:轻度神经功能损伤,偏瘫侧前爪内收;2 分:中度神经功能损伤,行走时大鼠向肢体瘫痪侧转圈;3 分:重度神经功能损伤,偏瘫侧肢体不能支撑大鼠行走;4 分:丧失行走能力,意识不清。剔除得分0 和4 分的大鼠,以得分1~3 为卒中造模成功,继续后续抑郁症造模实验。MCAO 术后第4 天开始,PSD 组、氟西汀组、醒脑解郁方低剂量组和高剂量组采用CUMS 法制备抑郁模型,正常对照组不做处理。选取7 种不同的刺激方式,包括禁食禁水24 h、潮湿垫料24 h、夹尾2 min、强迫4 ℃下游泳5 min、足底20 V 电击2 min、昼夜颠倒、晃笼3 min,每天随机选取1种刺激,相同刺激方式不重复进行,每种刺激方式使用2~3 次,以确保不可预知性,连续21 d。
1.3 药物干预方法 4 只大鼠在造模后神经功能缺损评分为0分,麻醉死亡2只,造模死亡5只,灌胃死亡4 只,均予以剔除,每组剩余9 只大鼠。CUMS期间,正常对照组和PSD 组给予0.9%氯化钠溶液,氟西汀组予0.208 mg/mL 盐酸氟西汀;醒脑解郁方低、高剂量组分别予1.05、2.10 g/mL 醒脑解郁方药液,连续灌胃21 d。
1.4 大鼠抑郁状态评估 每天观察并记录大鼠的精神状态、行为活动、毛色、进食、饮水、粪便情况,比较大鼠治疗前后体质量。于CUMS 实验第0、11、21 天观察大鼠强迫游泳时肢体动作及游动时间,评估大鼠糖水消耗量,测试大鼠在敞箱中4 min内水平方向行走格数和垂直方向时前肢抬起次数。
1.5 标本采集 给药结束后次日,将大鼠麻醉,每组分别取6只大鼠采集腹主动脉血,离心分离血清,-80 ℃保存,用于血清ACTH、CORT检测。剪断大鼠两侧肋骨,显露心脏,使用生理盐水进行心脏灌注,随后断头取脑。每组分别取3 只大鼠全脑,加入多聚甲醛固定,4 ℃保存,用于组织病理学观察;剩余6 只大鼠取全脑,冰上分离海马和下丘脑组织,-80 ℃保存,用于检测海马、下丘脑组织CRH、GR 蛋白表达水平。
1.6 血清HPA 轴相关激素ACTH、CORT 检测 采用ELISA 法。取血清样本37 ℃水浴锅中解冻,加入PBS 溶液后匀浆。取出预先包被封闭好的96 孔板,用移液枪将标准品和稀释的样品依次加入每个孔中,37 ℃孵育120 min。弃去液体,甩干,加入生物素标记抗体工作液,37 ℃孵育60 min。弃去液体,甩干,洗板,加入TMB 显色液,37 ℃避光孵育20 min。加入TMB 终止液混匀,终止反应。上酶标仪,于450 nm 处测OD 值,绘制标准曲线,计算ACTH、CORT含量。
1.7 大鼠海马组织形态观察 采用HE 染色法。取脑组织,梯度乙醇脱水,二甲苯透明,石蜡包埋、切片,脱蜡。加入苏木素染液染色5 min,浸洗返蓝。加入1%伊红染液染色5 min。置于无水乙醇、二甲苯中脱色透明,中性树胶封片,光学显微镜下观察海马组织病理改变。
1.8 海马、下丘脑组织HPA轴相关激素CRH、GR蛋白检测 采用Western blotting法。取海马、下丘脑组织,加入蛋白裂解液,提取总蛋白,采用BCA 法检测蛋白浓度。加入5×蛋白上样缓冲液,按30 μg 蛋白/孔道上样,SDS-PAGE分离蛋白,转移至PVDF膜,5%脱脂牛奶室温封闭1 h。TBST洗膜,加入一抗β-actin(1∶1 000)、CRH(1∶500)、GR(1∶3 000),4 ℃孵育过夜。TBST洗膜,加入二抗(稀释比例均为1∶600),常温孵育2 h,TBST清洗。滴加超敏ECL发光显影液显影,拍照,用Image J软件分析条带灰度值。以β-actin为内参,计算目的蛋白的相对表达量。
1.9 统计学方法 采用SPSS26.0统计软件。计量资料采用S-W 法进行正态性检验,呈正态分布的数据以±s表示,方差齐性时多组间比较采用单因素方差分析、两组间比较采用LSD法,方差不齐时采用Tamhane'sT2检验;重复测量的数据比较采用重复测量资料的方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠抑郁状态比较 各组大鼠体质量变化情况见表1。与正常对照组比较,PSD组体质量降低(P<0.01),与PSD 组比较,氟西汀组、醒脑解郁方低剂量组和高剂量组的体质量均增加(P均<0.01)。各组大鼠抑郁行为学评分比较见表2 ~ 5。实验第11天时,与正常对照组比较,PSD组强迫游泳时间缩短、糖水消耗量降低、水平及垂直运动得分降低(P均<0.01);与PSD 组比较,氟西汀组、醒脑解郁方低剂量组和高剂量组游泳时间及水平运动得分变化均增加(P均<0.05),醒脑解郁方低剂量组、高剂量组的垂直运动得分及低剂量组的糖水消耗量变化无统计学意义(P均>0.05)。第21 天时,与正常对照组比较,PSD 组强迫游泳时间缩短、糖水消耗量减少、水平及垂直运动得分降低(P均<0.01);与PSD 组比较,氟西汀组、醒脑解郁方低剂量组和高剂量组游泳时间、水平及垂直运动得分变化均增加(P均<0.05),氟西汀组、醒脑解郁方低剂量组糖水消耗量增加(P均<0.01),醒脑解郁方高剂量组糖水消耗量无明显变化(P>0.05)。
表1 各组大鼠体质量变化情况(g,± s)

表1 各组大鼠体质量变化情况(g,± s)
注:与正常对照组比较,*P<0.05,**P<0.01;与PSD组比较,#P<0.05,##P<0.01。
?
表2 各组大鼠强迫游泳时间比较(s,± s)

表2 各组大鼠强迫游泳时间比较(s,± s)
注:与正常对照组比较,*P<0.05,**P<0.01;与PSD组比较,#P<0.05,##P<0.01。
?
表3 各组大鼠糖水消耗量比较(mL,± s)
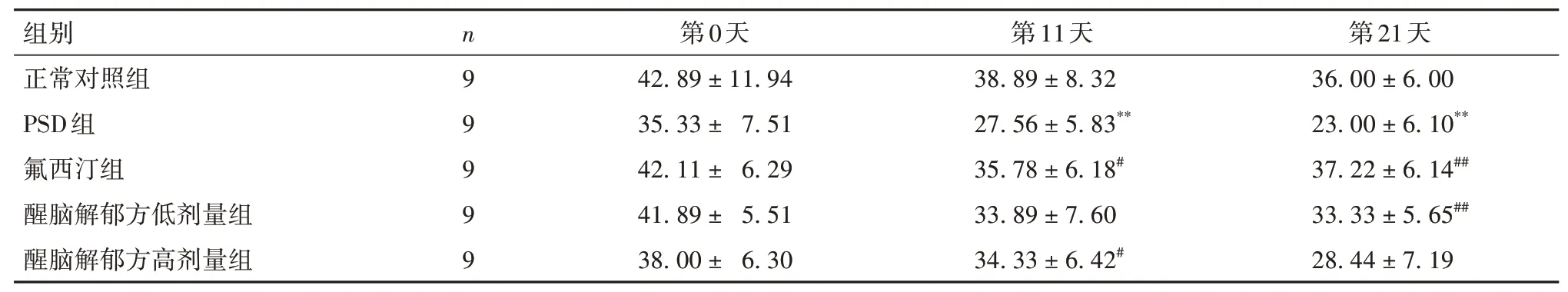
表3 各组大鼠糖水消耗量比较(mL,± s)
注:与正常对照组比较,*P<0.05,**P<0.01;与PSD组比较,#P<0.05,##P<0.01。
?
表4 各组大鼠水平运动行走格数比较(格/4分钟,± s)

表4 各组大鼠水平运动行走格数比较(格/4分钟,± s)
注:与正常对照组比较,*P<0.05,**P<0.01;与PSD组比较,#P<0.05,##P<0.01。
?
表5 各组大鼠垂直运动实验双上肢抬起次数比较(次/4分钟,± s)

表5 各组大鼠垂直运动实验双上肢抬起次数比较(次/4分钟,± s)
注:与正常对照组比较,*P<0.05,**P<0.01;与PSD组比较,#P<0.05,##P<0.01。
?
2.2 各组大鼠血清ACTH、CORT 水平比较 与正常对照组比较,PSD 组血清ACTH、CORT 水平升高(P均<0.01);与PSD 组比较,氟西汀组和醒脑解郁方低剂量组血清ACTH 水平降低(P均<0.05),且醒脑解郁方低剂量组血清ACTH 水平低于氟西汀组(P<0.01),醒脑解郁方高剂量组血清ACTH 水平与PSD组比较差异无统计学意义(P>0.05)。与PSD组比较,氟西汀组、醒脑解郁方低剂量组和高剂量组血清CORT 水平均降低(P均<0.05),且氟西汀组和醒脑解郁方低剂量组血清CORT 水平低于醒脑解郁方高剂量组(P均<0.01)。见表6。
表6 各组大鼠血清ACTH、CORT水平比较(ng/mL,± s)

表6 各组大鼠血清ACTH、CORT水平比较(ng/mL,± s)
注:与正常对照组比较,*P<0.05,**P<0.01;与PSD 组比较,#P<0.05,##P<0.01。
?
2.3 各组大鼠海马组织病理形态比较 PSD 组大鼠海马组织神经元数量缺失明显,排列松散,轮廓模糊,胞体肿胀,胞核消失,呈现炎性改变;氟西汀组及醒脑解郁方低剂量组和高剂量组大鼠海马组织神经元较PSD 组结构基本完整,损伤减轻,水肿减少,细胞存活量增多,排列较为整密。见OSID码图1。
2.4 各组大鼠海马组织GR 和下丘脑组织CRH 蛋白表达水平比较 与正常对照组比较,PSD 组大鼠海马组织GR 蛋白表达水平降低,下丘脑组织CRH蛋白表达水平升高(P均<0.01);与PSD 组比较,氟西汀组及醒脑解郁方低、高剂量组海马组织GR 蛋白表达水平升高,下丘脑组织CRH 蛋白表达水平降低(P均<0.01)。见表7。
表7 各组大鼠海马组织GR与下丘脑组织CRH蛋白表达比较(± s)

表7 各组大鼠海马组织GR与下丘脑组织CRH蛋白表达比较(± s)
注:与正常对照组比较,*P<0.05,**P<0.01;与PSD 组比较,#P<0.05,##P<0.01。
?
3 讨论
PSD 是卒中发病后常见的一种情感障碍性疾病,表现为一系列情绪低沉、言语减少、兴趣缺失、食欲减退、睡眠欠佳、思维悲观等情感精神障碍的综合征。PSD 的病因及发病机制至今尚未完全阐明,其机制涉及反应性和内源性两方面。反应性机制也称为社会心理机制,脑卒中后出现肢体运动功能障碍、言语障碍等,一定程度上可加重负面情绪,给患者造成严重心理负担,继而导致抑郁、焦虑等情绪产生。内源性机制主要包括神经递质学说、炎性因子学说、神经内分泌学说、营养因子学说等。目前PSD 尚无特异性治疗方案,药物治疗仍是首选,代表药物有5-羟色胺再摄取抑制剂、特异性5-羟色胺能抗抑郁药以及三环类药物,这些药物虽然能够有效缓解PSD患者症状,但长期服用会引起便秘、口干、头晕、失眠等不良反应,甚至增加出血风险,不利于患者恢复及治疗。
PSD 是继发于中风的一种精神心理疾病,属于“中风”“郁证”的范畴。闫咏梅教授根据多年临床诊疗经验,认为PSD 乃诸因相互影响、交互为患,并由此开创醒脑解郁方。方中石菖蒲芳香化痰、醒脑开窍;远志性善宣泄通达,具有宁心安神、祛痰的功效,二药合用,安神定志、豁痰开窍之效愈显,共为君药;丹参活血调经、清心除烦;柴胡疏肝行气、解郁泻热;配以合欢皮解郁和血,郁金开郁行气、清心开窍,佐以长于补肾温阳之巴戟天,其性温可调和全方用药偏凉之弊。全方共奏醒脑解郁、化痰活血、理气扶正之功。现代药理研究发现,石菖蒲水提物对获得性无助模型大鼠具有抗抑郁作用,其机制可能是通过增强5-羟色胺的神经系统功能来发挥作用[6]。远志所含皂苷和寡糖酯类化合物能够抑制神经递质失衡和促进脑源性神经营养因子(BDNF)的表达来发挥对抑郁症的治疗作用[7]。丹参多酚酸是丹参的重要活性成分之一,具有抗炎、抗氧化作用,其可通过抑制JAK2/STAT3 信号通路活化以及IL-6、IL-1β、TNF-α表达,减轻神经炎症,调节单胺类神经递质水平,改善星形胶质细胞功能,从而有效改善大鼠抑郁样行为[8]。柴胡的主要活性成分柴胡皂苷A 能够抑制HPA 轴失衡、促进BDNF 表达、抑制免疫炎症反应、调节mTOR 信号通路,通过多种途径来改善抑郁症状[9-10]。郁金的有效成分β-谷甾醇、姜黄素以及合欢皮中的总皂苷、多糖等活性成分可通过调控NFκB 信号通路,以及调节神经递质和促炎因子表达,发挥抗抑郁和神经保护作用[11-12]。巴戟天所含成分寡糖、多糖、棕榈酸和丁二酸都具有抗抑郁功效。动物实验表明,巴戟天寡糖能使抑郁大鼠海马中BDNF、突触蛋白表达明显提高,还可增加海马神经元数量,促使神经细胞再生,调节神经可塑性[13-14]。我们的前期动物实验表明,醒脑解郁方可通过调控海马组织内凋亡蛋白Bcl-2/Bax表达,改善海马神经元形态,上调海马区钙调蛋白mRNA 以及钙调蛋白依赖激酶Ⅱ的表达,并可提高T淋巴细胞功能,增强抑郁大鼠的免疫功能[15-17],对PSD 发挥多途径、多靶点的治疗作用。
CUMS 模型是通过模拟人类生活中的不良应激事件,从而诱发动物抑郁样症状,其病理生理机制更符合人类抑郁症的发病机制。本研究结果显示,在第11 天行为学测试时,PSD 组多数大鼠精神萎靡不振,食量减少,体质量增长相对减慢,糖水消耗量减少,强迫游泳时间缩短,旷场实验活动量及活动范围减小,表明大鼠出现抑郁症状;与PSD 组比较,氟西汀组及醒脑解郁方组大鼠均表现为精神状态良好,饮食和饮水正常,体质量增加,糖水偏好度、强迫游泳时间及旷场实验得分明显增高,其中以氟西汀组、醒脑解郁方低剂量组变化更明显。以上提示氟西汀和醒脑解郁方均可改善PSD 大鼠的抑郁症状,且氟西汀短期内改善效果更快,而醒脑解郁方短期内症状改善稍差。在第21 天行为学测试时,PSD 组大鼠精神状态较前更差,体质量明显下降,对刺激无反应,糖水消耗量更少,强迫游泳时间及旷场实验得分明显减少,表明大鼠抑郁程度继续加重;而氟西汀组及醒脑解郁方低剂量组大鼠的精神状态及毛发光泽与空白组相似,体质量明显增加,糖水消耗量、强迫游泳时间及旷场实验得分均较PSD组明显增加。组织病理形态比较发现,与PSD组比较,氟西汀组及醒脑解郁方组大鼠海马组织神经元结构基本完整,损伤减轻,水肿减少,细胞存活量增多,排列较为整密。这表明醒脑解郁方能够减轻PSD模型大鼠海马神经元损伤,改善组织病理变化程度。以上结果表明,醒脑解郁方可有效改善PSD大鼠的抑郁症状,尤其具有远期疗效。
PSD 发生过程极其复杂,不仅涉及一系列的炎症级联反应,也激活了相应的神经内分泌系统。HPA 轴功能状态在PSD 的神经内分泌机制中起着非常关键的作用,是压力应激系统的重要组成部分之一,能够对各种压力和精神行为的变化做出适应性调节,使人体内环境和精神活动处于稳定状态。当经历应激事件时,HPA 轴被激活,下丘脑室旁核小细胞区合成和分泌CRH,CRH 信号传导至垂体前叶,继而分泌ACTH 到血液中并进入肾上腺,对肾上腺皮质细胞产生作用,调节肾上腺皮质束状带、网状带的合成与分泌,从而合成肾上腺皮质和刺激CORT 分泌[18]。CORT 能负调控CRH 和ACTH 的合成和分泌,随着CORT 水平的增加,下丘脑和海马体的受体感受器也会受到影响,从而负反馈调节引起应激反应下调。另一方面,HPA 轴通过介导炎症反应维持平衡。研究表明,免疫细胞可以通过释放促炎细胞因子来调节中枢神经系统,其关键环节仍然涉及HPA 轴,PSD 发病过程中释放大量促炎细胞因子,刺激下丘脑的室旁核分泌CRH、ACTH,促使CORT 大量增加,最后导致HPA 轴功能亢进[19]。因此,ACTH、CORT 水平与HPA 轴的功能状态密切相关。研究发现,抑郁患者表现为CRH、ACTH 和CORT 分泌水平升高[20]。另有研究表明,通过调节脑垂体ACTH 和肾上腺CORT 水平可以逐步恢复HPA 轴的功能,缓解卒中患者的抑郁行为[21]。本研究结果显示,PSD 组大鼠血清ACTH、CORT 水平较正常对照组明显升高,一方面可能是过量的炎症细胞因子刺激下丘脑及海马等区域,使CRH 水平升高,继而引起ACTH、CORT 水平相继升高;另一方面也可能是神经内分泌系统与CNS 相互作用的结果。氟西汀组和醒脑解郁方低剂量组血清ACTH、CORT水平均明显下降,表明醒脑解郁方在一定程度上可以抑制HPA轴过高的激素水平。
GR是一种核受体,属于核转录因子超家族的一员,调控着多种下游基因的转录激活或抑制,参与机体的应激反应、免疫调节和抗炎等过程,进而维持生理内稳态[22]。CRH 是由下丘脑分泌的一种肽类激素,主要作用于腺垂体,促进腺垂体合成与释放ACTH。CRH 是HPA 轴激活和级联反应的起始,随后刺激垂体前叶释放ACTH,肾上腺皮质受到ACTH刺激后释放出终产物CORT,进而参与各种生理活动的调控。脑卒中发生后,由于机体长期维持在应激环境中,以致交感神经亢奋,促使类固醇激素、GC等甾体激素分泌,GC异常分泌会对中枢神经系统产生慢性毒害作用,且机体应激时GC 与其受体GR 的结合增强,进而负反馈调节HPA 轴;此外,过度升高的GC可通过GR,作用于中缝核—海马系统,使5-羟色胺等单胺类神经递质和脑源性神经营养因子释放减少,从而导致中风患者出现情绪低落、快感丧失等抑郁样行为。因此,GR 是调节HPA 轴功能变化的关键靶点。本研究结果显示,PSD组大鼠海马GR蛋白表达减低、下丘脑CRH 蛋白表达水高,这可能是PSD 大鼠过高的血清CORT 作用于海马GR,从而使海马GR 表达下调,而下丘脑CRH 表达升高则是由于炎症因子刺激所致。经醒脑解郁方和氟西汀干预后,大鼠海马GR 蛋白水平明显上调,下丘脑CRH 蛋白水平显著下降,说明醒脑解郁方可通过降低血清中过高的激素水平、上调海马GR的表达来调节PSD大鼠的HPA 轴,从而抑制HPA 轴持续亢进,改善PSD 模型大鼠的神经功能缺损症状和抑郁表现,发挥治疗作用。
综上所述,醒脑解郁方可改善PSD 大鼠海马神经元损伤,通过抑制HPA 轴过度激活,上调海马GR蛋白水平、降低下丘脑CRH 蛋白水平,改善大鼠行为学症状,发挥抗抑郁功效,实现治疗PSD的目的。

