丛枝菌根真菌联合拮抗菌对花椒根腐病的防治作用
李梦玮,陈晓霞,廖礼彬,李婧怡,张楠楠,石福孙
(1.中国科学院成都生物研究所,成都 610041;2. 中国科学院大学,北京 100049;3. 中国科学院茂县山地生态系统定位研究站,四川 茂县 623200)
【研究意义】花椒(ZanthoxylumbungeanumMaxim.)在我国具有广泛的药用和经济用途,位于四川省阿坝藏族羌族自治州的茂县盛产“大红袍”花椒,因其色泽红润、麻香浓郁,是当地致富的支柱产业。但花椒易受根腐病病害侵袭,造成大批成年椒树死亡,且危害程度逐年上升,新椒园发病率为20.00%左右,种植5年以上的花椒发病率达45.00%以上,严重时可使花椒死亡率高达51.51%[1]。花椒根腐病的主要发病症状表现为侧根易发生病斑,随着病情加深,根系腐烂,根皮与木质部易脱离,严重时木质部呈黑色,有异臭味,地上枝叶发育不全、枯黄,果实小,产量下降,并且在已发病植株的土壤中再次种植健康花椒,根部仍会染病[2-3],不但给农民造成不可挽回的损失,也影响花椒产业的发展[4],是一项丞待解决的植物病害问题。目前,花椒根腐病的防治主要以农业管理和化学药剂使用为主,存在费时费力、污染环境等问题,因此,花椒根腐病的生物防治研究逐渐受到关注。生物防治技术具有绿色、环保、高效等特点,是将有益微生物或有拮抗作用的代谢物运用到防治病害中的一种方法。本研究围绕花椒根腐病的生物防治,通过丛枝菌根(Arbuscular mycorrhiza, AM)真菌联合拮抗菌对花椒根腐病的盆栽防效试验,明确AM真菌和拮抗菌对花椒根腐病的防治效果,对预防花椒根腐病具有重要意义。【前人研究进展】引发花椒根腐病的病因复杂。1994年,朱天辉等[5]首次发现四川汉源花椒根腐病的主要致病菌是腐皮镰刀菌(Fusariumsolani),李智敏等[6]、田凤鸣等[7]和阮钊等[2]将云南昭通、甘肃陇南和陕西凤的花椒根腐病致病菌也鉴定为腐皮镰刀菌,发现此病原菌致病力强,具有顽固性,且能在土壤环境中长期存活,根腐病也因此成为最难防控的土传植物病害。目前应用于花椒根腐病生防中的生防菌主要有芽孢杆菌属、木霉属菌株等,李姝江等[8]发现,高浓度的蜡样芽孢杆菌对花椒根腐病有明显抑制作用,在田间试验中预防率可达100%;田凤鸣等[9]发现2种木霉复配对花椒根腐病病原菌的抑制效果为88%,并且发现贝莱斯芽孢杆菌对花椒根腐病病原菌有平板抑制作用。生防菌主要包括真菌、细菌等有益微生物,广泛分布于自然环境中,其中青霉菌和枯草芽孢杆菌是常用于植物病害防治的生防菌株。草酸青霉对番茄青枯病病原菌、金线莲茎腐病病原菌等具有抑制作用[10-11],而枯草芽孢杆菌对水稻稻瘟病[12]、黄瓜白粉病[13]等多种植物病害有预防作用,能显著降低发病率。经四川省茂县生态站实验室前期从花椒根部及根际土壤中经分离、鉴定,获得对F.solani有抑制作用的1株拮抗真菌草酸青霉(PenicilliumoxalicumHB21-1)和1株拮抗细菌枯草芽孢杆菌(BacillussubtilisHX11),5 d的平板对峙试验显示其抑菌率分别为61.00%和42.34%。AM真菌属于球囊菌门(Glomeromycota),其作为有益菌能与植物建立互惠共生关系,以不同方式和途径影响植物的代谢过程,可增强植株对病原菌的抗逆性,是一类陆生植物中广泛存在的共生微生物[14-16]。研究发现,摩西球囊霉对洋葱根腐病有防治作用,并能减少病原菌对洋葱根系的侵染,提高植株抗病性[17],此后AM真菌对植物病害的影响逐步受到关注。接伟光等[18]发现,摩西管柄囊霉可抑制大豆根腐病原菌尖孢镰刀菌在根部的定殖,从而缓解根腐病的发生;Liu等[19]发现,接种根内根孢囊霉的芦笋,其根腐病病情指数呈下降趋势。丛枝菌根真菌不仅对植株根部的营养微环境有良好的改善作用,还能选择性地对根部周围的病原物产生抑制作用,降低病原菌侵染植株的概率,从而降低植株发病率和死亡率[20]。经四川省茂县生态站实验室前期对花椒根际土壤AM真菌群落结构进行分析,发现异形根孢囊霉(Rhizophagusirregularis)在感病、健康土样中均占比较高,设想其可与花椒建立良好的生态关系,易于定殖,所以选用异形根孢囊霉进行后续试验。综上,本研究通过AM真菌、HB21-1和HX11单独或联合进行盆栽试验处理,进一步探究生防菌对花椒根腐病的防治效果。【本研究切入点】目前,随着越来越多有益微生物的开发和应用,研究者们发现大多数有益菌对植物的防病效果具有协同作用,有益菌联合接种对植物影响的研究越来越受到重视。Tanwar等[21]发现,番茄接种尖孢镰刀菌后发病率为70.00%,接种AM真菌摩西管柄囊霉和光壁无梗囊霉后发病率降为20.00%,2种AM真菌和木霉菌联合接种则可完全抑制病害发生。Mwangi等[22]研究发现,与单独接种AM真菌混合菌剂或哈茨木霉相比,联合接种可将番茄地上生物量提高11.60%~69.70%,2种菌剂联合防治植物病害具有明显的协同作用。因此,有益菌联合防治植物病害成效显著,能有效降低植物病害发生率,然而关于花椒根腐病的联合生物防治研究鲜有报道。【拟解决的关键问题】以AM真菌、草酸青霉HB21-1和枯草芽孢杆菌HX11为供试菌株,以花椒根腐病病原菌腐皮镰刀菌为靶标菌,通过盆栽防效试验探究生防菌单独或联合处理对花椒根腐病的防治效果及机制,为花椒根腐病的生物防治及合理利用微生物资源开发提供理论依据。
1 材料与方法
1.1 供试材料
供试植株为“大红袍”一年生花椒幼苗,购于四川省阿坝州茂县五月脆农业科技有限公司。花椒幼苗根部经75%酒精浸泡5 min,磷酸盐溶液浸泡5 min,无菌水反复冲洗后备用。
供试土壤为农田土、珍珠岩、蛭石(6∶2∶2)混合基质,农田土过2 mm筛,珍珠岩、蛭石的粒径分别为2.0~5.0、0.1~0.5 mm,高压灭菌锅121 ℃灭菌1 h,灭菌2次,间隔24 h,晾凉后备用。
供试菌株有AM真菌异形根孢囊霉、花椒根腐病病原菌腐皮镰刀菌HO21、拮抗真菌草酸青霉HB21-1、拮抗细菌枯草芽孢杆菌HX11。其中丛枝菌根真菌异形根孢囊霉购于北京市农林科学院植物营养与资源研究所,菌株编号为BGC JX04B,由四川省茂县生态站实验室以三叶草为宿主进行扩繁;花椒根腐病病原菌腐皮镰刀菌HO21由四川省茂县生态站实验室分离于花椒患病根部,鉴定后于4 ℃保存;拮抗真菌草酸青霉HB21-1、拮抗细菌枯草芽孢杆菌HX11分别由四川省茂县生态站实验室前期分离于花椒根系及根际土壤,鉴定后于4 ℃保存。
1.2 供试拮抗菌间相互拮抗性试验
为避免菌株间的拮抗作用,复配后相互干扰防病效果。将供试菌株HB21-1、HX11菌饼分别接种于PDA培养基两侧,两菌饼间相距4 cm,于28 ℃恒温培养5 d,每天记录两菌落的生长情况,观察有无抑菌圈以确定是否可以复配组合。
1.3 盆栽试验
花椒根腐病病原菌腐皮镰刀菌HO21、拮抗真菌草酸青霉HB21-1孢子悬液的制备[23]:将菌株HO21、HB21-1分别接种至PDB培养液中,经28 ℃、120 r/min培养5 d,用无菌水调整浓度为1×106CFU/mL,备用。
拮抗细菌枯草芽孢杆菌HX11菌悬液的制备:将菌株HX11接种于NA培养基中,28 ℃恒温培养2 d,待长出明显的单菌落后,用直径6 mm的打孔器取出菌饼,接种于装有80 mL NB培养液的三角瓶中,120 r/min条件下,28 ℃恒温培养3 d,以无菌水稀释配成含菌量为1×106CFU/mL的菌悬液。
将花椒幼苗栽种至高20 cm,直径17 cm的塑料盆中,每盆填土量为3 kg。每盆浇灌100 mL植物营养液以保证幼苗生长所需营养。温室培养条件为夜间20 ℃、白天30 ℃,湿度60%,光周期为13 h光照和11 h黑暗。
AM真菌异形根孢囊霉接种方法[24]:先在塑料盆中加1500 g灭菌土壤基质,将40 g AM真菌接种剂平铺;不接种AM真菌处理则添加40 g灭活菌剂,并用3层42号滤纸过滤接种物中的AM真菌,将滤液加入土壤,确保土壤中其他微生物一致,最后覆盖1500 g无菌土。
缓苗14 d待幼苗发出绿芽后采用伤根灌注法进行试验处理,盆栽试验处理组合和接种量等信息如表1所示,每个处理10盆,重复3次。盆栽试验进行至60 d时进行病害调查,分级标准[8]如表2所示,统计花椒幼苗的发病率、病情指数和防治效果。
花椒根腐病病害计算公式:
D=d/T×100%
I=[∑(n×L)/(T×V)]×100
C=(K-S)/k×100%
式中:D为发病率;d为发病株数;T为总株数;I为病情指数;n为各级株数;L为级值;V为病害最高级;C为防治效果;K为对照病情指数;S为试验病情指数。
1.4 AM真菌侵染率测定
采用染色镜检法[25]测定花椒根系AM真菌侵染率。将花椒根系冲洗干净,剪成1 cm长的根段,装入20 mL刻度试管,加入10 mL 10% KOH,置于90 ℃水浴锅中20 min,用蒸馏水漂洗3次。然后将根系浸泡在1 mol/L 盐酸40 min,再用蒸馏水漂洗3次,装入试管,加入5 mL 0.05%曲利苯蓝染色剂,置于85 ℃水浴锅中20 min,蒸馏水漂洗3次。将清洗后的根系放置于载玻片,50%甘油封片后镜检。在显微镜下观察丛枝及菌丝的侵染情况,每个处理观察10个根样,每个根样观察5个根段,采用十字交叉法[26]记录其侵染率。

表1 花椒根腐病盆栽防效试验处理组合

表2 花椒根腐病病害分级标准
1.5 植株根部防御酶活性的测定
盆栽试验进行第30、60天时取样测定花椒幼苗根部防御酶活性。采用愈创木酚法[27]测定过氧化物酶(POD)活性,采用氮兰四唑(NBT)测定法[27]超氧化物歧化酶(SOD)活性,用宋金秋等[28]的方法检测苯丙氨酸解氨酶(PAL)活性。
1.6 土壤酶活性的测定
盆栽试验进行第30、60天时按五点法分别采集不同处理的土样,过1 mm筛后测定土壤酶活性。采用磷酸苯二钠比色法[29]测定土壤酸性磷酸酶活性,采用苯酚纳比色法[30]测定土壤脲酶活性,采用3,5-二硝基水杨酸比色法[30]测定土壤蔗糖酶活性。
1.7 数据分析
采用 Excel 2020、Origin 2023对数据进行处理和绘图,采用SPSS 23.0对数据进行单因素方差分析及差异显著性检验(Duncan法,P<0.05)。
2 结果与分析
2.1 生防菌拮抗性测试
如图1所示,将菌株HB21-1和HX11培养5 d后,可观察到草酸青霉HB21-1生长范围扩大,可分布在枯草芽孢杆菌HX11菌落上生长,无抑菌圈出现,表明两菌株间无拮抗作用,可组合作为复合菌处理。

a. 3 d时两菌株的平板对峙形态; b. 5 d时两菌株的平板对峙形态。a. The plate confrontation morphology of the two strains at 3 days; b. Plate confrontation morphology of two strains at 5 days.图1 菌株HB21-1和HX11的拮抗作用Fig.1 Mutual antagonism of strain HB21-1 and HX11
2.2 生防菌对花椒根腐病的盆栽防治效果
由图2、表3可知,与对照组(N)相比,经腐皮镰刀菌HO21(F)处理的花椒幼苗长势瘦小,根系韧皮部脱落腐烂,木质部呈褐色,地上部分枝叶枯萎,甚至枯死,发病率达86.67%(图2-b)。与病原菌(F)处理相比,AM真菌和拮抗菌处理下的花椒幼苗根尖处有轻微变黑现象,木质部生长正常,地上部分无明显根腐病发病症状。其中,AF处理下部分花椒幼苗根尖处腐烂较严重,韧皮部有脱落现象(图2-d),发病率为60.00%,病情指数为50.00。BPF、APF和ABF处理下的花椒幼苗长势与对照相近,部分根部有轻微腐烂变黑的现象(图2-e,f,g),发病率分别为33.33%、40.00%和53.33%。APBF处理下的少数花椒幼苗根部出现腐烂,大部分根部生长健康,枝叶正常,发病率最低,为13.33%(图2-h)。与F组处理相比,AM真菌与拮抗菌单独或2种接种的组合处理,均能降低花椒幼苗根腐病的发病率和病情指数。但不同处理下的防治效果不同,APBF处理对根腐病的防治效果最显著,病情指数相比F组降低57.23%,其次是PBF和APF处理,防治效果分别为62.78%、57.12%。

N: 无菌水; F: 病原菌HO21; BF: 枯草芽孢杆菌HX11+病原菌HO21; AF: AM真菌+病原菌HO21; PBF: 草酸青霉HB21-1+枯草芽孢杆菌HX11+病原菌HO21; APF: AM真菌+草酸青霉HB21-1+病原菌HO21; ABF: AM真菌+枯草芽孢杆菌HX11+病原菌HO21; APBF: AM真菌+草酸青霉HB21-1+枯草芽孢杆菌HX11+病原菌HO21。N: Sterile water; F: F. solani HO21; BF: B. subtilis HX11+F. solani HO21; AF: AM fungi+F. solani HO21; PBF: P. oxalicum HB21-1+B. subtilis HX11+F. solani HO21; APF: AM fungi+P. oxalicum HB21-1+F. solani HO21; ABF: AM fungi+B. subtilis HX11+F. solani HO21; APBF: AM fungi+P. oxalicum HB21-1+B. subtilis HX11+F. solani HO21.图2 AM真菌联合拮抗菌对花椒根腐病的防治效果Fig.2 Morphology of Z.bungeanum seedlings under different treatments

表3 不同处理下花椒根腐病的盆栽防治效果
2.3 AM真菌对花椒幼苗根系的侵染率
在不接种AM真菌的处理未出现根部菌根侵染,即AM真菌侵染率均为0;在接种AM真菌的处理中,有AM真菌与花椒根系的侵染共生现象,形成菌丝、泡囊等菌根结构(图3)。AM真菌菌丝可在根系表皮细胞间形成少量的胞间连丝,丛枝结构较少,集中分布在表皮细胞间,泡囊形态呈圆形、椭圆形等。由图4可知,单独接种AM真菌的侵染率最低,为24.89%,而在AM真菌+病原菌接种处理下的侵染率比AM真菌单独接种高3.55%。APBF组联合接种处理下的侵染率显著高于其他处理,为52.22%。
2.4 不同菌种处理对花椒幼苗根部的防御酶活性的影响
从图5-a可知,不同时期所有处理下的花椒根部POD酶活性均高于对照(N)。30 d时,在单个菌株的处理中,F组POD酶活性最高,较N、B和A组分别高91.15%、33.67%和14.22%,表明病原菌能刺激花椒根部POD酶活性升高;在多菌株的处理中,APF组POD酶活性最高,较F组高175.63%。60 d时,在单个菌株的处理中,对照(N)的POD酶活性最低;在多菌株的处理中,APF组的POD酶活性仍最高,较F组高355.24%,POD酶活性大小依次为APF>APBF>PBF>ABF>BF>AF。

V: 不规则泡囊; H: 菌丝。V:Vesicle;H:Hypha.图3 接种AM真菌的处理下花椒根系菌根形成情况Fig.3 Mycorrhizal formation of Z.bungeanum root under the treatment of AM fungi inoculation

AM真菌; AF: AM真菌+病原菌HO21; APF: AM真菌+草酸青霉HB21-1+病原菌HO21; ABF: AM真菌+枯草芽孢杆菌HX11+病原菌HO21; APBF: AM真菌+草酸青霉HB21-1+枯草芽孢杆菌HX11+病原菌HO21。A: AM fungi; AF: AM fungi+F. solani HO21; APF: AM fungi+P. oxalicum HB21-1+F. solani HO21; ABF: AM fungi+B. subtilis HX11+F. solani HO21; APBF: AM fungi+P. oxalicum HB21-1+B. subtilis HX11+F. solani HO21.图4 接种AM真菌的不同处理下花椒根系菌根侵染率Fig.4 Mycorrhizal infection rate of Z.bungeanum root under different treatments inoculated with AM fungi
由图5-b可知,随处理时间推移,F组的SOD酶活性呈显著下降趋势。30 d时,所有处理的花椒根部SOD酶活性均高于对照(N),在单个菌株的处理中,B组的SOD酶活性最高,较F组高28.24%;在多菌株的处理中,APBF组的SOD酶活性最高,比F、PBF组分别高0.34、0.05倍。60 d时,所有处理的SOD酶活性都显著高于F组,在单个菌株处理中,B、A和N组的SOD酶活性较F组分别高294.23%、273.67%和170.90%;在多菌株处理中,ABF的SOD酶活性最高,较F、BF组分别增加4.95、0.68倍,其次是APF、APBF组处理,分别比F组增加4.06、4.04倍。
从图5-c可知,随时间推移,有拮抗菌和AM真菌处理下的PAL酶活性呈显著升高趋势。30 d时,单个菌株的处理之间无显著差异,其中F组的PAL酶活性最低;在多菌株的处理中,ABF组的PAL酶最高,比F、BF组分别增加1.26、0.76倍,其次为APF、AF组,分别比F组增加0.93、0.71倍。60 d时,在单个菌株的处理中,F组的PAL酶活性最低;在多菌株的处理中,ABF组的PAL酶最高,比F、BF组分别增加2.86、1.43倍,且与其他处理差异显著。
2.5 不同菌种处理对土壤酶活性的影响
从图6-a可知,30 d时,所有处理的土壤酸性磷酸酶活性均高于病原菌(F)处理,在单个菌株的处理中,B组的酸性磷酸酶活性最高,比F组高19.54%;在多菌株处理中,APBF的酸性磷酸酶活性最高,比F组高40.25%。60 d时,在单个菌株处理中,土壤酸性磷酸酶活性大小依次为B组>A组>F组>N组;在多菌株处理中,PBF组的酸性磷酸酶活性最高,比F、PF和BF组分别高102.85%、35.39%和32.25%。

N: 无菌水; F: 病原菌HO21; B: 枯草芽孢杆菌HX11; A: AM真菌; BF: 枯草芽孢杆菌HX11+病原菌HO21; AF: AM真菌+病原菌HO21; PBF: 草酸青霉HB21-1+枯草芽孢杆菌HX11+病原菌HO21; APF: AM真菌+草酸青霉HB21-1+病原菌HO21; ABF: AM真菌+枯草芽孢杆菌HX11+病原菌HO21; APBF: AM真菌+草酸青霉HB21-1+枯草芽孢杆菌HX11+病原菌HO21.不同小写字母表示同一时间不同处理间的差异显著(P<0.05);*表示同一处理不同时间间的差异显著(P<0.05),下同。N: Sterile water; F: F. solani HO21; B: B. subtilis HX11; A: AM fungi; BF: B. subtilis HX11+F. solani HO21; AF: AM fungi+F. solani HO21; PBF: P. oxalicum HB21-1+B. subtilis HX11+F. solani HO21; APF: AM fungi+P. oxalicum HB21-1+F. solani HO21; ABF: AM fungi+B. subtilis HX11+F. solani HO21; APBF: AM fungi+P. oxalicum HB21-1+B. subtilis HX11+F. solani HO21.Different lowercase letters indicate significant differences among different treatments at the same time (P<0.05); *means significant differences between different times of the same treatment (P<0.05). The same as below.图5 不同处理下的花椒根部防御酶活性变化Fig.5 Changes of defense enzyme activity in Z.bungeanum root treated with different treatments
从图6-b可知,30 d时,所有处理的土壤蔗糖酶活性均高于对照(N),在单个菌株处理中,F组的蔗糖酶活性最高,较N、P、B和A组分别高229.65%、53.83%、50.97%和66.45%,表明病原菌能提升土壤蔗糖酶活性;在多菌株处理中,土壤蔗糖酶活性大小依次为ABPF组>APF组>ABF组>BF组>AF组>PBF组,其中APBF组的蔗糖酶活性较F组高67.33%。60 d时,单个菌株处理中,N组的蔗糖酶活性最低;在多菌株处理中,ABPF处理的蔗糖酶仍最高,其次为APF、ABF组,分别较F组高90.39%、85.69%和83.15%。
由图6-c可知,随处理时间推移,AM真菌处理中土壤脲酶活性均呈显著上升趋势。30 d时,单个菌株处理间无显著差异;多菌株处理中,APBF组的脲酶活性最高,较F、PBF组分别高65.17%、71.47%。60 d时,单个菌株处理中,A组的脲酶活性与其他处理差异显著,较N和F组高873.96%、766.60%;多菌株处理中,APF组的土壤脲酶活性与APBF组间无显著差异,且较F组高902.03%、826.11%。ABF组的土壤脲酶活性比BF组高550.66%,APBF组的土壤脲酶活性比PBF组高552.76%。
3 讨 论
植物共生微生物在促进作物生长、增强抗逆性等方面发挥着越来越重要的作用,以多种有益菌、生防菌等微生物组合来控制植物病害已成为当前研究热点之一。单一的植物共生真菌、细菌难以达到理想的生物防治效果,而将一些有益菌、拮抗菌联合接种可协同发挥更大的生理生态效应[31]。在本研究中,AM真菌+草酸青霉HB21-1+枯草芽孢杆菌HX11对花椒根腐病的防治效果最佳,其次是HB21-1+HX11的联合处理。与草酸青霉对花椒根腐病的防治效果[23]对比发现,AM真菌+HB21-1、AM真菌+HX11联合处理下的防治效果均高于AM真菌、拮抗菌的单独处理,表明AM真菌联合拮抗菌可发挥协同作用,有效降低花椒根腐病的发病率,提高生物防治效果,这与Eman等[32]的研究结果一致。
AM真菌与宿主间的亲和力决定了其菌根效应是否能较好发挥,侵染率能够表明AM真菌对植株根皮层的定殖情况[33]。刘芳洁[34]研究表明,AM真菌摩西球囊霉对紫苏的侵染率达82.36%,接种AM真菌可显著提升对紫苏根腐病的预防效果。本研究表明,接种AM真菌处理下,花椒根系均能形成菌根结构。AM真菌+HB21-1+HX11联合处理下的菌根侵染率最高,其次是AM真菌+HB21-1处理。AM真菌单独处理下的侵染率最低,一定程度上表明病原菌或拮抗菌等外界条件的刺激下,能够提高AM真菌对花椒根系的侵染能力。本研究表明,AM真菌对花椒根系的侵染率越高,其根腐病发病率越低,表明丛植菌根真菌能提高花椒对根腐病的抗病性,这与唐燕等[35]的研究结果一致。但在娄璇[36]的研究中,侵染率高并不能代表防治效果好,不同种类的AM真菌对植物病害的防治效果还受环境、寄主等其他因素的影响。
经AM真菌侵染后,形成菌根的植株可以更迅速对病原菌的入侵产生防御,通过提高植物的防御酶活性,清除因病原菌入侵而形成的氧化逆境,提升植物抗病性[37-39]。Cai等[40]将AM真菌、木霉、枯草芽孢杆菌与荧光假单胞菌复配探究对番茄根腐病的防治效果,发现4种生防菌联合处理下番茄的POD、PAL等酶活性大幅提高。本研究表明,60 d时AM真菌+枯草芽孢杆菌HX11处理的SOD、PAL酶活性最高,AM真菌+草酸青霉HB21-1处理的POD酶活性最高,且随时间推移植株防御酶活性均呈上升趋势,表明AM真菌和拮抗菌的单独、联合接种均能诱导植株防御酶活性的升高。本研究还发现,病原菌也能刺激植株SOD、POD酶活性增加,推测可能在病害作用下激发了花椒免疫防御反应,致使防御酶活性升高,这与张涛等[41]测定的黄萎病病原菌能激发棉花POD、SOD酶活性的升高,但拮抗菌的添加能诱导植株产生更高的防御酶活的研究结果一致。
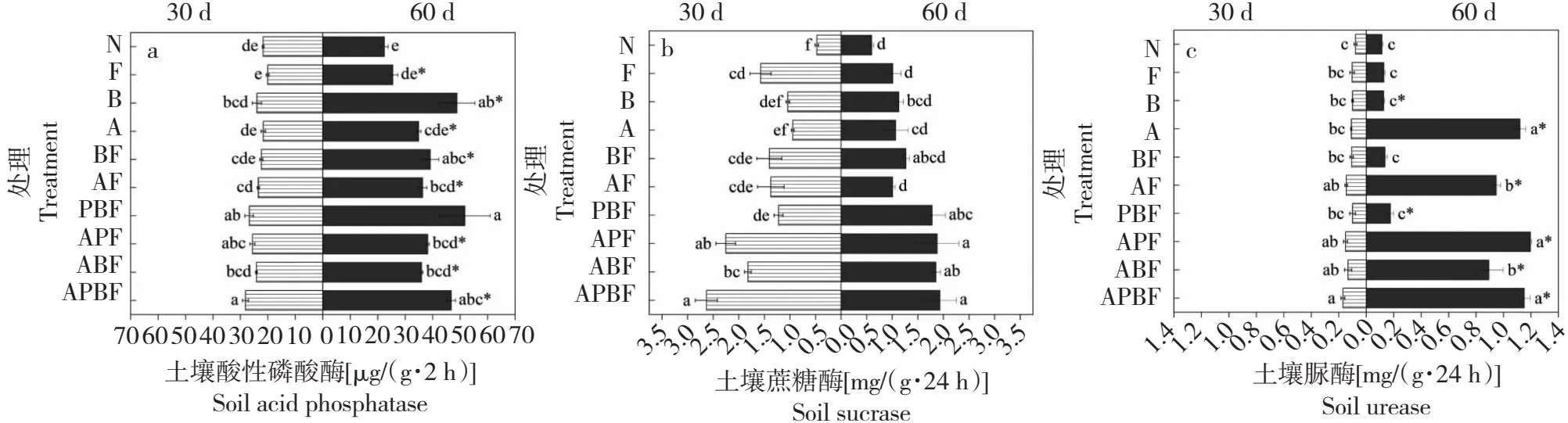
图6 不同处理花椒土壤酶活性变化Fig.6 Changes of soil enzyme activity of Z.bungeanum under different treatments
土壤酶活性反映土壤肥力的高低,对保持土壤肥力具有重要意义,能反映土壤有机养分转化情况[42]。贾红梅等[43]研究表明,荫性球囊霉及一些复合菌种能显著提高丹参根际土蔗糖酶活性,改善土壤营养条件,促进植株生长。本研究发现,60 d时草酸青霉HB21-1+枯草芽孢杆菌HX11处理的土壤酸性磷酸酶活性最高,AM真菌+草酸青霉HB21-1处理的土壤脲酶活性最高,且随时间呈显著上升趋势;AM真菌+HB21-1+HX11处理下的土壤蔗糖酶最高,但随时间呈下降趋势。综合来看,AM真菌、枯草芽孢杆菌HX11能促进土壤酸性磷酸酶、脲酶活性随时间显著升高,草酸青霉HB21-1能促进土壤蔗糖酶活性显著升高。添加不同拮抗菌均能不同程度提高土壤酶活性,表明AM真菌联合拮抗菌可在一定程度上提高花椒根际土肥力。本研究中,土壤蔗糖酶活性随时间呈下降趋势,土壤酶活性变化随时间推移会出现峰值,但还需进一步监测探究,这与姜莉莉等[44]发现的草酸青霉作用下土壤酶活性变化结果一致。虽然本研究通过盆栽试验探究AM真菌联合拮抗菌对花椒根腐病的防治效果,并初步分析了防病机理,但所选菌种资源有限,不同组合间菌株的相互作用特点还需进一步深入研究,同时对花椒根腐病的防效还需进行大田试验进一步探究。
4 结 论
在生防菌单个或联合处理中,AM真菌+HB21-1+HX11 3种菌株的联合处理对根腐病的防治效果最好,可达78.89%,其次为HB21-1+HX11 2种拮抗菌联合的防效。AM真菌单独接种处理下的花椒根部侵染率最低,为24.89%;AM真菌+HB21-1+HX11 3种菌株联合接种处理下的侵染率最高,为52.22%。与对照(N)相比,添加菌株处理的防御酶和土壤酶活性均有不同程度升高。与病原菌处理(F)相比,随时间推移,拮抗菌、AM真菌处理的花椒根部POD、SOD和PAL酶活性均呈上升趋势,且土壤酸性磷酸酶、脲酶活性也呈上升趋势,土壤蔗糖酶活性稍有下降,但均高于F组,表明AM真菌、HB21-1和HX11能不同程度诱导植株防御酶活性、土壤酶活性的升高。综上,AM真菌+草酸青霉HB21-1+枯草芽孢杆菌HX11这3种菌株联合处理对花椒根腐病有较好的防治效果,该微生物组合具有开发为有效生防剂的潜力。

