急性ST段抬高型心肌梗死患者PCI后左心室壁瘤形成的影响因素分析及预测模型的初步构建*
李楠, 郭永梅, 蔡雄, 张上仕, 邹金荣
(1.上饶市人民医院 心内三科, 江西 上饶 334000; 2.江西医学高等专科学校,江西 上饶 334000)
急性心肌梗死(acute myocardial infarction, AMI)是急性冠状动脉综合征的一种类型,包括ST 段抬高型心肌梗死(ST segment elevation myocardial infarction, STEMI)和非ST 段抬高型心肌梗死(non-ST-segment elevation myocardial infarction,NSTEMI)[1-2]。AMI 常见的临床并发症有心力衰竭、心源性梗死、心律失常、心脏骤停和机械性并发症等,发病率低但病死率高[3]。室壁瘤是一种机械性并发症,是AMI 患者的重要并发症,主要发生在左心室和心尖壁[4]。 左心室壁瘤(Left ventricular aneurysm, LVA)是病理因素诱发的部分心肌变性坏死,导致心肌变薄,应变能力下降,活动范围缩小或丧失,逐渐形成向外膨出的瘢痕组织,导致左心室射血分数(left ventricular ejection fraction, LVEF)降低和心源性死亡[5]。LVA 的发生会对心脏功能产生长期影响,需要实时监测或手术治疗[6]。因此,找出LVA 形成的危险因素尤为重要。既往研究表明,LVA 的危险因素包括年龄、性别、吸烟、血管闭塞和血管通过时间等[7]。然而,这些证据不足以解释接受经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)STEMI 患者发生LVA 的危险因素。近年来,随着心肌梗死血运重建技术的不断发展,LVA 的发病率逐渐下降[8]。但临床上没有模型能够准确预测LVA 的形成。本研究探讨急性STEMI 患者PCI 后LVA 形成的影响因素,并初步构建LVA 形成的预测模型,为降低LVA 形成风险提供临床依据,现报道如下。
1 资料与方法
1.1 病例资料
回顾性分析2020 年1 月—2023 年1 月上饶市人民医院收治的110 例STEMI 患者的临床资料,按照PCI 后是否发生LVA 分为无LVA 组(76 例)和LVA 组(34例)。其中,男性87例,女性23例;年龄50~80岁,平均(62.83±8.19)岁。LVA 诊断标准[9]:①室壁变薄,局部向外膨隆,运动消失或呈矛盾运动;②瘤颈较宽,长径大于瘤腔的最大径;③在矛盾运动和正常收缩的室壁间可见转折点。本研究经医院医学伦理委员会批准。
1.2 纳入与排除标准
1.2.1 纳入标准 ①符合急性STEMI 诊断标准[10];②LVA 组患者符合上述LVA 诊断标准;③行PCI 治疗;④临床资料完整。
1.2.2 排除标准 ①既往心肌梗死病史;②伴有非缺血性心肌病;③伴有严重心脏瓣膜病;④冠状动脉痉挛、心肌桥、冠状动脉畸形等导致的STEMI;⑤既往有溶栓或冠状动脉旁路移植治疗史;⑥先天性心脏病。
1.3 研究方法
收集两组患者一般资料,包括性别、年龄、吸烟、饮酒、高血压、糖尿病病史。
患者心梗入院即刻至7 d 内采用彩色多普勒超声诊断仪(荷兰飞利浦公司,型号:CX50)测定左室舒张末期(left ventricular end diastole, LVED)、LVEF;冠状动脉造影(荷兰飞利浦公司,规格:Allura CV20)测定左前降支(left anterior descending branch, LAD)、左回旋支(left circumflex branch, LCX)和右冠状动脉(right coronary artery, RCA)狭窄程度。
临床生化指标取PCI 治疗后第一次检测结果。采用全自动生化分析仪(日本OLYMPUS 公司,型号:AU5400)测定糖化血红蛋白(glycosylated hemoglobin, HbA1c)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)水平;应用全自动特种蛋白分析仪(德国德灵有限公司,型号:BNⅡ)及配套试剂盒,采用乳胶免疫扩散法检测C反应蛋白(C-reactive protein, CRP)水平;应用全自动电化学发光仪(瑞士罗氏公司,型号:Cobas E411),采用酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)测 定 脑 钠 肽(brain natriuretic peptide, BNP)、基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)水平,试剂盒购自上海通蔚生物科技有限公司。
应用全自动生化分析仪(德国西门子公司,型号:ADVIA 2400),采用酶动力学法测定心肌型肌酸激酶同工酶(myocardial creatine kinase isoenzyme,CK-MB)水平。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验。多因素分析用逐步Logistic 回归分析,绘制受试者工作特征(receiver operating characteristic, ROC)曲线。P<0.05为差异有统计学意义。
2 结果
2.1 STEMI患者PCI后LVA形成的单因素分析
LVA 组与无LVA 组患者年龄、发病12 h 内就诊、吸烟、高血压、糖尿病、发病至血运重建时间、LVED、LAD 狭窄、LCX 狭窄、RCA 狭窄、HbA1c、CKMB、LDL-C 比较,经χ2或t检验,差异均无统计学意义(P>0.05)。两组患者性别、饮酒、LVEF、CRP、BNP、MMP-9 水平比较,经χ2或t检验,差异均有统计学意义(P<0.05);LVA 组女性占比、饮酒率、CRP、BNP、MMP-9 水平均高于无LVA 组,LVEF 水平低于无LVA 组。见表1。

表1 STEMI患者PCI后LVA形成的单因素分析
2.2 LVEF、CRP、BNP、MMP-9 预测LVA 形成的临界值
ROC 曲线分析结果表明,LVEF、CRP、BNP、MMP-9 预测STEMI 患者PCI 后LVA 形成的曲线下面积(area under curve, AUC)分别为0.836、0.860、0.868和0.803,预测LVA 形成的临界值分别为49.478%、27.905 mg/L、389.798 pg/mL 和 279.807 pg/mL。见表2。
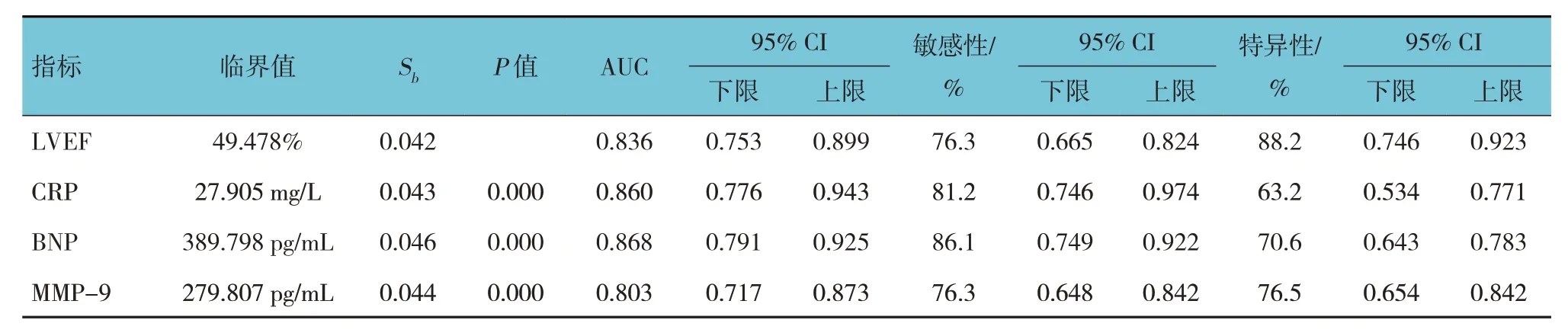
表2 LVEF、CRP、BNP、MMP-9预测LVA形成的效能分析
2.3 STEMI 患者PCI后LVA 形成的多因素逐步Logistic回归分析
以是否形成LVA(否= 0,是= 1)为因变量,以单因素分析中差异有统计意义的指标(性别、饮酒、LVEF、CRP、BNP、MMP-9 为自变量(赋值见表3),进行多因素逐步Logistic 回归分析(α入=0.05,α出=0.10),结果显示:女性[=3.589(95% CI:1.428,7.215)]、饮 酒[=2.694(95% CI:1.437,5.482)]、LVEF ≤ 49.478% [=3.978(95% CI:0.537,1.176)]、CRP ≥ 27.905 mg/L [=4.959(95% CI:2.003,19.350)]、BNP ≥ 389.798 pg/mL [=2.739(95% CI:1.455,5.712)]、MMP-9 ≥ 279.807 pg/mL [=5.105(95% CI:1.684,14.178)]是STEMI 患者PCI 后LVA 形成的危险因素(P<0.05)。见表4。

表3 赋值表
2.4 LVA 形成预测模型预测STEMI 患者PCI 后LVA形成的ROC曲线
根据多因素逐步Logistic 回归分析结果,将临床相关指标LVEF、CRP、BNP、MMP-9 纳入LVA 形成预测模型,Logit(P) = -31.584 + 1.381XLVEF+ 1.601XCRP+1.007XBNP+ 1.630XMMP-9。经ROC 曲线分析结果表明,该模型预测STEMI 患者PCI 后LVA 形成的临界值为31.580,AUC 为0.941,敏感性为92.1%(95% CI:0.846,0.988),特异性为88.2%(95% CI:0.754,0.934)。LVA 形成预测模型的敏感性优于各项指标单独预测。见图1。
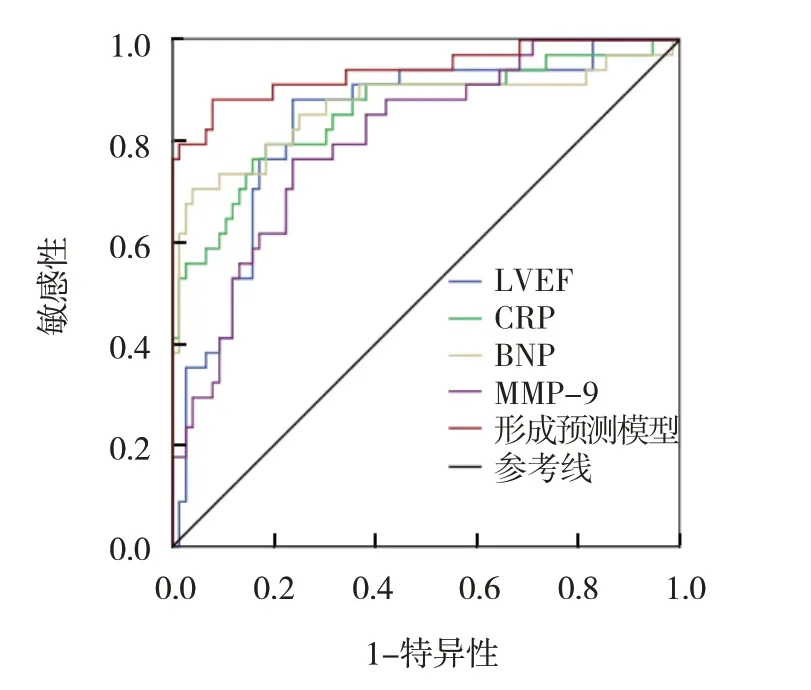
图1 LVA形成预测模型预测STEMI患者PCI后LVA形成的ROC曲线
3 讨论
AMI 的临床病死率仍然较高,尤其是对合并心血管疾病的患者[11]。虽然LVA 作为AMI 的机械并发症发生率相对较低,但LVA 对AMI 患者的预后影响较大,甚至危及生命[12]。LVA 是由成熟的瘢痕组织形成的左心室膨出,在急性STEMI 患者中,LVA 的形成与病理生理机制有关[13]。目前,已有较多研究探索了STEMI 患者PCI 后LVA 形成的风险因素[7,14-16],但关于STEMI 患者PCI 后LVA 形成预测模型的报道仍较少见。因此,有必要进一步探索STEMI 患者PCI 后LVA 形成的影响因素,并在此基础上构建LVA 形成的预测模型,为降低LVA 风险提供帮助。
本研究中,LVA 组女性占比明显高于非LVA组,这可能是由于女性LVA 患者非梗死区的收缩功能优于男性患者,由于性别差异,导致肾上腺素能神经元对梗死区的反应不同,当女性患者出现心室收缩障碍时,心肌梗死区心室腔内压力升高,从而导致LVA 形成风险增加。相关研究显示,性别不是AMI 患者心血管疾病形成的独立危险因素[17],与本研究结果不同,可能是由于本研究病例样本量较少所致。本研究结果还表明,饮酒是STEMI 患者PCI后LVA 形成的影响因素,可能是由于酒精摄入易引起心、肝、胰腺等多器官并发症,从而使血液流动性降低,出现高凝状态,且酒精摄入过多也可增加血小板聚集,诱导应激反应,激活炎症因子,导致左心室扩张,从而形成LVA。郭影影等[18]研究指出,饮酒是STEMI 患者LVA 形成的独立危险因素,与本研究结果相佐证。
LVEF 是急性心肌梗死患者的一个关键指标,其揭示了心肌收缩性,也被用作心肌梗死后心力衰竭分类的参考指标[19]。相关研究显示,射血分数对STEMI 相关心源性休克患者的住院病死率有预测价值[20]。本研究中,LVA 组患者LVEF 水平低于无LVA组患者,经多因素逐步Logistic 回归分析证实LVEF是STEMI 患者PCI 后LVA 形成的影响因素。相关研究结果表明,LVEF 水平下降的患者更易导致LVA形成,且较LVEF 正常的患者更易发生体循环栓塞[21]。这可能与LVA 患者心肌收缩能力下降、心室腔扩大,导致左心室内血流减慢有关。
本研究对临床常用的相关生化指标CRP、BNP、MMP-9 进行比较,发现LVA 组CRP、BNP、MMP-9 水平显著高于无LVA 组,可见LVA 形成后上述指标也呈现明显的异常表达。心脏功能的生物标志物可为STEMI 后的心脏预后提供有用的评估信息,CRP、BNP 是心肌坏死炎症性标志物,其水平可反应AMI治疗后心肌和血管免疫炎症状态[22-23]。有研究结果表明,CRP 是STEMI 后LVA 形成的影响因素[24]。另一项研究结果表明,BNP 水平是AMI 并发症,如左心室假性动脉瘤的预测因子[25]。本研究结果表明,CRP、BNP 是STEMI 患 者PCI 后LVA 形成的 影 响 因素。可能是由于炎症因子参与STEMI 患者PCI 后心室重构过程,CRP 作为炎症因子,参与心血管疾病发生、发展,且CRP 水平升高,表示心血管出现损伤[26]。另外心肌缺血增加室壁应力,从而诱导BNP的合成和释放,并与缺血损伤的程度呈正比,因此LVA 形成前BNP 呈高水平状态[27]。MMP 作为生物力学应变和压力相关的心血管损伤的潜在生物标志物,在结缔组织稳态中发挥重要作用,与心血管瘤的发病机制有关[28]。本研究结果表明,MMP-9 是STEMI 患者PCI 后LVA 形成的危险因素,与SEZER等[29]研究相似,可能是由于动脉压力上升速率降低,而MMP-9 参与主动脉瘤的细胞外基质降解,当MMP-9 水平上升,可引起动脉重塑和扩张,从而导致LVA 形成。另外蒋光传等[30]研究结果表明,AMI患者较早接受PCI 干预,开通梗死动脉,能够有效逆转室壁瘤形成,同时降低机体MMP-9 水平。本研究结果表明,CRP、BNP、MMP-9 水平在一定程度上能预测LVA,但其特异性相对较低,因此还需要结合其他临床指标进行综合预测。
本研究选择LVEF、CRP、BNP 和MMP-9 构 建STEMI 患者PCI 术后LVA 形成的预测模型,主要是因为这些是临床常见的炎症因子和心肌坏死的炎症标志物,具有较好的客观性和敏感性。经ROC 曲线分析证实,LVA 形成预测模型预测STEMI 患者PCI后LVA 形成方面可以获得较好的敏感性,提示本研究构建的模型具有较高的预测准确性。因此,后续在STEMI 患者PCI 后的诊疗过程中可对LVEF、CRP、BNP、MMP-9 进行检测,并代入Logit(P) = -31.584 +1.381XLVEF+ 1.601XCRP+ 1.007XBNP+ 1.630XMMP-9中,从而筛查LVA 形成的高危人群,提高医务人员的关注度。然而,本研究构建的模型是通过回顾性分析获得的,未能验证其预测效果。需要进一步研究完善LVA 形成预测模型,验证其预测价值。
综上所述,女性、饮酒及LVEF≤ 49.478%、CRP ≥27.905 mg/L、BNP ≥ 389.798 pg/mL、MMP-9 ≥ 279.807 pg/mL 与STEMI 患者PCI 后LVA 形成有关,临床应该对存在危险因素的患者进行长期跟踪随访,尽早发现LVA 的发生,以便早期治疗,以降低STEMI 患者PCI 后LVA 发生率。本研究存在的不足:本研究为单中心病例对照性研究,在研究对象选择上可能存在偏移;另外本研究为回顾性分析,未选用更加准确的影像学对患者心脏进行检查;最后,本研究样本量较少,无法分析更多的危险因素并进行预测模型构建。因此后续应扩大研究样本,增加更准确的心脏影像学检查,进一步分析STEMI 患者PCI 后LVA 形成的危险因素并进行预测模型构建。

