腺苷A3受体对浅筋膜成纤维细胞cAMP/Epac信号通路及炎症因子表达的影响*
崔艳茹, 许经萍, 可红, 席超, 徐尚呈, 杜红, 屈飞
(江西中医药大学, 江西 南昌 330004)
中医经络系统作为针灸治疗的理论基础,具有运行气血、连接全身脏腑表里的功能,现有医学技术和解剖学研究并不能完全阐述经络的实质。筋膜从表到里依次为真皮层、浅筋膜、深筋膜、内脏筋膜[1],是一个全身连续的网络,贯穿并包围所有器官、肌肉、骨骼和神经纤维,被认为是单一的器官,统一的整体,与人类生理学的各个方面都有联系[2]。白宇等[3]通过发现,经络的实质是全身非特异性结缔组织所构成的筋膜支架,筋膜作为支撑、营养和储备系统遍布全身,其位置和走形与经络相似,穴位则为筋膜上能够被刺激产生生物信息的位置。
浅筋膜分布着大量的穴位,成纤维细胞作为浅筋膜中最主要的细胞,具有较强的增殖能力,参与组织修复的过程,是经络腧穴主要的感受性细胞和效应性细胞,在针刺力的信号传导中具有重要意义[4]。
针刺镇痛主要和调控炎症有关,cAMP、Epac在炎症反应中扮演了重要角色[5]。研究发现,针刺可通过降低ERK1/ERK2 下游转录因子cAMP 反应元件结合蛋白的DNA 结合活性,减轻炎症反应和缓解疼痛,治疗炎症性疼痛大鼠[6]。针刺可通过降低cAMP 激活的交换蛋白Epac1 和Piezo2 的表达减轻炎症后肠易激综合征的机体的超敏反应[7]。针刺可通过抑制白细胞介素-6(Interleukin-6, IL-6)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和单核细胞趋化蛋白-1 的表达,治疗胶原诱导的关节炎大鼠模型[8]。
文献报道,针刺可引起穴位区腺苷释放[9],腺苷可作为一种工具药,作用于穴位区,起到类似针刺的作用[10],其作用机制尚不明确。本课题组致力于研究浅筋膜中腺苷A3 受体(adenosine A3 receptor,A3R)途径在针刺镇痛中作用机制,前期研究发现A3R 在痛觉传导通路中的脊髓、脑干、丘脑、大脑皮层均有广泛表达,在足三里浅筋膜、腹股沟中点处、腹膜浅筋膜亦有分布;针刺足三里浅筋膜可以激活A3R 参与针刺镇痛,其针刺镇痛效应可能与上调Ras/MAPK 途径、下调cAMP/Epac 途径有关[11-12]。成纤维细胞是浅筋膜中最主要的细胞,本文设计腺苷干预成纤维细胞,观察成纤维细胞中A3R 表达,以期明确腺苷镇痛是否与成纤维细胞中A3R 表达有关。前期主要从体内实验说明A3R 与针刺镇痛的关系,笔者发现腺苷A3 受体可介导针刺镇痛,影响cAMP/Epac 信号通路。本研究从体外实验出发,探讨siRNA 转染浅筋膜中的成纤维细胞通过沉默A3R对cAMP/Epac 信号通路和炎症因子的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级健康雄性SD 大鼠10 只,体重(200±20)g,购自湖南斯莱克景达实验动物有限公司[实验动物生产许可证号:SCXK(湘)2019-0004,实验动物使用许可证号:SYXK(赣)2017-0004]。
1.1.2 主要试剂 Lipofectamine 2000(型号:11668-027)购自美国Invitrogen 公司,Vimentin(货号:ab92547)、AKA(货号:ab134923)、CD45(货 号:ab10558)、cAMP(货号:ab76238)、Epac(货号:ab109415)均购自美国Abcam 公司,F Ⅷ(货号:NB100-91761)购自美国Novusbio 公司,YBR Green PCR 试剂盒(货号:KM4101)购自美国Novusbio 公司,逆转录试剂盒(货号:639505)购自日本TaKaRa 株式会社,引物由南京金斯瑞生物科技有限公司合成。IL-6(货号:AD3249Ra)和TNF-α(货号:AD3238Ra)购自美国Andygene 公司。
1.1.3 主要仪器 二氧化碳恒温培养箱(型号311)购自美国Thermo 公司,荧光倒置显微镜(型号IX53)购自日本Olympus 株式会社,离心机(Centrifuge 5424R 型)购自德国Eppend 公司,荧光定量PCR 仪、水平电泳设备(型号DYC-31D)、凝胶成像系统(型号Universal Hood Ⅱ型)和电泳仪(型号mini protean 3 cell)购自美国BIO-RAD 公司,酶标仪(型号MK3)购自芬兰雷勃公司,全自动化学发光分析仪(型号Tanon-5200)购自上海天能科技有限公司。
1.2 方法
1.2.1 大鼠浅筋膜成纤维细胞的原代分离 在无菌的条件下获取大鼠浅筋膜组织,并去除腹膜上的脂肪组织和血管,将组织切为1 mm×1 mm×1 mm 的小方块置于DMEM 培养液中,置于37 ℃水浴摇床消化,将收集的细胞以1 500 r/min 离心5 min,弃上清液,用完全培养基(1%三抗+ 10%胎牛血清+ 89%DMEM)重悬细胞,置于37 ℃、5% 二氧化碳细胞培养箱内静置培养,48 h 换液,每隔2~3 d 换1 次液。待细胞长至85%左右时,开始进行传代(1∶3 传代),显微镜下观察细胞状态。
1.2.2 实验分组 腺苷预处理细胞并分为Control组、10 nmol/L组、100 nmol/L组、10 μmol/L组和100 μmol/L组,均培养48 h。腺苷siRNA 干扰实验将细胞分为对照组、腺苷组、A3R 干扰组、空载组。转染前1 d 将0.5×105~2.0×105个/孔细胞接种于24 孔板,A3R 干扰组添加2 μL siRNA-A3R(20 μmol/L)、空载组添加2 μL siRNA-NC(20 μmol/L)用来转染,细胞在培养箱孵育6 h 后换上维持液,培养48 h。对照组不予任何处理,腺苷组用10 μmol/L 腺苷浓度,培养48 h。
1.2.3 免疫荧光检测浅筋膜成纤维细胞Vimentin、CD45、FⅧ、AKA、ICAM-1表达 将细胞用磷酸盐缓冲液(phosphate buffered saline, PBS)洗2 次,加入4%多聚甲醛室温固定30 min,再将细胞置于0.5% Triton X-100 室温通透20 min,用5%胎牛血清蛋白37℃封闭1 h,封闭完成后,加入一抗,4 ℃孵育过夜。用PBS洗涤一抗3次,再加入二抗,37 ℃孵育1 h,用PBS 洗涤3 次,洗去多余的二抗。再加少量抗荧光淬灭封片液[含4′, 6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)],覆盖住样品,置于荧光显微镜下观察,将同一位置的2张荧光图片重叠为Merge图。
1.2.4 siRNA转染 转染前1天将细胞以0.5×105~2.0×105个/孔密度接种于24孔中,保证转染时细胞汇合达90%~95%。准备2种复合物,第1种是将0.8 μg DNA稀释于50 μL Opti-MEM中形成的复合物;第1种将2 μL Lipofectamine 2000 稀释于50 μL Opti-MEM 形成的复合物,室温孵育5 min,再将第2种复合物缓慢加入第1种中,继续室温孵育20 min,加入培养孔中,置于二氧化碳培养箱中孵育6 h,48 h后检测细胞转入基因表达。
1.2.5 实时荧光定量聚合酶链反应检测cAMP、Epac mRNA表达 用TRIzol 提取总RNA,再将RNA 逆转录为cDNA,逆转录样本置于-20 ℃冰箱冷冻保存,将制备好的cDNA 进行PCR 扩增,反应条件:95 ℃预变性3 min,95 ℃变性5 s,56℃退火10 s,72 ℃拉伸25 s,39个循环后65 ℃拉伸5 s,95 ℃再变性50 s。采用2-ΔΔCt法计算cAMP、Epac mRNA相对表达量。见表1。

表1 PCR引物序列
1.2.6 Western blotting 检测A3R、cAMP、Epac 蛋白表达 将细胞从培养箱中取出,吸出培养液,用预冷的PBS 洗3 次,加入裂解液,4 ℃充分裂解细胞,将细胞刮入1.5 mL EP 管中,95 ℃以上加热10 min,以12 000 r/min 离心10 min,取上清液,BCA 法测定蛋白浓度,制备8%、12%的分离胶,每孔上样量为10 μg,电泳1.5 h、转膜50 min、将膜置于5%脱脂奶粉室温封闭2 h,分别加入A3R、cAMP、Epac 抗体,一抗4 ℃孵育过夜,再用TBST 洗涤3 次,再将膜置于1∶10 000 稀释HRP 标记的二抗中,室温孵育1 h,再用TBST 洗涤3 次,电化学发光法化学显色,用TANON GIS 软件分析条带的灰度值。
1.2.7 酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测上清液IL-6、TNF-α水平 将细胞以0.5×105~2.0×105个/孔接种于24孔板,进行siRNA 转染。在37 ℃、5%二氧化碳培养箱中培养48 h 后,收集上述各孔培养上清液,采用ELISA 检测上清液IL-6、TNF-α 水平,按照试剂盒说明书进行操作,用酶标仪测定570 nm 波长处吸光度值,计算IL-6、TNF-α 相对表达量。
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 浅筋膜成纤维细胞的分离鉴定
镜下成纤维细胞呈梭形(见图1)。Vimentin 为Ⅲ型中间丝蛋白,主要表达于中胚层起源的间充质细胞中,在成纤维细胞中大量分布,可作为成纤维细胞的标志。免疫荧光结果显示,Vimentin 阳性,FⅧ,CD45、AKA 阴性(见图2)。

图1 浅筋膜成纤维细胞
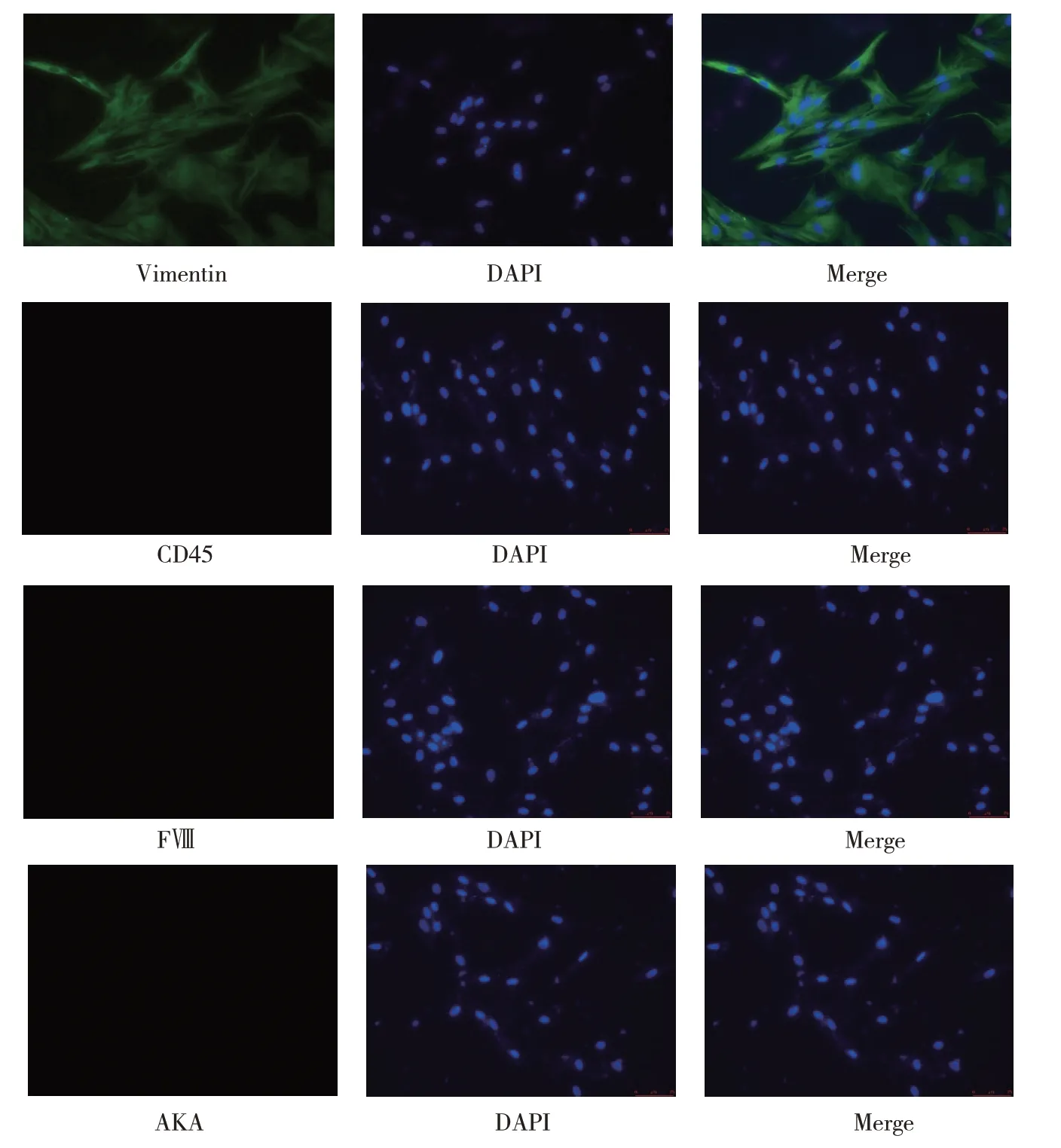
图2 浅筋膜成纤维细胞Vimentin、CD45、FⅧ、AKA表达 (免疫荧光染色)
2.2 各组A3R蛋白相对表达量比较
Control 组、10 nmol/L 组、100 nmol/L 组、10 μmol/L组和100 μmol/L 组A3R 蛋白相对表达量分别为(0.24±0.01)、(0.29±0.02)、(0.36±0.02)、(0.41±0.02)和(0.45±0.02),经单因素方差分析,差异有统计学意义(F=166.700,P=0.000);进一步组间两两比较,100 μmol/L 组高于其他4 组(P<0.05),10 μmol/L组高 于Control 组、10 nmol/L 组、100 nmol/L 组(P<0.05),100 nmol/L 组高于Control 组、10 nmol/L 组(P<0.05),10 nmol/L 组高于Control 组(P<0.05),表明腺苷预处理可剂量依赖性地上调A3R 蛋白表达。见图3。

图3 各组A3R蛋白条带图
对照组、腺苷组、A3R 干扰组、空载组A3R 蛋白相对表达量分别为(0.37±0.05)、(0.65±0.07)、(0.15±0.03)和(0.64±0.05),经单因素方差分析,差异有统计学意义(F=64.270,P=0.000);进一步组间两两比较,腺苷组高于对照组(P<0.05),A3R 干扰组低于腺苷组(P<0.05),但空载组与腺苷组比较,差异无统计学意义(P>0.05),表明腺苷siRNA干扰可下调A3R蛋白表达,而空载组并无明显影响。见图4。
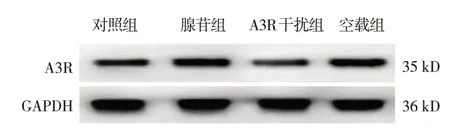
图4 各组A3R蛋白条带图
2.3 各组cAMP、Epac mRNA相对表达量比较
对照组、A3R 干扰组、空载组cAMP、Epac mRNA相对表达量比较,经方差分析,差异均有统计学意义(P<0.05);进一步组间两两比较,A3R 干扰组均高于对照组(P<0.05)。见表3。
表3 各组cAMP、Epac mRNA相对表达量比较 (±s)
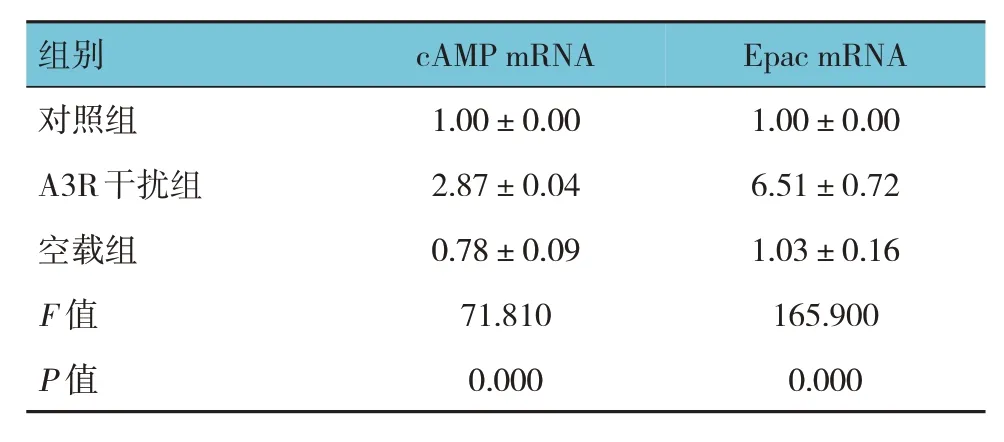
表3 各组cAMP、Epac mRNA相对表达量比较 (±s)
组别cAMP mRNA Epac mRNA对照组A3R干扰组空载组F 值P 值1.00±0.00 2.87±0.04 0.78±0.09 71.810 0.000 1.00±0.00 6.51±0.72 1.03±0.16 165.900 0.000
2.4 各组cAMP、Epac蛋白相对表达量比较
对照组、A3R 干扰组、空载组cAMP、Epac 蛋白相对表达量比较,差异均有统计学意义(P<0.05);进一步组间两两比较经LSD-t检验,A3R 干扰组高于对照组(P<0.05)。见表4 和图5。
表4 各组cAMP、Epac蛋白相对表达量比较 (±s)

表4 各组cAMP、Epac蛋白相对表达量比较 (±s)
组别cAMP蛋白Epac蛋白对照组A3R干扰组空载组F 值P 值0.35±0.04 0.52±0.04 0.32±0.04 24.930 0.001 0.41±0.04 0.57±0.04 0.41±0.03 18.820 0.003
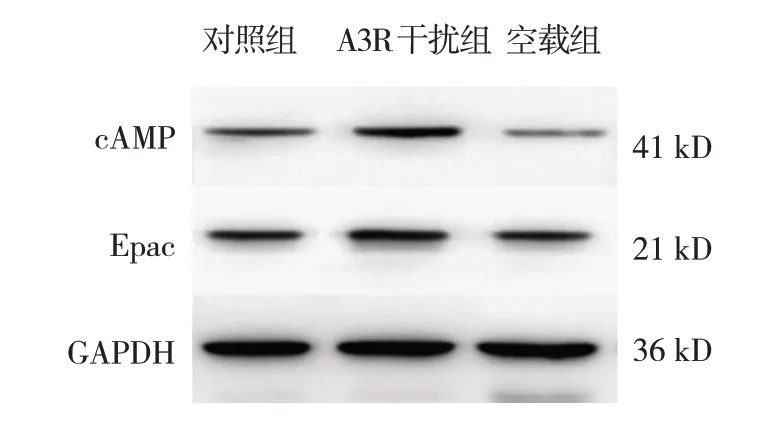
图5 各组cAMP、Epac蛋白条带图
2.5 各组IL-6、TNF-α相对表达量比较
对照组、A3R 干扰组、空载组IL-6、TNF-α 水平比较,差异均有统计学意义(P<0.05);进一步组间两两比较经LSD-t检验,A3R 干扰组高于对照组(P<0.05)。见表5 和图6。
表5 各组IL-6、TNF-α水平比较 (pg/mL, ±s)

表5 各组IL-6、TNF-α水平比较 (pg/mL, ±s)
组别IL-6 TNF-α对照组A3R干扰组空载组F 值P 值39.32±6.61 136.64±13.48 37.40±4.70 117.100 0.000 73.49±1.31 198.66±1.66 98.22±42.97 21.370 0.002
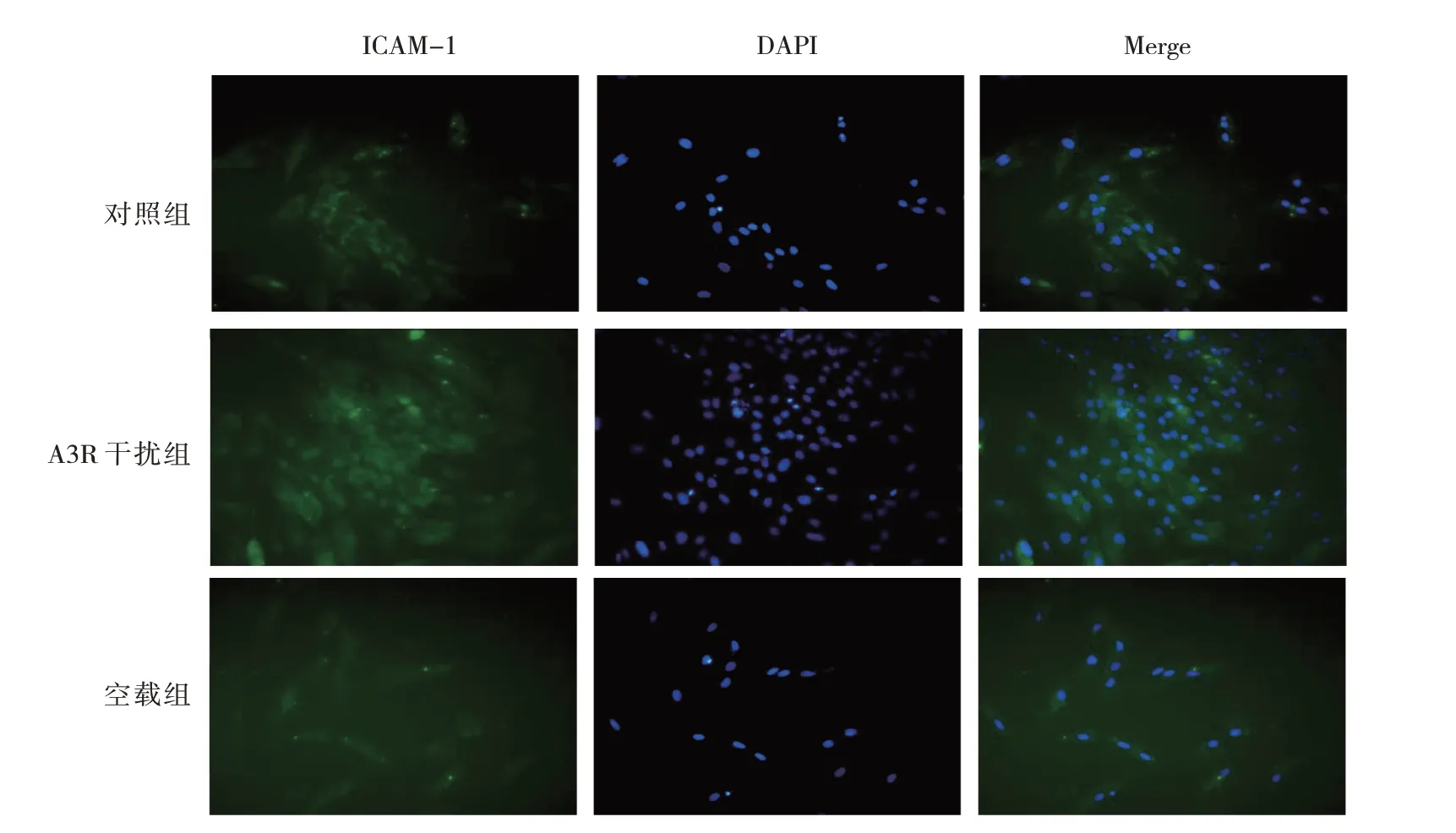
图6 siRNA干扰A3R表达对ICAM-1表达的影响
3 讨论
针刺镇痛机制具有多样性,复杂性,矛盾性等特点,大多研究主要是从神经机制主导来阐述,如中枢神经传导、中枢神经递质、免疫学炎症因子参与针刺镇痛[13-14]。在慢性压迫性损伤疼痛模型中,电针可以通过增强脊髓中强啡肽的表达,提高脊髓小胶质细胞上κ 阿片受体mRNA 表达,来抑制Toll 样受体4 的疼痛信号传导[15]。也有一部分学者认为,筋膜结缔组织和局部的生化改变也可介导针刺镇痛机制。筋膜作为一种胶原纤维结缔组织,具有支持和储备功能,其在形态学和功能学与中医经络相似,而且结缔组织平面与经络、穴位和针刺镇痛机制密切相关[16],陈德成等[17]提出可以找到肌筋膜激痛点,针刺至皮下浅筋膜处留针,通过主动运动来进行针灸治疗。
成纤维细胞作为穴位感受器,能对刺激产生较强的生化信号。针刺作为一种伤害性机械性刺激,通过提插捻转等手法形成力学信号,引起筋膜结缔组织发生形变,作用到对刺激敏感的成纤维细胞,激活细胞,引起细胞发生变异,如突起、周长和横截面积的改变,通过换能将细胞表面的信号转化为胞内生化信号途径,最终将生化信号转化为针刺效应[4]。陈波等[18]发现在体外实验中,给予筋膜中成纤维细胞压力刺激,能使细胞回缩、间隙增大和形态缩小。本课题组前期研究发现,体外压力刺激可以上调A3R,激活MAPK 信号通路,诱导成纤维细胞腺苷的表达增加,促进成纤维细胞增殖[19]。压力刺激可能会激发和提高穴位处的筋膜成纤维细胞的活力[20]。由此可见,筋膜中的成纤维细胞可能介导力学传导,影响针刺效应。本研究结果显示,腺苷siRNA 干扰可下调A3R 表达,提示筋膜中的成纤维细胞的A3R 可能参与针刺镇痛的过程。本实验培养浅筋膜成纤维细胞,应用不同浓度腺苷干预,结果显示,腺苷可剂量依赖性地上调成纤维细胞A3R 表达,提示腺苷可能通过A3R 发挥作用,那么成纤维细胞A3R 表达增加的意义值得探讨。
钟欢等[21]提出针刺可以治疗大鼠慢性萎缩性胃炎,下调COX-2、IL-6、IL-8 水平。郑倩华等[22]发现在膝骨性关节炎模型中,针刺可以降低IL-6、Chemerin表达,提示针刺可能具有抗炎作用。有研究发现,Epacs 在炎症的产生增强中起着至关重要的作用[23]。炎症损伤引起感觉细胞中Epac 表达大幅升高。在炎症性损伤后,PGE2 通过激活PKA 和Epac-PKC 产生增强的痛觉过敏,cAMP/Epac 可以增强炎症后PGE2介导的痛觉过敏,对炎症疼痛有着关键作用。在由皮肤肌肉切开牵拉诱导的CPSP 大鼠模型中,鞘内注射Epac1 抑制剂CE3F4 可明显抑制皮肤肌肉切开牵拉诱导的机械性异常和脊髓中星形胶质细胞的活化,表明脊柱Epac1 介导的星形胶质细胞活化可能有助于缓解慢性术后疼痛,抑制Epac1 可以有效预防CPSP,提示cAMP/Epac 可能参与炎症的调节[24]。本课题组前期研究发现,A3R 途径的激活可以下调cAMP/Epac 通路,在针刺前注射A3R 激动剂IBMECA 可进一步下调cAMP、Epac 表达,A3R 拮抗剂Reversine 可逆转这一效应。本研究结果发现,siRNA干扰下调A3R 表达后,cAMP、Epac 表达上调,与前期实验结果一致。在前期实验发现,A3R 途径激活可能有利于改善炎症疼痛,本实验结果发现,siRNA 干扰A3R 表达后,IL-6、TNF-α 表达上调,提示沉默的A3R 途径可能不利于炎症疼痛,与上调浅筋膜成纤维细胞的cAMP/Epac 信号通路有关;针刺可能通过调节炎症来发挥镇痛效应,这可能与针刺激活A3R,下调cAMP/Epac 通路,降低炎症因子表达有关。
综上所述,结合前期的体内实验和本实验发现,针刺可能通过激活A3R 途径,下调cAMP/Epac 通路,降低IL-6、TNF-α 表达,起到抗炎镇痛作用。

