消化道早癌患者内镜黏膜下剥离术后迟发性出血的危险因素分析*
刘荣泉, 季云, 张杰
(泰州市人民医院 消化内科, 江苏 泰州 225300)
消化道早癌是指发生在黏膜内层的表浅性癌症,具有隐匿性、多发性和易复发性等特点,临床上以胃癌、食管癌较常见[1]。全球最新癌症调查结果显示,胃癌和食管癌的发病率分别为5.7%和3.2%,居所有癌症发病率的第5 位和第7 位,两者的病死率依次为8.2%、5.3%,居全部因癌症死亡比例的第3 位和第4 位[2]。早期诊断和治疗是提高食管癌和胃癌患者生存率的关键。近年来,随着内镜治疗技术的飞速发展,内镜下切除技术已逐渐应用于消化道早癌患者。相关研究指出,内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是一种保留消化道黏膜的创新治疗方法,主要原理是用内镜下专用器械,如高频电刀,逐步将消化道的早期黏膜癌变或黏膜下良性肿瘤与其下方正常的黏膜下层剥离,以达到完整切除病灶的目的。ESD 相较传统外科手术,能够通过小切口完成手术操作,创伤小、术中出血少、恢复快,同时完整切除病变组织,复发率低,提高患者生活质量,已被国内外指南推荐为治疗消化道早癌的一线治疗方案[3-4]。有研究指出,ESD仍存在一定不足,如对操作者经验水平要求高、耗时较长、操作难度较大,且相比内镜下黏膜切除术,其术后出血、狭窄等并发症发生风险更高[5]。LI 等[6]研究证实,出血是ESD 术后最常见的并发症之一,主要包括术后迟发性出血和术中出血,对于术中出血,通常可以通过内镜下治疗成功止血。但对于术后迟发性出血,由于其发生时间不确定且部分患者已经出院,因此治疗难度较大,导致患者死亡风险增加。为改善患者预后,尽早识别ESD 术后迟发性出血的高危因素具有重要的临床意义。目前,国内有关分析消化道早癌患者ESD 术后迟发性出血危险因素的报道较少。鉴于此,本研究回顾性分析泰州市人民医院收治的625 例消化道早癌患者的临床资料,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2020 年5 月—2023 年2 月泰州市人民医院收治的625 例消化道早癌患者,其中胃癌257 例,食管癌368 例。本研究经医院医学伦理委员会批准,患者及家属均签署知情同意书。
1.2 纳入与排除标准
1.2.1 纳入标准 ①有胃癌[7]与食管癌[8]ESD 相对与绝对适应证;②年龄≥ 18 岁;③临床资料完整。
1.2.2 排除标准 ①ESD 术后病理检查提示胃肠间质瘤、神经内分泌肿瘤、颗粒细胞瘤、平滑肌瘤等;②放化疗史;③胃、食管恶性肿瘤手术史;④凝血功能异常;⑤远处淋巴结转移;⑥自身免疫性疾病。
1.3 方法
1.3.1 治疗方法 所有研究对象接受ESD。患者术前禁水≥ 2 h,禁食≥ 6 h。术前30 min 口服1 袋二甲硅油乳剂(四川健能制药有限公司,国药准字H20103302,规格:135 g/袋)改善手术视野。全身麻醉后用GIF-XP190N 型单通道电子胃镜(日本奥林巴斯公司)进行手术。结合放大内镜与染色内镜观察并了解病变的形态、深度、范围等。沿病灶边缘3~5 mm 用一次性黏膜切开刀进行电凝标记,黏膜下注射肾上腺素、玻璃酸钠、生理盐水、靛胭脂,隆起黏膜。沿标记处外侧,用一次性黏膜切开刀进行环形切割。沿黏膜下基底通过一次性黏膜切开刀将瘤体完整剥离。肿瘤切除完全后,通过止血钳、氩离子体凝固创面血管。采用尼龙绳荷包缝合封闭创面,抽取胃内液体,放置胃肠减压器,标记固定切除病灶后送检。术后密切监测患者生命体征至苏醒。术后第1 天禁水、禁食,同时密切监测患者生命体征,充分补液,并给予抗炎、保护胃肠道黏膜、抑酸等支持治疗,以促进消化道的恢复,减少并发症的发生。术后第2 天逐渐开始进食软食或流食,并逐步恢复正常饮食。因食管癌的位置较高,手术时需要注意避开喉返神经等重要组织结构,同时还需使用长型内窥镜进行操作。
1.3.2 ESD 术后迟发性出血 迟发性出血判定标准:患者出现生命体征变化(如心率、血压等),术后溃疡明显需要内镜治疗;相比术前,血红蛋白降低20 g/L 或伴有黑便、便血、呕血等表现[9]。多数ESD术后迟发性出血发生在术后24 h 内,而且持续时间可达14 d。根据ESD 术后是否发生迟发性出血,将胃癌患者分为胃癌发生组、胃癌未发生组;食管癌患者分为食管癌发生组、食管癌未发生组。
1.3.3 收集资料 包括年龄、性别、既往病史(冠心病、糖尿病、高血压)等、病灶直径、黏膜下有无纤维化、手术时间、是否长期使用抗凝药物(服用时间> 14 d)、是否累及脉管、是否累及淋巴管等。
1.4 统计学方法
数据分析采用SPSS 26.0 统计软件。计数资料以构成比或率(%)表示,比较用χ2检验;计量资料以均数±标准差(±s)表示,比较用t检验;影响因素的分析用多因素Logistic 回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 消化道早期患者ESD术后迟发性出血情况
257 例胃癌患者中,ESD 术后迟发性出血27 例,迟发性出血发生率为10.51%;368 例食管癌患者中,ESD 术后迟发性出血23 例,迟发性出血发生率为6.25%。
2.2 胃癌发生组与胃癌未发生组临床资料比较
胃癌发生组与胃癌未发生组患者病灶部位、病灶直径、病灶深度、黏膜下有无粗大血管、黏膜下有无纤维化、手术时间、是否长期服用抗凝药物比较,经χ2检验,差异均有统计学意义(P<0.05);胃癌发生组病灶部位为胃体、病灶直径≥ 20 mm、黏膜下有粗大血管、黏膜下有纤维化、手术时间≥ 60 min、长期服用抗凝药物占比高于胃癌未发生组,胃癌发生组病灶深度为黏膜层占比低于胃癌未发生组。胃癌发生组与胃癌未发生组患者年龄、性别、既往史、病灶形态、病理类型、切片大小、累及脉管、累及淋巴管比较,差异均无统计学意义(P>0.05)。见表1。
2.3 胃癌患者ESD术后发生迟发性出血的影响因素
以胃癌患者ESD 术后是否发生迟发性出血为因变量(否= 0,是= 1),病灶深度(贲门胃底或胃窦或胃角= 0,胃体= 1)、病灶部位(黏膜下层= 0,黏膜层= 1)、黏膜下有无粗大血管(无= 0,有= 1)、是否长期服用抗凝药物(无= 0,有= 1)、病灶直径(< 20 mm= 0,≥ 20 mm= 1)、黏膜下有无纤维化(无=0,有= 1)、手术时间(< 60 min= 0,≥ 60 min= 1)为自变量,进行多因素逐步Logistic 回归分析(引入水准为0.05,排除水准为0.10),结果显示:黏膜下有粗大血管[=3.838(95% CI:1.687,8.731)]、黏膜下有纤维化[=3.511(95% CI:1.544,7.988)]、手术时间≥60 min [=2.821(95% CI:1.240,6.417)]、长期使用抗凝药物[=4.415(95% CI:1.941,10.043)]为胃癌患者ESD 术后发生迟发性出血的影响因素(P<0.05)。见表2。
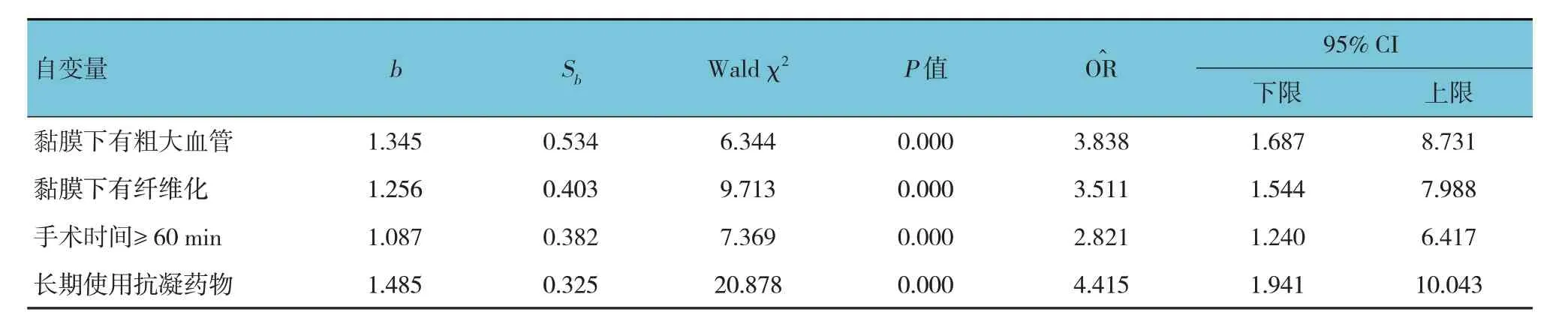
表2 胃癌患者ESD术后发生迟发性出血的多因素逐步Logistic回归分析参数
2.4 食管癌发生组与食管癌未发生组临床资料比较
食管癌发生组与食管癌未发生组患者黏膜深度、切片大小、切除管径大小、黏膜下有无粗大血管、黏膜下有无纤维化、手术时间、是否长期使用抗凝血药物比较,经χ2检验,差异均有统计学意义(P<0.05);食管癌发生组黏膜深度为黏膜下层、切片大小≥ 40 mm、切除管径大小为环周、黏膜下有粗大血管、黏膜下有纤维化、手术时间≥ 60 min、长期服用抗凝血药物占比高于食管癌未发生组。食管癌发生组与食管癌未发生组患者年龄、性别、既往史、病灶部位、病灶直径、病灶形态、病理类型、累及脉管、累及淋巴管比较,差异均无统计学意义(P>0.05)。见表3。
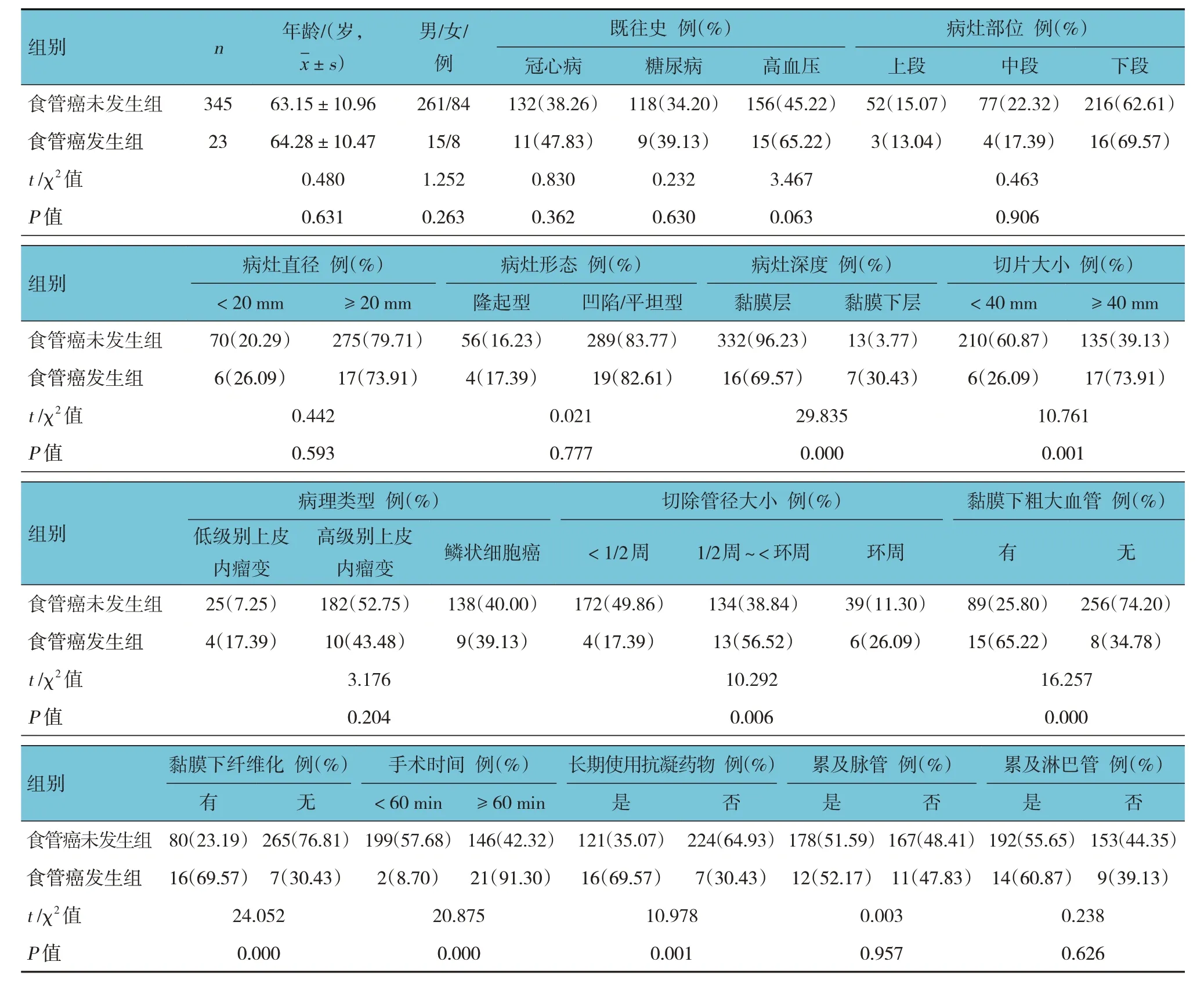
表3 食管癌发生组与食管癌未发生组患者临床资料比较
2.5 食管癌患者ESD术后发生迟发性出血的影响因素
以食管癌患者ESD 术后是否发生迟发性出血为因变量(否= 0,是= 1),切片大小(< 40 mm= 0,≥ 40 mm= 1)、黏膜下有无粗大血管(无= 0,有= 1)、切除管径大小(<环周= 0,环周= 1)、是否长期服用抗凝药物(无= 0,有= 1)、黏膜下有无纤维化(无=0,有= 1)、病灶深度(黏膜层= 0,黏膜下层= 1)、手术时间(< 60 min= 0,≥ 60 min= 1)为自变量,进行多因素逐步Logistic 回归分析(引入水准为0.05,排除水准为0.10),结果显示:黏膜下有粗大血管[=3.056(95% CI:1.343,6.951)]、手术时间≥ 60 min [=3.607(95% CI:1.586,8.206)]、长期使用抗凝药物[=4.104(95% CI:1.804,9.336)]为食管癌患者ESD 术后发生迟发性出血的影响因素(P<0.05)。见表4。
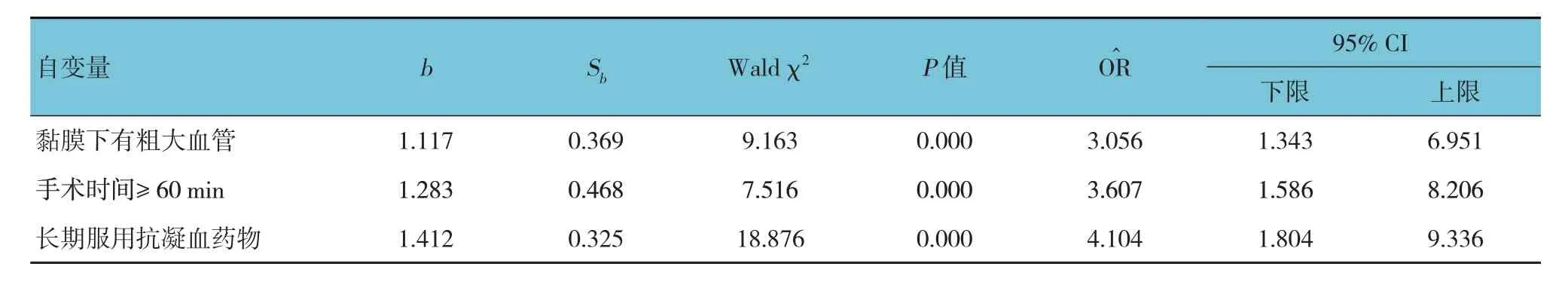
表4 食管癌患者ESD术后发生迟发性出血的多因素逐步Logistic回归分析参数
3 讨论
消化道早癌是指在病变组织侵犯肌层或淋巴管之前,被内镜检查发现的消化道癌变,包括早期食管癌、早期胃癌等。最新研究表明胃癌、胰腺癌和胆道癌的发病率有上升趋势[10]。相关研究指出,ESD 为治疗消化道早癌的首选方法,相比传统外科手术,ESD 具有住院时间短、术后恢复快、侵袭性小等优势,然而该技术耗时长、技术难度大,可出现狭窄、穿孔、出血等并发症[11]。SHIOTSUKI 等[12]研究表明,ESD 术后出血风险较高,其中迟发性出血大部分发生在术后24 h 内,也有少部分患者迟发性出血发生在术后24 h~14 d。有报道指出,结直肠癌、胃癌ESD术后迟发性出血发生率分别为2.7%~8.1%、1.8%~15.6%,虽然在大部分条件下,内镜下止血能够控制ESD 术后迟发性出血,但也可能造成失血性休克等不良预后[13-14]。另有研究结果显示,尽管采用预防性止血、抑酸剂等预防策略,也无法完全防止ESD术后迟发性出血的发生[15]。
本研究结果显示,胃癌患者ESD 术后迟发性出血发生率为10.51%,与公宇等[16]报道(10.6%)类似。本研究结果显示,黏膜下有粗大血管、黏膜下有纤维化、手术时间≥ 60 min、长期使用抗凝药物为胃癌患者ESD 术后发生迟发性出血的影响因素。既往研究结果显示,黏膜下粗大血管越丰富,迟发性出血风险越高[17],与本研究报道相符。研究结果表明,与上半部分胃体相比,下半部分胃体并发迟发性出血的风险更高,可能由于上半部分胃体含有丰富的黏膜下粗大血管,特别是在胃底管连接处,这些血管容易受到不同因素的刺激而破裂,手术期间更容易损伤黏膜下粗大血管,引发迟发性出血[18]。本研究中,迟发性出血主要集中于胃体,且胃癌发生组与胃癌未发生组的病灶部位对比有差异,与上述研究报道不符。日本人认为食管胃底部位容易发生出血,可能是因为胃上部分血管较为集中,临床医师在对其进行止血处理时会比较充分,而胃下半部分操作相对安全,因此在该部位的止血处理相对不足。临床研究发现,黏膜下纤维化可能会增加黏膜下固有肌层与黏膜层分离的难度,导致手术者无法识别黏膜下层组织结构,可能造成整块切除失败[17]。同时,在剥离期间,黏膜下纤维化的组织也极易损伤黏膜下血管,使术中无法早期识别部分隐藏血管出血,从而使迟发性出血发生率升高,严重情况下,还可能导致穿孔或肌层断裂等并发症。本研究结果显示,黏膜下有粗大血管、手术时间≥ 60 min、长期使用抗凝药物为食管癌患者ESD 术后发生迟发性出血的影响因素。分析其原因为食管壁较薄、黏膜下血管较为丰富等特殊结构,如果黏膜下存在粗大的血管,手术过程容易损伤这些血管,这种损伤可能会增加术后迟发性出血的风险。大量研究证实,手术时间> 60 min 为ESD术后迟发性出血发生的独立危险因素,与本研究报道相符[19-20]。自口服抗凝药物问世以来,其在处方抗凝药物中使用比例逐渐增加,口服抗凝药物为消化道严重出血的重要因素[21]。国外有研究指出,肝素或华法林桥接口服抗凝药物与ESD 术后迟发性出血密切相关,与本研究报道相符[22]。国内有研究指出,使用抗凝药为早期胃癌患者ESD 术后迟发性出血的独立危险因素[23],与本研究结果相符。分析其原因为长期服用抗凝药物可延迟创面愈合、抑制前列腺素合成、损伤胃黏膜,增加迟发性出血的风险。
综上所述,黏膜下有粗大血管、手术时间≥ 60 min、长期使用抗凝药物的消化道早癌患者ESD 术后迟发性出血风险更高。然而本研究样本量有限,为单中心研究,且未构建ESD 术后迟发性出血风险评估模型,后续可扩大样本量、构建ESD 术后迟发性出血风险评估模型进行多中心研究来深入分析消化道早癌患者ESD 术后迟发性出血的发生风险。

