慢性阻塞性肺疾病患者血浆溶血磷脂酸和可溶性ST2的表达水平及其临床意义*
洪静雪 黄钟 张妤 卢献灵
(石河子大学医学院第一附属医院1.呼吸内一科;2.急诊内科,新疆 石河子 832000)
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种可预防和治疗的疾病,但近年来死亡率不断上升,已成为全球人类第三大死因[1-3]。COPD与气道的慢性炎症有关,表现为多种炎症细胞的浸润及炎症因子的改变[4]。溶血磷脂酸(Lysophosphatidic acid, LPA)是一种水溶性小分子甘油磷脂,广泛存在于血液、各种组织和体液中,其生物学功能是由细胞外信号通过至少六个7跨膜G蛋白偶联受体驱动的[5]。LPA参与肺的多种病理过程,包括炎症、纤维化和癌症等[6-8]。有研究发现,LPA水平与COPD急性加重的发生率有关[9],提示LPA可能参与了COPD的发生发展,但其发挥作用的机制尚未被阐明。ST2是白细胞介素-1(IL-1)受体家族的成员,也称为白介素1受体样蛋白1(IL1RL-1),ST2有两种主要的异构体,跨膜型(ST2L)和可溶型(sST2)[10]。IL-33与ST2L的结合引起多效性作用[11],可溶型sST2可以以高亲和力结合IL-33,阻断IL-33/ST2L之间相互作用[12]。有研究表明,LPA可促进人支气管上皮细胞sST2的生成与释放[13],提示LPA发挥作用的机制可能与sST2有关。但目前LPA与sST2之间联系的相关机制以及LPA与sST2在COPD发病机制中的作用需要进一步探索。本试验拟通过研究血浆中LPA、sST2在慢阻肺患者的不同阶段和健康人中的表达水平,以探讨LPA与sST2的关系及两者在COPD疾病发生发展中的作用及临床意义。
1 资料与方法
1.1 研究对象 本研究对象为本院呼吸一科在2021年10月-2022年6月期间因COPD急性加重而收住院的患者42例,诊断符合中华医学会呼吸病学分会慢性阻塞性肺疾病学组于2021年修订的《慢性阻塞性肺疾病诊治指南》[14]中的诊断标准者纳入本研究:①年龄≥40岁和(或)有危险因素暴露史、慢性咳嗽、咳痰。②使用支气管舒张剂后FEV1/FVC<0.7。排除标准:①支气管哮喘、矽肺、肺结核、间质性肺疾病等慢性肺部疾病的患者。②有冠心病、动脉粥样硬化、2型糖尿病、肿瘤及自身免疫性疾病的患者。③有肝、肾功能不全病史的患者。④在入组前使用过全身皮质类固醇药物、抗生素及免疫抑制剂的COPD患者。⑤不能配合完成肺功能者及不同意、不配合完成本研究者。符合条件者纳入COPD急性加重期组,患者经止咳平喘等专科治疗后,气道症状较入院明显缓解,病情基本恢复稳定者则判定为稳定期,为COPD稳定期组;选取同时间段于本院体检的40例健康受试者为对照组。血液样本及基本信息收集均获得患者知情同意并通过医院伦理委员会批准(KJX-2021-072-01)。
1.2 方法
1.2.1 一般资料 收集临床基线资料及白细胞计数、中性粒细胞计数、红细胞分布宽度(RDW)等临床指标。COPD稳定期组和对照组进行肺功能检查。
1.2.2 肺功能检测 在同一专科医师指导下,每例COPD患者应用同一台肺功能仪,按照标准肺功能检测程序进行测定;测定1秒用力呼气容积(Forced expiratory volume in one second,FEV1 )、用力肺活量(Forced vital capacity,FVC)及第1秒用力呼气容积占预计值百分比(Forced expiratory volume in the first second in percent predicted values,FEV1%pred),当 FEV1/FVC<70%时,定义为气流受限。
1.2.3 血浆中LPA、sST2的检测 各组受试者晨起未进食情况下抽取外周静脉血5 mL,放于EDTA.K2抗凝剂管中,以3 000 r/min离心10 min,取上层血浆,储存在-80 ℃冰箱备用。使用酶联免疫吸附法(Enzyme-linked immunosorbent assay,ELISA)测定血浆中LPA及sST2水平。LPA试剂盒购于武汉云克隆有限公司,sST2试剂盒购于美国KRISHGEN BioSystems。
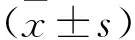
2 结果
2.1 一般资料分析 研究纳入COPD组男性29例、女性13例,年龄46~82岁,平均(63.79±8.63)岁;对照组男性21例、女性19例, 年龄43~77岁,平均(60.9±7.48)岁。COPD组与对照组在性别、吸烟史、年龄、体重指数(BMI)方面的差异无统计学意义(P>0.05),COPD组FEV1/FVC、FEV1%pred低于对照组,差异有统计学意义(P<0.05),见表1。
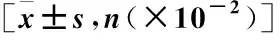
表1 COPD组与对照组的基线资料比较
2.2 COPD急性加重期、稳定期与和对照组LPA、sST2水平的比较 COPD急性加重期的LPA、sST2水平显著高于稳定期,COPD急性加重期、稳定期组的LPA、sST2水平显著高于对照组(均P<0.05),见表2、3。
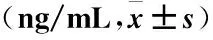
表2 COPD急性加重期、稳定期与对照组LPA水平的比较
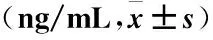
表3 COPD急性加重期、稳定期与对照组sST2水平的比较
2.3 COPD患者LPA与sST2水平的相关性分析经Pearson相关性分析表明,COPD急性加重期LPA水平与sST2呈正相关(P<0.05),稳定期LPA水平sST2与呈正相关(P<0.05)。见表4。
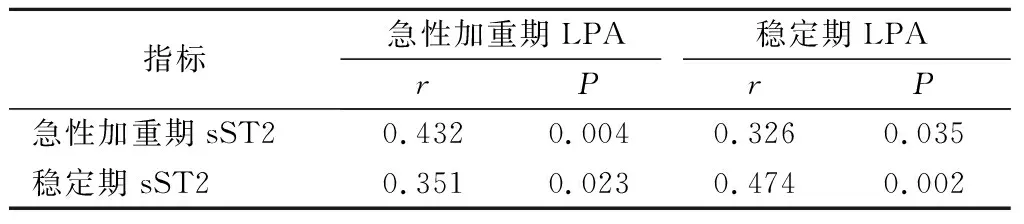
表4 COPD患者LPA与sST2的相关性分析
2.4 COPD急性加重期患者LPA、sST2水平与临床指标的相关性分析 COPD患者急性加重期LPA水平与白细胞计数、RDW、中性粒细胞/淋巴细胞比率(NLR)、血小板/淋巴细胞比率(PLR)、白蛋白、中性粒细胞百分比、单核细胞/高密度脂蛋白比率(MHR)呈正相关(均P<0.05)。COPD患者急性加重期sST2水平与中性粒细胞百分比、白细胞计数、嗜酸性粒细胞计数,RDW、NLR、白蛋白呈正相关(均P<0.05)。COPD急性加重期患者LPA、sST2水平与年龄、BMI、吸烟和血红蛋白均无显著相关性(P>0.05)。见表5。

表5 COPD组急性加重期LPA、sST2与临床指标的相关性分析
2.5 COPD稳定期患者LPA、sST2水平与临床指标的相关性分析 COPD患者稳定期LPA水平与FEV1%pred、FEV1/FVC呈负相关(P<0.05),与白细胞计数、RDW、中性粒细胞百分比、NLR、PLR呈正相关(P<0.05)。COPD患者稳定期sST2水平与FEV1%pred、FEV1/FVC呈负相关(P<0.05),与白细胞计数、RDW、中性粒细胞百分比、嗜酸性粒细胞计数,NLR、白蛋白呈正相关(均P<0.05)。COPD患者稳定期LPA、sST2水平与年龄、BMI、吸烟史、血红蛋白、降钙素原和MHR均无显著相关性(P>0.05)。见表6。
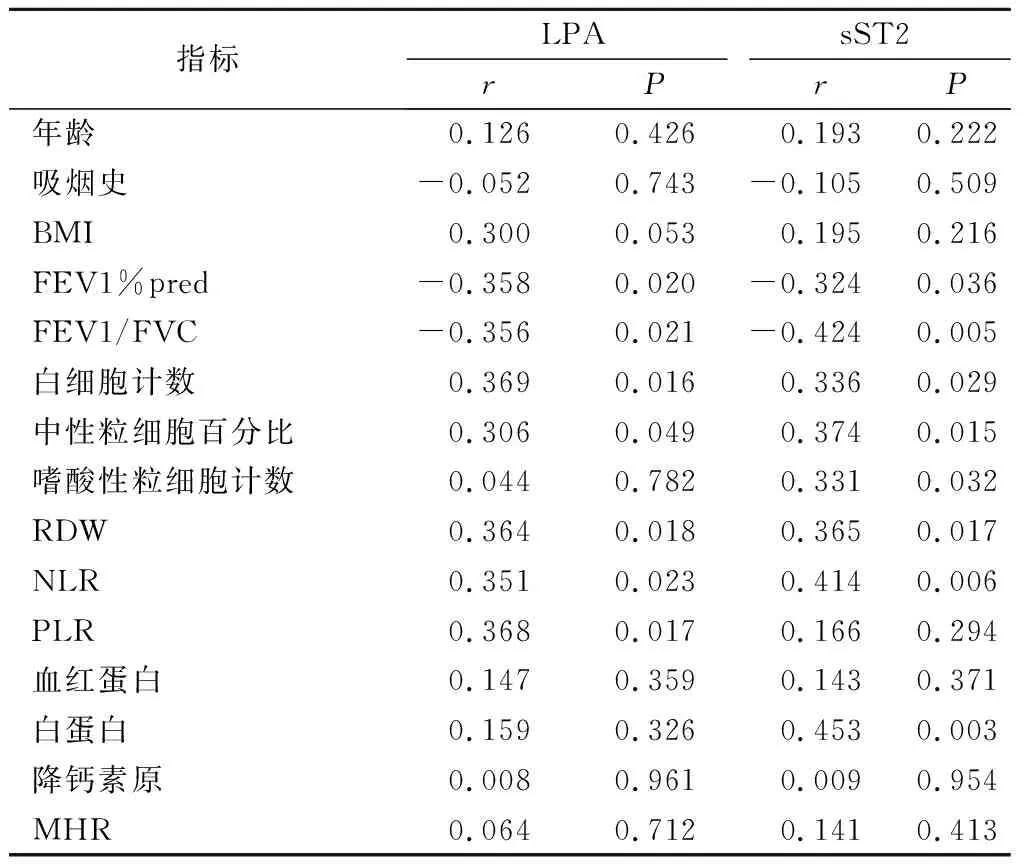
表6 COPD组稳定期LPA、sST2与临床指标的相关性分析
3 讨论
目前我国COPD总发病率为8.6%,全国患病人数已接近1亿[15],给国家卫生系统增大了很大的负担。因此,对COPD的发病机制进行近一步的探索是必要且迫切的,COPD主要的分子病理学基础是炎症、氧化应激、蛋白酶与抗蛋白酶失衡[4]。其中最主要的是炎症机制,有多种炎症细胞参与其中,并伴有炎性因子的变化。本研究将42例COPD患者作为研究对象,40例同期健康受试者作为对照,使用ELISA法检测各组外周血LPA、sST2水平,并探讨两者之间的关系。
LPA是一种生物活性溶血磷脂,其化学结构名称为1-酰基-2-羟基-3-磷酸甘油(1-acyl-2-hydroxy-snglycerol-3-phosphate),所有LPA分子都由连接到磷酸酯头部基团的甘油主链组成,并且通过酯键连接到不同长度和饱和度的酰基链[16]。LPA广泛存在于血液、各种组织和体液中,近年来,其在多种肺部炎症性疾病中的作用已有报道[9,17-18]。本研究发现,COPD组患者血浆LPA水平明显高于对照组,且急性加重期LPA水平明显高于稳定期组,提示LPA参与了COPD患者的炎症反应,并可能在疾病的急性加重中发挥作用,这与Ren等[18]研究结果相符。考虑其原因可能是COPD的病理变化包括慢性炎症,即肺部特定部位炎性细胞增多,及反复损伤和修复导致的支气管结构变化,而COPD的患者多免疫力低下,易受细菌、病毒等感染,使病情出现急性加重,引发急性炎症反应,中性粒细胞、单核细胞、巨噬细胞等炎症细胞聚集,释放一系列炎症因子,其中LPA可以促进炎症细胞因子的产生和中性粒细胞浸润,同时LPA还可促进单核细胞迁移,并介导单核细胞向巨噬细胞的分化,巨噬细胞释放活性氧以消除病原体[19-22]。结合以上,可以认为LPA作为一种炎症因子,在COPD炎症反应中起到重要的作用,因此COPD患者血浆中LPA会升高,并在急性加重期明显升高,但是对LPA在慢阻肺疾病中发挥作用的机制目前尚无法阐明。
有研究发现,LPA可增加支气管上皮细胞中sST2表达和释放,主要由转录因子NF-κB和AP-1的激活和组蛋白H3在sST2启动子区域的乙酰化所介导,同时sST2融合蛋白可抑制LPS诱导的气道上皮屏障功能障碍[13],本研究相关性分析也提示,COPD患者急性加重期与稳定期的LPA水平与sST2呈较显著的正相关,这表明LPA在慢阻肺中发挥作用的机制可能与sST2有关。
ST2作为白细胞介素1受体家族的成员,位于人类2q12染色体上。包括跨膜型(ST2L)和可溶型(sST2),两者均可与IL-33结合产生特定效应[12]。sST2广泛分布在各种免疫和炎症反应机制中,导致不同组织的不同病理生理结果。近期研究发现,sST2水平在新冠肺炎患者中呈升高趋势,并且与炎症和反应疾病临床严重程度的其他标志物相关[23]。在急性低氧性呼吸衰竭患者中,sST2浓度与死亡率密切相关,气管插管时测量sST2可预测患者预后,并且重复测量sST2可提供关于呼吸机脱机的信息[24]。在本研究中,COPD急性加重期和稳定期患者血浆中sST2水平高于对照组,COPD急性加重期患者血浆sST2水平高于稳定期,这证明sST2在COPD中同样存在重要作用,可以认为sST2作为一个重要的炎症因子,参与COPD的炎症反应过程。COPD患者外周血中sST2水平升高,sST2是COPD患者全因死亡率的独立预测因子,且其浓度与COPD患者的疾病严重程度和长期预后相关[25]。国内也有研究发现,COPD急性加重期患者外周血sST2表达水平升高,并且sST2可以作为判断疾病预后的一项临床指标[26]。综合以上研究结果,可以认为LPA可促进sST2的生成,并且两者在COPD的疾病的发生发展中起到重要作用,但其内部分子机制仍待进一步研究发现。
相关性分析提示,COPD患者急性加重期LPA、sST2水平与中性粒细胞百分比、白细胞计数、NLR、PLR、红细胞分布宽度等反映机体全身炎症状态的指标有相关性,考虑其原因,COPD的发病机制与全身炎症的增加有关,而且在病情加重时,炎症反应会上调[27]。其中NLR和PLR已成为反应COPD患者全身炎症情况的较为有价值的标志物[28],RDW作为循环红细胞的变异系数,反映了红细胞的异质性,且研究发现RDW是COPD急性加重患者住院期间和1年死亡率的一个强有力的独立危险因素[29]。本研究结果提示LPA、sST2与上述全身炎症标志物相关,并且在病情急性加重时相关性更高,可以认为LPA、sST2的指标测定在一定程度上可以反映呼吸道的炎症负荷,在COPD中起到反映炎症严重情况的作用。此外,本研究对LPA、sST2水平与肺功能指标进行相关性分析,结果显示COPD患者LPA、sST2水平与FEV1%pred、FEV1/FVC呈负相关,提示LPA、sST2与COPD患者气流受限情况有关,反映COPD患者病情轻重的主要指标即肺功能,这进一步证实了LPA、sST2与COPD患者病情密切相关,但其具体机制尚有待阐明。
本研究仍存在一些缺陷,研究未从纵向监测COPD患者从急性加重到恢复期间的多个时间点的LPA、sST2水平,研究样本量较小,同时对于LPA与sST2之间的关系未进行进一步的体外实验研究,因此后期有待设计研究的大型临床试验及体外研究进一步探索LPA与sST2之间关系及其在慢阻肺发病机制中的作用。
4 结论
LPA与sST2可能共同参与COPD疾病发生的炎症机制,COPD患者血浆的LPA、sST2水平可能有机会被用于识别评估COPD患者的病情,但仍需要进一步的研究来了解LPA与sST2在COPD发生发展中的机制与联系。

