MTHFD2过表达通过糖酵解促进慢性阻塞性肺疾病的中性粒细胞胞外陷阱
刘晓辉 郝世柱 吴晓瑭
(1.唐山市人民医院胸外科,河北 唐山 063000;2.唐山工人医院肿瘤外一科,河北 唐山 063000;3.桂林理工大学,广西 桂林 310000)
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是常见的呼吸道疾病[1],其产生与持续性的气流阻塞和呼吸道炎症有关,由于患者呼气后不能完全排空肺脏,导致二氧化碳在体内积聚,由此产生的二氧化碳潴留导致呼吸功能下降、缺氧和高碳酸血症[2-3]。COPD具有病程长、易反复发作等临床特点,可进一步发展为肺心病和呼吸衰竭,严重影响人体健康[4-5]。据统计,全球每年有300多万人死于COPD[6]。因此,探究有效的生物标志物对COPD的治疗具有重要的意义。研究发现,亚甲基四氢叶酸脱氢酶2(Methylenetetrahydrofolate Dehydrogenase(NADP+Dependent)2,MTHFD2)是COPD可靠的生物标志物,其在COPD的预后和诊断治疗中发挥重要的作用[7]。COPD患者病情的加重与中性粒细胞(Neutrophil,NEU)及其胞外陷阱(Neutrophil extracellular trap,NET)的活化关联甚密[8-9]。当NEU被活化时,会释放颗粒蛋白和染色质,在细胞外与胞外纤维结合形成网状结构的NET[8,10-11]。随着COPD患者病情的加重,其痰液和气道中NETs含量会增多,炎症反应和肺功能的受损程度均加大[8-9,12]。有研究发现,MTHFD2与糖酵解具有协同表达效果,表现为高MTHFD2促进高糖酵解[13]。糖酵解是机体内除有氧线粒体呼吸外第二种获取能量的方式。在低氧或缺氧条件下,大多数真核细胞为维持一定的ATP水平会将主要代谢策略从线粒体呼吸转向糖酵解[14]。因此,本研究将从COPD中MTHFD2基因的表达水平对NET的形成和糖酵解代谢的影响出发,探究MTHFD2对COPD的作用机制,以期对COPD的治疗提供新的思路。
1 材料与方法
1.1 生物信息分析 从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)下载COPD相关的芯片数据GSE38974(normal:9,COPD:23)。利用“limma”包对芯片数据进行差异分析(logFC=0.585,adjust P-value=0.05),发现MTHFD2基因显著上调。利用The Human Protein Atlas数据库(http://www.proteinatlas.org/)分析MTHFD2在人体中的表达模式。
1.2 痰液的采集与痰液DNA的定量测定 收集2022年7月就诊于唐山市人民医院的COPD患者痰液30份为COPD组(符合COPD诊断标准),肺功能检查正常的健康人群的痰液30份为对照组。两组取样时间一致,且确保两组采样前1 h不进食,不吸烟、不刷牙,未剧烈运动。清水漱口5 min后统一收集痰液于采样管中。4 ℃条件下运回实验室[15]。为了确定不同处理组获得的细胞痰液上清液中NET丰度,按照制造商的说明,使用PicoGreen®dsDNA定量试剂(美国赛默飞世尔科技公司)在480 /520 nm的滤光片设置下进行荧光光谱定量,根据试剂盒说明书的要求测定并获得标准曲线的直线方程。测定待测样品的荧光值。根据标准曲线,计算样品的DNA浓度[16]。
1.3 中性粒细胞的分离和NET的诱导 本研究从DSMZ(德国布伦瑞克公司)获得中性粒细胞表型功能的常用替代细胞系HL-60细胞[17],按照开发商说明书的要求进行HL-60细胞的培养。为了评估健康组和COPD组中性粒细胞的NET形成能力,采用脂多糖(LPS)刺激HL-60体外分化获得的中性粒细胞。利用非细胞膜通透的染料Sytox green和Hoechst染料对胞外DNA进行染色,在荧光显微镜下观察DNA结构,以此表征NETs形成[18];采用免疫荧光染色检测NET标志物MPO和cit-H3的表达水平[19]。通过Trizol法进行总RNA提取,PrimeScript RT Reagent Kit(日本Takara公司)用于cDNA合成。随后,使用TB Green PCR Kit(日本Takara公司)进行qRT-PCR分析检测基因表达,β-肌动蛋白作为检测基因表达量的内参。使用2-ΔΔCt法计算目的基因的相对表达量。引物序列,见表1。
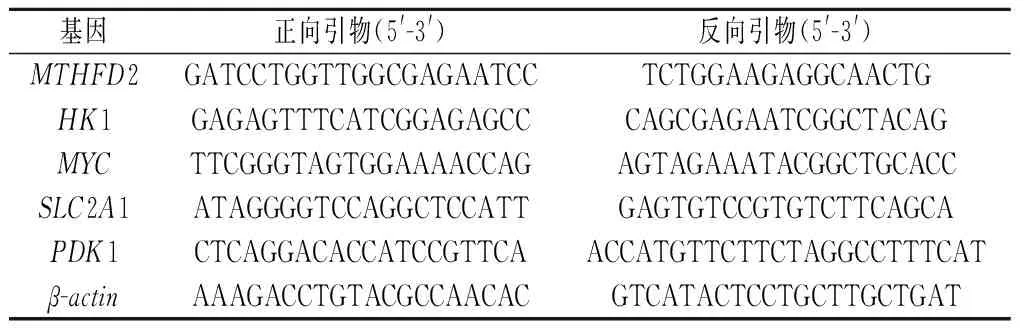
表1 qRT-PCR引物表
1.4 MTHFD2过表达的中性粒细胞的糖酵解测定和NET形成评估 将从中国GenePharma公司购买的pcDNA3.1-MTHFD2质粒转染到HL-60分化形成的中性粒细胞中,构建过表达MTHFD2的中性粒细胞HL-60/oe-MTHFD2[20]。用LPS刺激HL-60/oe-MTHFD2,诱导NET的生成。用SYTOX染料对
胞外DNA进行染色,用免疫荧光染色检测NET标志物MPO和cit-H3的表达水平。根据制造商的说明,乳酸测定试剂盒(3MAK064-1KT)和葡萄糖试剂盒(3GAGO20)重复测定待测样品中性粒细胞中的乳酸和葡萄糖含量[21]。用qRT-PCR分析HL-60/oe-MTHFD2中MTHFD2、糖酵解相关基因(HK1、PDK1、SLC2A1和MYC)的表达水平。生物信息学分析发现MTHFD2与糖酵解通路相关基因、中性粒细胞标志物之间呈正相关关系。为了探究MTHFD2基因、糖酵解和NET三者的关系,本研究构建HL-60/oe-NC组、HL-60/oe-MTHFD2组、HL-60/oe-MTHFD2+2-DG组,并用LPS分别处理各实验组细胞,诱导NET的生成。测定各处理组中MTHFD2基因表达量、糖酵解信号及NET形成情况。
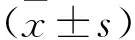
2 结果
2.1 MTHFD2与COPD中性粒细胞胞外陷阱相关 通过GEO数据的差异分析,发现MTHFD2在COPD中高表达(图1A)。与此相符的是,picogreen染料染色结果显示COPD痰液中DNA含量显著高于健康对照组,表明慢性阻塞性肺疾病中形成了较多的NET(图1B)。进一步使用免疫荧光染色分析了健康对照组(未用LPS处理的HL-60细胞)和COPD组(用LPS处理的HL-60细胞)样本中NET标志蛋白MPO和cit-H3的含量,COPD组中MPO和cit-H3的表达均显著高于健康对照组(图1C)。Pearson相关性分析结果显示MTHFD2与中性粒细胞标志物(ICAM1,ICOSLG,ITGAM,CR1)[22-23]的表达呈正相关(图1D)。qRT-PCR的结果表明,COPD组NEU中MTHFD2的表达水平显著高于对照组(图1E)。结合以上结果表明,MTHFD2的表达水平的提高与COPD患者体内NET的形成有关。
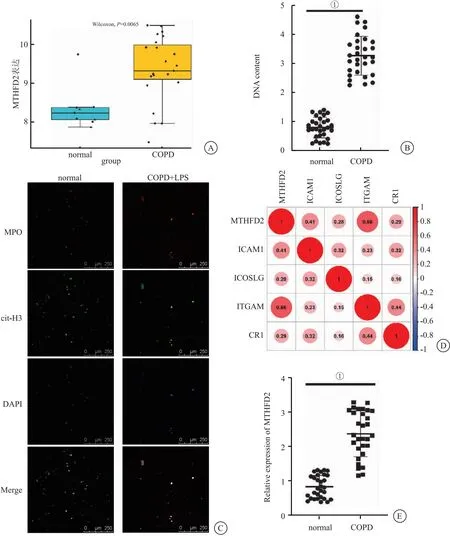
图1 MTHFD2与COPD中性粒细胞胞外陷阱相关性分析
2.2 MTHFD2过表达激活糖酵解信号通路并增加了中性粒细胞NET的形成 过往研究表明,MTHFD2可以促进糖酵解代谢,而NET的形成需要糖酵解代谢提供能量。本研究通过Pearson分析探究了MTHFD2与糖酵解代谢的相互作用关系,发现MTHFD2与糖酵解代谢通路多个酶基因(MYC,SLC2A1,HK1,PDK1)的表达呈显著正相关(图2A),表明MTHFD2基因可能与糖酵解信号有关。为了进一步探究MTHFD2与糖酵解和NET之间的相互作用关系,本研究构建了过表达MTHFD2的中性粒细胞,并用LPS刺激NEU以促进NET的形成。免疫荧光染色和SytoxGreen染色的结果显示(图2B、图2C),MTHFD2的过表达使中性粒细胞向胞外空间释放更多的DNA、MPO和cit-H3。这些数据表明,MTHFD2过表达可能促进COPD中NET的形成。荧光定量PCR实验的结果显示(图2D-H),MTHFD2的过表达使得中性粒细胞中MTHFD2基因以及糖酵解相关基因(HK1、PDK1、SLC2A1、MYC)的表达量显著提高(P<0.05),表明MTHFD2的过表达可以激活糖酵解信号通路。通过对葡萄糖和乳酸含量进行测定,发现MTHFD2过表达的中性粒细胞中葡萄糖含量显著下调,而乳酸的含量显著提高(图2I、图2J)。上述研究证实了过表达MTHFD2可以促进中性粒细胞的糖酵解代谢和COPD中NET的形成。
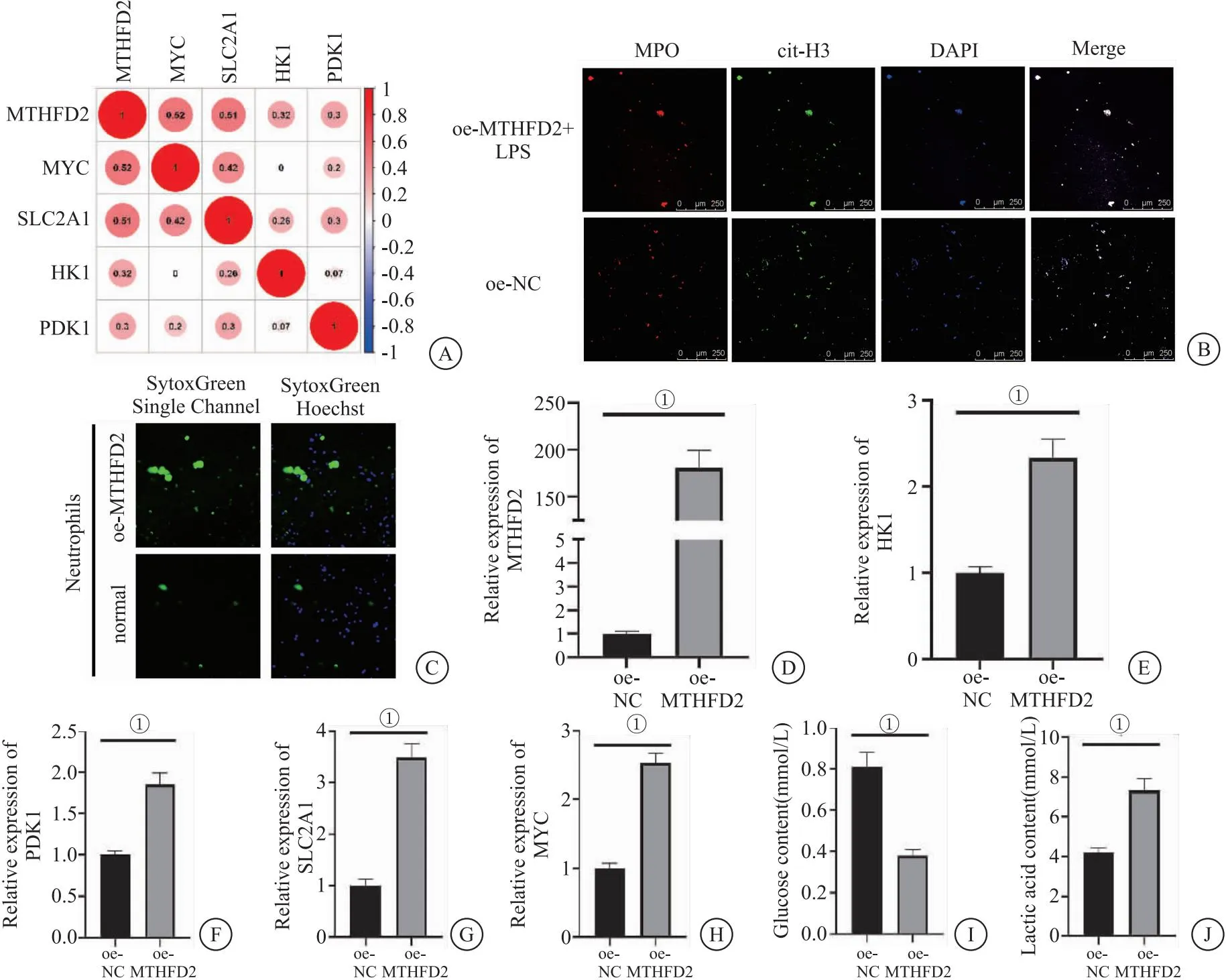
图2 MTHFD2与糖酵解信号通路和NET的形成密切相关
2.3 MTHFD2过表达可以诱导糖酵解信号通路影响COPD中性粒细胞胞外陷阱的产生 之前的研究发现,MTHFD2的过表达可以促进糖酵解代谢,促进NET的形成。但是MTHFD2过表达是否可以通过调节糖酵解信号通路来诱导NET的形成尚不明确。因此,使用糖酵解抑制剂(2-DG)处理过表达MTHFD2的中性粒细胞来进一步探究MTHFD2、糖酵解、NET三者之间的相互作用关系。结果显示,与HL-60/oe-MTHFD2相比,2-DG处理的HL-60/oe-MTHFD2向胞外空间释放的DNA减少(图3A),表明2-DG处理可以抑制NET的形成。此外本研究发现,2-DG处理可以显著抑制葡萄糖的消耗和乳酸的生成(图3B、图3C);而与HL-60/oe-NC相比,无论是否添加2-DG,MTHFD2的过表达均使中性粒细胞中NET形成能力显著提高。表明MTHFD2可能通过糖酵解信号通路刺激COPD中的糖酵解代谢和NET的形成。关于糖酵解信号通路,qRT-PCR的结果显示,过表达MTHFD2的中性粒细胞中MTHFD2基因的表达量(图3D)以及糖酵解相关基因(HK1、PDK1、SLC2A1、MYC)的表达量显著提高(P<0.05);2-DG加入使HL-60/oe-MTHFD2的MTHFD2、HK1、PDK1、SLC2A1、MYC的表达量显著降低(图3E-H)。表明过表达MTHFD2可以激活糖酵解信号通路,加入2-DG可抑制糖酵解水平。结合以上结果表明,过表达MTHFD2可以显著诱导COPD中的糖酵解代谢,进而促进NET的形成。
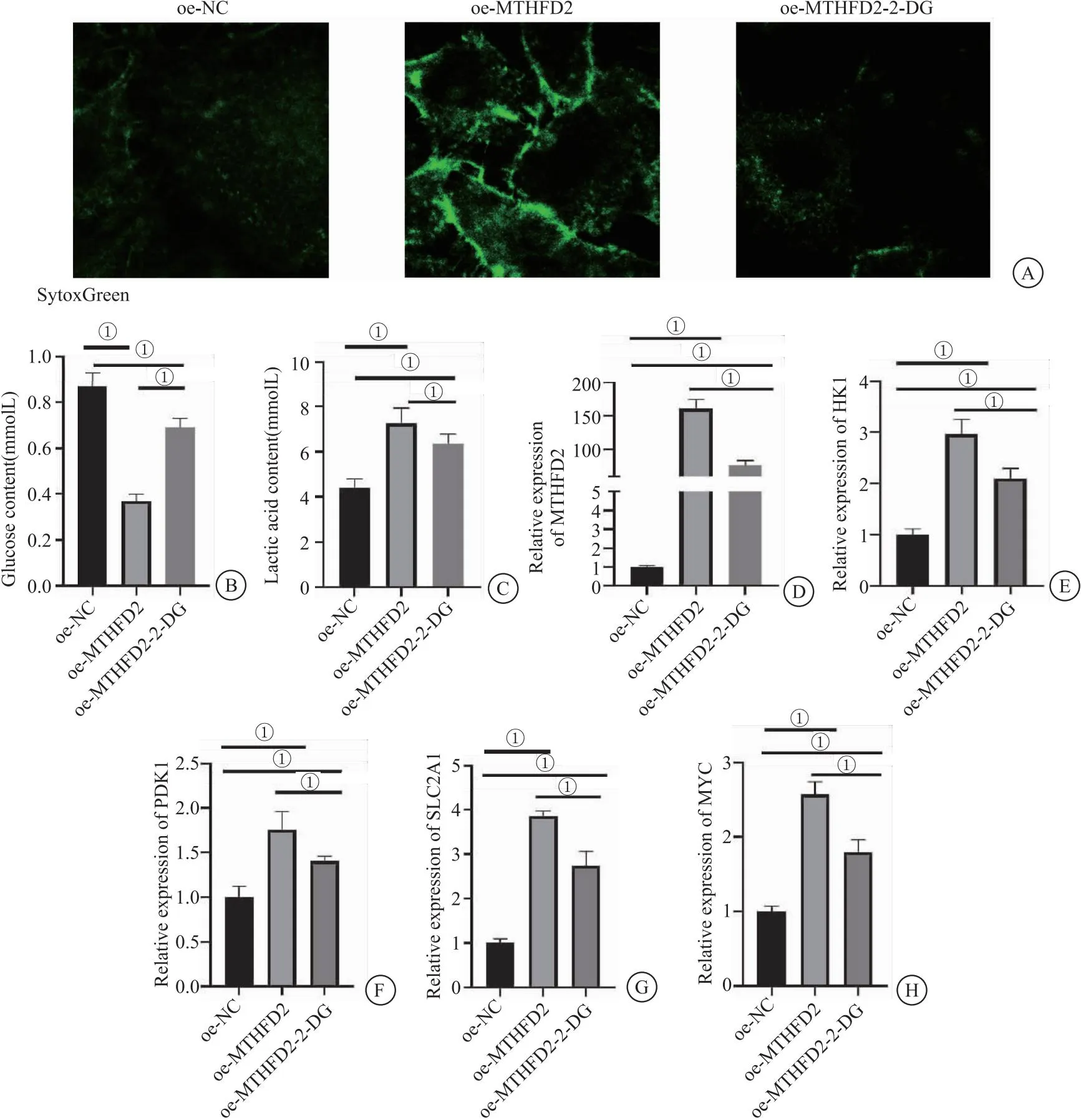
图3 过表达MTHFD2诱导糖酵解信号通路促进COPD中NET的产生
3 讨论
MTHFD2是线粒体中一碳叶酸代谢中的关键酶,可为细胞增殖提供所需要的NAD(P)H和ATP,参与多种炎症相关的反应。MTHFD2基因在多种炎症性疾病中过表达,MTHFD2在体内以及体外炎症部位的活化CD4 T细胞中的过表达,可以影响CD4 T细胞亚群(TH1、TH17、Treg)的活化、增殖、存活,促进炎症相关细胞因子的产生,进而调控免疫相关反应。Sugiura等[24]研究发现,抑制MTHFD2基因的表达,可以促进调节性T细胞(Treg)的分化,进而缓解多种炎症性疾病的病情。Yu等[7]研究发现,MTHFD2的高表达可作为COPD的预后指标。本研究通过对GEO数据库COPD相关的数据集分析发现,MTHFD2在COPD患者中呈显著上调表达。体外实验的结果也证实了这一现象,即MTHFD2的表达程度与COPD的严重程度有关。
中性粒细胞是免疫防御的第一道防线[25],在炎症反应中起着至关重要的作用[19]。研究表明COPD患者病情的加重与NEU及其NET的活化关联甚密[8-9]。NEU是一种特殊的白细胞,是机体先天免疫系统的关键组成部分[26],NET是中性粒细胞响应免疫反应的产物,具有杀菌的作用[10,27]。当NEU被活化时,会释放颗粒蛋白和染色质,在细胞外与胞外纤维结合形成网状结构的NET[8,10-11]。其中的组蛋白H1、中性粒细胞弹性蛋白酶NE、髓过氧化物酶MPO和DNA是组成NET的重要成分,也是表征NET形成水平的重要指标[11,28]。研究发现NET中的NE可以降解毒力因子并杀死细菌,NET中的组蛋白也被证明是最有效的抗菌剂[27,29]。Alison J.Dicker的研究表明,NET标志物(cfDNA、DNA-弹性蛋白、组蛋白弹性蛋白等)与COPD严重指数(预测FEV百分比和CAT评分)之间具有显著的相关关系;此外研究发现与稳定型COPD患者相比,加重型COPD患者痰液和血清中NET浓度显著高于稳定COPD痰液和血清中NET浓度,这表明NET的形成与COPD患者疾病的严重程度有关[8,9,12]。本研究中,通过测定两组受试者痰液中的MPO、cit-H3和DNA含量以及MTH-FD2的基因表达量,结果发现COPD患者痰液中性粒细胞中这些物质的含量以及MTHFD2的基因表达量均显著高于健康对照组;相关性分析的结果显示,MTHFD2与中性粒细胞标志物的表达呈显著正相关。这些表明COPD患者中有较多的NET形成,且与MTHFD2的表达有关。
糖酵解是低氧条件下细胞内葡萄糖代谢的关键途径,为能量的产生提供中间体[30]。有研究认为,肿瘤细胞即使在有氧的情况下也倾向于优先进行糖酵解[31]。COPD导致呼吸功能下降,进而可能导致缺氧[2],本研究通过生物信息学分析和转基因实验研究发现,糖酵解代谢水平可以显著影响COPD中NET的形成。过往研究发现表明,当炎症发生时,机体可以通过激活糖酵解代谢,促进葡萄糖分解成乳酸为中性粒细胞的吞噬活动、活性氧的产生、中性粒细胞胞外陷阱的形成提供能量[32]。Wang等[33]研究发现,抑制COPD患病小鼠中的糖酵解代谢,可以抑制炎症因子的产生,进而提高COPD患者的存活率。Pranvera等[32]研究发现,NEU可以通过糖酵解和糖异生促进有效的免疫反应。糖酵解也是健康NEU中NET形成所必须的。微管排列的重组以及由此产生的NET已被证明依赖于糖酵解释放的ATP;同时,糖酵解抑制剂2-脱氧-d-葡萄糖(2-DG)可以通过抑制糖酵解和PPP来阻断NET的形成[34]。有研究发现,使用糖酵解抑制剂(2-DG)抑制糖酵解,可以防止慢加急性肝衰竭(ACLF)患者中NET的过度生成[35]。此外,还有研究发现MTHFD2与糖酵解具有协同表达效果,表现为高MTHFD2促进高糖酵解[13],这与本研究结果一致。本研究结果表明,MTHFD2可以促进糖酵解代谢,进而诱导COPD中NET的形成。
4 结论
MTHFD2可以通过诱导糖酵解促进COPD的中性粒细胞胞外陷阱的形成。这为使用MTHFD2作为COPD治疗的潜在药物靶点提供了理论基础。当然,缺乏体内验证MTHFD2诱导糖酵解信号调控NET形成的数据是本研究的主要局限性。在未来应进一步确定MTHFD2在COPD患者中的作用。

