贵州腌鱼微生物多样性和益生特性分析
李思雨,杜贺超,包佳亮,姚宏亮,蒋加进
(金陵科技学院动物科学与食品工程学院,江苏南京 210038)
腌鱼是贵州省黔东南苗族侗族自治州的传统发酵食品。为了延长食物的食用期限、赋予食物特有风味,常采用自然发酵的方式加工鱼肉制品,形成了具有当地特色的“腌食文化”[1]。贵州腌鱼风味独特、味道鲜美、易于贮藏,这些特点与发酵食品中微生物多样性具有一定关系。
高通量测序技术(High-throughput sequencing,HTS) 是目前研究微生物多样性最有效的方法。不仅能全面分析一个物种的基因组,还能处理大规模样品。与传统的平板分离纯化、基因指纹图谱技术(如变性梯度凝胶电泳DGGE 和温度梯度凝胶电泳TGGE) 相比,高通量测序具有高灵敏度和高效性,广泛应用于在微生物多样性的研究中[2]。张双虹等人[3]的高通量测序结果显示袋装番茄酱中主要由乳杆菌属、伯克式菌属等菌属起作用。高通量测序在腌制大头菜、发酵大豆、腊肉、奶豆腐、甜面酱[4-7]等传统发酵食品的研究中均有应用。此外,高通量测序技术也是研究发酵剂对风味物质影响和探究发酵过程中理化性质变化规律的有效方法。例如,通过高通量测序对四川泡菜母水进行研究,李恒等人[8]发现微生物与pH 值具有紧密的相关性;单玉鑫等人[9]在酸鱼的研究中发现不同菌属赋予酸鱼不同的风味物质。
益生菌进入人体,需要经过胃液的低pH 值和胆囊中胆汁的胁迫。因此,耐酸耐胆盐能力对其达到肠道定植发挥益生作用具有重要意义。该研究基于Illumina MiSeq 第二代高通量测序平台,进行16S rRNA 序列测序,分析贵州腌鱼中的细菌多样性,在此基础上对腌鱼中的优势细菌进行分离,对其耐酸耐胆盐等益生特性进行评价,为贵州腌鱼微生物资源的利用奠定基础。
1 材料与方法
1.1 材料与仪器
3 份腌鱼样品,购自贵州省凯里市;DNA 凝胶回收试剂盒,AXYGEN 公司提供;琼脂糖、PBS 磷酸盐,北京索莱宝公司提供;MRS 肉汤,青岛海博生物有限公司提供;猪胆盐、胃蛋白酶(1∶3000),上海源叶生物技术有限公司提供;革兰氏染色试剂盒,温州市康泰生物科技有限公司提供。
生化培养箱,上海新苗医疗器械有限公司产品;立式压力蒸汽灭菌器,上海博讯实业有限公司产品;PCR 仪,美国ABI 公司产品;DYY-6C 型电泳仪,北京六一仪器厂产品;Illumina Miseq 测序仪,美国Illumina 公司产品;高速冷冻离心机,德国Eppendorf 公司产品。
1.2 高通量测序方法
1.2.1 DNA 提取和PCR 扩增
按照细菌基因组DNA 抽提试剂盒提取3 个样品的DNA,并经琼脂糖凝胶电泳检测DNA 的完整性。采用V3-V4 区引物338F(5'-ACTCCTACGGGAG GCAGCA-3'),806R(5'-ACTCCTACGGAGGCAGCA-3')进行16S rRNA 序列扩增。扩增程序如下:预变性95 ℃3 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,35 个循环;72 ℃持续延伸10 min。采用QuantiFluorTM-ST 蓝色荧光定量系统对PCR 产物电泳结果进行定量。提取到的DNA 样品送至上海美吉生物医药科技有限公司进行Miseq 测序。
1.2.2 高通量测序
按照参考文献[10]中的方法,采用TruSeqTM DNA Sample Prep Kit 建库试剂盒构建Miseq 文库:通过PCR 在靶区域外端添加接头序列,然后切胶回收产物,经NaOH 变性后产生DNA 单链片段。随后在Illumina MiSeq 平台进行上机测序。
1.2.3 数据处理和分析
利用FLASH 和Trimmomatic 软件对序列进行优化,提取非重复序列并且对重复单序列进行剔除。使用USEARCH 软件按照97%相似性对非重复序列进行操作分类单元(Operational taxonomic units,OUT) 聚类并筛出嵌合体,在此条件下使用RDP classifier 贝叶斯算法获取OTU 对应的物种分类信息,并统计各分类学水平(如门、属等) 下的样品群落组成情况。
选择97%相似度的OTU,利用Mothur 计算不同随机抽样下的多样性指数,利用R 语言工具制作曲线图和群落柱形图。利用Vegan 包,绘制群落Heatmap 图[11]。通过Qiime 平台,以Ace、Chao、Bergerparker、Coverage 指数等进行Alpha 多样性分析[12]。利用SPSS 16.0 进行统计分析。
1.3 益生特性分析方法
1.3.1 乳酸菌的分离
取25 g 腌鱼样品,剪碎后加入含有225 mL 灭菌PBS 的锥形瓶中,振荡培养30 min,使细菌均匀分散于液体。取1 mL 液体倍比稀释,分别取200 μL 均匀涂布于MRS 平板,于37 ℃下静置培养48 h。挑取乳白色单菌落,接种到MRS 液体培养。
1.3.2 耐胆盐能力测定
活化的菌株按2.0%的接种量,分别接种于胆盐质量分数为0,0.2%,0.3%的MRS 培养液,于37 ℃下静置培养4 h。于0 h 和4 h 分别取样,测定每株菌种的OD600nm值,按公式(1) 计算菌株生长率,用MRS 液体培养基调零,每组3 次平行。
式中:C——生长率,%;
A0——不含胆盐MRS 培养基中0 h 的OD600nm值;
A1——不含胆盐MRS 培养基中4 h 的OD600nm值;
A2——含胆盐MRS 培养基中0 h 的OD600nm值;
A3——含胆盐MRS 培养基中4 h 的OD600nm值。
1.3.3 耐胃酸能力测定
(1) 菌悬液的制备。取0.2 mL 活化后的菌液接种至10 mL MRS 液体培养基中,于37 ℃条件下培养24 h,以转速8 000 r/min 离心15 min,弃上清液,收集菌体,用无菌PBS 缓冲溶液洗涤后重悬,重复2 次,加入10 mL 无菌PBS 缓冲溶液混匀制成菌悬液,需现做现用。
(2) 人工胃液的制备。参考熊涛等人[13]的方法制备人工胃液。取稀盐酸1.64 mL(23.4 mL 浓盐酸,加水稀释至100 mL,得9.5%~10.5%稀盐酸) 加入超纯水稀释至100 mL,121 ℃下灭菌15 min,待温度冷却至50 ℃以下,加入1.0 g 胃蛋白酶混匀,用1 mol/L NaOH 调节pH 值至3.0。
(3) 菌株耐酸性测定。参考陈仪婷等人[14]的方法测定菌株的耐酸性。将菌悬液与人工胃液按1∶9(V∶V) 的比例混合,于37 ℃条件下恒温培养3 h,于0 h 和3 h 分别取样,采用平板涂布计数法测定0,3 h 的活菌数,按照公式(2) 计算菌株存活率,每组3 次平行。
式中:C——存活率,%;
m1——3 h 活菌数,CFU/mL;
m2——0 h 活菌数,CFU/mL。
1.3.4 菌株的鉴定
挑取单菌落进行革兰氏染色和镜检,并根据以下方法进行分子生物学鉴定。
(1) 反应体系。2×Taq Master Mix(Dye Plus)12.5 μL;引物(27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R;5'-GGTTACCTTGTTACGACTT-3')各1 μL;模板DNA 1 μL;超纯水9.5 μL。
(2) PCR 条件。95 ℃预变性10 min,95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸90 s,30 个循环;72 ℃延伸5 min。PCR 产物送去苏州金唯智生物科技有限公司进行测序。将测序结果在GenBank 中进行BLAST 比对。
2 结果与分析
2.1 样品数据统计
3 份腌鱼样品分别标记为Y1,Y2 和Y3。利用Illumina Miseq 高通量测序方法测得的腌鱼样品原始序列数与碱基长度。测序的3 份样品的有效序列为98 695 条,长度区间范围主要集中于421~460 bp,平均长度为450 bp,符合测序目标序列(V3-V4 可变区) 特征。比对后共获得92 个OUTs,说明贵州腌鱼中细菌种类丰富。
样品信息记录表见表1。
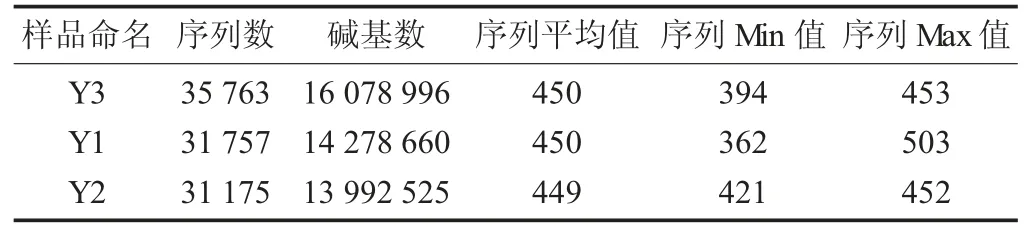
表1 样品信息记录表
2.2 Alpha 多样性分析
Alpha 多样性(单样品的多样性) 可以用来分析腌鱼样品中微生物群落的丰度和多样性,常用的统计学分析指数有丰富度指数(Ace 指数、Chao 指数)和群落多样性指数(Coverage 指数) 等。
3 份腌鱼样品的Alpha 多样性指数见表2。
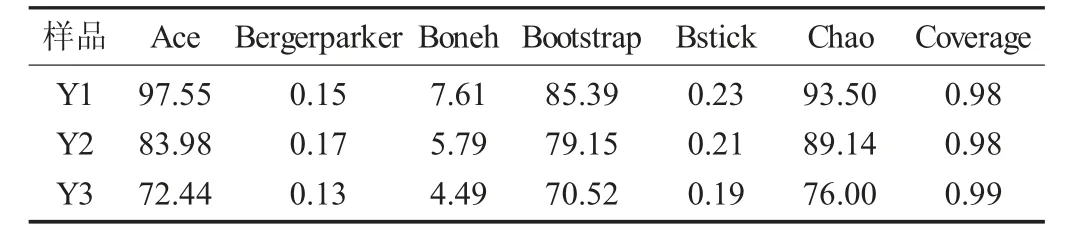
表2 3 份腌鱼样品的Alpha 多样性指数
由表2 可知,3 份样品的Coverage 指数均在98%以上,说明测序覆盖了腌鱼样品的绝大部分物种类别,准确率较高。样品Y1 的Chao 指数和Ace 指数高于Y2、Y3,说明Y1 中物种相对丰富。这也表明,不同的制作店家,腌鱼中微生物的多样性有一定的差别,筛选某些特定性能的微生物时需要覆盖较大的样品量。
2.3 稀释曲线分析
稀释曲线也叫Shannon 曲线,是以随机抽取的数据量(Reads) 为横坐标,OUT 水平的Shannon 指数为纵坐标,构建的曲线。Shannon 指数曲线趋向平坦时,说明测序数据量足够大,可以反映样本中绝大多数的微生物多样性信息。
腌鱼样品稀释曲线图见图1。

图1 腌鱼样品稀释曲线图
由图1 可知,3 个腌鱼样品的稀释曲线逐渐趋向平坦,说明测序数据呈饱和状态,测序结果涵盖了腌鱼样品中的绝大多数微生物,样品已经包含足够多的微生物多样性信息。测序数据量合理,测序深度可靠,可用于后续生物信息学分析。
2.4 菌群多样性分析
基于有效序列的聚类结果,利用可视化的群落直方图进行群落组成分析,可以清晰地看出样品在不同分类水平上的菌落组成情况。
2.4.1 门水平群落结构分析
门水平群落图见图2。
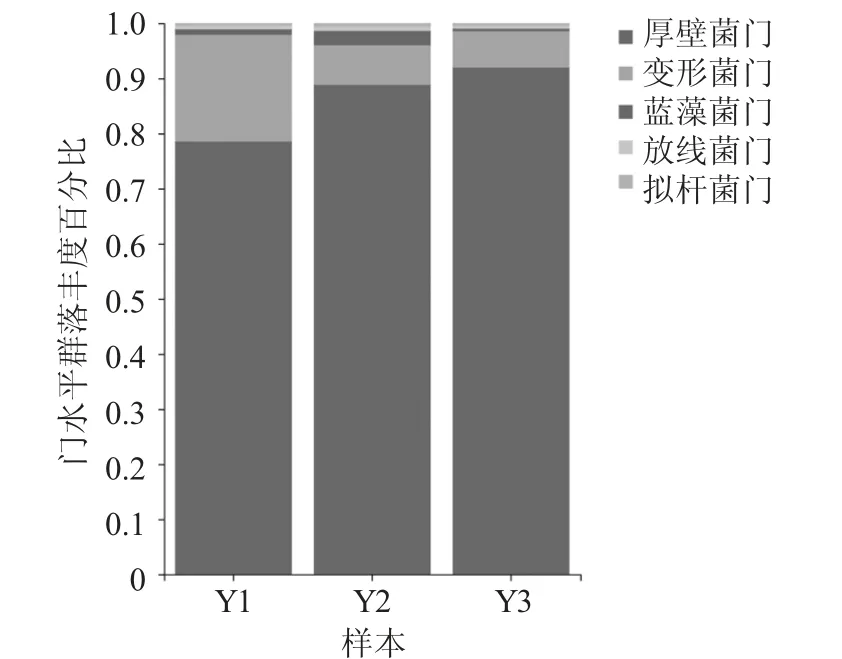
图2 门水平群落图
3 份腌鱼均含有五大类门水平细菌,其中厚壁菌门(Firmicutes) 为绝对优势菌门,Y1、Y2、Y3 3 份腌鱼样品中厚壁菌门占比分别为78.52%,88.84%,91.95%。变形菌门(Proteobacteria),Y1、Y2、Y3这3 份腌鱼样品占比分别为19.36%,7.15%,6.56%。此外,还有蓝藻菌门(Cyanobacteria)、放线菌门(Actinobacteria) 和拟杆菌门(Bacteroidetes)。3 份样品中,Y2 和Y3 菌落组成的相似度较高,Y1 中变形菌门含量高于Y2 和Y3,而厚壁菌门含量略低于Y2和Y3。
厚壁菌门在腌鱼样品中具有较高的丰度,可能是厚壁菌门中的乳酸菌能够在高酸和厌氧环境中生存,同时在发酵过程中抑制其他细菌的生长,含量较高。变形菌门通常构成鱼本身的微生物菌落,多属于好氧菌,但在缺氧、产酸、产醇的腌鱼发酵环境中难以生存。因此,发酵后存在一定比例,但丰度受到限制[15]。此外,腌鱼发酵原料中的植物叶绿体可能是少量蓝藻菌门细菌产生的原因。
2.4.2 属水平群落结构分析
属水平群落图见图3。
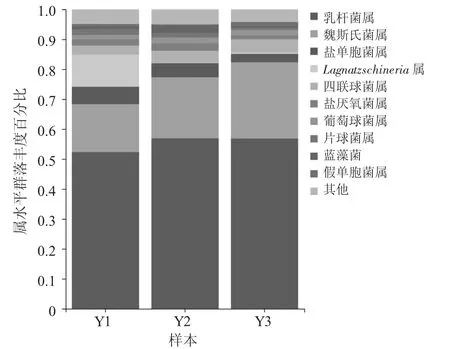
图3 属水平群落图
由图3 可知,挑选3 份腌鱼样品中排名前10 位的优势菌属进行分析比较。
由图3 可知,乳杆菌属(Lactobacillus) 是3 份腌鱼样品共同的优势菌属,占比均在50%以上,Y1,Y2,Y3 分别为52.35%,56.93%,56.87%。魏斯氏菌属(Weissella),Y1,Y2,Y3 占比分别为15.98%,20.37%,25.47%。此外,还有盐单胞菌属(Halomonas)、Ignatzschineria 属、四联球菌属(Tetragenococcus)、盐厌氧菌属(Halanaerobium)、葡萄球菌属(Staphylococcus)、片球菌属(Pediococcus)、蓝藻菌(Cyanobacteria)、假单胞菌属(Pseudomonas) 等。3 份腌鱼样品中,乳杆菌均为绝对优势菌,魏斯氏菌属也占有一定比例,说明乳酸菌在传统发酵腌鱼食品的制作和贮藏中发挥关键作用。Y1 与Y2,Y3 相比,Ignatzschineria 属含量较高,可能是鱼体来源不同,本身所含细菌有差异导致,也是Y1 中变形菌门含量较高的原因。
2.4.3 群落热图分析
群落热图(Heatmap 图) 能够呈现出高丰度和低丰度的物种聚类,并通过颜色变化和相似性来反映不同样品在各分类水平上群落组成的异同点。
样品群落Heatmap 图见图4。

图4 样品群落Heatmap 图
由图4 可知,3 份样品中,Y2 与Y3 聚类在一个分支,说明两者菌落组成相似性较高,与Y1 相似性较远。红色的厚壁菌门占有较高比例,结合属水平和门水平的群落结构分析,3 份样品的优势菌均为厚壁菌门乳杆菌属。
2.4.4 耐胆盐能力分析
挑选腌鱼样品中分离的11 株乳酸菌,测定其在0.2%,0.3%胆盐中的生长率,从而评估菌株对胆盐的耐受能力。
乳酸菌在不同胆盐质量浓度中的生长率见表3。
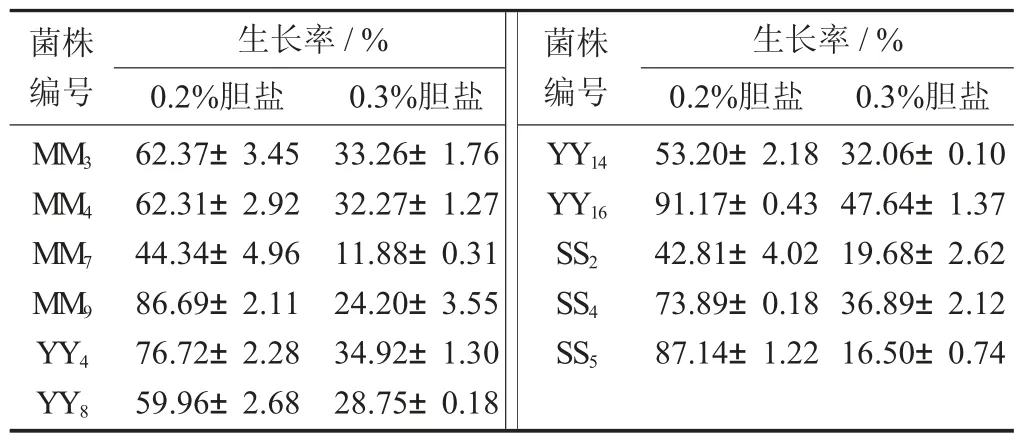
表3 乳酸菌在不同胆盐质量浓度中的生长率
由表3 可知,在0.2%胆盐培养基中,除MM7和SS2外,其余9 株菌的生长率均在50%以上。其中,YY16,SS5,MM9 的生长率最高,分别为91.17%,87.14%,86.69%。MRS 培养基中胆盐浓度增加到0.3%时,11 株菌的生长显著下降(p<0.05),生长率集中在20%~40%。此时生长率最高的为YY16,在0.3%胆盐浓度MRS 培养基中胁迫4 h 仍能达到47.64%。由此可见,11 株乳酸菌中,胆盐耐受性最好的是YY16。研究表明,乳酸菌在胆盐存在环境中可以分泌胆盐水解酶(Bile salt hydrolase,BSH),将结合型胆盐分解为胆酸和游离氨基酸,从而降低胆盐对自身的危害[16]。
2.4.5 耐胃酸能力分析
人体胃酸的主要成分是盐酸,进食后pH 值可达3.0~5.0,消化时间为2~4 h。因此,配置pH 值为3.0 的人工胃液,将作用3 h 后的菌种存活率作为耐受胃液评价的依据。
乳酸菌在人工胃液中的耐受性评价见表4。
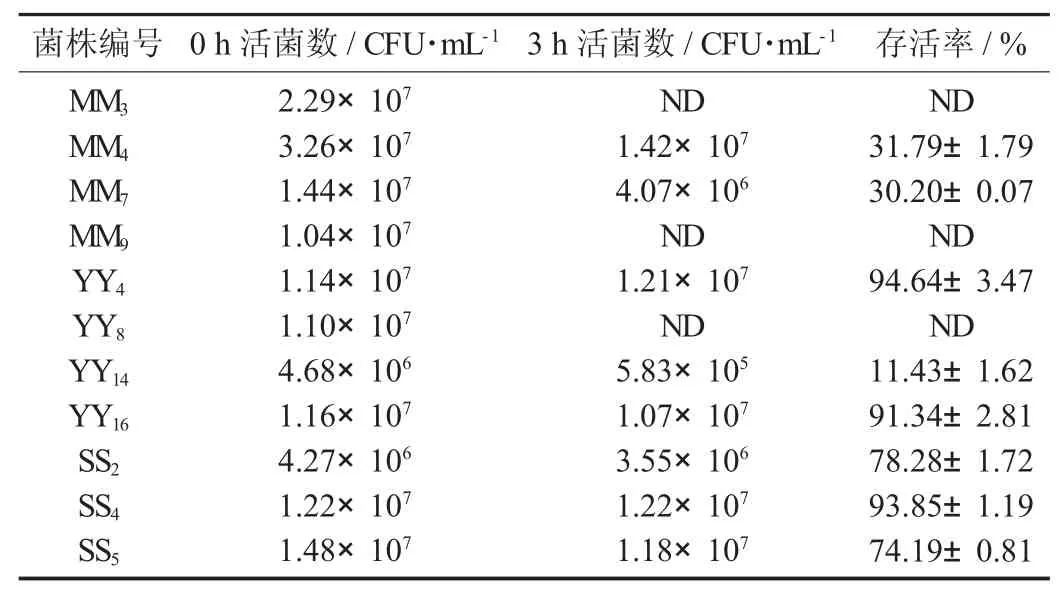
表4 乳酸菌在人工胃液中的耐受性评价
在人工胃液中培养3 h 后,菌株YY4、SS4、YY16的存活率在90%以上,分别为94.64%,93.85%,91.34%,同时这几株菌的活菌数都保持在107CFU/mL以上。说明这3 株菌具有较强的耐酸性。结合耐胆盐结果,表明YY16具有较好的益生特性。
2.4.6 菌种鉴定
菌株YY16 的菌落形态(a)、菌体形态(b) 和PCR 电泳条带(c) 见图5。
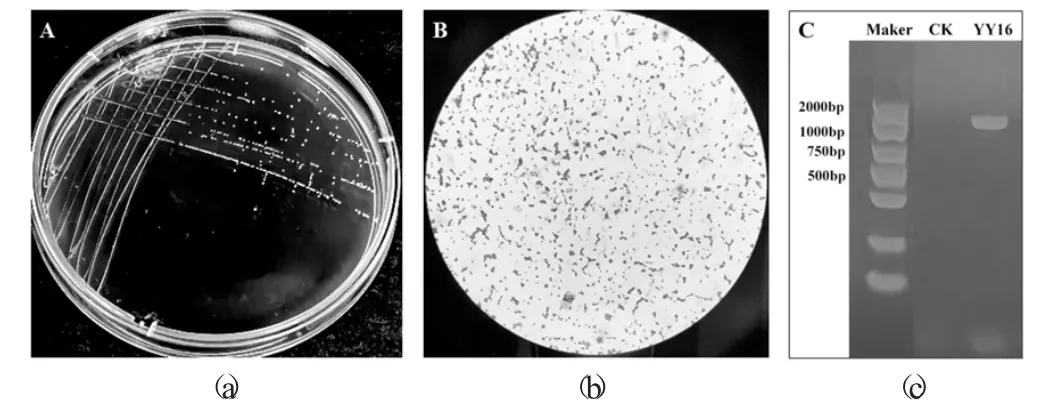
图5 菌株YY16 的菌落形态(a)、菌体形态(b) 和PCR 电泳条带(c)
菌株YY16在MRS 固体培养基中的菌落呈圆形,白色,表面光滑湿润,边缘整齐,符合乳酸菌菌落形态特征(见图5(a))。革兰氏染色后,镜检曾蓝紫色短杆状(见图5(b)),为革兰氏阳性杆菌。16S rRNA 片段PCR 扩增产物经1%的琼脂糖凝胶电泳检测(见图5(c)),特异性条带在1 400 bp 左右,说明扩增成功。测序后,在美国国家生物信息技术中心(NCBI) GenBank 中进行BLAST 比对,YY16与植物乳杆菌Lactiplantibacillus plantarum strain 2383 的覆盖率为98%,同源性为99.8%。结合形态学鉴定和分子生物学鉴定,判定菌株YY16是植物乳杆菌。
3 结论
微生物的生长代谢在贵州腌鱼发酵、贮藏等过程中发挥重要作用。基于Illumina Miseq 高通量测序结果,Y2 与Y3 的菌落组成相似性较高,与Y1 略有差异。说明加工方式的不同、原材料来源的不同,都会对发酵过程中的菌落结构产生影响,进而影响发酵产品的品质。微生物多样性在一定程度上影响食品的贮存期限和风味。研究微生物的多样性及微生物的菌群结构特征,不仅能为微生物资源的挖掘提供依据,还能指导发酵工艺的优化。
3 份腌鱼样品中的优势菌均为厚壁菌门的乳酸菌,主要包括乳杆菌和魏斯氏菌。乳杆菌具有抑制杂菌生长、延长食品保存期、改善食品风味等作用。乳杆菌能在高酸环境中存活,并能够通过分解糖类物质使之生成最终产物乳酸等有机酸,使得环境pH值降低、酸度升高,同时还能产生过氧化氢、乙醇氧化物、细菌素等多种具有抑菌作用的产物,降低了一些杂菌的生长,从而延长食品的保质期。此外,随着酸度的升高,也会产生醛、酮等物质,丰富发酵食品的风味[17]。单玉鑫等人[9]发现乳杆菌对于酸鱼中的鲜味物质释放起到了一定的作用,大大增加了酸鱼的食用口感。陆洲[18]研究发现植物乳杆菌D1501发酵黄浆水具有抑菌活性,并能将干丝保鲜期延长到5 d。魏斯氏菌也是一类乳酸菌,作用与乳杆菌类似,是很好的食品发酵剂,能够提升腌鱼的风味和口感。魏斯氏菌存在于泡菜、腐乳、酒曲等传统发酵食品中。接种魏斯氏菌和植物乳杆菌复合菌种能缩短麻竹笋泡菜发酵周期,提高食用安全性,改善口感[19]。
乳酸菌的最低活菌数目为106CFU/mL[20]才能发挥益生作用,试验中植物乳杆菌YY16 在0.2%,0.3%胆盐中的生长率分别为91.17%和47.64%,在人工胃液中培养3 h 后,存活率为91.34%,可承受胆盐和胃酸的胁迫。与熊涛等人[20]研究的副干酪乳杆菌在pH 值为2.5 的环境中作用3 h 存活率仍高达98.21%,且活菌数在107CFU/mL 以上的结果相一致,说明植物乳杆菌YY16具有较强的耐酸耐胆盐能力,具有在功能食品开发中的应用潜力。

