基于网络药理学和分子对接技术探讨苍膝通痹胶囊治疗骨关节炎的作用机制
张正则,马吉智,孙 然,孟 凯
1 山东中医药大学,山东 济南 250000; 2 山东中医药大学附属医院创伤骨科,山东 济南 250000
骨关节炎(osteoarthritis,OA)是以关节软骨退行性病变和继发性骨质增生为特征的慢性关节疾病,其临床表现主要为关节僵硬、疼痛、无力、畸形、肿胀等[1]。OA是常见的慢性关节疾病,近年来发病率持续升高,已成为影响人类生活质量的重要问题[2]。OA与年龄密切相关,全球约2.4亿人患病,且在过去数十年中其发病率总体呈增长态势[3]。
OA 属中医“痹证”“骨痹”等范畴,其病机是以肝肾亏虚为本,风寒湿邪痹阻经络为标,形成本虚标实,虚实夹杂的证候[4]。中医治疗OA 以补益肝肾、舒筋活络、温补肾阳、祛风除湿为主,具有独特的优势。山东中医药大学附属医院院内制剂苍膝通痹胶囊(原名关节止痛胶囊,鲁药制字Z20130043),主要由独活、威灵仙、苍术、萆薢、鸡血藤、桑寄生、川牛膝、骨碎补、续断9 味药物组成。苍膝通痹胶囊在治疗OA,特别是在保护关节软骨方面具有一定疗效[5-6]。但苍膝通痹胶囊中成分多,涉及靶点通路复杂,其药理机制尚不明确。
网络药理学具有系统性、整体性特点,注重药物间的相互作用,这与中医学整体观、辨证论治观念不谋而合[7]。本研究运用网络药理学方法筛选苍膝通痹胶囊的活性成分及作用靶点,并进行网络分析,构建药物-活性成分-疾病靶点网络,通过数据库进行信号通路分析,进一步预测其治疗OA的作用机制。
1 研究方法
1.1 数据库、软件及分析平台生物信息学和数据挖掘技术使用数据库、软件及分析平台,见表1。

表1 数据库、软件及分析平台
1.2 苍膝通痹胶囊活性成分及其作用靶点筛选运用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)获取苍膝通痹胶囊中各中药的活性成分,依据中药成分ADME 信息(吸收、分布、代谢及排泄)筛选有效活性成分,口服生物利用度(oral bioavailability,OB)≥30% 和 类 药 性(drug-likeness,DL)≥0.18[8]。通过TCMSP 数据库查询活性成分对应的靶点蛋白,利用Unitprot 数据库,选择物种为“人类”(Homo sapiens),剔除重复、非人源与不规范靶点,将靶点蛋白名转换为靶点基因名。
1.3 苍膝通痹胶囊治疗OA 的靶点预测利用Drugbank、GeneCards、TTD 及CTD 数据库,以“osteoarthritis”为关键词,检索OA 的相关治疗靶点,将所有筛选结果合并去重后得到OA 的相关靶点信息。使用Unitprot 进行基因名标准化。运用Venny 平台将苍膝通痹胶囊的活性成分调控靶点与OA 治疗靶点取交集,得到苍膝通痹胶囊治疗OA的靶点。
1.4 中药-成分-靶点-疾病网络构建运用Cytoscape 3.7.2 软件中Network Analyzer 插件进行拓扑学分析,计算节点度值(degree)、介度中心性(betweenness centrality,BC)和紧密中心性(closeness centrality,CC),设置阈值为BC值中位数和CC值中位数,按degree值大小排序筛选满足上述参数的活性成分作为苍膝通痹胶囊治疗OA的关键活性成分。
1.5 蛋白质相互作用关系构建将苍膝通痹胶囊治疗OA的潜在作用靶点导入STRING数据库,设置物种为“Homo sapines”,靶点蛋白置信度>0.4,获得蛋白-蛋白互作网络(protein-protein interactions,PPI)。在Cytoscape 3.7.2 软件中构建靶点蛋白PPI 网络。使用Cytoscape 3.7.2中的CytoHubba 工具进行拓扑分析,筛选出关键靶点,作为苍膝通痹胶囊治疗OA的核心靶点。
1.6 GO富集分析与KEGG富集分析将交集靶点导入DAVID 数据库。运用DAVID 数据库进行基因本体论(gene ontology,GO)富集分析,包括生物过程(biological process,BP)、细胞组分(cellular component,CC)、分 子 功 能(molecular function,MF);京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)富集分析。设置阈值P<0.05,排除非特异性GO 功能以及KEGG 通路,按P值大小以及核心靶点筛选与OA 关联度较大的条目,将分析结果可视化。应用Cytoscape 3.7.2 软件构建活性成分-靶点-通路网络。
1.7 分子对接按照Degree 值排序筛选出排名前5的活性成分,将其与PPI网络筛选出的核心靶点进行分子对接验证。从RCSBPDB 数据库获取靶点的晶体结构文件,从Pubchem 数据库获取活性成分的结构文件,利用AutoDock vina 软件计算靶点与活性成分之间的最低结合能并将分子对接验证结果可视化。
2 结果
2.1 活性成分及潜在作用靶点通过TCMSP 数据库,共筛选得到86个活性成分,包括独活11个,骨碎补18 个,桑寄生2 个,威灵仙8 个,萆薢2 个,鸡血藤24个,苍术9个,续断8个,川牛膝4个。其中威灵仙、独活、鸡血藤、川牛膝、骨碎补、续断交集活性成分1 个,威灵仙、鸡血藤、骨碎补交集活性成分1个,鸡血藤、骨碎补交集活性成分2个,川牛膝、桑寄生交集活性成分1 个,桑寄生、续断交集活性成分1 个。删除重复数据后剩余活性成分75 个,由于筛选结果过多,仅列出共有活性成分及每味药OB值前5的活性成分。见表2。

表2 苍膝通痹胶囊活性成分信息
通过TCMSP数据库对75个活性成分进行进一步预测,初步获得个1187 靶点,将相同靶点归一,结合Uniprot数据库确认并转换,最终得到140个苍膝通痹胶囊药效靶点。
2.2 苍膝通痹胶囊治疗OA靶点预测共得到OA相关靶点469 个。运用Venny 平台将苍膝通痹胶囊药效靶点与OA的治疗靶点取交集,得到52个苍膝通痹胶囊治疗OA的靶点。见图1。
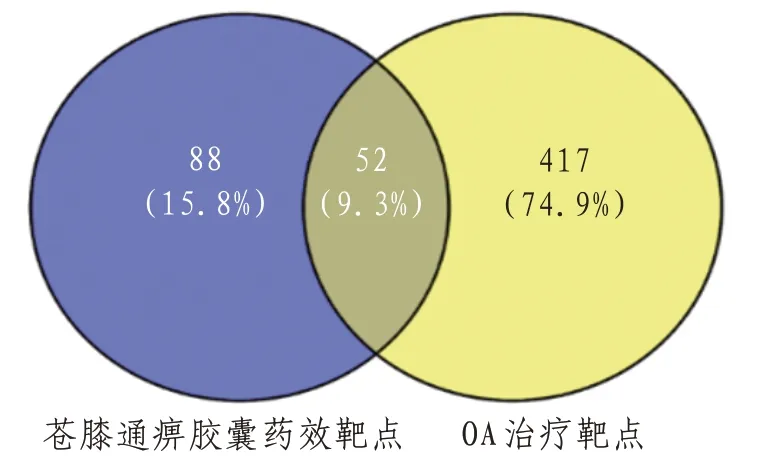
图1 活性成分靶点与疾病靶点Venn图
2.3 药物-成分-靶点-疾病网络构建及拓扑分析利用Cytoscape 3.7.2 构建苍膝通痹胶囊的药物-成分-靶点-疾病网络。以不同颜色或形状表示,粉色圆形节点代表药物,蓝色六边形节点代表疾病,绿色三角形节点代表成分,紫色圆形节点代表靶点。该网络共含有122个节点和639条边,涉及60 种活性成分和52 个潜在靶点。其同一成分对应多个靶点和多个成分对应同一靶点的关系,体现了苍膝通痹胶囊多成分、多靶点治疗OA的作用特点。见图2。
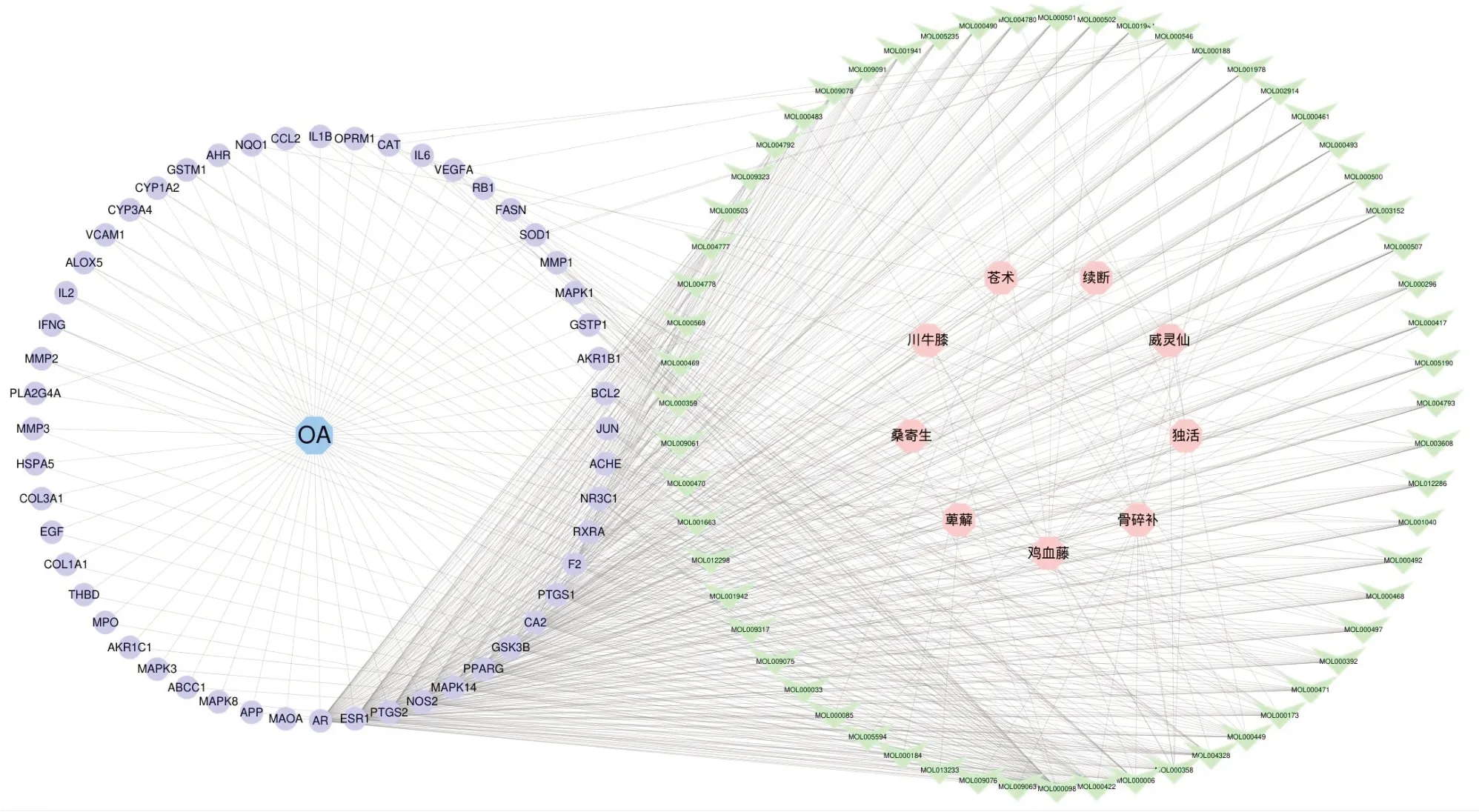
图2 药物-成分-靶点-疾病网络图
根据网络拓扑值进行关键活性成分确定,Network Analyzer 计算结果显示degree 中位数倍 值 为6,BC 中 位 数 为0.0145,CC 中 位 数 为0.411569,筛选同时符合BC中位数以上及CC中位数以上的靶点,按Degree 值排序选取前5 名作为苍膝通痹胶囊治疗OA的关键活性成分。见表3。

表3 关键活性成分信息
2.4 PPl 网络构建及拓扑分析将获得的52 个交集靶点上传STRING 数据库,构建PPI 网络。图中节点表示蛋白,边表示功能相关性,共涉及52个节点,509 条边,平均节点数为19.6,平均局部聚类系数为0.679。见图3。

图3 PPI网络
使用CytoHubba 工具进行拓扑分析,筛选出10 个关键蛋白基因,分别是IL-1B、IL-6、VEGFA、MAPK1、MAPK3、MAPK8、MAPK14、JUN、CCL2、PTGS2。这10 个蛋白基因在整个网络中起关键作用,这些基因对应的靶点可能是苍膝通痹胶囊治疗OA 的关键靶点。见图4。

图4 PPI网络关键节点
2.5 GO 和KEGG 富集结果GO 分析共得到190 个生物进程、32个细胞组分、39个分子功能;KEGG分析得到78 条信号通路。排除非特异性条目,按P值排序以及核心靶点筛选与OA 关联度较大的条目,绘制气泡图。Y 轴代表名称,X 轴代表所占百分比,气泡面积代表富集基因数。其中,生物过程主要是氧化还原过程、衰老、转录的正调控、骨化调节、凋亡、对机械刺激的反应、细胞增殖的正调控等。细胞组分主要是细胞质、线粒体、高尔基体、细胞外区域、胞质溶胶、外泌体等。分子功能主要是蛋白结合、酶结合、受体结合、转录调节区DNA 结合、细胞因子活性、转录因子结合、类固醇激素受体活性、类固醇结合、蛋白质同源二聚活性等。KEGG 富集通路分别是MAPK 信号通路、PI3KAkt信号通路、TNF信号通路、HIF-1信号通路、NOD样受体信号通路、FoxO 信号通路、NF-κB 信号通路等。富集结果表明,苍膝通痹胶囊可能通过上述功能及信号通路发挥治疗作用。根据PPI 筛选得到的10 个关键靶点与KEGG 通路的关系,利用Cytoscape 3.7.2 软件,构建中药-成分-靶点-通路网络。见图5—6。
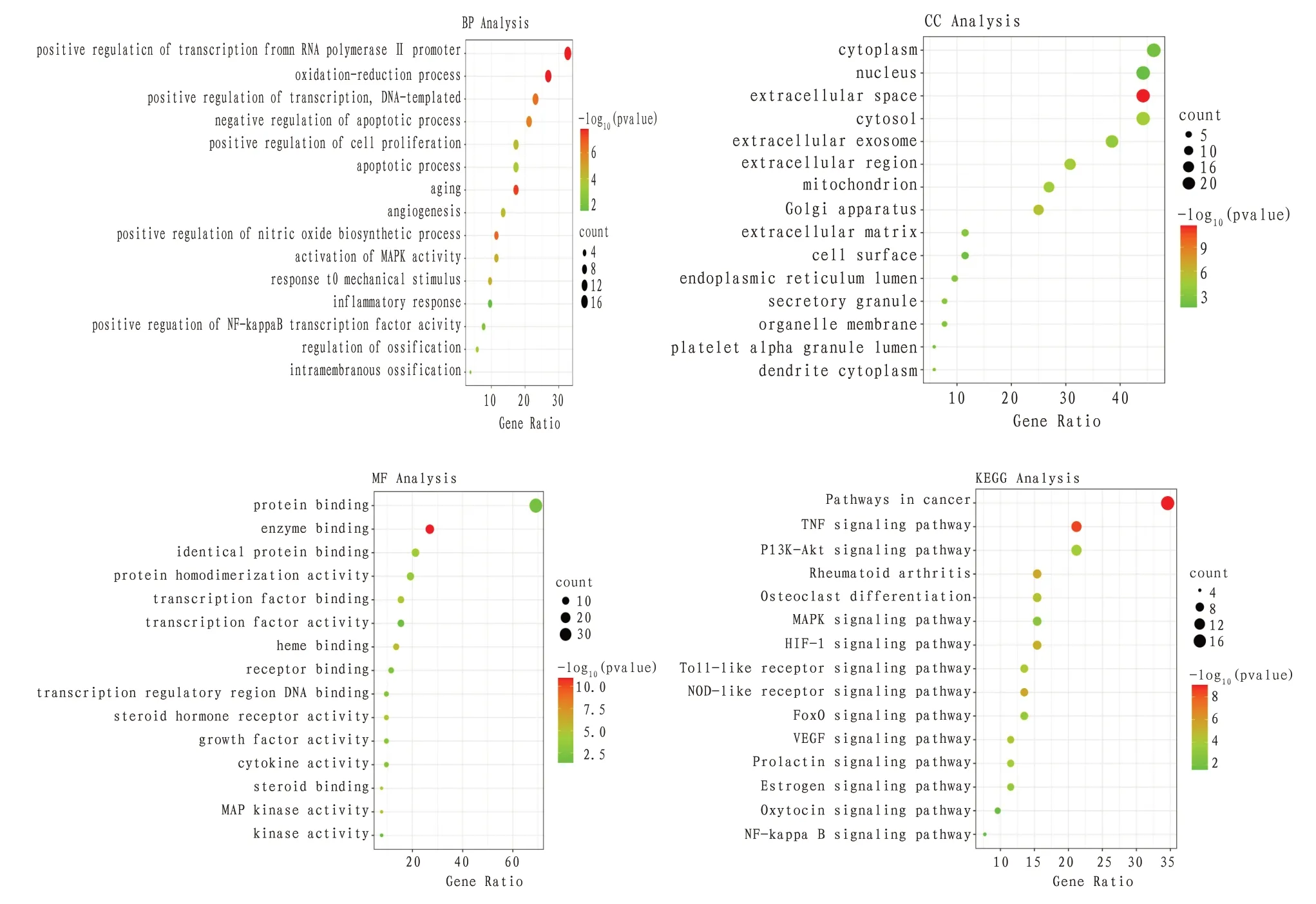
图5 GO和KEGG富集分析气泡图

图6 药物-成分-靶点-通路网络
2.6 分子对接验证结果按照Degree 值排序筛选出排名前5 的活性成分为槲皮素、山柰酚、木犀草素、β-谷甾醇、柚皮素。将其与核心靶点IL-1β、IL-6、VEGFA、MAPK1、MAPK3、MAPK8、MAPK14、JUN、CCL2、PTGS2 进行分子对接验证,靶点信息见表4。利用Auto vina软件计算靶点与活性成分之间的最低结合能,分值≤-5 表示具有潜在活性,分值≤-7表示具有较强稳定性,并将分子对接验证结果可视化。结果表明主要活性成分和核心靶点在分子对接过程中均进入了活性位点,这表示两者具有较强的结合能力。见图7—8。
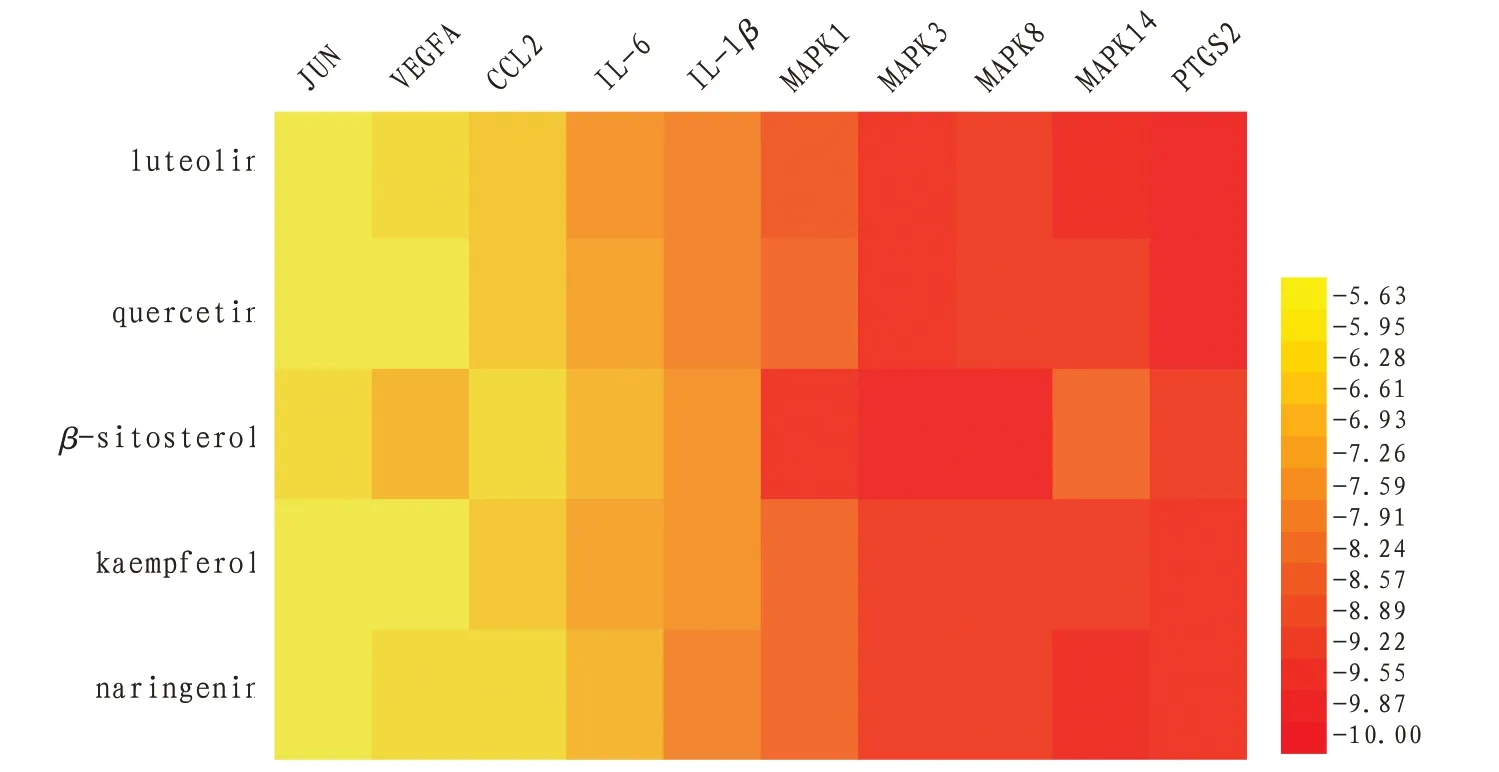
图7 分子对接热图
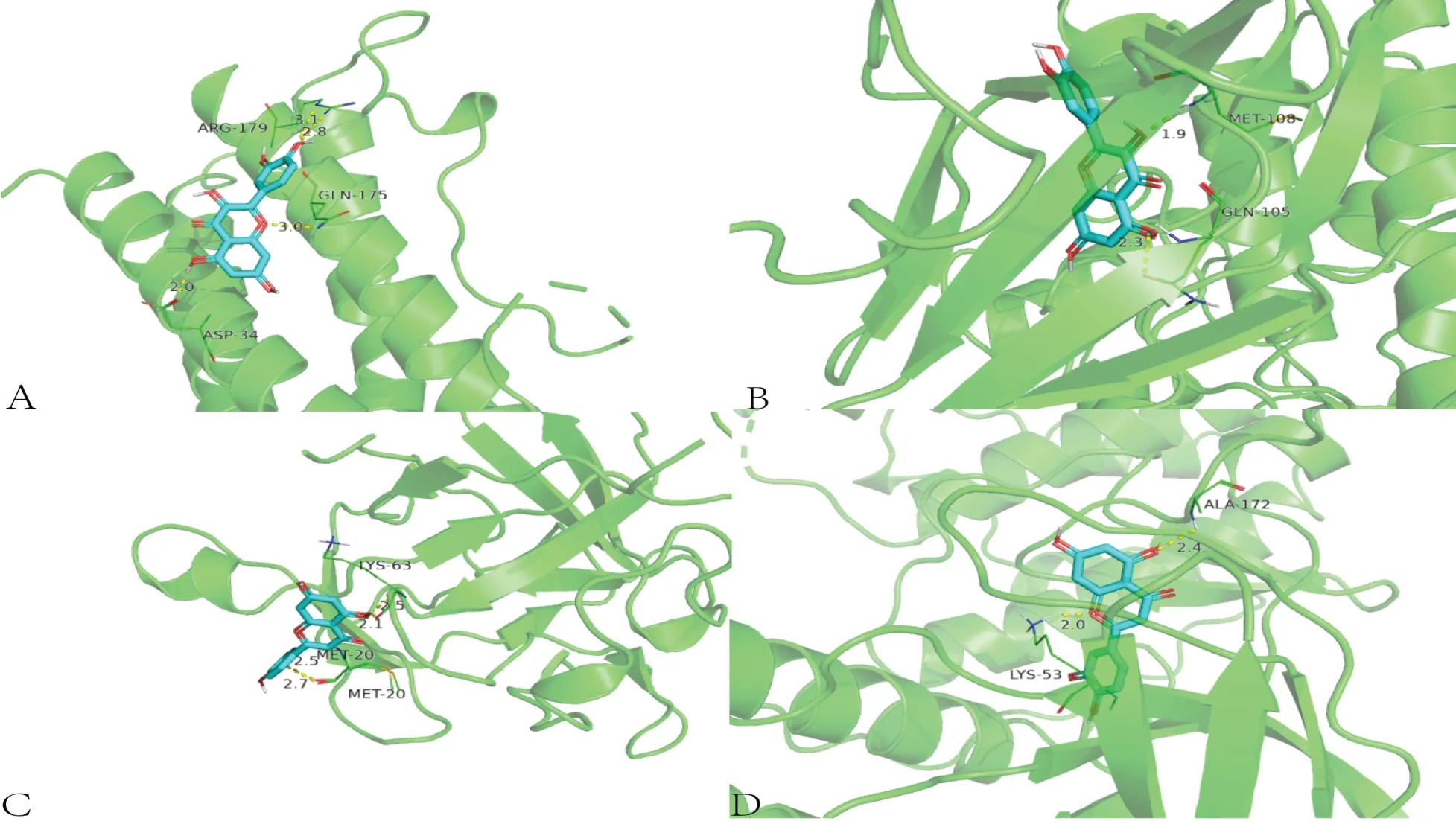
图8 分子对接图

表4 靶点蛋白信息
3 讨论
本研究运用网络药理学方法探究苍膝通痹胶囊治疗OA的作用机制。得到有效活性成分60个、作用靶点140 个、OA 疾病靶点469 个,苍膝通痹胶囊与OA 的交集靶点52 个。分子对接结果显示苍膝通痹胶囊的活性成分与OA 的核心靶点具有较好的结合活性,这表示活性成分可能作用于上述靶点从而影响OA的发展变化。
药物-成分-靶点-疾病网络结果显示,苍膝通痹胶囊的核心活性成分包括槲皮素、β-谷甾醇、木犀草素、豆甾醇等。豆甾醇是一种能够与软骨细胞膜结合的植物甾醇,具有潜在抗炎和抗分解代谢特性。GABAY等[9]研究发现,豆甾醇可发挥抑制多种基质降解和炎症介质的功能,减少OA 导致的软骨退变,并且可以通过抑制白细胞介素1β(interleukin-1β,IL-1β)表达,靶向作用于对OA重要的核转录因子κB(nuclear factor-κB,NF-κB)通路。基质金属蛋白酶(matrix metalloproteinases,MMPs)在OA 发展过程中发挥关键作用,可造成关节畸形、降解细胞外基质、加速关节软骨破坏。CHEN等[10]发现豆甾醇能抑制MMPs表达,延缓关节软骨降解,延缓OA 病程发展。LEYVA 等[11]研究显示槲皮素能减少IL-1β、IL-6、TNF-α等的表达,下调MMP-13 表达。并且可上调超氧化物歧化酶表达,以清除炎症部位所产生的自由基[12],从而保护关节软骨,延缓OA 发病进程。曾丽萍等[13]研究显示,β-谷甾醇可增高成骨细胞护骨素和破骨细胞分化因子的比值,增加雌二醇分泌,上调成骨作用并下调破骨作用,从而调节骨代谢平衡。LIAO 等[14]发现,β-谷甾醇可通过抑制炎症小体激活以抑制MAPK 信号通路活化,减少IL-1β、IL-6、TNF-α的生成,起抗炎作用。木犀草素具有良好的抗炎抗氧化作用,可保护软骨细胞,从而延缓关节软骨变性。FEI等[15]发现木犀草素可降低IL-1β诱导的前列腺素E2(prostaglandin E2,PGE2)、TNF-α、环氧合酶2(cyclooxygenase-2,COX-2)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、MMPs 产生,逆转由IL-1β诱导的Ⅱ型胶原蛋白降解。在体外木犀草素还可下调IL-1β诱导的NF-κB 磷酸化,预防OA 大鼠体内软骨破坏并增强胶原蛋白Ⅱ表达。
PPI 结果表明,核心靶点有IL-6、IL-1β、JUN、MAPK1、MAPK14、VEGFA 等。这些靶点在苍膝通痹胶囊治疗OA 的进程中可能起重要作用。JIKKO等[16]发现IL-1β和IL-6在介导软骨降解或胶原降解方面有协同作用。JENEL 等[17]发现IL-1β可通过影响软骨、滑膜、软骨基质来干预OA 发病进程。IL-1β可影响软骨细胞中IL-6、TNF-α、PGE2、NO、COX-2 等炎症介质或iNOS 的分解代谢过程,并激活滑膜成纤维细胞和免疫细胞来促进滑膜炎症,使软骨组织降解永久化[18]。IL-6 可诱导MMP-3、MMP-13 和ADAMTS 表达,介导软骨退变[19]。还可抑制成骨细胞活性,同时增加破骨细胞活性,导致骨质流失[20]。研究显示VEGFA 可调节成骨细胞和破骨细胞分化和增殖[21],增强软骨细胞MMP-9 和MMP-13表达,从而导致软骨退变、滑膜肥大、血管侵入软骨和加速骨溶解、软骨下囊肿和骨赘形成[22]。同时VEGFA 的表达可通过促进病理性血管生成,导致感觉神经顺着软骨、骨赘、滑膜和半月板中新生成的血管向内生长,导致发生疼痛[23]。JUN 可激活对OA 至关重要的FoxO、MAPK 和PI3K-Akt 信号通路[24-25],通过调节软骨细胞合成代谢和分解代谢基因表达,对OA 软骨破坏起作用[26]。雌激素可通过抑制破骨细胞分化,促进肠道钙吸收来调节骨骼系统,对于关节软骨有潜在保护作用,从而对OA 的病程产生影响[27]。李健等[28]研究显示雌激素受体1(estrogen receptor 1,ESR1)可刺激转化生长因子α(transforming growth factor alpha,TGF-α)和胰岛素样生长因子1(insulinlike growth factor-1,IGF-1)以促进软骨细胞增殖,抑制IL-1、IL-6、TNF-α 等促炎性细胞因子以保护软骨组织,同时ESR1 还可调控IL-1β诱导的软骨细胞中MMPs 表达。MAPK1 和MAPK14 参与调控MAPK 通路、细胞增殖、凋亡和炎症[29],对损伤有重要影响,在软骨细胞中的高表达与OA 相关性较高[30]。
KEGG 富集分析结果显示核心通路有MAPK 信号通路、PI3K-Akt通路、TNF通路、HIF-1通路、NOD样受体通路、FoxO 通路、NF-κB 通路等。提示苍膝通痹胶囊可能通过以上途径对OA 进行调控。PI3K-Akt 通路是经典的抗凋亡通路,在细胞代谢、增殖、凋亡、转录以及蛋白质合成等过程中发挥作用。PI3K-AkT 通路与IL-1β诱导的炎症反应密切相关。PI3K 和AkT 选择性抑制剂还可降低MMPs 表达[31]。PI3K-AkT 通路会影响下游凋亡相关蛋白活性,从而介导细胞分化、增殖、凋亡,是调节OA 软骨细胞凋亡的重要通路[32]。MAPK 通路与PI3K-Akt 通路同为破骨细胞分化通路[33],可调控软骨细胞凋亡及骨破坏等进程[34]。激该通路活可增强MMPs 和ADAMTS 表达,导致软骨基质丢失[35]。ZHANG 等[36]研究显示PI3K-Akt 通路和MAPK 通路均能增加促凋亡因子Casp-3、Casp-8 和抑制抗凋亡因子Bcl-2 表达以促进软骨细胞凋亡,从而影响OA。NF-κB 信号通路是诱导破骨细胞分化的重要信号通路,通过激活破骨细胞和促进破骨前体细胞成熟以调控关节软骨退变[37]。JI 等[38]研究显示NF-κB信号通路单独作用或与BMP、Wnt等通路联合作用,可抑制软骨细胞合成代谢,触发MMPs、ADAMTS、PEG2、iNOS、COX-2 等的表达,导致关节软骨侵蚀,加快OA的发生和软骨细胞凋亡。LEPETSOS等[39]发现在肥大的软骨细胞中,NF-κB 信号通路可 诱 导BMP2、CXCL8 和GADD45-β产 生,它 们 与ELF3 和HIF-2α通路一起促进MMPs、VEGF 和骨钙素肥大标志物产生,导致软骨细胞钙化和骨赘形成。ESR 通路可通过调控雌激素促使成骨细胞表达骨保护素,以促进骨膜形成,减少破骨细胞数量[40],干扰NF-κB 因子和配体结合,调控MMPs 表达[41],实现抑制骨吸收。王健等[42]发现NF-κB 信号通路还可对炎症因子、细胞因子、生长因子产生抑制作用,从而保护关节软骨。FOXO 是MAPK 和PI3K-Akt 通路下游的转录因子,可保护软骨细胞功能,调节软骨细胞生长成熟和基质合成[43]。FOXO通路可通过上调FOXO转录因子,抑制软骨细胞的氧化应激速率[44-45],调控OA病理过程。
综上所述,苍膝通痹胶囊调控OA 靶点存在复杂的相互作用关系,苍膝通痹胶囊可通过多成分、多靶点、多通路调控OA 的病理进程。在促进血管生成、调节软骨细胞增殖、干预炎症进程等方面发挥作用。
网络药理学作为一种新兴的研究方法,可为中药的临床应用提供了方向。但仍存在局限性,在后续研究中,可通过质谱、液相色谱等方法鉴别苍膝通痹胶囊的有效成分,并对本研究筛选出的靶点和通路进行验证。

