基于生/醋大黄的大承气汤对实热壅滞证胎粪性腹膜炎小鼠血清ET、NO和T NF-α的影响*
陆景荣,陆梅元,曾海生,马秀梅,陈 勇,赵凤仙,陈宏夏
1 广西国际壮医医院,广西 南宁 530201; 2 广西壮族自治区食品药品审评查验中心,广西 南宁 530029;3 右江民族医学院附属医院,广西 百色 533000; 4 广西中医药大学,广西 南宁 530200
大承气汤出自《伤寒论·辨阳明病脉证并治》,由大黄、枳实、厚朴和芒硝组成,是泻法的代表方剂[1-3],具有泻下热结的作用,主治阳明腑实证和里热实证等[4]。目前临床主要用于治疗急腹症、肠梗阻与胃肠道功能障碍等疾病,该方还用于辅助改善脑血管患者意识、有机磷农药急性中毒抢救的辅助治疗等[5-6]。研究表明,大承气汤具有泻下、抑制血清内毒素、抗炎、提高机体免疫力等药理作用[3]。大黄经过不同炮制方法,其化学成分及其药效变化差异较大,甚至产生相反的药效[7]。目前多报道大黄与多味药配伍前后药效变化情况[8-10],鲜见报道大黄不同炮制品与多味药配伍后的泻下功效的变化。本实验主要研究生、醋大黄炮制品的大承气汤对实热壅滞证胎粪性腹膜炎(faecal peritonitis with excessive heat stagnation,ABP)小鼠血清内毒素(endotoxin,ET)、一氧化氮(nitric oxide,NO)和肿瘤坏死因子α(tumor necrosis factorα,TNF-α)含量的影响。
1 材料与方法
1.1 仪器20110793 型全波长酶标仪[BIOTEKEpoch(美国)];PRACTUM224-KN SOP型电子分析天平(赛多利斯科学仪器北京有限公司);TDL-80-2B型低温离心机(上海安亭科学仪器厂);ZH-B6 型代谢笼(安徽正华有限公司);PYX-190H-B 型育温箱(广东科力有限公司)。
1.2 药物与试剂显色基质鲎试剂盒(厦门市鲎试剂试验厂有限公司,批号:160525);炎性介质TNF-α、NO 测试盒(南京建成生物工程研究所,批号:201706、20170406);氨苄西林胶囊(联邦制药厂有限公司,批号:20300);实验用水为纯水。
1.3 药材大黄、枳实、厚朴及芒硝购于广东康美药业有限公司,经广西中医药大学药用植物教研室李斌副教授鉴定,大黄为蓼科植物药用大黄Rheum officinaleBaill.的干燥根和根茎;枳实为芸香科植物酸橙Citrus aurantiumL.的干燥幼果;厚朴为木兰科植物厚朴Magnolia officinalisRehd.et Wils.的干燥干皮、根皮及枝皮;芒硝为硫酸盐类矿物芒硝族芒硝,主要含十水硫酸钠(Na2SO4·10H2O)。见表1。

表1 药材批号与产地
1.4 动物清洁级昆明种小鼠,体质量(20±2)g,雄性。实验动物质量合格证号:0001757;实验动物生产许可证号:SCXK(桂)2019-0002,均由广西医科大学试验动物中心提供。
1.5 方法
1.5.1 药液提取 按处方比例取厚朴24 g,枳实12 g,大黄生/醋药材粉末各12 g,芒硝9 g,分别精密称定,厚朴与枳实加纯水500 mL,浸泡30 min后,加热煮沸后保持微沸30 min,使用500目滤布过滤,药渣再加纯水500 mL 浸泡30 min,加热煮沸保持微沸30 min,过滤,合并2 次滤液,然后分别加入生/醋大黄粉末,浸泡20 min,加热煮沸,保持微沸20 min,使用500目滤布过滤,药渣加入纯水300 mL,加热煮沸后保持微沸20 min,滤过,合并滤液,趁热加入芒硝,搅拌使溶解,浓缩成浓度为0.3∶1 的药液(含生药0.3 g/mL),置于2~8 ℃冰箱储存备用。同上述制备药液方法,将药液浓缩成浓度为0.5∶1的药液(含生药0.5 g/mL),置于2~8 ℃冰箱储存备用。
1.5.2 ABP 小鼠动物模型建立 参考文献[11]以及结合预实验,随机选取15 只健康小鼠为空白对照组,腹腔注射氯化钠注射液0.5 mL/只。取小鼠粪便6 g,加入100 mL 生理盐水,研磨均匀,静置30 min,取上层混悬液,腹腔注射0.5 mL/只,20 h 后小鼠眼角出现浓稠分泌物、少动、蜷曲蹲伏、腹部鼓胀和大便极干等实热壅滞症状。解剖腹腔可见腹腔内有少量浑浊液体,多数肠管膨胀,肠管充血,部分肠管痉挛,表示造模成功。
1.5.3 分组给药 取体质量为(20±2)g 的健康小鼠105只,雄性,适应性喂养3天后随机分为生大承气汤6、10 g/kg 剂量组,醋大承气汤6、10 g/kg剂量组,空白对照组、模型组、阳性对照组[(氨苄西林20 mL/kg(体质量)、60 mg/mL],每组15 只。生/醋大承气汤不同剂量组造模成功后灌胃,连续2天,每日1次。阳性对照组灌胃氨节西林1.2 g/kg,容积为20 mL/kg(体质量),连续2 天,每日1 次。空白对照组腹腔注射生理盐水20 mL/kg(体质量),20 h后给予蒸馏水灌胃,连续2天,每日1次。模型组造模成功后灌胃蒸馏水,每日20 mL/kg(体质量),连续2天,每日1次。
1.5.4 血清ET、NO 和TNF-α含量测定 各组小鼠造模成功42 h 后,吸取鲎试剂检测配套的血液抗凝剂于无热源试管中,无菌操作下眼球取血,血液置于无热源试管中,与抗凝剂混匀,至冰水中加盖,低温离心(离心半径10 cm,3000 r/min 离心12 min),精密吸取上清液适量,用ET 检查用水配制成2 倍稀释液储存备用。取2 倍稀释液0.2 mL加入到0.8 mL 样本处理液中,混匀,制成10 倍稀释液备用。将10倍稀释液于68 ℃恒温水浴中加热12 min,将加热后的10倍稀释液水浴冷却后在常温条件下离心半径10 cm,3000 r/min离心12 min,取上清液检测ET、NO和TNF-α,检测步骤见显色基质鲎试剂盒说明书。
1.6 统计学方法采用SPSS 21.0 统计软件分析数据,计量资料以±s表示,采用单因素方差分析,组间多重比较方差齐,采用SNK-q检验,方差不齐用Tanbane's T2 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 ET 标准溶液配制与标准曲线的制作ET 标准曲线溶液及其标准曲线见表2、图1。
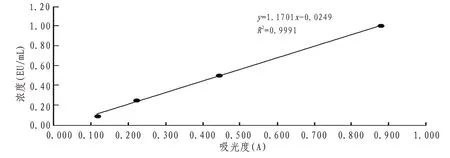
图1 ET标准曲线

表2 ET标准曲线溶液
2.2 血清ET 含量与空白对照组比较,生大承气汤10 g/kg 剂量组血清ET 含量差异无统计学意义(P>0.05),生大承气汤6 g/kg剂量组与醋大承气汤6、10 g/kg 剂量组、模型组和阳性对照组比较ET 含量差异具有统计学意义(P<0.01);与模型组比较,生大承气汤6、10 g/kg 剂量组、醋大承气汤6、10 g/kg 剂量组血清ET含量差异具有统计学意义(P<0.01),阳性对照组差异无统计学意义(P>0.05);与生大承气汤10 g/kg剂量组比较,醋大承气汤10 g/kg 剂量组和阳性对照组血清ET含量差异具有统计学意义(P<0.01);与阳性对照组比较,生大承气汤6、10 g/kg 剂量组、醋大承气汤10 g/kg 剂量组血清ET 含量差异具有统计学意义(P<0.01),醋大承气汤6 g/kg 剂量组血清ET含量差异具有统计学意义(P<0.05)。见表3。
表3 各组小鼠血清ET、NO及TNF-α含量比较(±s)

表3 各组小鼠血清ET、NO及TNF-α含量比较(±s)
注:与空白对照组比较,**表示P<0.01;与模型组比较,●●表示P<0.01;与生大承气汤10 g/kg剂量组比较,△表示P<0.05,△△表示P<0.01;与阳性对照组比较,#表示P<0.05,##表示P<0.01;-表示等体积蒸馏水
TNF-α(pg/mL)4.42±0.75**●●##3.92±0.68**●●##4.57±1.13**●●##4.38±0.99**●●##5.89±0.46**●●△△0.56±0.49●●△△##9.31±0.95**△△##组别生大承气汤组鼠数15醋大承气汤组阳性对照组空白对照组模型组15 15 15 15给药剂量(g/kg)6 10 6 10 1.2--外周血ET(EU/mL)0.32±0.11**●●##0.16±0.08●●##0.39±0.09**●●△#0.32±0.08**●●△△##0.46±0.07**△△0.13±0.04●●△△##0.52±0.10**△△NO(μmol/L)186.21±16.84**●●##285.16±28.31**●●##160.98±16.29**●●△△##267.73±26.56**●●△△##204.12±10.62**●●△△44.06±8.74●●△△##75.08±7.15**△△##
2.3 NO含量与空白对照组比较,生大承气汤6、10 g/kg 剂量组、醋大承气汤6、10 g/kg 剂量组、模型组和阳性对照组血清NO 含量差异具有统计学意义(P<0.01);与模型组比较,生大承气汤6、10 g/kg 剂量组与醋大承气汤6、10 g/kg 剂量组和阳性对照组血清NO 含量差异具有统计学意义(P<0.01);与生大承气汤10 g/kg剂量组比较,醋大承气汤6、10 g/kg 剂量组和阳性对照组血清NO 含量差异具有统计学意义(P<0.01);与阳性对照组比较,生大承气汤6、10 g/kg 剂量组、醋大承气汤6、10 g/kg 剂量组血清NO 含量差异具有统计学意义(P<0.01)。见表3。
2.4 TNF-α 含量与空白对照组比较,生大承气汤6、10 g/kg 剂量组、醋大承气汤6、10 g/kg 剂量组、模型组和阳性对照组血清TNF-α含量差异具有统计学意义(P<0.01);与模型组比较,生大承气汤10 g/kg剂量组、醋大承气汤6、10 g/kg 剂量组和阳性对照组血清TNF-α含量差异具有统计学意义(P<0.01);与生大承气汤10 g/kg 剂量组比较,阳性对照组血清TNF-α含量差异具有统计学意义(P<0.01);醋大承气汤6、10 g/kg 剂量组血清TNF-α含量差异无统计学意义(P>0.05);与阳性对照组比较,生大承气汤6、10 g/kg 剂量组、醋大承气汤6、10 g/kg 剂量组血清TNF-α含量差异具有统计学意义(P<0.01)。见表3。
3 讨论
相关研究表明,急性感染性疾病和急腹症等多是ET 生物活性的体现,或由其诱导产生的细胞因子与其他炎症介质所致。实热便秘是阳明腑实证的一种,实热便秘的致病因素之一即为ET[12]。TNF 的生成释放是机体对各种外源性或内源性物质刺激的反应,ET 是TNF 释放的物质,ET 和TNF 都会对机体产生损害,两者结合能产生协同作用[12]。肿瘤坏死因子可通过内分泌作用进入血液循环,还可通过旁分泌形式对邻近肠上皮细胞发生影响,从而对肠道屏障功能产生一定影响[13]。NO 具有生物学活性,广泛分布于生物体内各组织中,它是一种新型生物信使分子,其在肠道内导致的多器官功能衰竭综合征(multiple organ dysfunction syndrome,MODS)发病过程中起关键作用[14]。相关研究[15]表明,NO 是炎症介质网络的最后共同途径,是导致器官功能损害的重要介质,炎症介质引起的全身性炎症反应综合征是MODS 发生的主要机制,在细菌ET 和炎症细胞因子刺激下过度产生的NO 为败血症性休克病理发生过程中的关键中介机制[11]。
本研究表明,生、醋大黄的大承气汤作用于实热壅滞的ABP 小鼠,其血清NO 增加,ET、TNF-α降低,可能与生、醋大黄炮制品及其配伍的厚朴、枳实和芒硝有关,至于与什么成分变化或含量的增减作用有关,有待进一步研究。

