MALDI-TOF MS在鲍曼不动杆菌同源性分析中的临床应用评估
郑 恬,周 柯,周 磊,杨玉琪,陈 潇,白 露,刘家云
(空军军医大学第一附属医院检验科,陕西 西安 710032)
环境污染可导致高达20%的医院获得性感染[1-2]。越来越多的研究[3-5]表明,医院环境、医疗设施是医院感染病原体的主要来源和重要传播媒介。鲍曼不动杆菌(Acinetobacterbaumannii, AB)是全球医院感染最常见的机会性多重耐药病原菌之一,对公共卫生及健康构成严重威胁[6-7]。AB在临床中难以消尽,并存在反复感染暴发的风险,且目前尚未研发出有效的新型抗菌药物[8]。改变AB感染的临床现状,需探索科学的环境微生物筛查方法,快速准确地找出源头,控制耐药性传播,避免医院感染暴发。近年来,基质辅助激光解析电离飞行质谱(MALDI-TOF MS)在铜绿假单胞菌、肺炎克雷伯菌、大肠埃希菌、金黄色葡萄球菌等微生物研究方面的应用较为广泛,但鲜有涉及AB同源性分析相关应用的报道[9-12]。
本研究使用MALDI-TOF MS技术,对某院2020年5月—2021年2月神经内科重症监护病房(ICU)患者和环境中分离的46株AB进行同源性分析,探讨其在医院内的水平传播路径,采用多位点序列分型(multilocus sequece typing, MLST)方法进行比对、验证,评估MALDI-TOF MS对AB同源性分析的临床应用价值。
1 资料与方法
1.1 一般资料 剔除同一患者或环境多次送检样本中的重复菌株,收集某三甲综合医院2020年5月—2021年2月神经内科ICU患者痰标本和环境标本分离的46株AB,其中,40株分离自患者气管插管/气管切开吸痰标本,6株分离自环境标本。
1.2 仪器与试剂 VITEK 2 Compact全自动微生物鉴定及药敏分析系统、GN革兰阴性菌鉴定卡片、VITEK-MS质谱仪、CHCA基质液及配套靶板(法国Bio-merieux公司);Beckman DU800核酸蛋白分析仪(美国Beckman公司);QIAamp DNA纯化试剂盒(德国Qiagen公司);凝胶电泳系统(美国Bio-Rad公司);ABI 2720聚合酶链反应(PCR)扩增仪(美国ABI公司);Mueller-Hinton培养基(中国北京奥博星公司);电泳成像系统(中国上海复日公司)及PCR反应试剂(中国上海生工公司)。
1.3 方法
1.3.1 培养及鉴定 严格按照《全国临床检验操作规程》[13]操作步骤对患者和环境标本进行常规培养、分离,采用全自动细菌鉴定分析仪VITEK 2 Compact/VITEK-MS对分离菌株进行最终鉴定。
1.3.2 MALDI-TOF MS同源性分析 挑取新鲜单一菌落,采用直涂法[14],涂布至靶板标本孔上,精确滴加1 μL CHCA基质液覆盖于靶孔,晾干后靶板上机,运行MALDI-TOF MS RUO系统。检测完毕后,将目标菌株图谱数据导入VITEK-MS SARAMIS Premium软件图形数据库进行聚类分析,绘制聚类树图,以同一菌种不同菌株间相似度≥65%为同源菌株的标准对聚类树进行质谱分型[15],以MS-a、MS-b、MS-c、MS-d、MS-e和MS-f表示不同型别。
1.3.3 MLST同源性分析 经细菌DNA提取、PCR扩增和产物测序后,于MLST数据库(https://blast.ncbi.nlm.nih.gov/blast/Blast.cgi?PROGR-AM=tblastn&PAGE_TYPE=BlastSearch &LI-NK_LOC=blasthome)比对分析,获得gltA、gyrB、gdhB、recA、cpn60、gpi和rpoD 7个等位基因对应的编号,从而确定每株菌株的序列分型(sequence type, ST)。管家基因引物序列和片段长度见表1。运行BioNumerics 8.0软件,导入含7个等位基因编号阵列的profile文件,经功能模块UPGMA及Categorical分析计算,分别生成聚类树和最小生成树。

表1 AB MLST各管家基因引物序列及片段长度Table 1 Primer sequences and fragment lengths of house-keeping genes of AB MLST
2 结果
2.1 MLST序列分型 经MLST数据库检索、比对,46株AB为12个ST型别:ST195、ST208、ST540、ST369、ST136、ST436、ST1893、ST381、ST469、ST938、ST1821和新型STN1。ST208、ST540、ST369、ST136、ST436与ST195间仅管家基因gpi不同;ST1893与ST195为管家基因recA的差异;ST381、ST469和ST938三个型别间存在gpi和gyrB 2个管家基因不同;ST1821、STN1与其他ST型别分别存在6、7个管家基因的差异。46株AB的ST型别及构成比见表2。
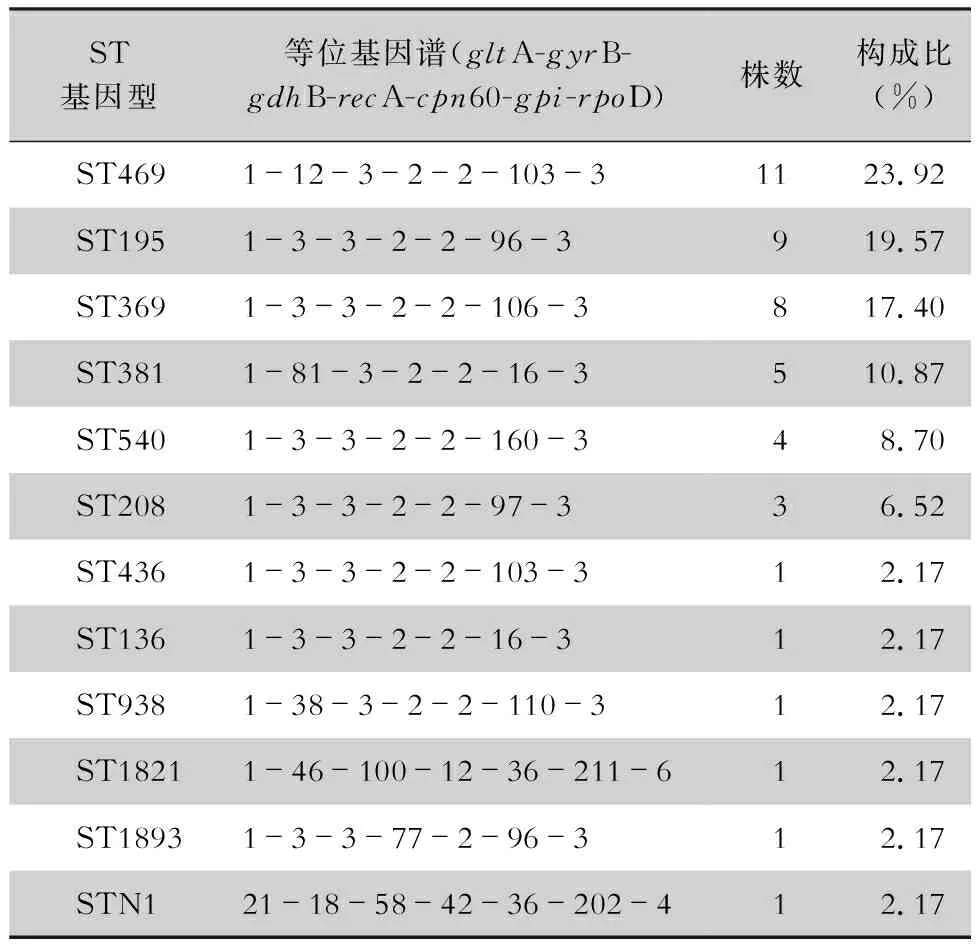
表2 46株AB ST型别分布情况Table 2 ST genotype distribution of 46 AB strains
2.2 MLST同源性分析结果
2.2.1 MLST聚类树 ST195、ST208、ST540、ST369、ST136、ST436基因高度同源,相似度约为85%;ST1893与ST195相似度为75%~85%;ST381、ST469和ST938相似度约为70%;ST1821、STN1与其他ST型别间相似度均<15%。46株AB聚类分析结果见图1。

图1 46株AB MLST聚类树Figure 1 Clustering tree of 46 AB strains by MLST
依据MLST最小生成树的基因位点差异数量相同、亲缘相近原则,将46株AB的MLST聚类分为MT-A、B、C、D四个簇群。MT-A簇27株(58.70%),包括9株ST195,3株ST208,4株ST540,8株ST369,ST136、ST436及ST1893各1株;MT-B簇17株(36.96%),包括5株ST381,11株ST469和1株ST938;MT-C、D簇各1株(2.17%),分别为ST1821、STN1。
2.2.2 MLST最小生成树 由软件BioNumerics 8.0绘制,见图2。圆形数量表示ST个数,圆形面积大小及其分割份数表示菌株数量,圆形连线上的数字表示相邻ST型别间的位点变化数量。结果显示,ST195为46株AB所有ST的共同鼻祖,与ST208、ST540、ST369、ST136、ST436和ST1893均只有1个基因位点差异,亲缘关系较近;与ST381、ST469和ST938均有2个基因位点差异;而与ST1821和STN1分别存在6和12个位点差异,且ST1821与STN1两者之间亦有6个不同基因位点变化,亲缘关系差。
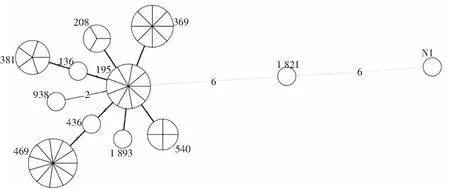
图2 46株AB MLST最小生成树Figure 2 Minimum spanning tree of 46 AB strains by MLST
2.3 MALDI-TOF MS同源性分析结果 46株医院感染AB菌株的质谱数据经VITEK-MS SARAMIS Premium软件的相似性分型功能聚类分析生成聚类树图,见图3。质谱分型显示,46株AB分成MS-a、b、c、d、e和f六个质谱型别,最多者为MS-a型,共39株(84.78%),MS-c、e型各2株(4.35%),MS-b、d、f型各1株(各2.17%),见表3。
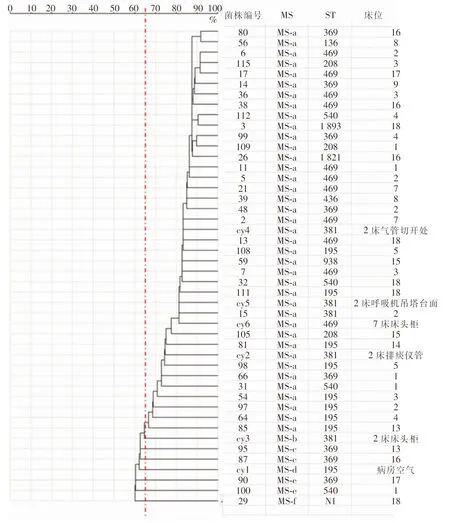
图3 46株AB MALDI-TOF MS聚类树Figure 3 Clustering tree of 46 AB strains by MALDI-TOF MS
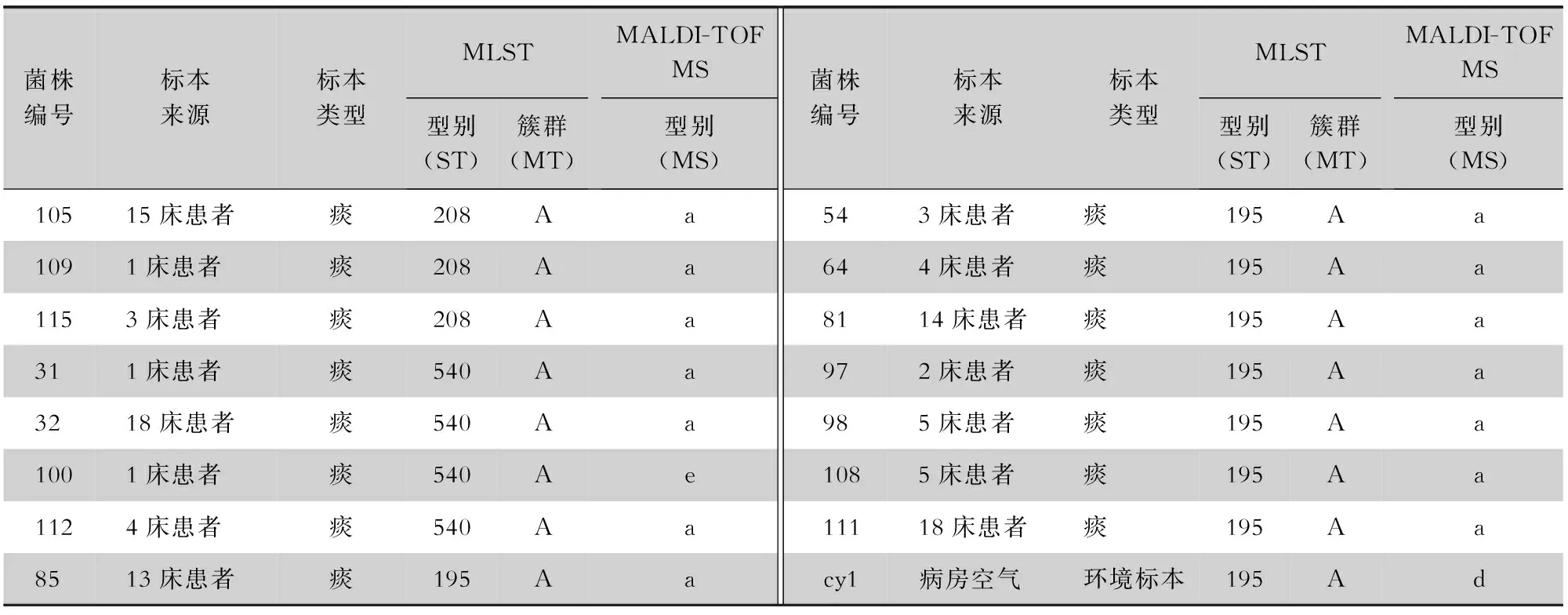
表3 MALDI-TOF MS与MLST分析AB菌株同源性结果对比Table 3 Comparison of AB homology results between MALDI-TOF MS and MLST analyses
2.4 MALDI-TOF MS与MLST分析AB菌株同源性结果 对比MALDI-TOF MS鉴定的39株MS-a型中,22株为MT-A簇,包括ST208型3株,ST540型3株(3/4),ST195型8株(8/9),ST369型5株(5/8)及ST136、ST436、ST1893型各1株;16株为MT-B簇,包括ST381型4株(4/5),ST469型11株和ST938型1株;1株为MT-C簇(ST1821)。1株MS-b型为MT-B簇的ST381;2株MS-c型为MT-A簇的ST369;1株MS-d型为MT-A簇的ST195;2株MS-e型分别为MT-A簇的ST540和ST369;1株MS-f型为MT-D簇的STN1。见表3。
3 讨论
目前,脉冲场凝胶电泳(pulsed-field gel electrophoresis, PFGE)仍为临床微生物同源性分析的金标准[16],其精确度高,稳定性好,但因操作繁琐、费时,费用高昂,难以作为常规技术在医院普及,普遍被MLST替代[7,12,17]。近年来MALDI-TOF MS作为新技术,具有检测快速,成本低廉的优势,逐渐被应用于临床进行常规菌株鉴定及同源性分析[18]。
本研究通过MLST同源性分析发现,2、3、4、5、13、14、18床的患者痰标本分离的AB菌株与病房空气取样的cy1号菌株为同一型别ST195,符合空气传播引起的医院内感染;从1、2、4、8、9、13、15、16、17、18床患者中分离的ST208、ST540、ST369、ST136、ST436和ST1893型别的菌株,依从最小生成树的相同基因位点变化判断,与ST195同为MT-A簇,之间的同源性>75%。2床患者还分离出ST381菌株,与从其周围环境分离的cy2、cy3、cy4、cy5号(cy2:排痰仪管患者端;cy3:床头柜;cy4:气管切开处;cy5:呼吸机塔吊台面)菌株型别一致。7床患者分离出ST469菌株,与从其床头柜取样的cy6号菌株型别一致,且ST381与ST469同为MT-B簇,故推测2床与7床患者周围环境已经发生同源AB的水平传播。
然而,MALDI-TOF MS与MLST聚类分析结果对比显示,同一ST型可出现在不同的MALDI-TOF MS型别中,如,ST195出现于MS-a和MS-d型(cy1号空气采样)中,若以此MALDI-TOF MS质谱分型作为同源性分析结果,将否定ICU医院感染经空气传播的判断,与临床实际情形相悖。另一方面,同一MALDI-TOF MS型别中又可包含不同ST型,甚至不属于同一MLST簇群。两种方法分析的型别呈交叉分布,表明MALDI-TOF MS无法精确区分相应的MLST簇群,难以甄别同源菌株,这可能与MALDI-TOF MS基于微生物蛋白质的表达及其丰度进行聚类分析的原理有关[19]。此外,临床分离株可受抗菌药物、感染位置、培养时间、培养基等环境因素影响,或因菌体蛋白发生过表达或不表达而产生峰图变化,导致MALDI-TOF MS聚类分析的误差扩大[20]。本研究中,仅新发现基因型STN1菌株为MS-f,与MT-D单株对应。
尽管MALDI-TOF MS在其他微生物的同源性分析中具有一定优势,但在AB中的应用仍存在局限性,与当前主流的、相媲美于PFGE的MLST方法结果一致性相差甚远[21],与相关研究[22-24]报道的结论略有出入,是否与不同仪器型号、参数设置或试验标本数量多寡有关,尚待进一步研究。
综上所述,MALDI-TOF MS作为医院感染控制机构对环境AB同源性分析方法具有一定的局限性,其分型结果与MLST结果不一致,分辨特异性低,目前尚无法取代MLST技术。
利益冲突:所有作者均声明不存在利益冲突。

