近平滑念珠菌临床分离菌株毒力因子差异表达研究
瞿玉洁,李婷婷,李茂媛,胡方芳,金婷婷,杨 斌,罗振华,
(1. 贵州大学医学院,贵州 贵阳 550025; 2. 贵州医科大学医学检验学院,贵州 贵阳 550004; 3. 贵州省人民医院检验科,贵州 贵阳 550002; 4. 贵州省人民医院中心实验室,贵州 贵阳 550002)
念珠菌是全身血流感染中主要的条件致病菌,可引起人类浅表和深部感染性疾病,免疫功能低下、长期住院、使用广谱抗菌药物及使用侵入性导管等因素,致使近平滑念珠菌感染逐年增加。近平滑念珠菌通过表达毒力因子,如分泌水解酶、形成生物膜,以及对人体组织、器官及植入性医疗器械表面的黏附等促进其侵袭和感染[1]。生物膜是由细胞外多聚基质与菌细胞构成,可附着在组织表面,在大部分念珠菌中生物膜都在其生存过程中起着重要的作用[2]。生物膜能防止抗真菌药物穿透基质,对药物的穿透性有着一定的抵抗作用,从而降低药物的杀伤作用;同时形成生物膜的菌体,在机体内会迁移扩散,导致感染反复发作,增加临床治疗的难度[3]。近平滑念珠菌可形成生物膜,生物膜结构主要由假菌丝形态的菌体和少量基质构成。当近平滑念珠菌以假菌丝状态存在时表现出更强的侵袭性,且菌丝的存在也有利于其定植,增加机体患病的概率[4]。近平滑念珠菌黏附在组织或者医疗器械上均可能导致生物膜形成,增大感染和发病的概率。目前研究[5]发现,有多个基因参与近平滑念珠菌生物膜的形成过程,如生物膜和细胞壁调节剂1(biofilm and cell wall regu- lator 1, BCR1)、增强丝状生长蛋白1(enhanced fila-mentous growth protein 1, EFG1)、菌丝壁蛋白1(hyphal wall protein 1, HWP1)等,在生物膜重要结构的形成、调节等过程发挥着重要的作用。
蛋白酶降解宿主细胞的不同蛋白质、抗体、补体和细胞因子[6];天冬氨酸蛋白酶能结合至细胞表面,也能分泌到周围环境中,参与宿主组织的黏膜降解,并促进免疫防御蛋白的降解[7]。近平滑念珠菌SAPP基因家族包括SAPP1、SAPP2及SAPP3 3个基因,对编码天冬氨酸蛋白酶有着不同的功能。SAPP基因表达水平的增加与念珠菌毒力增加有关[8]。
为进一步了解不同部位来源及不同时期分离的近平滑念珠菌临床株的毒力因子表达情况,本研究通过比较同一患者不同部位来源及不同分离时期的临床株生物膜形成能力和体外分泌型天冬氨酸蛋白酶表达水平,以及生物膜形成相关基因BCR1、EFG1、HWP1和分泌型天冬氨酸蛋白酶SAPP1、SAPP2、SAPP3等毒力基因的表达差异,为研究近平滑念珠菌的毒力机制及其感染防治提供新的思路。
1 资料与方法
1.1 菌株来源 8株近平滑念珠菌分离自2015年7月—2016年7月某院2例老年患者的非重复送检标本,包括尿、导管尖端、血(静脉血),菌株均由贵州省人民医院中心实验室于-80℃保存。质控菌株为近平滑念珠菌标准菌株ATCC 22019。临床分离菌株患者来源信息见表1。
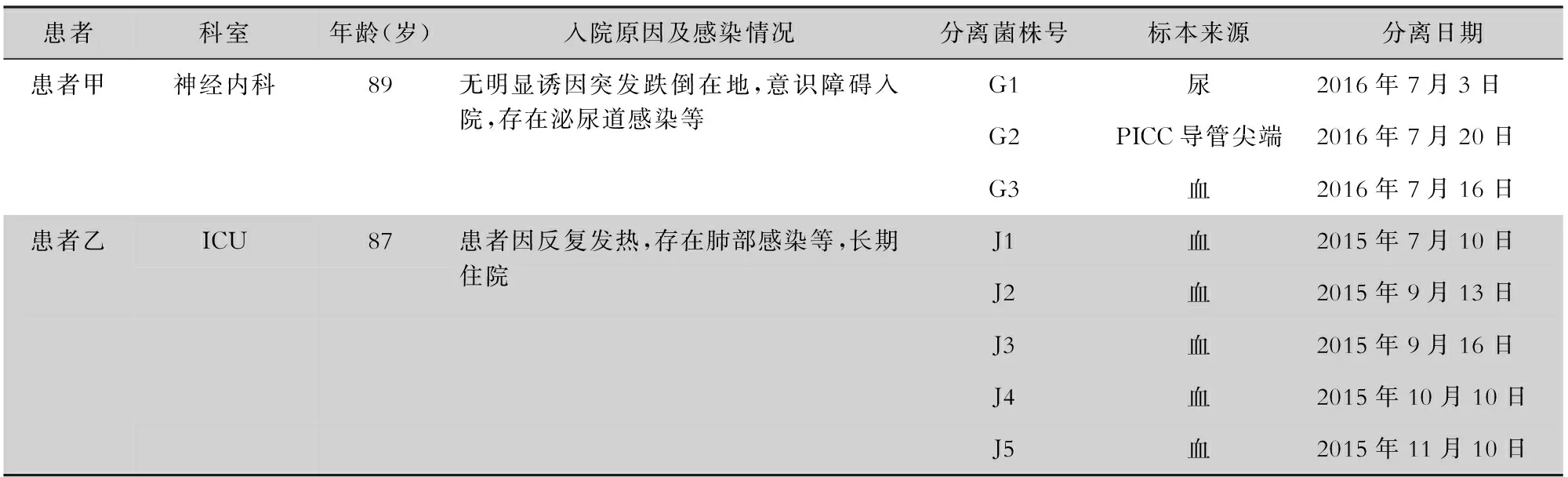
表1 8株临床分离近平滑念珠菌患者来源信息Table 1 Information of patients from whom 8 clinical strains of C. parapsilosis were isolated
1.2 主要仪器与试剂 BACTECTMFX全自动血培养仪、Phoenix-100全自动微生物鉴定仪购自美国BD公司,普通基因扩增仪购自德国耶拿分析仪器股份公司,Synergy H1微孔板检测仪购自美国BioTek公司,CFX Connect RT-QPCR仪购自美国BIORAD公司,酵母基因组DNA提取试剂盒购自北京天根生化科技有限公司,Tirol、PrimeScriptTMRT reagent Kit with gDNA Eraser (perfect Real Time)试剂盒、TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒购自日本Takara公司,沙氏葡萄糖琼脂培养基(SDA)、沙氏葡萄糖液体培养基(SDB)购于青岛海博生物技术有限公司,牛血清白蛋白(BSA)购自biosharp公司,琼脂粉购自北京索莱宝科技有限公司。
1.3 方法
1.3.1 菌株分离与鉴定 将患者送检标本接种至沙氏培养基,血标本接种至BD BACTECTMFX系统,35℃培养24~48 h,将真菌培养的菌株进行革兰染色,肉眼观察菌落的颜色及形态。采用酵母基因组DNA提取试剂盒提取真菌DNA,扩增真菌的ITS区和26s rRNA基因的D1/D2区域(引物见表2)。利用BLAST程序将扩增获得的序列与GenBank中的序列进行比对鉴定,比对结果与已知菌种ITS序列相似度达到98%以上时,则可鉴定菌种种类。
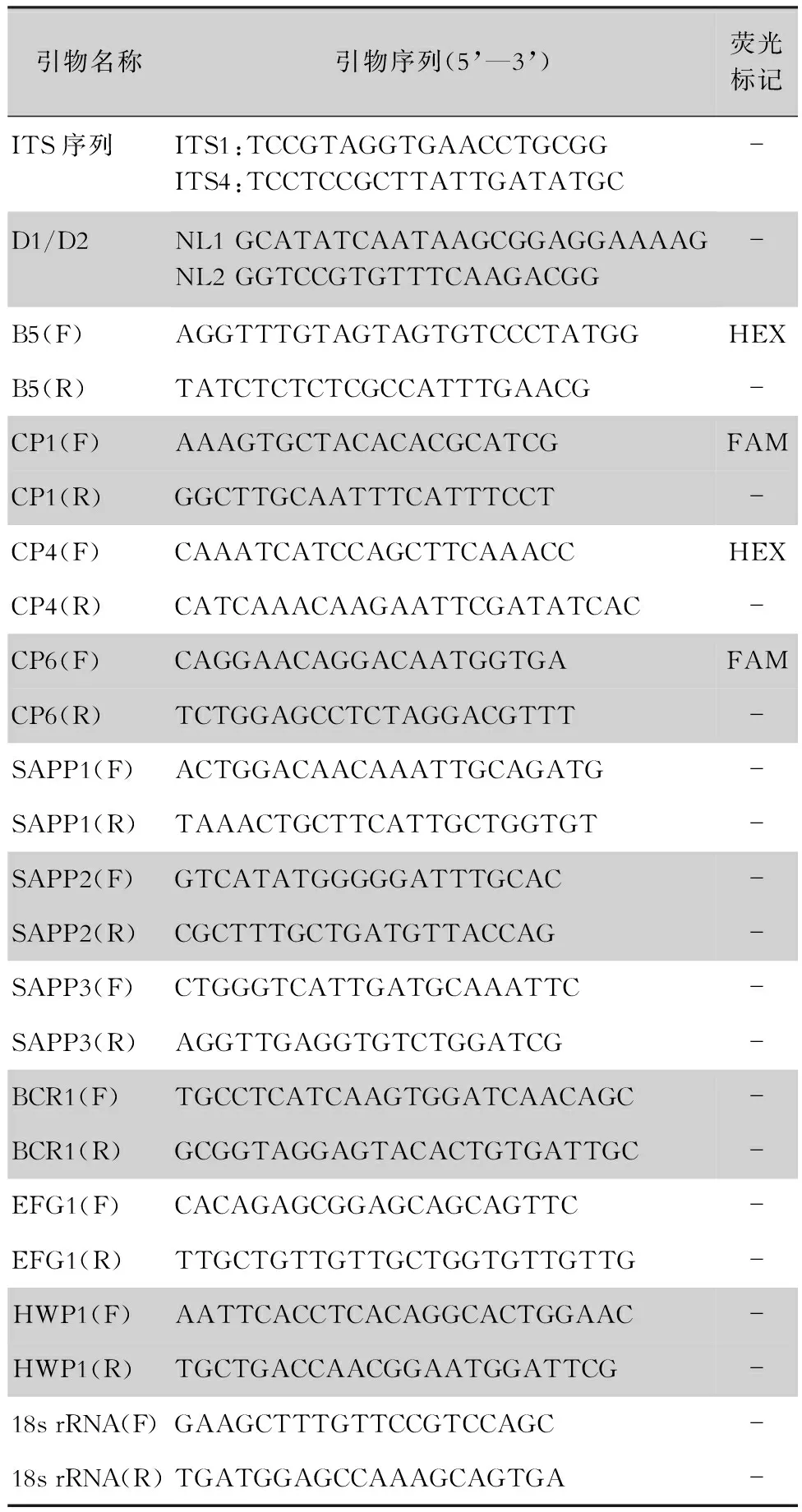
表2 近平滑念珠菌PCR扩增引物序列信息Table 2 PCR amplification primer sequences of C. parapsilosis
1.3.2 微卫星分型 参照Tavanti等[9]的方法,选择B5、CP1、CP4、CP6 4个高度多态性的微卫星位点对近平滑念珠菌临床菌株进行基因分型,用6-羧基荧光素标记B5和CP4正向引物,用六氯荧光素标记CP1和CP6正向引物,引物序列见表2。使用4对荧光标记的引物对提取的DNA进行扩增,对扩增产物进行毛细管电泳测定和结果分析。
1.3.3 生物膜形成能力的检测及判断 挑取近平滑念珠菌单菌落于SDB培养基中混匀制备成菌悬液,调整菌液浓度至1×106CFU/mL,取100 μL加入到聚苯乙烯无菌96孔板中,37℃培养24 h,用预冷的无菌PBS缓冲液(pH=7.2~7.4)清洗3次将未附着的菌体洗下,检测OD490nm值。试验设置3个生物学重复。根据如下判定方法判定菌株生物膜形成能力:OD490nm<0.03,无生物膜形成能力;0.03≤OD490nm<0.08,生物膜形成能力弱;0.08≤OD490nm<0.16生物膜形成能力一般;OD490nm≥0.16,生物膜形成能力强[10]。将96孔板中的PBS缓冲液吸取干净,置于倒置显微镜下200×观察生物膜形成情况。
1.3.4 天冬氨酸蛋白酶检测 挑取近平滑念珠菌单菌落,分别用无菌生理盐水配置为1×106CFU/mL的菌悬液备用。参考杨艳华等[10]的方法制作牛血清白蛋白培养基。取10 μL上述制备的各菌株菌液,滴于牛血清白蛋白培养基中预先贴有直径6 mm的圆形滤纸片上(每板三次生物学重复),将平板翻转倒置于37℃培养箱中培养6 d,量取菌落直径和菌落加沉淀圈层的直径。计算Pz值:Pz=菌落直径/(菌落直径+圈层总直径)。结果判断:Pz≤0.59,水解酶高表达;0.60≤Pz≤0.79,水解酶中表达;0.80≤Pz<1.00,水解酶低表达;Pz=1,表示不产水解酶[11]。
1.3.5 毒力相关基因表达检测 按照RNAiso试剂说明书提取菌种总RNA,采用PrimeScriptTMRT reagent Kit with gDNA Eraser(perfect Real Time)试剂盒对RNA进行逆转录,根据TB GreenTMPremix Ex TaqTMⅡ (Tli RNaseH Plus)试剂盒进行qRT-PCR,采用BIO-RAD CFX96荧光定量PCR仪分别检测近平滑念珠毒力相关基因SAPP1、SAPP2、SAPP3、BCR1、EFG1和HWP1以及内参基因18s rRNA的荧光信号,以BIO-RAD CFX96 Manager分析软件收集处理各试验组扩增基因CT值及RQ (relative quantity)值,RQ=2-ΔΔCT。以内参基因为对照,计算各毒力相关基因的相对表达量。所有基因引物均由上海生工有限公司合成,见表2。

2 结果
2.1 菌株鉴定及微卫星分型结果 利用通用引物ITS1/ITS4扩增序列片段后,将扩增产物进行测序,测序后获得的碱基序列在NCBI的BLAST中进行核酸序列比对,8株近平滑念珠菌均鉴定为基因Ⅰ型。采用微卫星分型方法,通过UPGMA聚类分析将8株近平滑念珠菌分为4个微卫星型别(microsatellite genmotype, MT),见图1。甲患者不同部位分离的3株菌株G1、G2、G3之间的遗传相似系数较低,变化范围为0~0.444,为3个不同的MT型别;乙患者不同时间自血液分离的菌株J1、J2、J3、J4、J5之间的遗传相似系数为1.000,为同一MT型别。见表3。
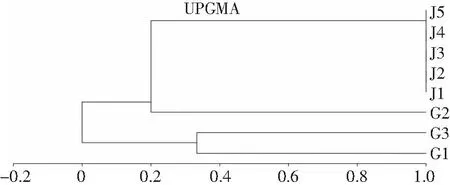
图1 8株临床分离的近平滑念珠菌微卫星分型结果聚类分析Figure 1 Cluster analysis on microsatellite results of 8 clinically isolated C. parapsilosis strains
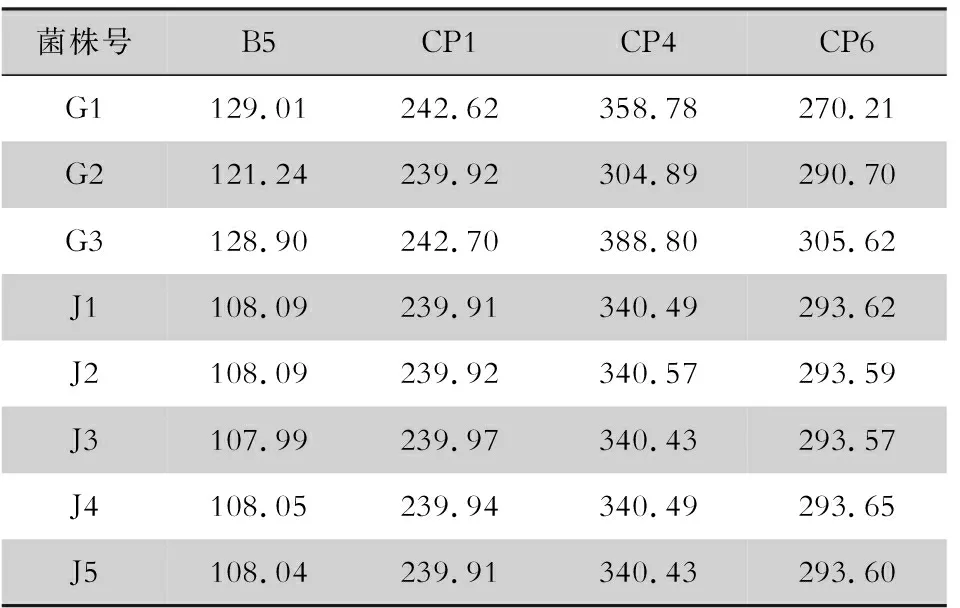
表3 8株临床分离的近平滑念珠菌微卫星分型等位基因位点测定结果Table 3 Allele loci detected by microsatellite typing in 8 clinically isolated C. parapsilosis strains
2.2 生物膜形成能力 临床菌株培养24 h后,倒置显微镜200×观察各菌株体外生物膜形成情况。结果显示,标准菌株ATCC 22019无生物膜形成能力,镜下可见菌株呈圆形或椭圆形,有少量菌体,菌体无明显聚集或少量聚集。8株临床分离菌均能够形成生物膜,其中甲患者分离的G1和G3菌株生物膜形成能力强,镜下见大量菌体和菌丝,菌体与菌丝聚集交织形成致密的网状结构;G2菌株生物膜形成能力弱,菌体较少,有少量聚集现象。乙患者的5株菌中,J5菌株生物膜形成能力强;J1、J2、J3、J4菌株生物膜形成能力中等,与生物膜形成能力强的菌株比较,菌体较少,并有菌丝生长且有聚集。见表4、图2。

注:A~C分别为G1、G2、G3;D~H分别为J1、J2、J3、J4、J5;I为ATCC 22019。图2 近平滑念珠菌生物膜形成情况(200×)Figure 2 Formation of biofilm by C. parapsilosis (200×)

表4 近平滑念珠菌生物膜形成能力Table 4 Biofilm formation ability of C. parapsilosis
2.3 分泌型天冬氨酸蛋白酶表达水平 牛血清白蛋白培养基近平滑念珠菌最佳生长时间为第6天,于第6天测量菌圈及圈层直径,计算Pz值,结果显示,8株临床菌株均能在牛血清白蛋白培养基上不同程度地产生天冬氨酸蛋白酶,在菌落周围形成乳白色的沉淀圈。来自患者甲的菌株产天冬氨酸蛋白酶活性存在差异,G1菌株中表达,G2菌株高表达,G3菌株低表达,3株菌酶体外表达水平比较,差异均有统计学意义(均P<0.05);来自患者乙不同时期血标本分离的5株菌,J1、J5菌株中表达,酶体外表达水平差异无统计学意义(P>0.05),J2、J3、J4菌株高表达,酶体外表达水平差异均无统计学意义(均P>0.05),中表达菌株与高表达菌株比较,差异有统计学意义(均P<0.05)。见表5、图3。
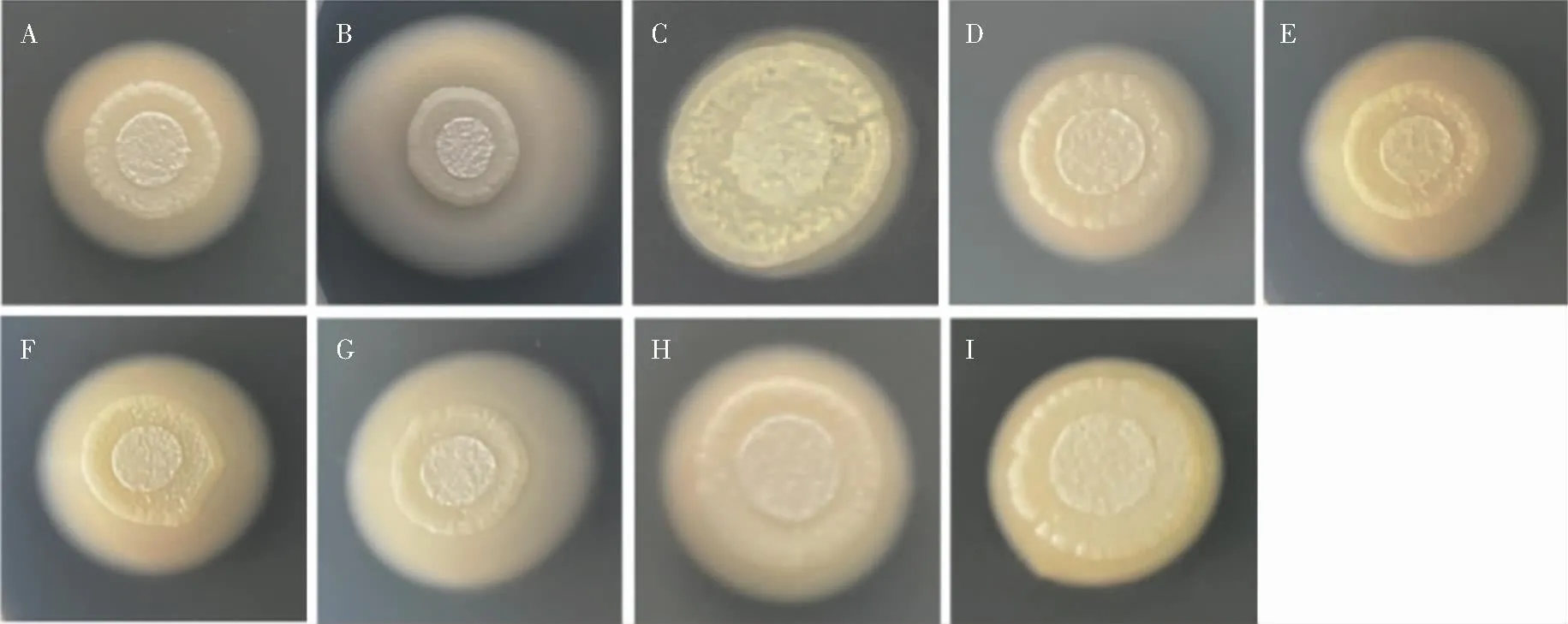
注:A~C分别为G1、G2、G3;D~H分别为J1、J2、J3、J4、J5;I为ATCC 22019。图3 近平滑念珠菌在牛血清白蛋白培养基上产生天冬氨酸蛋白酶情况(培养第6天)Figure 3 Production of aspartic protease by C. parapsilosis on bovine serum albumin medium (on the 6th day of cultivation)
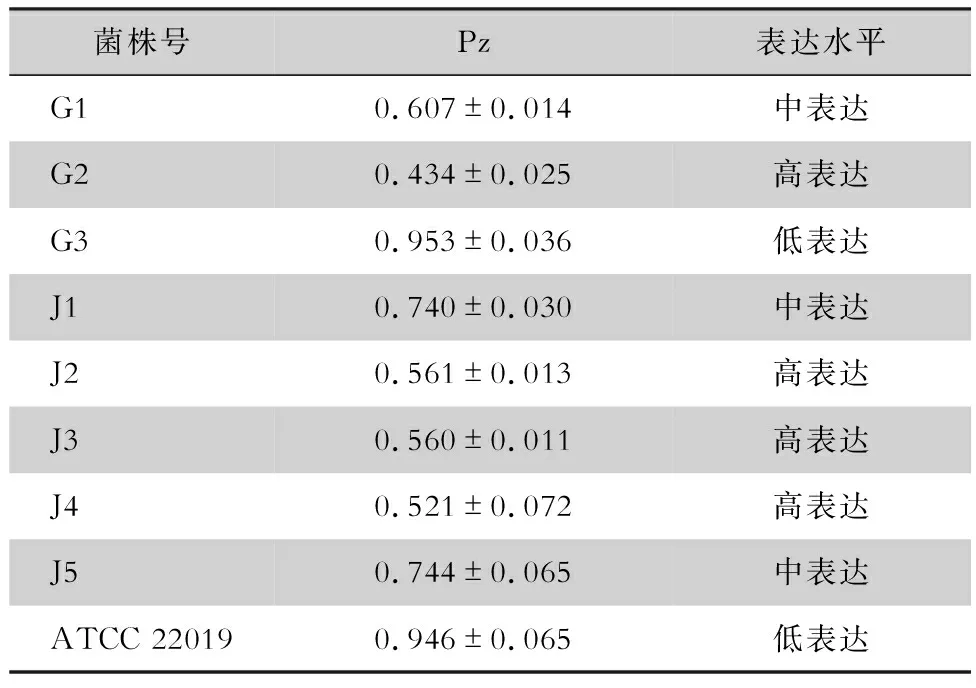
表5 近平滑念珠菌体外天冬氨酸蛋白酶表达水平Table 5 In vitro expression levels of aspartic protease in C. parapsilosis
2.4 毒力相关基因表达情况
2.4.1 生物膜形成相关基因BCR1、EFG1、HWP1 采用qRT-PCR检测8株近平滑念珠菌BCR1、EFG1、HWP1基因表达水平,其中G1、G3、J1菌株BCR1基因表达上调,G1、J1、J2、J3、J4菌株EFG1基因表达上调,J3菌株HWP1基因表达上调,与标准株ATCC 22019相比,差异均有统计学意义(均P<0.05)。患者甲自尿液分离的G1菌株,BCR1、EFG1、HWP1基因的表达水均为最高,G2菌株EFG1基因表达水平低于G1菌株(P<0.05),其余菌株基因表达水平比较,差异无统计学意义(均P>0.05)。患者乙以分离时间最早的J1菌株为对照,各菌株BCR1、EFG1、HWP1基因表达均上调,但差异均无统计学意义(均P>0.05)。见图4。

注:*表示与标准菌株ATCC 22019相比,P<0.05;**表示与标准菌株ATCC 22019相比,P<0.01;#表示与甲患者G1菌株相比,P<0.05;※表示与乙患者J1菌株相比,P<0.05。图4 近平滑念珠菌生物膜形成相关基因的表达水平Figure 4 Expression levels of biofilm formation-related genes in C. parapsilosis
2.4.2 天冬氨酸蛋白酶SAPP基因 采用qRT-PCR检测8株近平滑念珠菌天冬氨酸蛋白酶SAPP1、SAPP2、SAPP3基因表达水平,与标准株ATCC 22019相比,G1菌株SAPP1基因表达上调,G1、G3、J1菌株SAPP2基因表达上调,G1、G3菌株SAPP3基因表达上调,差异均具有统计学意义(均P<0.05)。患者甲自尿液分离的G1菌株,SAPP1、SAPP2、SAPP3基因表达水平均为最高,G2、G3菌株SAPP1、SAPP2基因表达水平均低于G1菌株(均P<0.05),其余菌株各基因表达水平比较,差异均无统计学意义(均P>0.05)。患者乙以分离时间最早的J1菌株为对照,除J3、J5菌株SAPP2基因表达低于J1菌株(P<0.05)外,其余各菌株SAPP1、SAPP2、SAPP3基因表达均上调,但差异均无统计学意义(均P>0.05)。见图5。
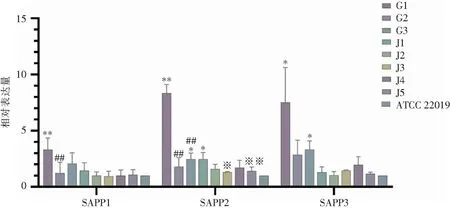
注:*表示与标准菌株ATCC 22019相比,P<0.05;**表示与标准菌株ATCC 22019相比,P<0.01;#表示与甲患者G1菌株相比,P<0.05;##表示与甲患者G1菌株相比,P<0.01;※表示与乙患者J1菌株相比,P<0.05;※※表示与乙患者J1菌株相比,P<0.01。图5 近平滑念珠菌SAPP基因表达水平Figure 5 Expression level of SAPP gene in C. parapsilosis
3 讨论
近平滑念珠菌是最常见侵袭性念珠菌,能引起人类浅表和全身性真菌感染,其感染发病率在不断增加,是目前亚洲、欧洲和南美国家医院中侵袭性念珠菌感染第二或第三常见的菌种[5]。本研究8株临床分离株均来自于老年患者,提示老年人是近平滑念珠菌的易感染人群,与老年人器官功能老化,免疫功能下降,住院时间长等因素相关。因此,老年患者应该积极治疗原发病,提高抵抗力,缩短卧床时间,以减少感染的发生。目前发现的近平滑念珠菌具有Ⅰ、Ⅱ、Ⅲ型三种基因型,据报道[12]其中感染发病率最高的是Ⅰ型近平滑念珠菌,其次是Ⅱ型,Ⅲ型较罕见。本研究临床分离株通过基因鉴定,均为基因Ⅰ型。对8株近平滑念珠菌临床菌株进行微卫星分型后共分为4个型别,甲患者不同部位分离的3株菌属于3个不同的型别,提示患者可同时感染不同型别的近平滑念珠菌;乙患者不同时间自血液分离的5株菌株为同一型别。
真菌的发病机制是由多种毒力因子的动态表达促进的,其形成的生物膜和分泌的蛋白水解酶与疾病的发生和发展有关。生物膜是微生物菌体与细胞外基质的复合体,是由菌体在其分泌的细胞外基质内包裹中形成的结构。念珠菌形成的生物膜结构和组成具有高度的物种依赖性,与白念珠菌相比,近平滑念珠菌形成的生物膜结构更简单,主要由聚集的芽孢、假菌丝和大量低蛋白质含量的细胞外碳水化合物组成。不同临床分离株的整体生物膜形成能力存在很大的差异[13]。近平滑念珠菌产生的成熟生物膜对宿主构成了威胁,其为抗真菌药物作用菌体和宿主免疫识别菌株提供了保护。多数情况下生物膜的存在加重患者的病情,甚至威胁患者的生命[14]。BCR1基因是生物膜主要的调节因子及转录因子,是白念珠菌和近平滑念珠菌生物膜形成所必需的一种乙炔锌脂蛋白的编码基因[15],该基因对白念珠菌中的细胞壁蛋白基因Als1、Als3和Hwp1的表达十分重要。在Δbcr1/bcr1菌株中ALS3和HWP1的表达降低,黏附于内皮细胞、上皮细胞的能力降低[16]。在近平滑念珠菌中,删除BCR1基因时,生物膜与正常条件下形成的生物膜相比更薄[17]。EFG1基因编码增强丝状生长蛋白,通过改变菌株存在的形态,使菌株侵袭能力增强[18]。HWP1基因编码酸性甘露糖蛋白(HWP1P),研究[19]发现,HWP1P是近平滑念珠菌菌丝发育和生物膜形成所必须的,同时还可介导近平滑念珠菌稳定的黏附在宿主细胞上。本研究中的8株临床菌株均能不同程度的形成生物膜,患者甲不同部位分离的菌株形成生物膜的能力比较,差异具有统计学意义(P<0.05),其中尿液和血液来源的近平滑念珠菌较导管来源的近平滑念珠菌生物膜形成能力更强,与其生物膜形成基因表达一致。G1菌株生物膜形成相关基因BCR1、EFG1及HWP1的表达都是最高的,其次是从血液分离的菌株G3,自导管分离的菌株G2 3个基因的表达量均低于G1、G3株菌。患者乙不同时间自血液分离的5株近平滑念珠菌体外生物膜形成能力,均有中等形成能力,各菌株间分离时间相差一个月左右,其中J5菌株生物膜形成能力强于其他4株(均P<0.05),提示临床分离的近平滑念珠菌大多数具有生物膜形成能力,给近平滑念株菌感染患者带来严重的威胁。不同生存环境会影响生物膜的形成,导致菌株之间的致病能力也有所不同。近年来,植入式医疗设备在患者中的应用数量急剧增加。医疗设备植入后,宿主组织细胞和病原菌竞争黏附于其表面。生物膜定植在组织和留置装置上被认为是危及生命感染的一个重要危险因素,特别是在易感宿主中,近平滑念珠菌是医疗植入设备感染的主要原因。因此,抑制生物膜的形成,将成为防治近平滑念珠菌感染的一个重要靶点。
在入侵过程中,病原真菌会分泌各种水解酶破坏宿主细胞膜,降解细胞外基质成分,从而破坏宿主组织。除损伤宿主屏障功能外,真菌水解酶还可促进细胞黏附,生物膜形成或细胞内存活。天冬氨酸蛋白存在于各种生物体中,是病原真菌分泌的水解酶,可以直接介导毒力。天冬氨酸蛋白酶通过降解参与宿主防御的蛋白质(如补体和抗菌蛋白)或逃避体液免疫反应的抗体来促进入侵宿主。此外该蛋白酶降解多种其他蛋白质,如细胞外基质和细胞表面蛋白质,以增强入侵过程中的营养获取[10]。目前,通过研究近平滑念珠菌产生天冬氨酸蛋白酶的分子机制,已经鉴定出3个天冬氨酸蛋白酶编码基因SAPP1、SAPP2和SAPP3。尽管SAPP1极大地决定了近平滑念珠菌的毒力,但其并不是蛋白酶产生的唯一原因。研究[20]表明,在没有SAPP1的情况下,另一个分泌天冬氨酸蛋白酶编码基因(SAPP2)的表达显著升高,显示出补偿作用。SAPP2对底物的作用不同于SAPP1对底物的切割,表明这两种蛋白质的激活机制有所不同[21]。SAPP3也可以翻译成活性蛋白,在重组人类口腔上皮感染的过程中SAPP3表达水平升高[22]。
本研究发现,8株临床菌株均能表达天冬氨酸蛋白酶,患者甲不同部位分离的不同MT型别的菌株天冬氨酸蛋白酶的表达水平具有明显的差异,其中G3为低表达,G1为中表达,G2为高表达。天冬氨酸蛋白酶基因表达检测结果显示,来自尿液的G1菌株SAPP1、SAPP2、SAPP3基因的表达水平是最高的,且均高于G2、G3菌,自血管导管分离的菌株G2 3个基因的表达水平最低,表明同一患者不同感染部位分离的菌株在不同的环境中天冬氨酸蛋白酶表达水平存在差异。患者乙不同时期自血液分离的5株近平滑念珠菌中天冬氨酸蛋白酶的表达水平,J1、J5为中表达,J2、J3、J4菌株为高表达;SAPP1、SAPP2、SAPP3基因表达水平差异不大,在不同时间段患者血液内,内环境在不断的变化,使得SAPP基因在这5株临床菌株内的表达水平不断变化。SAP家族酶学活性具有pH依赖性,常只在酸性pH值范围内活化。对病原体而言,若共处在中性pH值范围的宿主组织中极为不利。即便如此,SAP家族各成员的最适pH值也明显不同,SAPP1~SAPP3在低pH值活性最高。因此,SAP的最适pH值给近平滑念珠菌提供了pH值从2~7的水解活性范围,有利于真菌感染泌尿道或阴道(均为酸性)从而致病[22]。
病原菌的毒力因子能够促进病原菌侵入、定植及造成宿主损伤。毒力因子与感染风险、药物的敏感性密切相关,通过检测毒力因子的表达水平可以确定感染菌株的毒力大小,预测抗真菌感染药物的疗效及患者的感染风险,从而指导抗真菌药物的选择,为制定针对性治疗方案提供依据。与标准菌株相比,临床分离株的各毒力因子表达水平均明显升高,提示临床分离株强毒力导致其致病能力增强,引起患者感染。老年患者由于基础疾病较多,免疫力下降,是真菌感染的高危人群,同时长期卧床的老年患者常留置导管,从而引起多源性感染。本研究发现同一患者同时期可能存在多部位感染不同型别的近平滑念珠菌,不同部位分离的菌株毒力因子表达存在差异,分离自尿液的临床株毒力因子表达水平明显高于其他来源的菌株,不同时期分离的菌株间毒力因子的表达无明显差异。近平滑念珠菌感染是一个复杂的过程,受患者血液、尿液等体液环境变化的影响,可能通过影响菌株毒力的表达从而导致致病力的不同。本研究发现自尿液分离的G1菌株生物膜形成能力强,体外天冬氨酸蛋白酶分泌水平较高,其相关基因的表达水平也相应较高,提示近平滑念珠菌临床株生物膜形成能力与生物膜形成相关基因BCR1、EFG1、HWP1表达可能存在关联,天冬氨酸蛋白酶的分泌水平与天冬氨酸蛋白酶SAPP基因的表达可能存在关联。本研究因样本量较少,具有一定的局限性,后续将扩大样本量,进一步研究不同来源菌株毒力因子差异的特征及关联性。
利益冲突:所有作者均声明不存在利益冲突。

