四羧基苯基卟啉铜敏化BiOCl纳米片的制备及其增强光催化性能研究
毕佳敏, 徐 来, 孙惠钰, 刘瑞丹, 乔 儒
(浙江师范大学 先进催化材料教育部重点实验室,浙江 金华 321004)
0 引 言
自1972年Fujishima等[1]发现TiO2电极在紫外光照射下能够电解水之后,半导体光催化技术因其绿色环保、高效清洁的特点,在光催化制氢、固氮、CO2转换、污染物降解等太阳能转换和环境治理方面的应用受到众多研究者的关注[2-5].近年来,各国研究人员相继开发出具有d10电子结构的ⅢA,ⅣA,ⅤA金属离子(如Ga3+,In3+,Ge4+,Sn4+,Sb5+等)的氧化物、硫化物、氮化物,以及具有d0电子结构的过渡金属(如Ti4+,Zr4+,Ta5+,Nb5+,W6+等)基化合物为代表的种类繁多的光催化材料[6-7].
在上述材料中,二维层状半导体材料,例如石墨相氮化碳、过渡金属硫化物、层状双氢氧化物、杂化钙钛矿材料等,以其独特的结构被广泛应用于光催化领域的研究,其中,铋基光催化剂BiOCl被认为是最具价值的光催化剂之一[8].BiOCl是一种Ⅴ-Ⅵ-Ⅶ族三元半导体[9],具有独特的层状结构、合适的化学稳定性和耐腐蚀性.但是宽禁带特性(3.2~3.5 eV)导致其光生载流子的分离能力较低,使其光催化活性受到抑制[10].染料敏化是目前通常采用的一种改性方法[11],它将染料作为敏化剂通过物理或化学方法固载到BiOCl表面,染料分子在吸收可见光后被激发,将电子注入到BiOCl导带(CB),从而提高BiOCl的光响应范围、可见光利用率、光生电子-空穴对的分离效率及其催化活性.例如Sarkar等[12]报道了BiOCl空心微球诱导RhB作为染料敏化剂参与光催化反应过程的工作,RhB的LUMO能级和BiOCl的CB边能级分别为-1.10,-0.15 eV,RhB能吸收可见光形成活性物质RhB*,其表面的电子转移到BiOCl的CB上.随后,转移的电子和形成的空穴与O2和H+反应形成自由基.由此可见,通过引入LUMO比BiOCl的CB更负的光敏剂对BiOCl进行表面光敏化处理,以拓展其在可见光范围的响应能力是一种简便、有效的改进策略.
但是,染料敏化处理也存在染料易脱附、流失及易被漂白而失活等问题,因此,获得稳定性良好的染料敏化剂是解决该问题的关键.卟啉及金属卟啉等卟啉类化合物是一类具有18个π电子的大共轭体系的染料,具有高效的光热稳定性、可见光吸收特性及光催化活性.通过共价键将金属卟啉与光催化活性单元连接在一起形成敏化剂/催化剂复合体系,可以提高复合材料对可见光的利用效率,通过二者的协同作用,可以有效提高其光催化活性.钴卟啉敏化TiO2、铜卟啉修饰In2TiO5、锌卟啉与异烟酸共同修饰TiO2等已报道的复合体系[13-14]与纯半导体相比,都具备更高的光催化活性.结合BiOCl与金属卟啉二者的优异性质,本文以CuTCPP为敏化剂,采用一步水热法原位合成了BiOCl/CuTCPP(BP)片状结构复合材料,研究了材料的结构、形貌、化学组成等性质,考察了CuTCPP的引入对BiOCl的光吸收、电荷分离和运输的改善效果.通过RhB降解实验评价了BP复合体系的光催化活性及稳定性.最后,通过自由基猝灭和电子顺磁共振谱测试探讨了活性物质的产生,并提出了该体系可能的光催化作用机制.
1 实验部分
1.1 材料制备
所用药品均为分析纯试剂,无须进一步纯化即可使用.
1.1.1 BiOCl纳米片的制备
将2 mmol Bi(NO3)3·5H2O(0.97 g)和2 mmol KCl(0.149 g)溶解于30 mL蒸馏水中,搅拌30 min,将上述混合溶液转移至40 mL的反应釜中,在160 ℃下反应6 h.反应结束后自然冷却至室温,离心收集所得产物,用水和乙醇分别洗涤多次,在80 ℃下干燥、研磨备用.实验同时考察了反应温度及反应时间对BiOCl形貌及光催化活性的影响,以此确定BiOCl及BP复合体系的最佳制备条件.
1.1.2 BiOCl/CuTCPP(BP)复合体系的制备
在1.1.1所述反应体系中加入一定量的CuTCPP,保持其他反应条件不变,反应结束后所得固体产品即为BP复合材料.为了考察CuTCPP在BiOCl表面沉积量改变对复合光催化剂作用活性的影响,按照CuTCPP与硝酸铋物质的量之比分别为0.1%,0.2%,0.4%和0.8%调整CuTCPP的加入量,所得4组样品分别标记为BP-0.1%,BP-0.2%,BP-0.4%和BP-0.8%.
1.2 表 征
利用扫描电子显微镜(SEM)、透射电子显微镜(TEM)、X射线衍射仪(XRD)、傅里叶红外光谱仪(FT-IR)、X射线光电子能谱仪(XPS)、荧光分光光度计、紫外-可见-近红外分光光度计对样品的形貌、结构、元素组成、样品表面官能团、化学状态、光学性能等性质进行表征.利用SC28-CHI660E型电化学工作站在300 W氙灯辐照下对样品的电化学性质进行测试.
1.3 光催化降解RhB性能评价
室温下将20 mg光催化剂超声分散于50 mL RhB(10 mg/L)溶液中,避光搅拌60 min以达到RhB在光催化剂表面的吸附-解吸平衡.吸取3 mL溶液离心处理,取上清液测其吸光度值.使用300 W氙灯,先后以紫外光及模拟太阳光作为激发光源,对RhB溶液进行光催化降解实验.在该过程中,每隔5 min吸取3 mL反应溶液,离心处理后,取上清液测定其吸光度值.
2 结果与讨论
2.1 BiOCl纳米片的制备
图1a为BiOCl样品的XRD谱图.如图所示,样品在2θ=11.9°,24.2°,25.9°,32.6°,33.7°等处的衍射峰分别对应于四方相BiOCl(JCPDS 06-0249)的(001),(002),(101),(110),(102)等晶面,这些衍射峰尖锐且没有其他杂峰出现,表明BiOCl样品结晶性良好且纯度很高.
图1b~图1e为改变水热反应温度所得BiOCl样品的SEM图.从SEM图中观察到,BiOCl的形貌整体呈现由纳米晶粒自聚集形成接近圆形的二维纳米片状结构.固定反应时间6 h不变,随着反应温度的提高,BiOCl的形貌仍为纳米片状结构,纳米片的尺寸从1.5 μm左右增加到3.0 μm左右,厚度从78 nm左右增加到156 nm左右,整体尺寸及厚度呈现逐渐增加的趋势.
如图1f所示,BiOCl样品的光催化活性随着水热反应温度升高没有明显的变化.将避光条件下催化剂表面RhB吸附平衡反应过程和紫外光照催化反应过程相结合,通过吸光度分析可以得出,4组样品光催化RhB降解率分别为97.8%(120 ℃),96.4%(140 ℃),100%(160 ℃)及97.9%(180 ℃).从该组数据可以发现,随着纳米片厚度增大,产品的光催化性能呈现微弱的先增强后减弱的趋势,反应温度为160 ℃时所得BiOCl样品相较其他3组样品可在更短的光照反应时间(20 min)内实现反应结束,具有最佳的表面吸附及光催化反应性能.目前普遍认为在量子尺寸效应的作用下,半导体纳米材料的粒径越小,其有效禁带越大,进一步提高光生电子和空穴的还原能力和氧化能力,进而使光催化活性增强.但据本文及文献[15]研究结果,影响BiOCl纳米片光催化活性的因素不仅仅是晶粒的尺寸大小,还应考虑量子尺寸效应所导致的带隙宽化度增加与实验光源响应性之间的关系.本文所用灯源紫外波长为280~380 nm,BiOCl尺寸增大会使其带隙能减小,因此,BiOCl的光响应范围增大,光诱导产生的电子和空穴数量也会相应增加,导致有效参与氧化还原反应的光生电子和空穴的数量增加,进而使得光催化效率提高;与之相反,当BiOCl尺寸降低时,带隙宽化度加剧会导致部分光源波长不能满足激发电子所需能量,所以出现120 ℃反应温度下所得样品的光催化性能略低于160 ℃下所得样品的性能.但是,当BiOCl纳米片的尺寸和厚度随反应温度的升高(180 ℃)而进一步增大时,光生电子和空穴从半导体相体内扩散运动至其表面的时间和路径都会延长,这也导致光生电子和空穴的复合概率增大,实际参与氧化还原反应的光生载流子数量降低,进而导致其光催化活性降低.
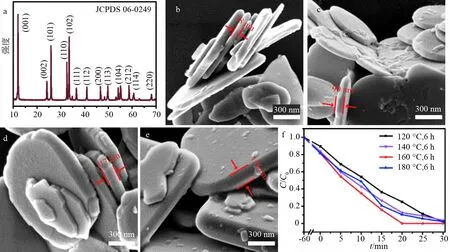
a:XRD;b:120 ℃;c:140 ℃;d:160 ℃;e:180 ℃;f:RhB光降解
图2显示,当反应时间为3 h时,所得BiOCl虽然尺寸大小分布并不均匀,但是产物形貌主体呈现四方形纳米片结构.当反应时间延长至6 h时,BiOCl尺寸增大,方形纳米片的4个角逐渐转变为圆弧角,形貌也逐渐向圆形纳米片转变.进一步延长反应时间至9~12 h时,BiOCl已完全生长为尺寸相近、边缘光滑的圆形纳米片结构,片层厚度有所增加.该变化可以通过Ostwald熟化原理解释,在反应初期通过常规的成核、表面能最小化驱动下的自聚集产生方形纳米片结构之后,由于4个角上的原子较为活泼,易被刻蚀发生重构,即在局部小晶体内部表面能比较高的情况下,逐渐溶解并溶出,随后在纳米片表面产生二次沉积,因此,导致向圆形片状结构的转变及厚度增加.
图3为上述不同反应时间所得BiOCl样品在紫外光照下催化降解RhB的效果图.如图所示,

a:3 h;b:6 h;c:9 h;d:12 h
与在160 ℃下分别反应3,9,12 h所得样品的光催化性能相比,依然是反应6 h所得到的BiOCl的光催化性能最佳,光照反应20 min后RhB的降解率达到100%.上述实验结果表明,BiOCl纳米片的尺寸、厚度及其光催化性能的优化可以通过调控水热反应温度和反应时间来实现,其中,最佳反应温度和反应时间分别为160 ℃和6 h,后续BP复合体系的一步法合成也在该条件下完成.
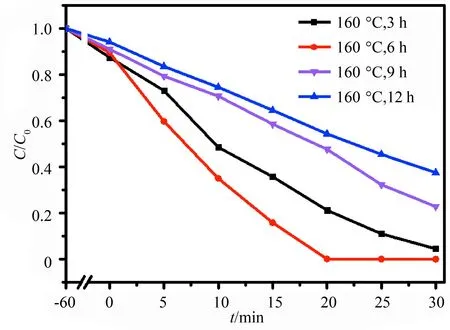
图3 BiOCl样品在紫外光下催化降解RhB的性能评价
2.2 BiOCl/CuTCPP(BP)复合光催化剂的制备
通过水热法原位合成BP复合材料的过程中,CuTCPP中-COOH可以与BiOCl表面的-OH发生键合,二者之间氢键的形成可以稳定BP的结构,在加热条件下,还可以发生酯化脱水反应形成共价键,足够强的官能化也可避免CuTCPP在水中的脱附.图4a为BP的SEM图,可以看出,BP的形貌及尺寸与BiOCl基本一致,呈现接近圆形的纳米片结构,说明在BiOCl表面负载CuTCPP对形貌影响不大.从图4b中可以观察到晶格条纹间距为0.275 nm,与四方相BiOCl的(110)晶面相对应.在BP复合体系中,因为CuTCPP的含量较低且作为光敏剂对HRTEM电子束非常敏感,所以没有明显观察到CuTCPP的存在.图4c为BP样品的XRD谱图,4组样品均呈现出与BiOCl四方晶相结构相匹配的衍射峰,且无其他杂质衍射峰,这表明CuTCPP的引入对BiOCl的晶体结构没有明显的影响.但随着非晶体物质CuTCPP沉积量的增加,BP在2θ=11.9°处的(001)衍射峰强度显著减弱,其他衍射峰强度相比BiOCl也有一定程度的减弱,类似结果在TiO2-SiO2复合体系的设计合成中也被报道过[16],证实了CuTCPP在BiOCl表面的负载及BP复合体系的成功构建.图4d为CuTCPP及系列BP复合光催化剂的红外图谱.对于BP而言,在500~600 cm-1处的特征吸收峰对应于BiOCl中的Bi-O键伸缩振动;1 000 cm-1左右的吸收峰对应于铜卟啉中的N-Cu
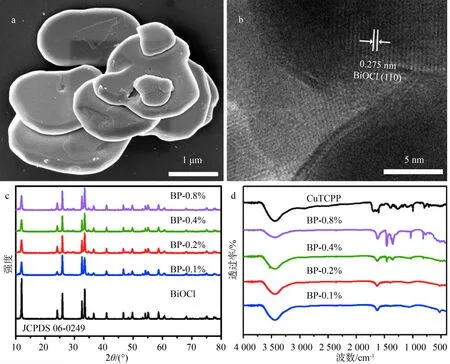
a:SEM;b:HRTEM;c:XRD;d:FT-IR
键的特征吸收;869与1 395 cm-1处出现的2个吸收峰对应于CuTCPP中的C-C和C-N键的伸缩振动;1 106和1 071 cm-1处的吸收峰对应于CuTCPP中羧基的C=O和C-O键的特征吸收.上述特征峰的存在说明了对应官能团或化学键的存在,它们分别来源于BP光催化剂中的BiOCl和CuTCPP,因此,进一步证明CuTCPP与BiOCl的成功结合.
利用XPS对样品的表面化学组成和价态进行表征.图5a为BiOCl单一组分与BP复合体系的元素分析全谱,2组全谱中均存在Bi,O和Cl的能谱峰.图5b为Bi 4f的高分辨谱图,159.30,164.61 eV处2个特征峰分别对应于BiOCl的Bi 4f7/2和Bi 4f5/2,而BP中Bi 4f的2个峰分别向低结合能方向偏移至159.06,164.40 eV,这是因为水热处理过程中,CuTCPP与BiOCl表面羟基形成共价键,增大了BiOCl表面电子流动性所致[17],同时也表明BiOCl在BP复合体系中得到电子.图5c是O 1s的高分辨谱图,位于530.04,531.17 eV处的2个能谱峰归属于半导体中的晶格氧和表面羟基氧,BP样品的O 1s分别向低结合能方向偏移至529.84,531.14 eV,同样可以验证BiOCl在复合体系中得到电子的状态.图5d是Cl 2p的高分辨谱图,197.72和199.30 eV处的2个特征峰分别对应于BiOCl的Cl 2p3/2和Cl 2p1/2,而BP中Cl 2p的2个峰分别向低结合能方向偏移至197.56,199.16 eV[18].图5e为C 1s的高分辨能谱,284.21,288.43 eV处的2个特征峰分别对应于CuTCPP中的C-C键和C=N键,而BP中的C-C峰向高结合能方向偏移至284.32 eV,表明CuTCPP失电子的特征.图5f为N 1s的XPS及分峰拟合谱图,在397.95,400.95 eV处的2个峰分别对应于CuTCPP中sp2杂化吡啶氮(C=N-C)和三级氮(N-C3),而BP的N 1s的吡啶氮的特征峰向高结合能方向移动,表明在BP体系中,电子从CuTCPP向BiOCl转移.
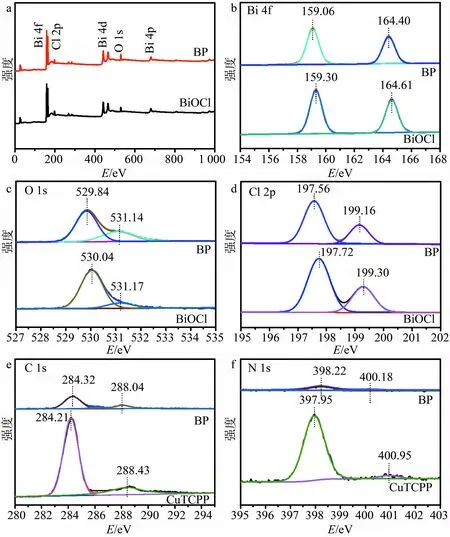
a:全谱;b:Bi 4f;c:Cl 2p;d:O 1s;e:C 1s;f:N 1s
从紫外-可见漫反射光谱(见图6a)可以看出,BiOCl纳米片的吸收边缘约为359 nm,表明其仅在紫外范围内具有光吸收能力.在可见光区,相比于纯BiOCl,随着CuTCPP含量的增加,BP复合体系的光吸收性能在400~700 nm处逐渐增强,这是因为CuTCPP的吸收峰位于420 nm附近(Soret带)和500~600 nm(Q带),有较强的紫外/可见光吸收能力.因此,CuTCPP对BiOCl表面敏化处理后,BP的光吸收范围明显拓宽到可见光区域,而且随着CuTCPP负载量的增加,BP的光吸收强度增强.
图6b为BiOCl与BP的荧光光谱,BiOCl在激发波长处有1个较强的发光峰.与纯BiOCl相比,BP复合材料的光致发光强度显著降低,表明电子和空穴的复合受到了较大的阻碍.随着CuTCPP负载量的增加,该二元复合材料的光致发光强度先减弱后增强,BP-0.2%的光致发光强度最低,说明其光生电子-空穴对的分离效果最佳.由此可知,CuTCPP与BiOCl成功结合后,光生电子-空穴对的重组被有效抑制,二者的快速分离是提高该复合材料光催化活性的直接原因.
图6c为紫外光照射下BiOCl与BP样品的瞬态响应光电流图,结果表明,BP复合体系的光电流密度明显比BiOCl更高,而且随着CuTCPP沉积量的增加表现出先升高后降低的趋势,其中,BP-0.2%样品具有最高的光电流密度,表明其光激发电荷寿命长,可以增强材料的光催化活性.该现象产生的原因在于光照条件下,CuTCPP的LUMO电子跃迁到BiOCl导带,有效抑制了光生载流子的复合,提升了光生电子和空穴的分离效率.图6d为BP样品的电化学阻抗谱图,突出显示了催化剂与电解质溶液之间的界面电荷转移电阻.与BiOCl相比,BP样品的EIS Nyquist弧半径明显减小,表示其光生载流子转移过程的限制变低,因此,BP具有更高的光生载流子分离和传输效率.其中,BP-0.2%展示出最小的EIS Nyquist半径,说明该样品具有最佳的电荷转移能力,这与光致发光谱图和瞬态光电流谱图的结果一致.
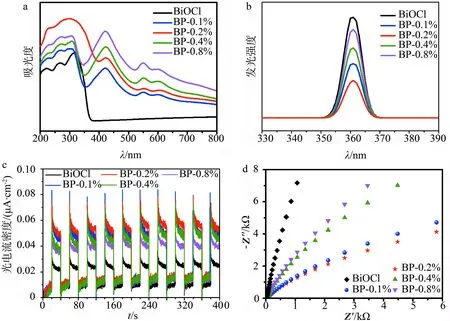
a:UV-Vis图谱;b:光致发光谱图;c:瞬态响应光电流;d:阻抗图
2.3 BP光催化降解RhB的性能评价
图7a为BP样品在紫外光照射下光催化降解RhB的效果图,与相同条件下所得BiOCl纳米片相比,BP样品光催化降解RhB的效果更加显著,其中,BP-0.2%的光催化活性最佳,在紫外光照5 min后便可使RhB的降解率达到98%,光照时间延长至10 min可实现染料分子的完全降解,明显节省了反应时间并降低了反应能耗,同时也证实了CuTCPP的引入提高了BiOCl的光催化活性.BP体系在紫外光激发下催化活性增强的主要原因在于,利用CuTCPP对BiOCl纳米片表面进行敏化处理既增强了BiOCl在紫外范围内的光吸收能力,同时又有效抑制了BiOCl内的光生电子-空穴对的复合.但是CuTCPP在BiOCl表面过多的负载也会导致体系的光催化活性减弱,该现象产生的原因可能是,过量的CuTCPP在BiOCl表面的聚集会导致半导体吸收光子的效率降低,并且影响半导体与染料分子的接触面积,不能保证光照条件下所产生的电子、空穴分别与氧分子和水充分反应,同时金属卟啉含量较多时,容易转化为没有活性的二聚体,导致催化敏化效果较差,因此,BP复合体系的光催化活性呈现出先升后降的趋势.
图7b探究了BP在模拟太阳光下催化降解RhB的效果.紫外光在模拟太阳光谱中占比较少,所以BP样品在模拟太阳光下所展示出的催化活性相较于在紫外光下的催化活性有所减弱,但仍表现出比纯BiOCl更高的活性.在模拟太阳光激发下,与BiOCl及其他BP样品相比,BP-0.2%表现出最强的光催化降解RhB效率,该结果与紫外光激发下所得结果一致.在光照反应10 min后,BP-0.2%便可使RhB的降解率达到97.2%,光照时间延长至20 min可实现染料分子的完全降解,在控制反应时间及降低反应能耗方面也表现优良.同时,由于光催化降解RhB遵循伪一级动力学,可以用表观速率常数表示样品的催化效率.图7c表明在模拟太阳光激发下,BP样品的催化效率明显高于单一BiOCl,其中BP-0.2%具有最高的催化效率,再次证明,表面负载CuTCPP有利于提高BiOCl的光催化活性.
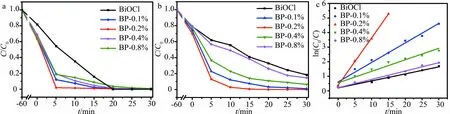
a:紫外光;b:模拟太阳光;c:表观速率常数图
在模拟太阳光照射下,通过设计BP-0.2%样品回收循环利用催化降解RhB实验来考察BP样品的光催化稳定性.如图8所示,BP-0.2%的光催化活性在样品经过循环使用7次之后有一定的下降,但下降的幅度较小,光照反应30 min后,光催化降解RhB的效率仍然能够保持在94.0%,说明BP的重复使用性能比较理想,这主要归因于CuTCPP与BiOCl之间产生的较强的相互作用.在此基础上,进一步提高其循环利用次数,BP光催化降解RhB的效率会因为多次回收过程中催化剂的损失,以及表面吸附的染料分子对活性点位的遮蔽而有较为明显的降低(BP-0.2%在第8次回收使用中,RhB的降解率降至83.0%,在第9次中降至64.0%).
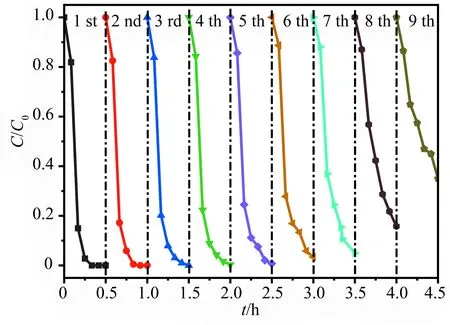
图8 光催化降解RhB的循环使用性能
2.4 光催化反应机理
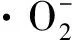
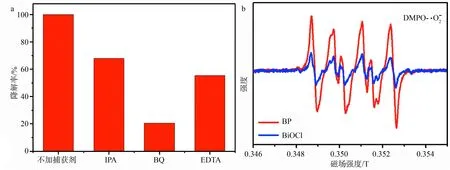
a:自由基猝灭实验结果;b:ESR谱图
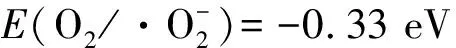
3 结 论
采用简单的一步水热法制备了BiOCl/CuTCPP(BP)片状结构复合光催化材料.在紫外光及模拟太阳光激发的光催化降解RhB实验中,BP均表现出优于纯BiOCl的光催化性能,其中,BP-0.2%样品的光催化性能在所测的BP样品中表现最佳.
——潘桂棠光生的地质情怀

