藏红花素通过跨膜受体蛋白/发状分裂相关增强子1信号通路对缺氧诱导的视网膜神经节细胞凋亡的影响
王玉风,付珂,王洪亮
作者单位:南阳医学高等专科学校第一附属医院眼科,河南 南阳473000
视网膜组织的缺氧性病变是引起常见眼部疾病如青光眼、糖尿病视网膜病和视网膜中央动脉阻塞的原因之一[1]。视网膜神经节细胞(retinal ganglion cells, RGCs)逐渐凋亡和视野缺损是视力障碍和失明的主要病理特征[2]。RGCs 位于视网膜内层,在视觉功能正常运行中起着重要作用,缺氧所致的视网膜损伤可以诱发RGCs 凋亡,严重时可导致病人失明[3]。藏红花素提取自鸢尾科植物藏红花柱头的有效活性成分,具有活血化瘀、抗肿瘤和抗氧化等多种药理作用[4]。发状分裂相关增强子1(Hes-1)是细胞跨膜受体蛋白(Notch1)信号通路的靶基因,与神经元受损后修复有着密切关系。研究发现,藏红花素可能通过调节Notch1∕Hes-1 信号通路对RGCs有神经保护作用,但其对RGCs 凋亡的影响研究较少[5]。本研究于2021年1月至2022年1月通过氯化钴处理RGCs 建立缺氧模型,探讨藏红花素对缺氧诱导的RGCs细胞凋亡的影响。
1 材料与方法
1.1 材料SD 大鼠视网膜神经节细胞系RGC-5 购于美国ATCC 公司。藏红花素(陕西浩洋生物科技有限公司,货号HY-798);跨膜受体蛋白信号通路抑制剂(DAPT)(上海易恩化学技术有限公司,货号A01906);抗坏血酸(上海西格玛奥德里奇贸易有限公司,货号W210901);β-肌动蛋白(β-actin)、B 细胞淋巴瘤因子2(Bcl-2)、Bcl-2 相关蛋白(Bax)和钙依赖性蛋白酶家族1(Calpain1)多克隆抗体、山羊抗兔二抗IgG(美国Cell Signaling 公司)。FACS Verse 型流式细胞仪(美国Becton,Dickinson and Company);DYY-6C型电泳仪(北京六一仪器厂)。
1.2 方法
1.2.1 MTT 检测细胞存活情况 采用MTT 实验检测不同浓度藏红花素对RGC-5 细胞活力的影响,取对数生长期RGC-5 细胞200 μL,接种于96 孔板中,细胞浓度为1×104个∕毫升。分别给予0、5、10、25、50和100 μmol∕L 的藏红花素处理细胞,细胞贴壁生长后,每孔加入10 μL MTT 溶液(5 g∕L),继续培养4 h,加入二甲基亚砜溶液100 μL 振荡10 min。酶标仪检测各孔吸光值,计算细胞存活率。
1.2.2 缺氧模型建立 将RGC-5 细胞常规培养传代,取第3 代对数生长期细胞用于实验。参考文献[6]用量,使用氯化钴(COCl2)400 mmol∕L处理RGC-5细胞建立缺氧模型,MTT法检测细胞存活率,细胞存活率约为50%,即接近半数致死浓度,模型建立成功。
1.2.3 细胞分组 缺氧模型建立成功的细胞分为缺氧组、藏红花素组、阳性对照(抗坏血酸)组和藏红花素+Notch1 信号通路抑制剂(DAPT)组,另设对照组。另提前配制好实验所需的藏红花素溶液和抗坏血酸溶液,备用。藏红花素组在氯化钴处理24 h 前使用含有25 μmol∕L 藏红花素溶液的细胞培养液进行预处理,参考文献[7-8]用量,阳性对照组在氯化钴处理24 h 前使用20 μmol∕L 抗坏血酸溶液的细胞培养液进行预处理,藏红花素+DAPT 组在氯化钴处理24 h 前使用25 μmol∕L 藏红花素和10 μmol∕L DAPT溶液的细胞培养液进行预处理,对照组为等量完全培养基。
1.2.4 MTT 法检测细胞存活情况 将对数生长期RGC-5 细胞使用胰蛋白酶消化重悬,接种于96 孔板中,每孔约1×104个细胞,按“1.2.2”所述进行药物干预,参照“1.2.1”的方法检测细胞存活率。
1.2.5 细胞凋亡率检测 胰蛋白酶消化RGC-5 细胞,磷酸盐缓冲液(PBS)清洗2 次,重悬细胞制备细胞悬液,浓度调整为5×105个∕毫升,细胞接种于6 孔板中,按“1.2.2”所述进行药物干预。离心收集细胞于离心管中,PBS溶液清洗,每孔加入异硫氰酸荧光素标记的膜粘连蛋白液5 μL和碘化丙啶染液5 μL,混匀,避光孵育15 min,上机检测。
1.2.6 Flou-4染色检测细胞钙离子水平 将RGC-5细胞制成单细胞悬液,密度为1×106个∕毫升,以每孔200 μL 的量接种于6 孔板中,按照“1.2.1”所述给药后,常规培养24 h 后。取适量钙荧光探针Fuo-4AM母液用PBS配制成5 μmol的工作液,取出6孔板,每孔加入稀释后的Fuo-4AM工作液2 mL,于37 ℃孵育30 min,弃去上清液,预冷PBS洗涤细胞2次,荧光显微镜下观察并拍照。
1.2.7 RT-PCR 检测mRNA 表达 取按照“1.2.2”所述进行药物干预后的各组RGC-5 细胞,通过Trizol一步沉淀法提取总RNA,检测各组细胞跨膜受体蛋白(Notch1)、发状分裂相关增强子1(hairy division related enhancer 1,Hes-1)mRNA 表达情况。使用逆转录试剂盒获得cDNA。配制PCR 反应体系进行扩增,设置PCR 反应条件为:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火55 s,72 ℃延伸50 s,共进行40次循环,根据2-ΔΔCt法计算目的基因与内参基因的相对表达量。引物设计:Notch1 正向5′GATGGCCTCAATGGGTACAAG3′,反向5′TCGTTGTTGTTGATGTCACAGT3′;Hes-1 正向5′TCAACACGACACCGGACAAAC3′,反向5′ATGCCGGGAGCTATCTTTCTT 3′;β-actin 正 向5′GTGACGTTGACATCCGTAAAGA3′,反向5′GCCGGACTCATCGTACTCC3′。
1.2.8 蛋白质印迹法检测蛋白表达 取按照“1.2.2”所述进行药物干预后的各组RGC-5 细胞,裂解提取总蛋白,BCA 检测盒测定蛋白浓度。取40 μg蛋白进行聚丙烯酰胺凝胶电泳,并将分离胶上的蛋白湿转至PVDF 膜上,5%脱脂奶粉封闭1 h,抗体(1∶1 000)4 ℃孵育过夜,二抗(1∶5 000)室温孵育1 h,TBST 溶液清洗。ECL 法显色,凝胶成像系统显影,Image J 分析蛋白条带灰度值,计算各组相对蛋白表达量。
1.3 统计学方法SPSS 23.0软件进行数据分析,细胞活力、细胞凋亡率、细胞内钙离子水平、Notch1 和Hes-1mRNA 表达水平以及Bcl-2、Bax 和Calpain1 蛋白表达水平相关数据以±s表示,多样本间比较采用One-way ANOVA 进行分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 藏红花素对细胞活力的影响与0 μmol∕L 藏红花素组比较,5、10、25、50 和100 μmol∕L 藏红花素组细胞存活率明显降低(P<0.001)。藏红花素浓度小于25 μmol∕L 时对RGC-5 细胞无明显毒性,后续实验藏红花素选择25 μmol∕L 作为统一给药浓度。见表1。
表1 各组培养的SD大鼠视网膜神经节细胞存活情况比较∕(%, ± s)
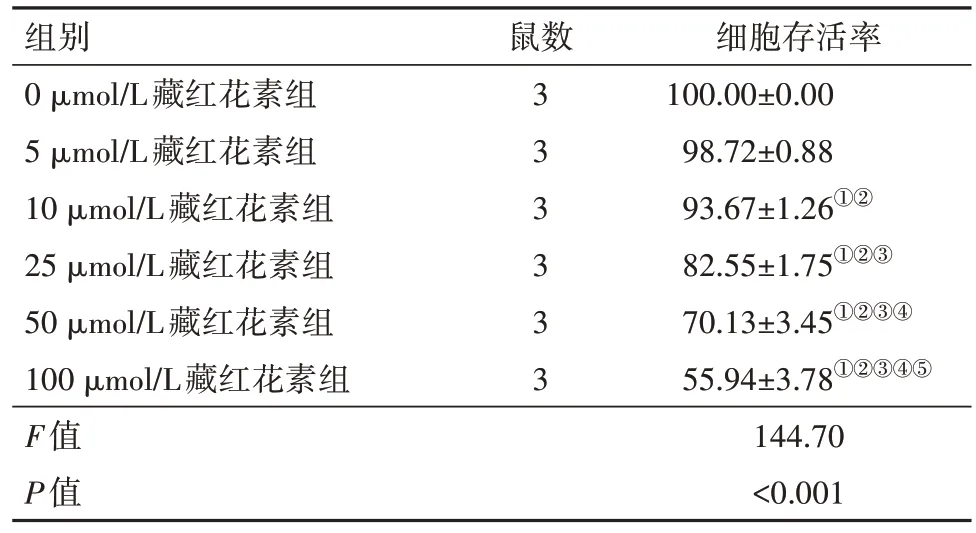
表1 各组培养的SD大鼠视网膜神经节细胞存活情况比较∕(%, ± s)
注:①与0 μmol∕L藏红花素组比,P<0.05。②与5 μmol∕L藏红花素组比,P<0.05。③与10 μmol∕L藏红花素组比,P<0.05。④与25 μmol∕L藏红花素组比,P<0.05。⑤与50 μmol∕L藏红花素组比,P<0.05。
细胞存活率100.00±0.00 98.72±0.88 93.67±1.26①②82.55±1.75①②③70.13±3.45①②③④55.94±3.78①②③④⑤144.70<0.001组别0 μmol∕L藏红花素组5 μmol∕L藏红花素组10 μmol∕L藏红花素组25 μmol∕L藏红花素组50 μmol∕L藏红花素组100 μmol∕L藏红花素组F值P值鼠数3 3 3 3 3 3
2.2 各组细胞存活、凋亡情况及细胞钙离子水平比较与对照组比较,缺氧组细胞存活量明显降低(P<0.001)。与缺氧组比较,藏红花素组细胞存活量升高(P=0.002)。与藏红花素组比较,藏红花素+DAPT组细胞存活量降低(P=0.005)。与阳性对照组比较,藏红花素组细胞存活量差异无统计学意义(P=0.512)。
与对照组比较,缺氧组细胞凋亡率明显升高(P<0.001)。与缺氧组比较,藏红花素组细胞凋亡率降低(P<0.001)。与藏红花素组比较,藏红花素+DAPT组细胞凋亡率升高(P=0.001)。与阳性对照组比较,藏红花素组细胞凋亡率差异无统计学意义(P=0.141)。
与对照组比较,缺氧组细胞钙离子水平明显升高(P<0.001)。与缺氧组比较,藏红花素组细胞钙离子水平降低(P<0.001)。与藏红花素组比较,藏红花素+DAPT 组细胞钙离子水平升高(P=0.001)。与阳性对照组比较,藏红花素组细胞钙离子水平差异无统计学意义(P=0.463)。见表2;图1,2。
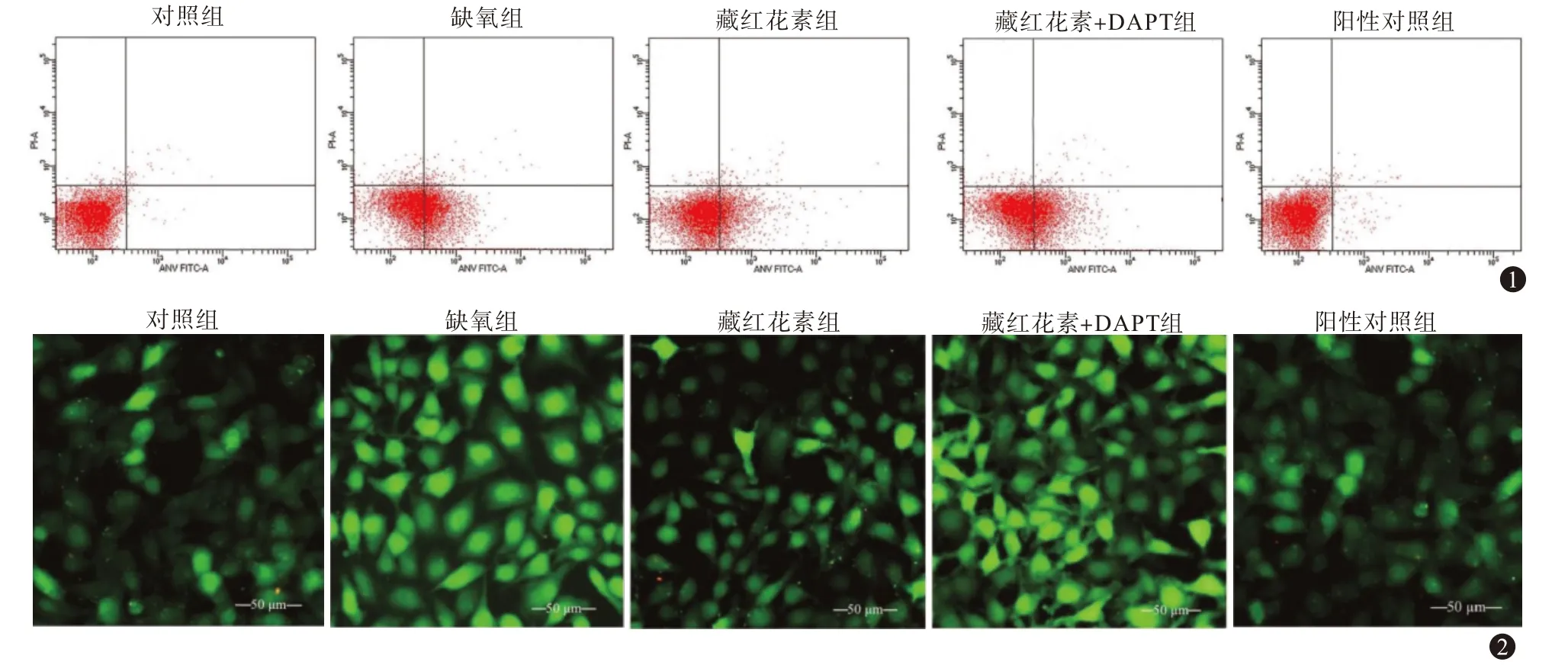
图1 流式细胞仪检测各组培养的SD大鼠视网膜神经节细胞凋亡情况图2 Flou-4检测培养的SD大鼠视网膜神经节细胞钙离子水平(Flou-4 AM×200)
表2 各组培养的SD大鼠视网膜神经节细胞活力比较∕ ± s
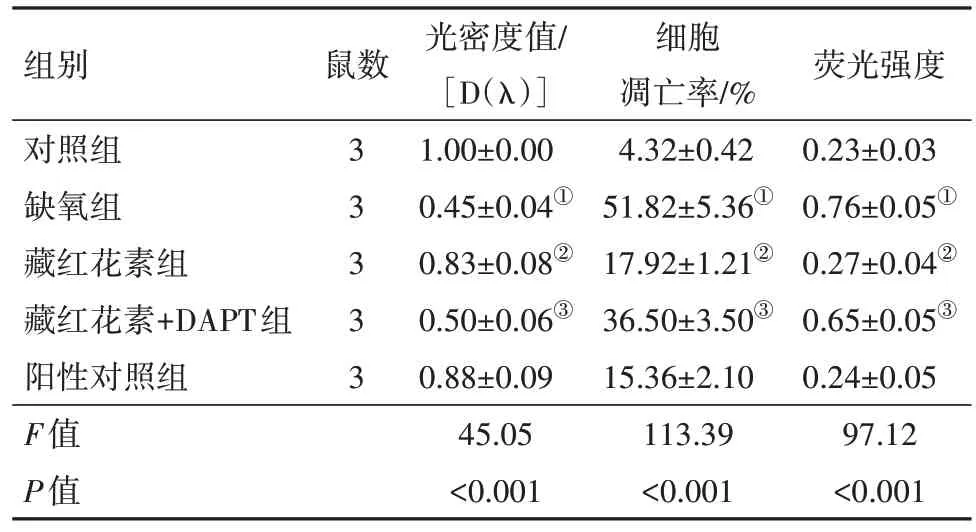
表2 各组培养的SD大鼠视网膜神经节细胞活力比较∕ ± s
注:①与对照组比,P<0.05。②与缺氧组比,P<0.05。③与藏红花素组比,P<0.05。
光密度值∕[D(λ)]1.00±0.00 0.45±0.04①0.83±0.08②0.50±0.06③0.88±0.09 45.05<0.001细胞凋亡率∕%4.32±0.42 51.82±5.36①17.92±1.21②36.50±3.50③15.36±2.10 113.39<0.001荧光强度0.23±0.03 0.76±0.05①0.27±0.04②0.65±0.05③0.24±0.05 97.12<0.001组别对照组缺氧组藏红花素组藏红花素+DAPT组阳性对照组F值P值鼠数3 3 3 3 3
2.3 Notch1/Hes-1 通路mRNA 水平比较与对照组比较,缺氧组细胞Notch1、Hes-1mRNA 表达水平明显升高(均P<0.001)。与缺氧组比较,藏红花素组细胞Notch1、Hes-1mRNA 表达水平降低(均P<0.001)。与藏红花素组比较,藏红花素+DAPT 组细胞Notch1、Hes-1mRNA 表 达 水 平升 高(P=0.013,0.001)。与阳性对照组比较,藏红花素组细胞Notch1、Hes-1 mRNA表达水平差异无统计学意义(P=0.425,0.248)。见表3。
表3 各组培养的SD大鼠视网膜神经节细胞Notch1∕Hes-1通路mRNA水平比较∕ ± s
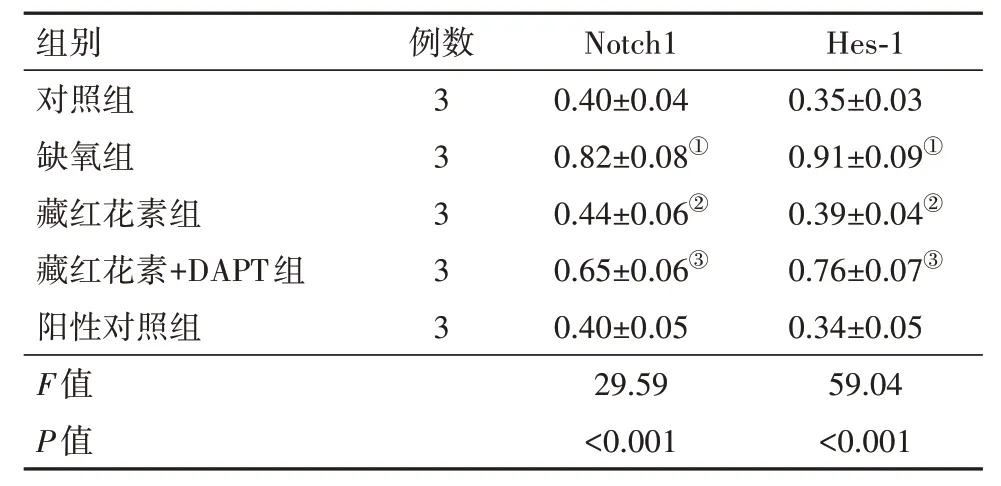
表3 各组培养的SD大鼠视网膜神经节细胞Notch1∕Hes-1通路mRNA水平比较∕ ± s
注:Notch1为跨膜受体蛋白,Hes-1为发状分裂相关增强子1。①与对照组比,P<0.05。②与缺氧组比,P<0.05。③与藏红花素组比,P<0.05。
Hes-1 0.35±0.03 0.91±0.09①0.39±0.04②0.76±0.07③0.34±0.05组别对照组缺氧组藏红花素组藏红花素+DAPT组阳性对照组例数3 3 3 3 3 Notch1 0.40±0.04 0.82±0.08①0.44±0.06②0.65±0.06③0.40±0.05 59.04 P值 <0.001<0.001 F值29.59
2.4 凋亡蛋白与钙依赖性蛋白水平比较与对照组比较,缺氧组细胞Bcl-2 蛋白表达水平降低(P<0.001),Bax 和Calpain1 蛋白表达水平明显升高(P<0.001,P<0.001)。与缺氧组比较,藏红花素组细胞Bcl-2 蛋白表达水平升高(P<0.001),Bax 和Calpain1蛋白表达水平明显降低(P<0.001,P<0.001)。与藏红花素组比较,藏红花素+DAPT 组细胞Bcl-2 蛋白表达水平降低(P=0.005),Bax 和Calpain1 蛋白表达水平明显升高(P=0.004,P=0.004)。与阳性对照组比较,藏红花素组细胞Bcl-2、Bax 和Calpain1 蛋白表达水平差异无统计学意义(P=0.533,P=0.800,P=0.617)。见表4,图3。
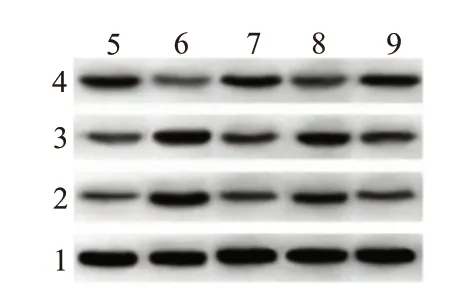
图3 各组培养的SD大鼠视网膜神经节细胞凋亡蛋白表达水平检测
表4 各组培养的SD大鼠视网膜神经节细胞蛋白水平比较∕ ± s
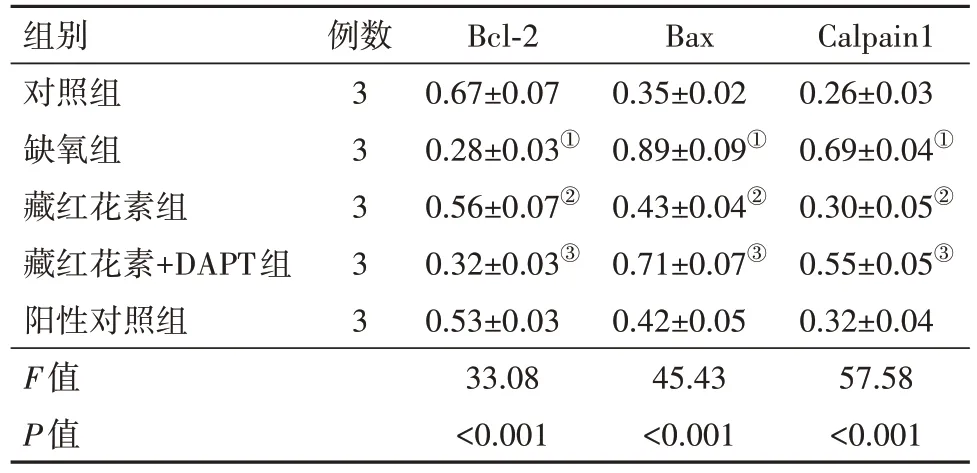
表4 各组培养的SD大鼠视网膜神经节细胞蛋白水平比较∕ ± s
注:Bcl-2 为B 细胞淋巴瘤因子2,Bax 为Bcl-2 相关X 蛋白,Calpain1为钙依赖性蛋白酶家族1。①与对照组比,P<0.05。②与缺氧组比,P<0.05。③与藏红花素组比,P<0.05。
Calpain1 0.26±0.03 0.69±0.04①0.30±0.05②0.55±0.05③0.32±0.04 57.58<0.001组别对照组缺氧组藏红花素组藏红花素+DAPT组阳性对照组F值P值例数3 3 3 3 3 Bcl-2 0.67±0.07 0.28±0.03①0.56±0.07②0.32±0.03③0.53±0.03 33.08<0.001 Bax 0.35±0.02 0.89±0.09①0.43±0.04②0.71±0.07③0.42±0.05 45.43<0.001
3 讨论
RGCs 细胞是视网膜重要结构之一,对氧环境十分敏感,而在缺氧微环境下,RGCs 细胞易发生凋亡[8]。研究表明,缺氧是导致RGCs细胞凋亡的主要原因之一[9]。近年来,部分研究表明,导致RGCs 凋亡的因素多是通过信号传导影响RGCs 细胞凋亡信号通路控制凋亡相关基因表达实现的[10]。因此,研究RGCs 细胞凋亡机制,不断开发新型药物,寻找作用靶点对视功能恢复临床治疗有着重大意义。
藏红花又名西红花、番红花,是传统中药材之一,具有凉血解毒、清肝明目和利尿等功效[11-12]。据报道,藏红花素能够抑制缺氧诱导的视网膜色素上皮细胞异常增殖,具有保护视力的药理作用[13]。另有研究发现,藏红花素可降低炎性因子水平保护视网膜缺血再灌注小鼠的RGC[14]。本研究结果显示,在MTT 实验中,采用不同浓度的藏红花素(0、5、10、25、50 和100 μmol∕L)作用于RGC-5 细胞后,各组细胞活性均明显降低,且呈现浓度依赖性。当藏红花素浓度 小 于25 μmol∕L 时对RGC-5 细 胞 无 明显毒性,因此后续实验选择25 μmol∕L作为藏红花素统一给药浓度。藏红花素组与缺氧组比较,细胞活力明显增加,且细胞凋亡率呈下降趋势,但这一趋势又在添加了DAPT 后受到影响。提示藏红花素能够抑制缺氧的RGC-5 细胞凋亡,对RGC-5 细胞具有保护作用,且藏红花素对RGC-5 细胞的保护作用会受到Notch1 信号通路抑制剂的影响。研究发现,藏红花素对谷氨酸盐诱导的RGC-5 细胞凋亡也具有明显的抑制作用[15],进一步证实藏红花素对RGC-5 细胞的保护作用。
在本研究中,与缺氧组比较,藏红花素组RGC-5细胞Notch1、Hes-1 基因表达水平降低,且抑凋亡蛋白Bcl-2 表达水平明显升高,促凋亡蛋白Bax 蛋白表达降低,且细胞内钙离子水平与钙依赖性Calpain1蛋白表达均呈降低趋势。Notch1∕Hes-1 信号通路是典型的钙依赖性细胞凋亡信号通路之一,Notch1 是Notch 家族成员之一,参与着神经元生长与发育,在神经受损后的修复再生过程中起着重要作用[16-17]。Notch1 信号激活主要通过位于胞膜的受体与Notch配体结合,当Notch1 上调时,可促进其下游基因Hes-1表达,同时抑凋亡蛋白Bcl-2表达下调,促凋亡蛋白Bax 蛋白水平升高,诱导细胞凋亡[18]。当细胞外大量钙离子内流,胞内钙离子水平异常升高,钙依赖性蛋白酶表达升高,钙依赖性凋亡信号通路Notch1∕Hes-1被激活,促使RGC-5细胞凋亡[19-20]。在本研究中,藏红花素组细胞钙离子水平明显降低,且钙依赖性Calpain1蛋白表达下调,而添加了DAPT后,钙离子水平与钙依赖性Calpain1 蛋白表达又逐渐上升。说明藏红花素可能是通过抑制钙离子内流,阻滞了Notch1∕Hes-1信号通路,上调抑凋亡蛋白Bcl-2表达水平,抑制RGC-5细胞凋亡。
综上所述,藏红花素对体外培养的缺氧RGC-5细胞凋亡有一定的抑制作用,可能是通过抑制钙离子内流,阻滞Notch1∕Hes-1通路,提高细胞内抑凋亡蛋白Bcl-2 表达水平发挥作用。本研究属于RGCs凋亡机制的基础研究,虽然很多证据显示Notch1∕Hes-1 信号通路对神经节细胞存活起到调节作用,但实验仍存在许多局限性和不足之处。首先本研究仅以细胞作为研究对象,缺乏动物实验数据的佐证。其次对于信号通路的研究过于浅显,需要继续深入探讨Notch1∕Hes-1 信号通路在RGCs 凋亡中的作用,因此本研究需要进一步补充和完善。
(本文图1,2见插图1-3)

