超声波-微波预处理辅助酶解制备大豆降糖肽及其稳定性分析
◎ 滕 飞,李欣芯,孟繁达,张和珍,娄沐雨,许 晶
(东北农业大学 文理学院,黑龙江 哈尔滨 150030)
《国家基层糖尿病防治管理指南(2022)》指出,糖尿病是一种由多病因引起的以慢性高血糖为特征的代谢性疾病,是胰岛素分泌和(或)利用缺陷所造成[1]。按照发病机制以及胰岛功能的不同,糖尿病主要分为I 型糖尿病、II 型糖尿病、妊娠糖尿病和非典型糖尿病4 类[2]。此外,国际糖尿病联盟在发布的2022 年糖尿病地图报告中也表明糖尿病是新型冠状病毒感染不良结果的重要危险因素,且患有I 型或II 型糖尿病的人若血糖控制不佳则更有可能在感染新型冠状病毒的情况下发生糖尿病酮症酸中毒[3]。目前,市场上针对糖尿病的治疗药物主要有双胍类(如二甲双胍)、波糖类(如伏格列波糖)、列汀类(如阿格列汀)和胰岛素等[4-5]。这些药物长期服用不仅会提高医治成本、增加经济负担,同时会产生一系列副作用,如低血糖、皮肤病变、胃肠道不适和腹型肥胖等。因此,需要探索出更加安全有效且成本低廉的防治方案。
蛋白质经过酶水解后产生的肽段可作为α-葡萄糖苷酶抑制剂、α-淀粉酶抑制剂或二肽基肽酶Ⅳ抑制剂,对II 型糖尿病具有辅助治疗作用[6]。目前,物理-酶解复合改性方法已成为高效、快速制备蛋白酶解物的研究热点之一。物理-酶解复合改性多见于超声波-酶解复合改性、微波-酶解复合改性、超高压-酶解复合改性和高温蒸汽-酶解复合改性等方法。超声波-微波预处理技术联合了超声波和微波两种物理改性手段,可在超声波诱导蛋白质构象变化,暴露出更多蛋白质切割位点的同时,利用微波引起蛋白质结构的展开和活性位点暴露,进一步提高蛋白酶的水解效率[7-8]。但是,超声波-微波预处理技术主要应用于生物活性有效成分的提取,在制备具有生物活性的肽段领域鲜有研究。
本文以大豆分离蛋白(Soy Protein Isolate,SPI)为原料,以α-葡萄糖苷酶抑制率为考察指标,研究酶解改性和超声波-微波预处理辅助酶解复合改性方法制备具有降血糖活性的大豆降糖肽,确定超声波-微波预处理辅助酶解制备大豆降糖肽的最优条件,分析大豆降糖肽的稳定性,为开发高活性和高稳定性的降血糖保健产品奠定理论基础,为充分利用大豆蛋白资源提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
大豆分离蛋白,北京市瑞达恒辉有限公司;中性蛋白酶,北京博奥拓达科技有限公司;对硝基苯-α-D-葡萄糖吡喃苷(PNPG),Aladdin 公司;α-葡萄糖苷酶,Solarbio 有限公司;其他试剂均为分析纯。
1.1.2 仪器与设备
超声微波化学反应器,巩义市科瑞仪器有限公司;GL-20G-Ⅱ高速冷冻离心机,上海安亭科学仪器厂;PHS-3C 型pH 计,上海仪电科学仪器股份有限公司;DZKW 型电热恒温水浴锅,北京市永光明医疗仪器厂;K750X 真空冷冻干燥器,英国Quorum 公司;Tecan sunrise 酶标仪,奥地利Tecan 公司。
1.2 实验方法
1.2.1 水解度的测定
采用pH-stat 法,水解度的计算公式为
式中:h代表单位质量蛋白质中被水解的肽键的量,mmol·g-1;htot代表单位质量蛋白质中肽键的总量,mmol·g-1,大豆蛋白为7.75 mmol·g-1。
水解过程中加入碱液的量与断裂肽键数量的定量关系,计算公式为
式中:B代表酶解过程中消耗的碱液的体积,mL;N代表碱液的浓度,mol·L-1;α代表氨基酸的解离数;Mp代表参加水解的蛋白质的质量,g。
α所代表氨基酸的解离数,计算公式为
式中:pK值根据Gibbs-Helmholz 方程计算[9],代表氨基酸解离常数。
1.2.2 α-葡萄糖苷酶抑制活性的测定
参考LEE 等[10]的研究检测α-葡萄糖苷酶抑制率,分别取200 μL 0.15 U·mL-1的α-葡萄糖苷酶溶液和50 mmol·L-1对硝基苯-α-D-吡喃葡萄糖苷(P-Nitrophenyl-α-D-Glucopyranoside,PNPG)溶液,与100 μL 样品溶液混合,用pH=6.8 的0.1 mol·L-1磷酸钾缓冲液定容至1 000 μL,在37 ℃下孵育60 min。孵育结束后立即添加1 500 μL 0.25 mol·L-1的Na2CO3溶液终止反应。将反应溶液摇匀后,取200 μL 液体于96 孔微板,使用Tecan sunrise 酶标仪在405 nm 处测量吸光度。通过检测反应体系内剩余的α-葡萄糖苷酶与PNPG 反应所释放的黄绿色产物对硝基苯酚(P-Nitrophenol,PNP)的含量,计算酶活性。α-葡萄糖苷酶抑制率的计算公式为
式中:A代表样品组的吸光度;A0代表无样品组的吸光度;A1代表无样品和无PNPG 组的吸光度;A2代表无PNPG 组的吸光度。
1.2.3 酶水解制备大豆降糖肽的最优工艺
配制最佳浓度(3%)的SPI 溶液,在55 ℃下搅拌30 min,调节反应体系的pH 值为7,以最佳加酶量(7 000 U·g-1)向反应体系中加入中性蛋白酶,在反应过程中向反应体系滴加浓度为0.5 mol·L-1的NaOH溶液,保证反应体系始终维持在pH=7。反应达到最佳酶解时间(60 min)后,在100 ℃条件下水浴反应10 min灭酶活。待酶解液冷却至室温后,在10 000 r·min-1条件下离心10 min,冷冻干燥上清液,即得到酶水解制备的大豆降糖肽(Soybean Protease Hydrolysate,SPH),将冻干样品密封于4 ℃下保存备用。
1.2.4 超声波-微波预处理辅助酶水解制备大豆降糖肽工艺的优化
(1)最佳超声波功率的确定。配制3%的SPI溶液,置于超声波微波化学反应器中,设置微波功率500 W、超声波-微波预处理温度40 ℃、超声波-微波预处理时间10 min,分别在100 W、200 W、300 W、400 W 和500 W 的超声波功率下对SPI 溶液进行预处理。物理改性结束后,参照1.2.3 的方法进行大豆分离蛋白的酶解改性,记录NaOH 消耗的体积,计算水解度。待酶解液冷却至室温后,在10 000 r·min-1条件下离心10 min,冷冻干燥上清液,得到超声波-微波预处理辅助酶水解制备的大豆降糖肽(Ultrasonic Microwave Pretreatment Soybean Protease Hydrolysate,UM-SPH)。将冻干的样品溶解成一定浓度的溶液,测定α-葡萄糖苷酶抑制活性,以α-葡萄糖苷酶抑制率为评价指标筛选最佳超声波功率。
(2)最佳微波功率的确定。配制3%的SPI 溶液,置于超声微波化学反应器中,设置最佳超声波功率200 W、超声波-微波预处理温度40 ℃、超声波-微波预处理时间10 min,分别在100 W、200 W、300 W、400 W、500 W、600 W 和700 W 的微波功率下对SPI溶液进行预处理。物理改性结束后,参照1.2.4(1)的方法测定α-葡萄糖苷酶抑制活性,以α-葡萄糖苷酶抑制率为评价指标筛选最佳微波功率。
(3)最佳超声波-微波预处理温度的确定。配制3%的SPI 溶液,置于超声微波化学反应器中,设置最佳超声波功率(200 W)、最佳微波功率(400 W)、超声波-微波预处理时间10 min,分别在35 ℃、40 ℃、45 ℃、50 ℃和55 ℃下对SPI 溶液进行预处理。物理改性结束后,参照1.2.4(1)的方法测定α-葡萄糖苷酶抑制活性,以α-葡萄糖苷酶抑制率为评价指标筛选最佳预处理温度。
(4)最佳超声波-微波预处理时间的确定。配制3%的SPI 溶液,置于超声微波化学反应器中,设置最佳超声波功率(200 W)、最佳微波功率(400 W)、最佳超声波-微波预处理温度(45 ℃),分别对SPI溶液进行0 min、5 min、10 min、15 min、20 min、25 min 和30 min 的预处理。物理改性结束后,参照1.2.4(1)的方法测定α-葡萄糖苷酶抑制活性,以α-葡萄糖苷酶抑制率为评价指标筛选最佳预处理时间。
1.2.5 大豆分离蛋白及大豆降糖肽的稳定性表征
(1)储存稳定性。将SPI、SPH 和UM-SPH 分别配制成30 mg·mL-1的样品溶液,调节pH 值至7.0。在4 ℃下储存28 d,每隔7 d 测量一次样品溶液的α-葡萄糖苷酶抑制率。根据降血糖活性表征酶解改性和超声波-微波预处理辅助酶解改性对大豆降糖肽储存稳定性的影响。
(2)热稳定性。将SPI、SPH 和UM-SPH 分别配制成30 mg·mL-1的样品溶液,调节pH 值至7.0。分别在37 ℃、50 ℃、65 ℃、80 ℃和95 ℃下加热15 min,测定样品溶液的α-葡萄糖苷酶抑制率。根据降血糖活性表征酶解改性和超声波-微波预处理辅助酶解改性对大豆降糖肽热稳定性的影响。
(3)冻融稳定性。将SPI、SPH 和UM-SPH 分别配制成30 mg·mL-1的样品溶液,调节pH 值至7.0。在-20 ℃的冰箱中储存24 h,取出后置于37 ℃的水浴中解冻1 h,测定样品溶液的α-葡萄糖苷酶抑制率。根据降血糖活性表征酶解改性和超声波-微波预处理辅助酶解改性对大豆降糖肽冻融稳定性的影响。
1.3 数据处理
2 结果与分析
2.1 超声波-微波预处理辅助酶水解制备大豆降糖肽工艺的优化
2.1.1 超声波功率对大豆降糖肽α-葡萄糖苷酶抑制率的影响
由图1 可知,随着超声波功率的增大,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度先逐渐上升;在超声波功率大于200 W 后,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度均不断下降。当超声功率达到200 W 时,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度均达到最大值,分别为(77.62±0.45)%和(19.00±0.19)%。这可能是因为超声波预处理引起的瞬态空化作用导致大豆分离蛋白的解折叠,增加了蛋白与酶的接触面积,得到了降血糖活性较高的大豆降糖肽[11]。但当超声波功率超过200 W 后,功率过大产生的巨大剪切力会使蛋白质分子加剧碰撞,导致蛋白质分子聚集,原本暴露出的酶切位点重新被掩埋,阻碍了酶解反应的进行,造成抑制α-葡萄糖苷酶活性的肽含量降低。因此,超声波功率过高显著降低了大豆降糖肽的α-葡萄糖苷酶抑制率和水解度(P<0.05)。
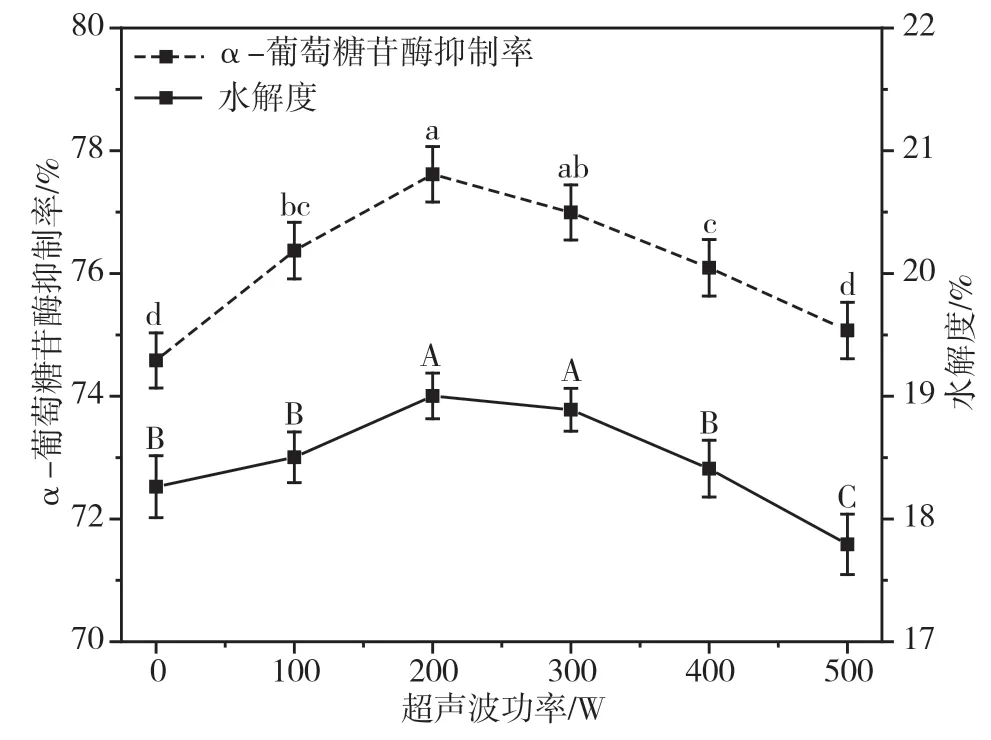
图1 不同超声波功率下大豆降糖肽的α-葡萄糖苷酶抑制率和水解度图
2.1.2 微波功率对大豆降糖肽α-葡萄糖苷酶抑制率的影响
由图2 可知,随着微波功率的增大,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度均逐渐上升;在微波功率大于400 W 后,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度均不断降低。当微波功率达到400 W 时,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度均达到最大值,分别为(78.35±0.50)%和(19.30±0.21)%。微波处理促使大豆分离蛋白中的极性分子在电磁场中发生振动,导致蛋白质的结构展开,暴露出更多的酶切位点,促进了蛋白发生水解反应[8]。当微波功率超过400 W 后,在较高的功率下,大豆分离蛋白溶液体系的温度迅速上升,导致蛋白质变性并且形成聚集体,阻碍酶解反应发生。因此,微波功率过高使大豆降糖肽的α-葡萄糖苷酶抑制率和水解度显著降低(P<0.05)。
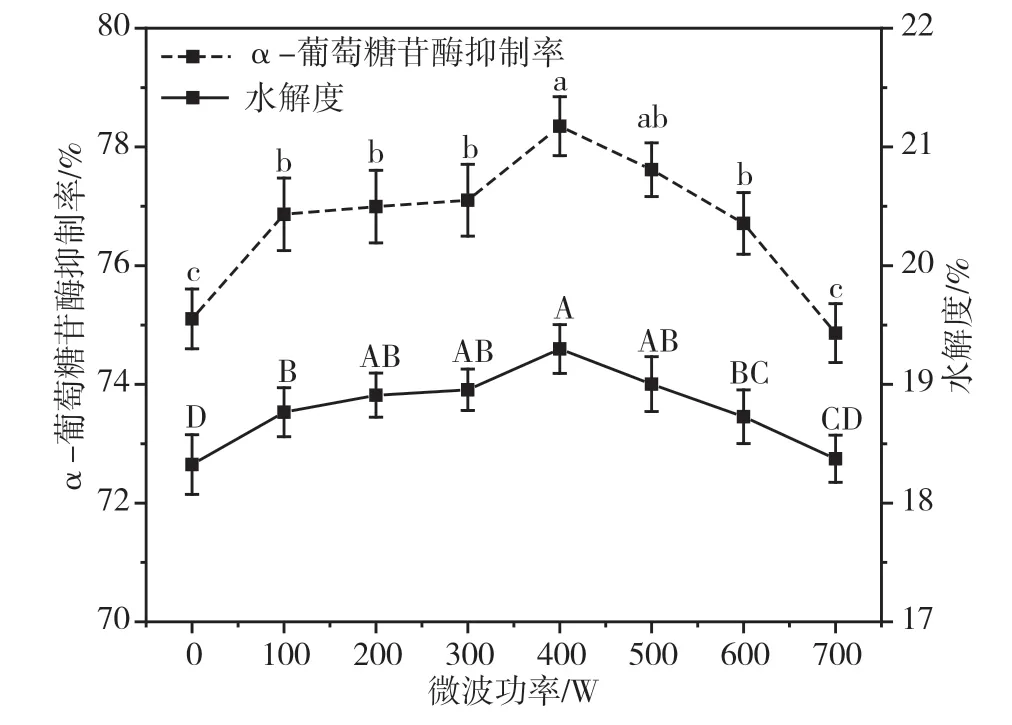
图2 不同微波功率下大豆降糖肽的α-葡萄糖苷酶抑制率和水解度图
2.1.3 预处理温度对大豆降糖肽α-葡萄糖苷酶抑制率的影响
由图3 可知,随着超声波-微波预处理温度的升高,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度均逐渐上升;在超声波-微波预处理温度大于45 ℃后,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度均不断下降。当超声波-微波预处理温度达到45 ℃时,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度均达到最大值,分别为(79.64±0.41)% 和(19.87±0.19)%。这是因为在一定范围内,温度的升高有利于大豆分离蛋白的溶解能力和溶解速度的提高,导致蛋白质在溶液内分布更加均匀,从而促进其与蛋白酶的结合效率,提高了抑制α-葡萄糖苷酶活性的肽含量[12]。于丽娜等[13]通过微波预处理辅助酶解的改性技术制备花生蛋白肽,也得出了微波预处理温度的升高促使花生蛋白肽的α-葡萄糖苷酶抑制率先升高后降低的实验结果。

图3 不同预处理温度下大豆降糖肽的α-葡萄糖苷酶抑制率和水解度图
2.1.4 预处理时间对大豆降糖肽α-葡萄糖苷酶抑制率的影响
由图4 可知,随着超声波-微波预处理时间的增加,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度均逐渐上升;当超声波-微波预处理时间超过20 min 后,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度均不断降低。当超声波-微波预处理时间为20 min 时,大豆降糖肽的α-葡萄糖苷酶抑制率和水解度均达到最大值,分别为(81.46±0.31)% 和(21.25±0.43)%。超声波-微波预处理20 min 之前,大豆分离蛋白溶液处于微波电磁场中,超声波的空化作用破坏蛋白质的分子间作用力使其解折叠;随着时间的延长,蛋白的分子热运动不断加剧,到预处理时间20 min 时,大豆分离蛋白在体系中的溶解性最佳,且酶切位点暴露最完全,酶解反应效率最高,抑制α-葡萄糖苷酶活性的肽含量最高[14]。超声波-微波预处理20 min 之后,由于处理时间过长,超声波和微波的不断作用导致分子热运动过于剧烈,会促进解折叠的蛋白质重组聚集,造成蛋白质表面的酶切位点被掩埋,影响酶与蛋白质的结合[15]。江明珠[16]对大豆分离蛋白进行超声波预处理,在研究超声波预处理时间对大豆蛋白肽的影响时,也得出了α-葡萄糖苷酶抑制率先升高后降低的结论。

图4 不同预处理时间下大豆降糖肽的α-葡萄糖苷酶抑制率和水解度图
综合上述实验结果,确定超声波-微波预处理辅助酶水解制备大豆降糖肽的最优工艺为超声波功率200 W,微波功率400 W,超声波-微波预处理温度45 ℃,超声波-微波预处理时间20 min,加酶量7 000 U·g-1,底物浓度3%,酶解时间60 min。
2.2 大豆分离蛋白及大豆降糖肽的稳定性
2.2.1 储存稳定性分析
储存稳定性是衡量蛋白质产品包装工艺、保质期和应用价值的重要指标。由图5 可知,随着储存天数的增加,SPI的α-葡萄糖苷酶抑制率逐渐降低;在28 d时,降糖活性仅为(15.61±0.72)%。在7 d 之内,SPH 和UM-SPH 的降糖活性无显著变化(P>0.05);在14 d到21 d,SPH 和UM-SPH 的降糖活性几乎保持不变;到第28 d 时,UM-SPH 仍能保持(76.14±0.73)%的α-葡萄糖苷酶抑制率,表现出良好的储存稳定性。

图5 大豆分离蛋白及大豆降糖肽的储存稳定性图
2.2.2 热稳定性分析
温度对SPI、SPH 和UM-SPH 的降糖活性和抗氧化活性的影响如图6 所示。当温度为37~95 ℃时,SPI、SPH 和UM-SPH 的α-葡萄糖苷酶抑制率变化较小;与SPI 和SPH 相比,UM-SPH 始终保持最强的降血糖活性,表现出最佳的热稳定性。综上所述,超声波-微波辅助酶解改性改善了大豆分离蛋白的热稳定性,SPH 和UM-SPH 表现出了良好的热稳定性,可实现37~95 ℃的热加工,为投入工业生产提供了理论基础[17]。

图6 大豆分离蛋白及大豆降糖肽的热稳定图
2.2.3 冻融稳定性分析
目前,冷冻是一种常见的延长食品货架期的处理方法,不仅能保持食品的风味和营养价值,还能最大限度地减少微生物繁殖对食品的影响[18]。因此,考察大豆分离蛋白和大豆降糖肽的冻融稳定性具有一定的实际意义。由图7 可知,冻融使SPI、SPH 和UM-SPH的α-葡萄糖苷酶抑制率均显著降低(P<0.05)。经历3 次冻融处理,UM-SPH 的α-葡萄糖苷酶抑制率无显著变化(P>0.05);第4 次冻融后,UM-SPH的降糖活性显著降低(P<0.05),但仍能达到(77.66±0.80)%的α-葡萄糖苷酶抑制率。与SPI 和SPH 相比,UM-SPH 降糖活性的冻融稳定性最佳。
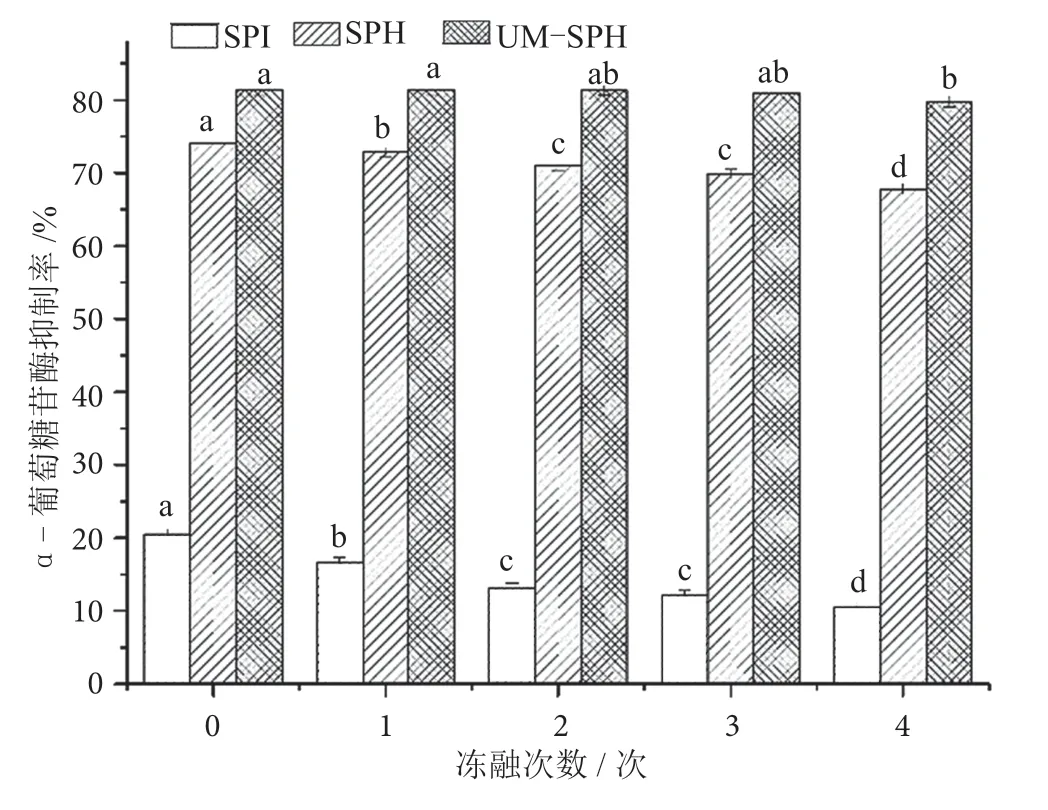
图7 豆分离蛋白及大豆降糖肽的冻融稳定性图
3 结论
在酶解改性的基础上,采用超声波-微波辅助酶水解制备大豆降糖肽,获得的最佳工艺条件为超声波功率200 W、微波功率400 W、超声波-微波预处理温度45 ℃、超声波-微波预处理时间20 min、加酶量7 000 U·g-1、底物浓度3%、酶解时间60 min,在此条件下大豆降糖肽的α-葡萄糖苷酶抑制率为(81.46±0.31)%。本实验制备的大豆降糖肽(SPH和UM-SPH),随着储存天数的增加和温度升高,表现出良好的储存稳定性和热稳定性;与SPI和SPH相比,UM-SPH 的降血糖活性受冻融次数的影响最小,表现出最佳的冻融稳定性。酶解改性和超声波-微波预处理辅助酶解改性提高了大豆分离蛋白的环境稳定性,3 种物质的稳定性顺序为UM-SPH >SPH >SPI。

