甲钴胺注射液有关物质检验方法研究
任萃文,陆 勇
(哈尔滨三联药业股份有限公司,黑龙江 哈尔滨 150025)
甲钴胺注射液(规格:1 ml:0.5 mg)为治疗周围神经病类药,主要适用于缺乏维生素B12引起的巨红细胞性贫血的治疗[1]。甲钴胺注射液原研厂家为日本卫材株式会社,商品名为“弥可保”,规格为1 ml:0.5 mg,参比制剂为Eisai Co.,Ltd.在国内上市的原研药品和卫材(中国)药业有限公司的国外原研企业在中国境内生产的药品。《中国药典》2020年版收载了甲钴胺和甲钴胺注射液[2],日本和韩国药典收载了甲钴胺质量标准[3-4]。本文对甲钴胺注射液质量标准中有关物质的分析方法进行了研究和优化,以期为药品研发人员提供参考。
1 甲钴胺理化性质
甲钴胺(mecobalamin),化学名称:Coα-[α-(5,6-二甲基苯并咪唑基)]-Coβ-甲基钴酰胺,分子式:C63H91CoN13O14P,分子量:1344.40。深红色结晶或结晶性粉末,见光易分解;在水或乙醇中略溶,在乙腈、丙酮或乙醚中几乎不溶。甲钴胺原料具有引湿性;200 ℃左右变黑,240 ℃左右分解;水溶液(1→100)pH值约为6,解离常数pKa=2.7(测定法:紫外-可见分光光度法)。其结构见图1。

图1 甲钴胺结构式
2 仪器与试药
2.1 仪器
2695型高效液相色谱仪(美国沃特世公司);MS205DU型电子分析天平(瑞士梅特勒公司);SHH-200HWD-2型药品高温试验箱(重庆市永生实验仪器厂);SHH-200DG型药品强光稳定性试验箱(重庆市永生实验仪器厂);FE28型酸度计(瑞士梅特勒公司)。
2.2 试药
甲钴胺对照品(中国食品药品检定研究院,批号:100692-201805);氰钴胺对照品(中国食品药品检定研究院,批号:100248-201705);羟钴胺对照品(批号:EP H1428000);甲钴胺注射液[哈尔滨三联药业股份有限公司,批号:200801,200802,200803,日本卫材株式会社,批号:170479,170674,卫材(中国)药业有限公司,批号:190105A,190206A];乙腈(色谱纯,美国Fisher Chemical公司)。
3 方法与结果
3.1 色谱条件
色谱柱:Agela Venusil MP C18(4.6 mm×250 mm,5 μm),流动相A:含0.47 %己烷磺酸钠的0.03 mol/L磷酸二氢钾溶液(用磷酸或氢氧化钾溶液调节pH至4.5)-乙腈(85:15),流动相B:乙腈,柱温:40 ℃,流速:1.3 ml/min,波长:266 nm,进样量:10 μl,洗脱梯度变化见表1。

表1 洗脱梯度表
3.2 溶液配制
3.2.1 甲钴胺对照品溶液 取甲钴胺对照品适量,精密称定,加水溶解并稀释制成每1 ml中含5 μg的溶液。
3.2.2 羟钴胺对照品溶液 取羟钴胺对照品适量,精密称定,加水溶解并稀释制成每1 ml水中约含羟钴胺10 μg的溶液。
3.2.3 供试品溶液 取样品5支,混匀。
3.2.4 系统适用性溶液 取氰钴胺和羟钴胺对照品适量,加水溶解并稀释成每1 ml中含氰钴胺、羟钴胺各约25 μg的溶液。
3.3 系统适用性试验
取系统适用性溶液,按3.1项下色谱条件进样,记录色谱图。按氰钴胺、羟钴胺的顺序出峰,氰钴胺峰与羟钴胺峰分离度大于3.0。
3.4 专属性试验
3.4.1 空白干扰试验 取溶剂、空白辅料溶液、系统适用性溶液、甲钴胺对照品溶液和供试品溶液,按3.1项下色谱条件进样,记录色谱图。
3.4.2 酸降解试验 取本品1 ml,加入1 mol/L盐酸溶液100 μl,放置12 h,加入1 mol/L氢氧化钠溶液100 μl中和,摇匀,作为酸破坏降解溶液。
3.4.3 碱降解试验 取本品1 ml,加入1 mol/L氢氧化钠溶液100 μl,放置12 h,加入1 mol/L盐酸溶液100 μl中和,摇匀,作为碱破坏降解溶液。
3.4.4 氧化降解试验 取本品1 ml,加入3 %过氧化氢溶液100 μl,剧烈振摇,放置10 h,作为氧化破坏降解溶液。
3.4.5 热降解试验 取本品,于100 ℃条件放置1 h后取出,放冷至室温,作为热破坏降解溶液。
3.4.6 光降解试验 取本品,于5000 Lux光照条件下30 s后取出,作为光破坏降解溶液。
空白干扰试验结果见图2。由图2可见,溶剂及空白辅料溶液对甲钴胺、氰钴胺和羟钴胺均无干扰。强制降解试验结果见图3。由图3可见,甲钴胺注射液在酸、碱、氧化、高温条件下均不稳定,在光照条件下极不稳定。产生的未知降解杂质均能与主峰及已知杂质得到良好的分离,专属性良好。
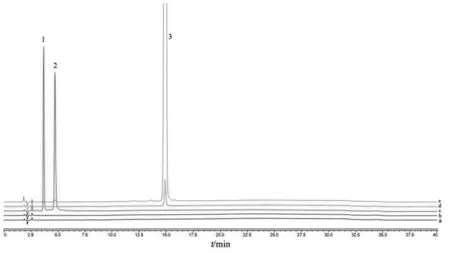
图2 空白干扰试验图谱
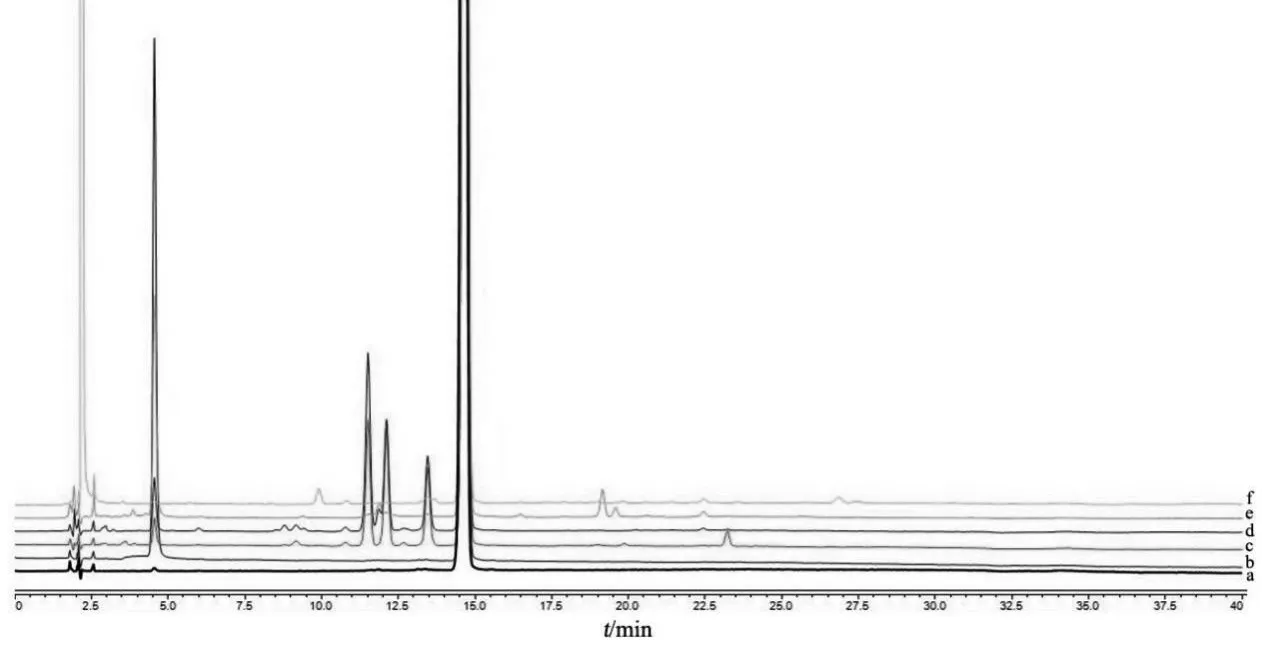
图3 强制降解试验图谱
3.5 检测限和定量限
分别取甲钴胺和羟钴胺对照品适量,用水定量逐级稀释,以信噪比(S/N)=3时相应浓度为检测限,以信噪比(S/N)=10时相应浓度为定量限。结果本品甲钴胺和羟钴胺的检测限均为0.5 ng,定量限分别为1.7 ng和1.6 ng。
3.6 线性试验
取甲钴胺对照品贮备液(浓度:0.5 mg/ml)和羟钴胺对照品储备液(浓度:1.0 mg/ml),精密量取各对照品储备液适量,分别梯度稀释成甲钴胺浓度为0.2,1.0,2.0,5.0,10 μg/ml,羟钴胺浓度为0.2,2.0,5.0,10.0,20 μg/ml的系列溶液,以质量浓度为横坐标,峰面积为纵坐标,进行线性回归。甲钴胺回归方程为y=0.1199x-0.003,r=0.9999,羟钴胺回归方程为y=0.0875x-0.005,r=1,表明甲钴胺在0.2~10 μg/ml,羟钴胺在0.2~20 μg/ml浓度范围内线性关系良好。
3.7 精密度试验
取供试品溶液,连续进样6针,羟钴胺峰面积RSD为0.5 %,甲钴胺峰面积RSD为1.2 %,表明仪器精密度良好。
3.8 重复性试验
取6份供试品溶液,重复进样,羟钴胺含量RSD为0.3 %,最大单个杂质含量RSD为0.6 %,总杂质含量RSD为0.2 %。
3.9 中间精密度试验
不同实验人员于不同日期,在不同仪器上进行重复性试验,12份供试品羟钴胺含量RSD为2.9 %,最大单个杂质含量RSD为1.5 %,总杂质含量RSD为3.1 %。
3.10 回收率
取本品,加入羟钴胺对照品使其含量分别为限度浓度的20 %,100 %,150 %,平行配制3份,分别进样,计算回收率,结果见表2。

表2 回收率检测结果
3.11 溶液稳定性和耐用性试验
供试品溶液在室温避光放置48 h后与0 h相比,各杂质含量的相对偏差均小于2.0 %。波长变化±2 nm、柱温变化±5 ℃、流速变化±0.2 ml/min、流动相中磷酸盐浓度变化±0.01 mol/L和不同批号色谱柱条件下,系统适用性溶液中氰钴胺峰与羟钴胺峰分离度均大于3.0;与标准条件比较,供试品溶液各杂质含量变化相对偏差均在5 %以内,表明方法的耐用性好。
3.12 有关物质检测
测定3家企业的7批样品有关物质,自制样品质量水平均不低于参比制剂,结果见表3。
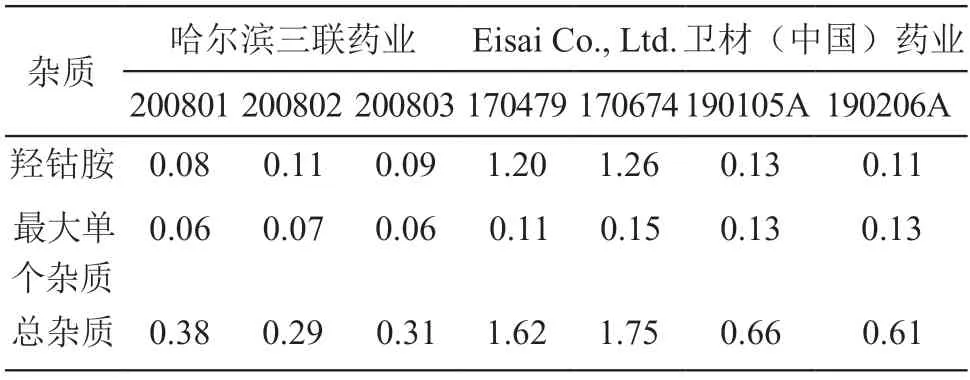
表3 不同厂家、不同批次样品有关物质检测结果/%
4 讨论
4.1 洗脱方法
对比分析韩国药典、日本药典、中国药典及文献[5]所使用的有关物质检测方法,主要区别于在检测波长和流动相系统。中国药典采用的检测波长是342 nm,日本和韩国药典采用的是266 nm;流动相均采用了磷酸盐和乙腈体系,日本和韩国另加入了离子对试剂。经实验证实,流动相中离子对试剂对氰钴胺、羟钴胺的洗脱和分离影响较大,氰钴胺、羟钴胺使用低有机相比例的流动相分离度较好,但甲钴胺在低有机相比例中保留明显增强,整个检测时间延长。因此,为了使各杂质能够有效分离,溶剂和空白辅料不干扰测定,同时确保杂质检出的灵敏度,在国内外药典检测方法基础上,设计梯度洗脱,最终确定优化的色谱条件。
4.2 检测波长
对甲钴胺对照品溶液、氰钴胺对照品溶液、羟钴胺对照品溶液在190 nm~400 nm波长扫描。结果,甲钴胺最大吸收波长为266 nm和342 nm,氰钴胺最大吸收波长为278 nm和360 nm,羟钴胺最大吸收波长为274 nm和350 nm。对经强光、高温和氧化强降解后的自制样品和参比制剂分别采用DAD全波长扫描,参照各国标准中有关物质检测波长,提取266 nm和342 nm波长的检测数据。已知杂质氰钴胺在强降解条件下变化不大,已知杂质羟钴胺342 nm检出量优于266 nm,未知杂质266 nm的检出总量及检出个数优于342 nm,自制样品与参比制剂结果基本一致,故选择266 nm作为有关物质检测波长,数据结果见表4。
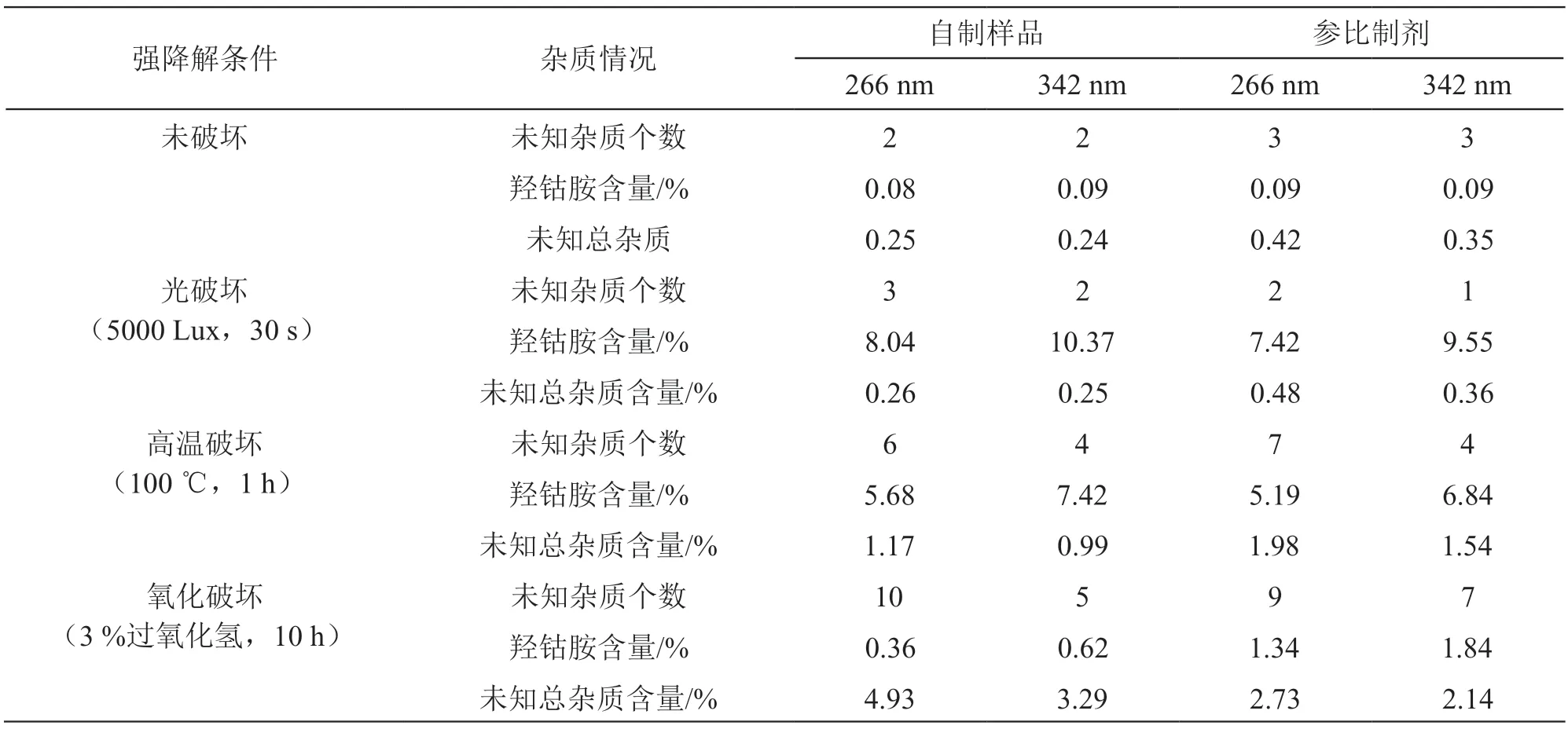
表4 强降解后样品考察结果
4.3 色谱柱对杂质检出的影响
本试验分别对GL Sciences Inertsil ODS-3v(250 mm×4.6 mm,5 μm)、Waters xselect@HSS T3(250 mm×4.6 mm,5 μm)、OMNI Orca C18-AB(250 mm×4.6 mm,5 μm)3个厂家的色谱柱分离及检出效果进行考察,见图4。结果显示,不同品牌和型号的色谱柱对杂质的分离度及杂质的检出量影响较大,系统适用性测试需关注不同色谱柱的影响。
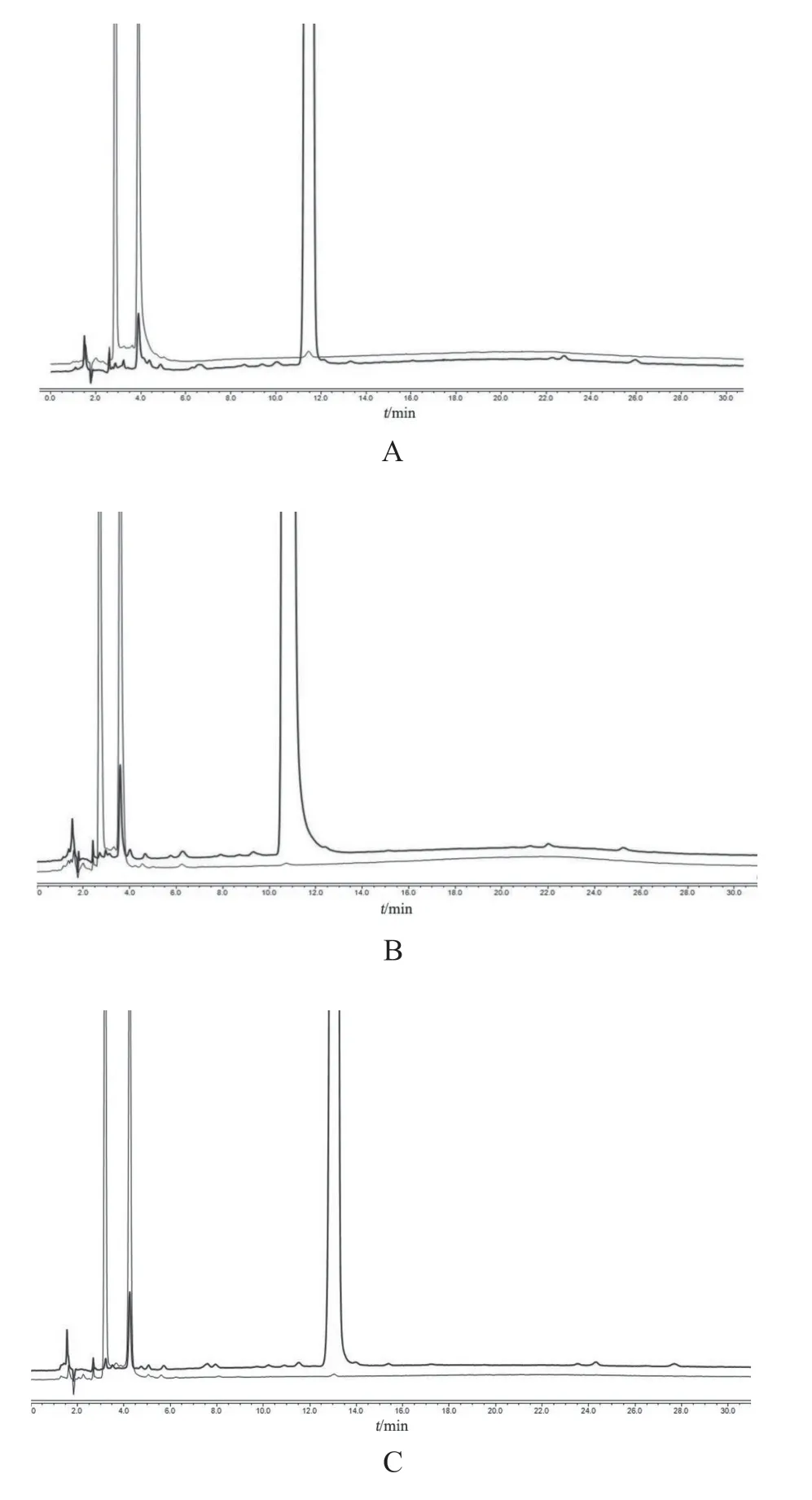
图4 不同厂家色谱柱HPLC图谱比较
4.4 各杂质限度
制剂的降解产物会影响产品的安全性,必须依据药典、ICH要求及参比制剂质量进行控制,以减少对患者的影响。产品中每种杂质及总杂质限度更应基于参比制剂质量进行设定[6]。已知杂质羟钴胺是甲钴胺注射液中的主要降解产物,本法设定的266 nm波长并非为羟钴胺的最大吸收波长,为了能更准确地控制该杂质,采用外标法进行计算,羟钴胺限度为不大于2.0 %;参照多批样品稳定性考察结果,制定其他单个杂质不大于0.5 %、总杂质不大于2.5 %,限度严于国家标准。
5 小结
本文对甲钴胺注射液有关物质分析方法从洗脱方法、检测波长、色谱柱选择等方面进行优化研究,并进行了方法学验证,采用建立的新方法对多批产品进行分析,并与参比制剂进行质量对比,科学合理地制定了杂质的计算方法和限度,提高了产品质量,以保证患者的用药安全。

