长时程亚低温通过抑制颅内压反弹促进颅脑创伤大鼠的神经保护作用
赵万勇,李晓红,王景景,孙洪涛△
颅脑创伤(traumatic brain injury,TBI)是世界范围内的一个重大公共卫生事件[1-2],如何促进TBI 后的神经功能恢复,已经成为医疗机构亟待解决的问题。亚低温(mild hypothermia,MHT)治疗在临床研究和动物实验中均表现出一定的神经保护作用[3-4],包括改善组织病理学和行为结果,保护血脑屏障,促进内源性神经再生,减轻炎症反应和抑制神经元凋亡等[5-7]。颅内压(intracranial pressure,ICP)升高与TBI 后神经功能缺失密切相关[8]。MHT 可缓解TBI造成的ICP升高,但其治疗的主要问题是复温后ICP的反弹,原因在于ICP通常在TBI后2~4 d达到高峰,短期的MHT治疗并未完全控制脑水肿的发生,引起ICP 再次回升进而影响神经功能的恢复。不同于临床研究,基础研究的MHT 治疗主要集中在短时程(4 h),且没有统一的标准[9-10]。然而,长时程MHT治疗对TBI 后ICP 的影响及神经保护作用机制目前缺乏相关的实验研究。本文旨在探索长时程MHT治疗TBI大鼠的最佳持续时间,并观察其对ICP变化和神经功能恢复的影响,以期为临床长时程MHT治疗TBI提供更充足的理论依据。
1 材料与方法
1.1 实验动物及分组 48只健康成年雄性SD大鼠,体质量(220±10)g,购自斯贝福(北京)生物技术有限公司,动物生产许可证号:SCXK(京)2019-0010。动物饲养于天津医科大学实验动物科学部动物房,动物使用许可证号:SYXK(津)2019-0004,室温20~24 ℃,相对湿度55%~60%,给光时间7:00—19:00,大鼠在动物房适应性饲养7 d后开始实验。采用随机数字表法分为常温治疗组(NT 组)、4 h MHT 治疗组(MHT4 h组)、24 h MHT治疗组(MHT24 h组)、48 h MHT治疗组(MHT48 h组),每组12只。
1.2 材料 苏木素-伊红染液、水合氯醛、多聚甲醛(天津索罗门生物科技有限公司);兔源抗神经元核抗原(NeuN)、B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、诱导型一氧化氮合成酶(iNOS)、白细胞介素(IL)-10、精氨酸酶1(Arg-1)、白细胞分化抗原86(CD86)抗体(Proteintech 公司,美国);5-溴脱氧尿嘧啶核苷(BrdU)、4,6-二脒基-2-苯基吲哚(DAPI)、伊文斯兰(Evans Blue,EB)染料(Sigma公司,美国);山羊抗兔二抗IgG(Abcam,英国);488 荧光二抗、568 荧光二抗(Invitrogen,美国);免疫组化染色试剂盒(上海基因科技有限公司);BCA 蛋白定量试剂盒(Thermo,美国);T1 亚低温治疗仪(珠海黑马,中国);电子可控性皮质损伤装置(Custom Design&Fabrication,美国);冰冻切片机(LEICA,德国);倒置荧光显微镜(LEICA CTR4000,德国);转膜仪(BIO-RAD,美国);ICP监测仪(Condam,美国)。
1.3 方法
1.3.1 TBI模型的制备 所有大鼠术前12 h禁食,按0.5 mg/g经腹腔注射5%水合氯醛进行麻醉,然后将其俯卧位固定于立体定向头架上,头部备皮消毒完毕后于中线切开头皮,剥离骨膜暴露右侧顶骨。以前囟为原点,向后1.5~2.0 mm旁开1.2 mm 为圆心颅钻穿孔磨开直径5 mm 骨窗,暴露硬脑膜并保持其完整。各组分别通过电子可控性皮质损伤装置对钻孔部分进行打击损伤(参数设置:深度1.6 mm,撞击速度4.5 m/s,停留时间120 ms)。在颅骨钻孔后5 mm 处电钻锥颅,在硬脑膜下2.5 mm置入ICP监测探头并固定,外接ICP监护仪。
1.3.2 MHT 治疗和ICP 监测 NT 组给予常温(37 ℃)维持6 h;MHT4 h 组、MHT24 h 组和MHT48 h 组分别给予MHT 治疗4 h、24 h 和48 h,使用体温监测仪连续监测大鼠肛温并使其温度保持在(33.0±1.0)℃,分别于MHT 治疗结束后记录各组ICP数值,然后以0.5 ℃/0.5 h的速度缓慢复温至37 ℃。
1.3.3 脑组织含水量(brain water content,BWC)计算 采用干湿重法计算BWC,评估脑水肿情况。每组取3 只大鼠,分别于MHT治疗结束后断头取脑,分离两个大脑半球,将同侧湿重的半球组织在75 ℃恒温烘干箱中干燥48 h,再次称重获得干重。BWC 计算公式为:BWC(%)=(湿重-干重)/湿重×100%。
1.3.4 EB 染色测定血脑屏障(blood brain barrier,BBB)通透性 每组取3 只大鼠,处死前2 h 以3 mL/kg 经股静脉注射2%EB染料溶液。断头取材后,分离损伤侧大脑皮层组织,测量湿重后放入试管中,加入5 mL 甲酰胺,37 ℃水浴48 h,组织离心20 min,收集上清液,在紫外分光光度计(波长=620 nm)进行比色,测得吸光度(A)值。根据标准曲线,计算EB 水平(µg/g),以大鼠脑组织中EB水平代表BBB通透性。
1.3.5 免疫荧光染色 每组取3只大鼠,分别于MHT治疗结束后断头取材,4%甲醛溶液固定过夜24 h,脱水后将组织块放置冰冻切片机内,OCT胶-25 ℃包埋,按14µm厚度进行切片。选取脑组织切片置于1 mol/L HCl 中4 ℃处理10 min,2 mol/L HCl 常温处理10 min,37 ℃处理20 min,0.01 mol/L 硼酸溶液中和10 min,PBS 洗5 min×3 次;0.5%Triton X-100 浸泡20 min,PBS 洗5 min×3 次;滴加5% BSA 100 µL/片封闭,37 ℃孵育15 min;用滤纸吸去血清,不洗,直接滴加一抗BrdU(1∶100)、NeuN(1∶200)、CD86(1∶200),放入湿盒后置于4 ℃冰箱过夜;隔日切片室温复苏1 h,PBS 洗5 min×3次;滴加二抗,37 ℃温箱避光50 min,PBS洗5 min×3次;滴加DAPI,PBS洗5 min×3次,50%甘油封片。在200倍荧光显微镜下以损伤侧海马作为观察区域,每只动物选取连续6张脑组织切片计数BrdU 阳性细胞数,最后算出6 张切片的平均阳性细胞数,同理计算CD86和NeuN/BrdU双标记阳性细胞数。
1.3.6 Western blot 每组取剩余3 只大鼠,通过5%水合氯醛进行麻醉,4%多聚甲醛心脏灌注后取脑,在冰浴中快速将损伤侧脑组织加入细胞裂解液中,组织经匀浆破碎后,用BCA 法进行蛋白定量,经10%SDS-PAGE 凝胶电泳,半干转法20 V恒压转膜30 min将目的蛋白转至NC膜。杂交步骤如下:5%脱脂奶粉封闭NC 膜1 h,TBST 洗10 min×3次,然后室温下与Bcl-2(1∶1 000)、Bax(1∶2 000)、iNOS(1∶300)、Arg-1(1∶1 000)、IL-10(1∶400)杂交反应1 h,TBST 漂洗同前。再将NC 膜与山羊抗兔二抗IgG(1∶2 000)杂交反应1 h,最后用TBST 洗NC 膜10 min×3 次。NC 膜滴加1∶1 配制的显影A 液和B 液,利用BIO-RAD 凝胶成像系统进行显影。使用ScnImage软件进行目的蛋白和内参的灰度值测定,计算目的蛋白相对灰度值。
1.4 统计学方法 采用Graph Pad 9.0软件进行统计分析,正态分布的计量资料用表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠BWC 和ICP 的比较 与NT 组比较,MHT4 h组、MHT24 h组和MHT48 h组BWC和ICP明显降低(P<0.05);与MHT24 h 组比较,MHT48 h 组BWC和ICP进一步降低(P<0.05),见表1。
Tab.1 Changes of water content of brain tissue and ICP in each group表1 各组大鼠脑组织BWC和ICP的变化(n=3,)

Tab.1 Changes of water content of brain tissue and ICP in each group表1 各组大鼠脑组织BWC和ICP的变化(n=3,)
**P<0.01;a与NT 组比较,b与MHT4 h 组比较,c与MHT24 h 组比较,P<0.05。表2—4同。
组别NT组MHT4 h组MHT24 h组MHT48 h组F BWC/%90.41±1.51 86.57±1.85a 82.07±2.04ab 76.42±1.76ac 116.000**ICP/mmHg 26.10±0.84 23.40±1.34a 18.50±0.92ab 11.40±0.98ac 347.900**
2.2 各组大鼠BBB 通透性的比较 NT 组、MHT4 h组、MHT24 h 组、MHT48 h 组EB 水平(µg/g)分别为201.5±13.4、162.2±9.8、138.2±13.1 和102.7±10.8,差异有统计学意义(n=3,F=73.870,P<0.01)。与NT组比较,MHT4 h 组、MHT24 h 组、MHT48 h 组EB 水平均降低;与MHT24 h 组比较,MHT48 h 组EB 水平进一步降低(P<0.05)。
2.3 各组大鼠BrdU、BrdU/NeuN 和CD86 阳性细胞数比较 与NT 组比较,MHT4 h 组、MHT24 h 组、MHT48 h 组海马区BrdU 阳性细胞数和BrdU/NeuN双标记阳性细胞数增多,CD86阳性细胞数降低(P<0.05);与MHT24 h 组比较,MHT48 h 组BrdU 阳性细胞数和BrdU/NeuN双标记阳性细胞数增高,CD86阳性细胞数进一步降低(P<0.05),见表2,图1—3。

Fig.1 The BrdU expression in hippocampus in each group(immunofluorescence staining,×200)图1 各组大鼠海马区BrdU表达情况(免疫荧光染色,×200)

Fig.2 BrdU/NeuN expression double markers in hippocampus in the MHT24 h group and the MHT48 h group(immunofluorescence staining)图2 MHT24 h组和MHT48 h组大鼠海马区BrdU/NeuN双标记表达情况(免疫荧光染色)
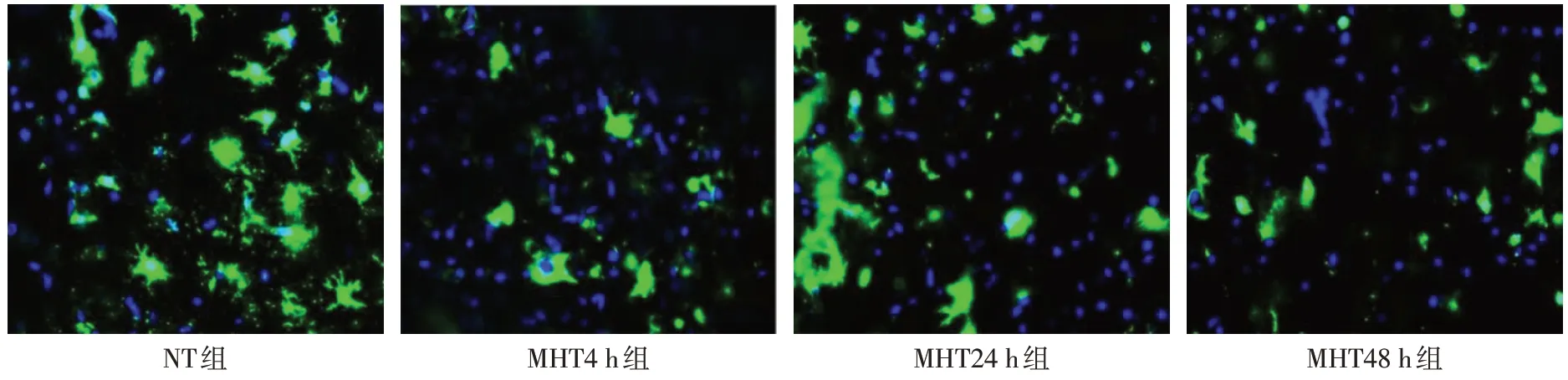
Fig.3 The expression of CD86 in each group(immunofluorescence staining,×200)图3 各组大鼠CD86表达情况(免疫荧光染色,×200)
Tab.2 Comparison of BrdU,BrdU/NeuN and CD86 positive cells between the four groups表2 各组大鼠BrdU、BrdU/NeuN和CD86阳性细胞数的比较(n=3,个/mm2,)

Tab.2 Comparison of BrdU,BrdU/NeuN and CD86 positive cells between the four groups表2 各组大鼠BrdU、BrdU/NeuN和CD86阳性细胞数的比较(n=3,个/mm2,)
组别NT组MHT4 h组MHT24 h组MHT48 h组F BrdU 39.83±5.27 65.50±9.42a 53.83±6.08ab 76.17±8.61ac 25.690**BrdU/NeuN 27.33±4.76 55.00±7.56a 44.50±4.63ab 64.50±8.26ac 35.860**CD86 81.33±6.95 59.33±5.65a 70.83±7.99ab 48.83±8.23ac 22.460**
2.4 各组大鼠Bcl-2和Bax表达水平的比较 与NT组比较,MHT4 h 组、MHT24 h 组、MHT48 h 组Bcl-2表达水平升高,Bax 表达水平降低(P<0.05)。与MHT24 h 组比较,MHT48 h 组的Bcl-2 表达水平升高,而Bax表达水平降低(P<0.05),见表3、图4。

Fig.4 The expression of Bcl-2 and Bax protein in each group图4 各组大鼠Bcl-2和Bax蛋白表达情况
Tab.3 Comparison of expression levels of Bcl-2 and Bax between the four groups表3 各组大鼠Bcl-2和Bax表达水平的比较(n=3,)

Tab.3 Comparison of expression levels of Bcl-2 and Bax between the four groups表3 各组大鼠Bcl-2和Bax表达水平的比较(n=3,)
组别NT组MHT4 h组MHT24 h组MHT48 h组F Bcl-2 0.59±0.07 1.10±0.15a 0.80±0.11ab 1.34±0.12ac 25.230**Bax 1.47±0.15 1.08±0.13a 0.80±0.10ab 0.49±0.15ac 29.820**
2.5 各组大鼠iNOS、IL-10 和Arg-1 表达水平的比较 与NT 组比较,MHT4 h 组、MHT24 h 组和MHT48 h 组iNOS 的表达水平降低,IL-10 和Arg-1表达水平升高(P<0.05);与MHT24 h 组比较,MHT48 h 组iNOS 的表达水平进一步降低,IL-10 和Arg-1表达水平进一步升高(P<0.05),见表4、图5。

Fig.5 The expression of iNOS,IL-10 and Arg-1 in each group图5 各组大鼠iNOS、IL-10和Arg-1表达情况
Tab.4 Comparison of expression levels of iNOS,IL-10 and Arg-1 between the four groups表4 各组大鼠iNOS、IL-10和Arg-1表达水平的比较(n=3,)

Tab.4 Comparison of expression levels of iNOS,IL-10 and Arg-1 between the four groups表4 各组大鼠iNOS、IL-10和Arg-1表达水平的比较(n=3,)
组别NT组MHT4 h组MHT24 h组MHT48 h组F iNOS 1.07±0.21 0.64±0.12a 0.83±0.13ab 0.49±0.11ac 16.980**IL-10 0.35±0.10 0.63±0.10a 0.51±0.06ab 0.82±0.06ac 31.720**Arg-1 0.38±0.07 0.73±0.10a 0.59±0.09ab 0.94±0.06ac 48.480**
3 讨论
低温疗法对TBI 有积极治疗作用,其最佳的治疗模式,如目标温度的管理、诱导方式的选择和持续实施的时间,目前尚不完全明确[11-12]。一项多中心随机对照试验表明,5 d 的长时程MHT 能够显著缓解重型TBI患者颅内压的急剧升高并抑制ICP反弹,进而减轻神经功能损伤[13]。本研究采用电子可控性皮质损伤装置建立TBI 大鼠模型,并实施不同时程的MHT治疗观察其对TBI大鼠的神经保护作用。
在基础实验中关于长时程MHT与ICP变化的研究相对较少,虽然长时程MHT 对ICP 升高具有抑制作用,但在治疗过程中由于长时间的持续镇静可能会导致机体发生感染和其他不良反应[14-15],因此有必要探索长时程MHT能够有效抑制ICP的最佳持续时间。本研究证实,在亚低温治疗组ICP 呈现明显下降的趋势,虽然24 h的MHT治疗时间比以往的实验研究时间更长,但24 h 治疗后的ICP 水平并没有显著下降,考虑与MHT后的复温期和水肿高峰期重合有关,而MHT48 h 组可以显著降低ICP 进而抑制ICP 的反弹。本课题组在预实验中,给予超过72 h的MHT并未起到更积极的脑保护作用,原因可能是长期亚低温状态给机体带来一定程度的不良反应。
MHT不仅能够减轻脑水肿、降低ICP,而且可以改善BBB通透性。本研究结果表明,48 h的MHT能够显著降低EB 水平并发挥神经保护作用。为评估MHT对TBI后海马区神经发生的影响,使用BrdU标记新生细胞,并对成熟神经元进行抗NeuN 抗体标记,结果显示48 h的MHT能够明显提高神经元的增殖和分化,更好地促进神经再生。由Bcl-2 蛋白家族(包括Bcl-2,Bcl-XL,Bax 等)构成的内源性凋亡通路在细胞凋亡的调控中起到重要作用[16],在外界不良刺激作用下Bax 被活化,造成细胞色素C 的释放,最终胱天蛋白酶(Caspase)-3被活化导致凋亡的发生;然而Bcl-2 的活化会妨碍下游蛋白通路的级联反应,从而起到抗细胞凋亡的作用。本研究结果显示,48 h 的MHT 能够进一步上调Bcl-2,下调Bax表达水平,进而抑制凋亡通路Caspase 的级联反应,阻碍程序性凋亡的发生。小胶质细胞是中枢神经系统固有的免疫效应细胞,发挥免疫监视的作用[17]。活化的小胶质细胞分为M1 和M2 表型,CD86 和iNOS 是M1型小胶质细胞标记物,M1型小胶质细胞可导致免疫应答失控,产生大量炎症介质,造成免疫损伤和继发性脑损伤,M2型小胶质细胞释放IL-10、Arg-1等抗炎因子,能够抑制M1型小胶质细胞驱动的炎症反应并促进组织修复[18]。本研究结果显示,MHT 治疗能够抑制iNOS 和CD86 的表达,增强IL-10和Arg-1的表达,在48 h的MHT 治疗中可以显著抑制M1型小胶质细胞的活化并促进M2型小胶质细胞的激活,进而抑制神经炎症。
长时程MHT是一种能够有效抑制ICP反弹的可调控的目标温度管理方式[19],由于动物和人类之间病理生理的差异,动物实验的时间应用并不完全等同于临床治疗的实际时间。本研究表明,48 h 的MHT可作为基础研究的长时程治疗时间模型,可以通过抑制ICP反弹来促进颅脑创伤大鼠的神经保护作用,为基础研究转化为临床运用提供更充足的理论依据。鉴于目前研究的局限性,有关更长时程的MHT 治疗以及如何预防相关并发症等问题尚有待进一步研究。

