气道类器官显微注射及极性反转模型的构建
宋立成,张宇涵,余忠阔,解立新△
研究表明,体外生长的3D类器官能够再现体内对应器官的基本属性,成为研究损伤和修复再生的有力工具[1]。肺成体干细胞(adult stem cells,ASCs)衍生的类器官完全由上皮细胞组成,较普通2D培养平面可动态展示细胞增殖分化过程,这更有利于呼吸道病毒感染后肺损伤的体外研究[2-3]。ASCs 分化成各类上皮细胞后,形成正常的顶端连接复合体,并具有上皮极性,但顶端或管腔表面包裹在类器官球体内,而面向球体外部的基底外侧表面与细胞外基质(ECM)相互作用[4]。气道上皮许多功能需要接触球体的顶面或腔面,包括微生物相互作用,吸收药物或毒素。类器官极性内向(apical in,AI)的特点有可能限制其在感染模型中的广泛应用[5]。然而通过机械破碎气道类器官使顶端表面暴露于培养基中的方法不能精确复制感染过程,甚至可能引起非特异性反应[6]。本研究旨在开发一种类器官显微注射模型,将病毒注射入类器官,使微生物与上皮极性表面直接接触造成感染。为了更好地模拟呼吸道病毒感染,笔者优化实验条件,成功构建极性外向(apical out,AO)肺类器官,增加呼吸道病毒对上皮的可及性,为呼吸道感染研究提供新平台。
1 材料与方法
1.1 实验材料 8 周龄雄性SPF 级C57BL/6 小鼠60 只,体质量18~20 g,购自斯贝福(北京)生物技术有限公司,动物生产许可证号:SCXK(京)2019-0010。小鼠均用于肺组织获取及类器官培养。小鼠饲养于中国科学院微生物研究所SPF级动物房内。分选磁珠为去死细胞磁珠、CD45 磁珠及CD326(EpCAM)磁珠均购自Miltenyi Biotec 公司。DMEM/F12、B27 补充剂、GlutaMAX、青霉素-链霉素双抗溶液购自Invitrogen 公司。Rspondin1、Noggin 购自MedChemExpress 公司。 N-acetylcysteine、Nicotinamide、SB431542、SB202190、CHIR99021 购自Sigma 公司。成纤维细胞生长因子(FGF)-7、FGF-10 购自Peprotech 公司。ROCK 抑制剂Y-27632 购自STEMCELL 公司。兔抗鼠α-微管蛋白(α-tubulin)抗体购自Proteintech 公司,大鼠抗小鼠紧密连接蛋白(ZO-1)购自Santa Cruz Biotechnology 公司,驴抗兔二抗IgG H&L(Alexa Fluor®568)及羊抗大鼠IgG H&L(Alexa Fluor®647)抗体购自Abcam 公司。无生长因子基质胶、transwell 小室及配套的24 孔板购自Corning 公司。显微镜为徕卡公司的DMI3000 B型,显微操作系统为艾本德公司的TransferMan®4r 型,微量自动注射仪为艾本德公司的FemtoJet®4x 型,微量移液器拉拔器为Sutter 公司的P-97 Flaming/Brown 型。绿色荧光蛋白(GFP)标记的流感病毒PR8(GFP-PR8)为中国科学院微生物所方敏实验室赠送。PCR 试剂盒、TRIzolTM试剂和反转录试剂盒购自Thermo Fisher Scientific公司。
1.2 实验方法
1.2.1 呼吸道原代上皮细胞的获取 参照Li等[7]的方法,1%苯巴比妥5µL/g 麻醉小鼠,切开腹膜后剪断腹主动脉,沿胸骨柄剪开胸廓,结扎气管,将1.5 mL 注射器吸取少量混合分散酶和胶原酶D的酶液注入肺内,将肺鼓起。将结扎后的肺取下,置于磷酸盐缓冲液(PBS)中漂洗,在3 mL 的Hanks'平衡盐溶液中室温消化30 min。将肺组织在DNase+DMEM 的培养基中将肺叶解离并切碎,置于摇床上按照300 r/min震荡15 min。使用70µm及40µm筛网过滤组织悬液,1 200 r/min离心5 min后,悬液加入红细胞裂解液1 mL置于37 ℃培养箱90 s。再次离心、重悬、计数,将细胞移至6 孔板中培养。按照说明书要求,分别采用去死细胞磁珠、CD45磁珠及CD326磁珠对获取的单细胞悬液进行抗体特异性阳性选择和阴性选择,以获取上皮细胞进行肺类器官构建。
1.2.2 培养基的配制 参考多项研究对气道类器官培养基进行整合优化[8-10]。根据生长及分化需要,培养基分为扩增及分化两种类型。在培养的第1周,采用扩增培养基诱导干细胞增殖并形成类器官,从第2周起改为分化培养基,促进干细胞向终末细胞分化。干细胞扩增培养基的主要成分包括Advanced DMEM/F12、双抗(1%)、Rspondin1(500 µg/L)、Noggin(100 µg/L)、B27 添加物(2%)、Y-27632(5 µmol/L)、SB431542(10µmol/L)、SB202190(1µmol/L)、FGF-7(5µg/L)、FGF-10(20µg/L)、CHIR99021(3µmol/L)。干细胞分化培养基在扩增培养基基础上添加10%胎牛血清(FBS),并去除SB431542和CHIR99021。
1.2.3 类器官模型的构建 参考Li等[11-12]的方法,获得的上皮细胞在干细胞扩增培养基中稀释,调整细胞含量为2×106/mL,放置无菌冰上。将4 ℃解冻的无生长因子基质胶在冰上用预冷低温低吸附枪头与细胞悬液等体积混合。在37 ℃细胞培养箱中放置transwell 小室及配套的24 孔板,30 min 后拿出。迅速将100µL 细胞悬液加入小室底部,所有小室添加完毕后,将24孔板再次放入细胞培养箱中,每隔10 min将24孔板上下翻转放置。30 min 后拿出24 孔板,在小室外每孔加入410µL 干细胞基础培养基,覆盖小室底层膜。此后每隔2 d更换下层培养基。1周后更换为类器官分化培养基。2周后进行传代。采用传3代的类器官进行后续实验。
1.2.4 类器官显微注射 使用拉拔器将1 mm的细丝毛细管拉至一个细点,注射针经酒精灯加热形成90°弯曲,最大限度地减少注射过程中基质胶中断和针断裂。在针头直径渐变至20µm处用细镊子钳断注射针。在微量注射前的7 d,将类器官进行传代培养。选取横断面半径为60~80µm 的类器官作为注射对象。通过使用0.4 nL 0.8%的70 ku FITC-dextran 靶向类器官进行微注射来评估该平台的效率。设置注射仪参数:注射压力200 hPa,注射时间0.1 s,补偿压力2 hPa。观察注射前后类器官直径的变化。
1.2.5 类器官极性反转 将transwell小室从24孔板取出,放置于超低吸附的6孔板中,每孔中加入3个transwell 小室,并加入5 mL EDTA 溶液,在4 ℃摇床上100 r/min 震荡60 min。用1 mL低吸附枪头轻柔冲洗transwell小室底膜,直至基质胶全部回收。将6孔板内的EDTA溶液及消化后的基质胶全部放入15 mL 离心管中,4 ℃,200×g,离心3 min,去除上清液,加入干细胞扩增培养基3 mL,然后转移至超低吸附6孔板中继续悬浮培养。每隔2 d,小心吸取上层1/3的培养基进行换液,并轻柔混匀整个培养基。通过光学显微镜每日统计各transwell内反转的类器官的比例(5个transwell为一组进行合并统计)。培养1 周后,将类器官4 ℃,200×g,离心3 min,重新铺到基质胶中,通过HE染色鉴定是否反转成功。
1.2.6 流感病毒感染类器官实验 将普通类器官培养体系的下层营养液更换为同体积病毒维持液,分别加入0.1、0.01、0.001 感染复数(MOI)的GFP-PR8 病毒,在37 ℃下孵育2 h。将病毒维持液吸净,用PBS清洗小室外层及孔板内部3次,再添加等体积干细胞扩增培养基,24 h后观察类器官形态及荧光产生情况。在类器官注射实验中,计算类器官体积后,按照60µL/mm3分别将PBS、GFP-PR8、PR8注射入类器官球中,在接种期间和接种后分别在下层培养基中加入丝氨酸蛋白酶抑制剂0.125 mmol/L。24 h 后,收集小室底部的基质胶并进行HE 染色及荧光染色。在类器官反转模型中,将反转后的类器官的培养基更换为病毒维持液,加入0.01 MOI 的GFPPR8病毒,在37 ℃下孵育2 h后进行洗涤,随后将接种的类器官重新包埋在基质胶中,然后在扩增培养基中培养。在PR8感染中,将4块6孔板中悬浮培养的类器官分成4组,分别为对照组、感染0.001 MOI 组、感染0.01 MOI 组、感染0.1 MOI组,在37 ℃下孵育2 h。在接种期间和接种后分别用丝氨酸蛋白酶抑制剂(0.125 mmol/L)处理PR8 接种的类器官。24 h后,对照组及各浓度感染组收集类器官进行后续免疫荧光及PCR分析,重复6次。对类器官进行PCR分析时,将Trypsin-EDTA 200 µL 加入上层小室中,对应24 孔板中加入500 µL Trypsin-EDTA,在37 ℃细胞培养箱中放置30 min,每隔10 min 用1 mL 枪头机械破碎基质胶。30 min 后将基质胶吸出,放置于15 mL 的预装等体积Trypsin-EDTA 离心管中,10 min 后加入等体积培养基,4 ℃,500×g离心5 min,去除上清液及云雾状基质胶,细胞沉淀用于后续实验。
1.2.7 免疫荧光染色 将transwell 底膜及黏附的基质胶用刀片小心割下,在4%多聚甲醛中剥离基质胶,并固定20 min,在70%乙醇中渗透,在含有0.1%Triton X-100 和3%牛血清白蛋白的PBS 中封闭60 min。将基质胶与兔抗鼠αtubulin,大鼠抗小鼠ZO-1 抗体在4 ℃封闭缓冲液中孵育过夜,用PBS洗涤2次,分别与二抗驴抗兔IgG H&L抗体及羊抗鼠IgG H&L抗体孵育,置于阻断缓冲液中在室温下放置2 h,用PBS洗涤2次,与DAPI孵育,用PBS洗涤2次。
1.2.8 RT-PCR TRIzol 试剂盒提取基质胶消化后的类器官的总RNA,Nanodrop 分光光度仪检测RNA 纯度和浓度。以RNA 为模板,使用逆转录试剂盒逆转录获得cDNA,以cDNA为模板进行扩增,反应条件:95 ℃30 s;95 ℃10 s,60 ℃30 s,共40个循环。以GAPDH为内参基因,采用2-ΔΔCt法计算基因的相对表达水平。引物由生工生物工程(上海)股份有限公司合成,序列见表1。

Tab.1 Primer sequences for qPCR表1 qPCR引物序列
1.3 统计学方法 采用GraphPad Prism 8.1.1 进行数据分析和绘图,数据分布采用Shapiro-Wilk 检验。正态分布的数据采用表示,行t检验。非正态分布的数据采用M(P25,P75)表示,行Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
2 结果
2.1 显微注射对类器官形态的影响 将FITC-dextran 注射入类器官后,类器官的体积发生明显增大,且直径越小的类器官形态改变越明显,见图1。荧光显微镜下观察发现,FITC-dextran 可均匀分布于整个类器官内部,使球体充分充盈,荧光素未出现外溢,见图2。
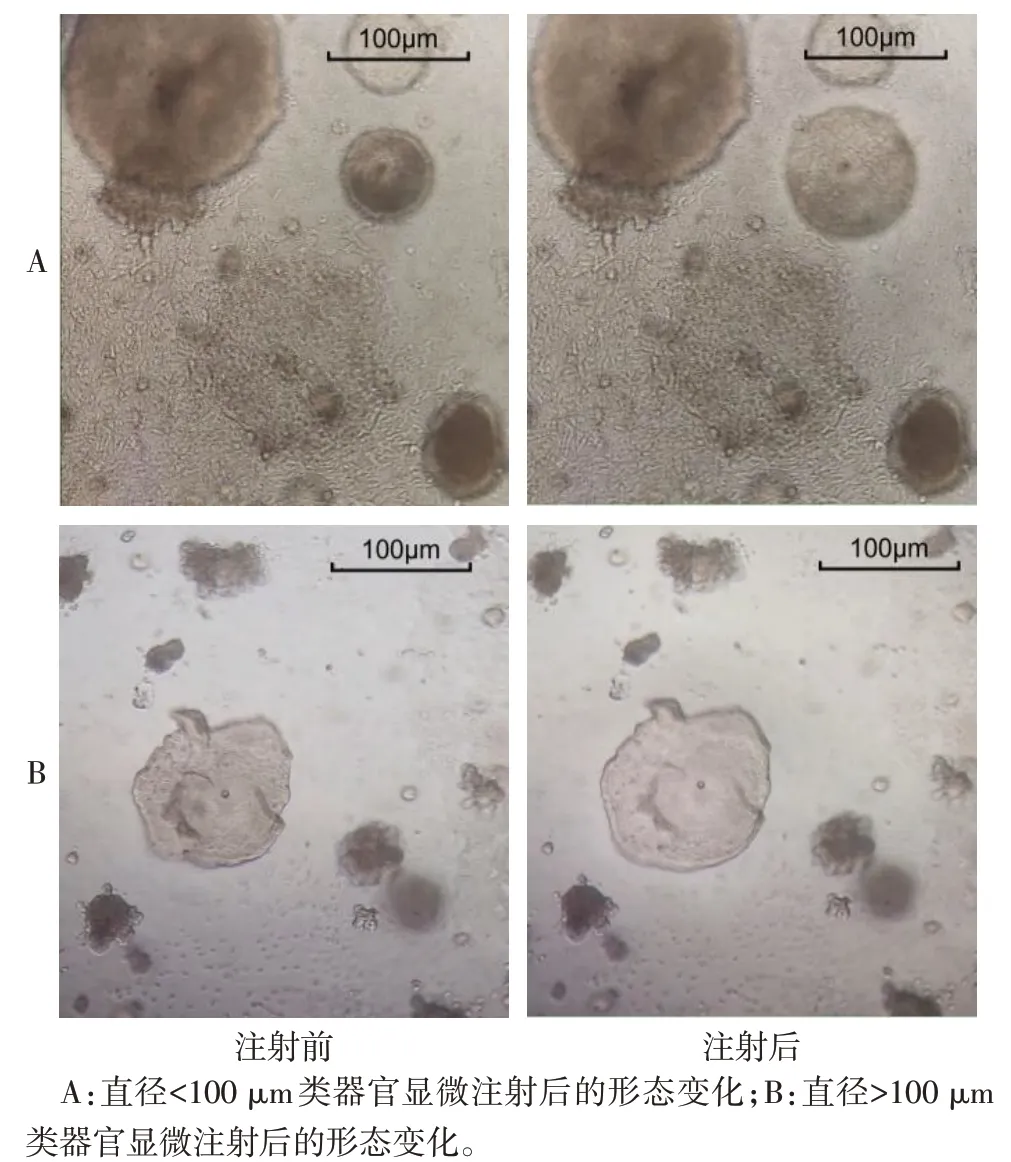
Fig.1 Morphological characteristics after microinjection of FITC-dextran in organoid图1 类器官显微注射FITC-dextran后的形态学特点
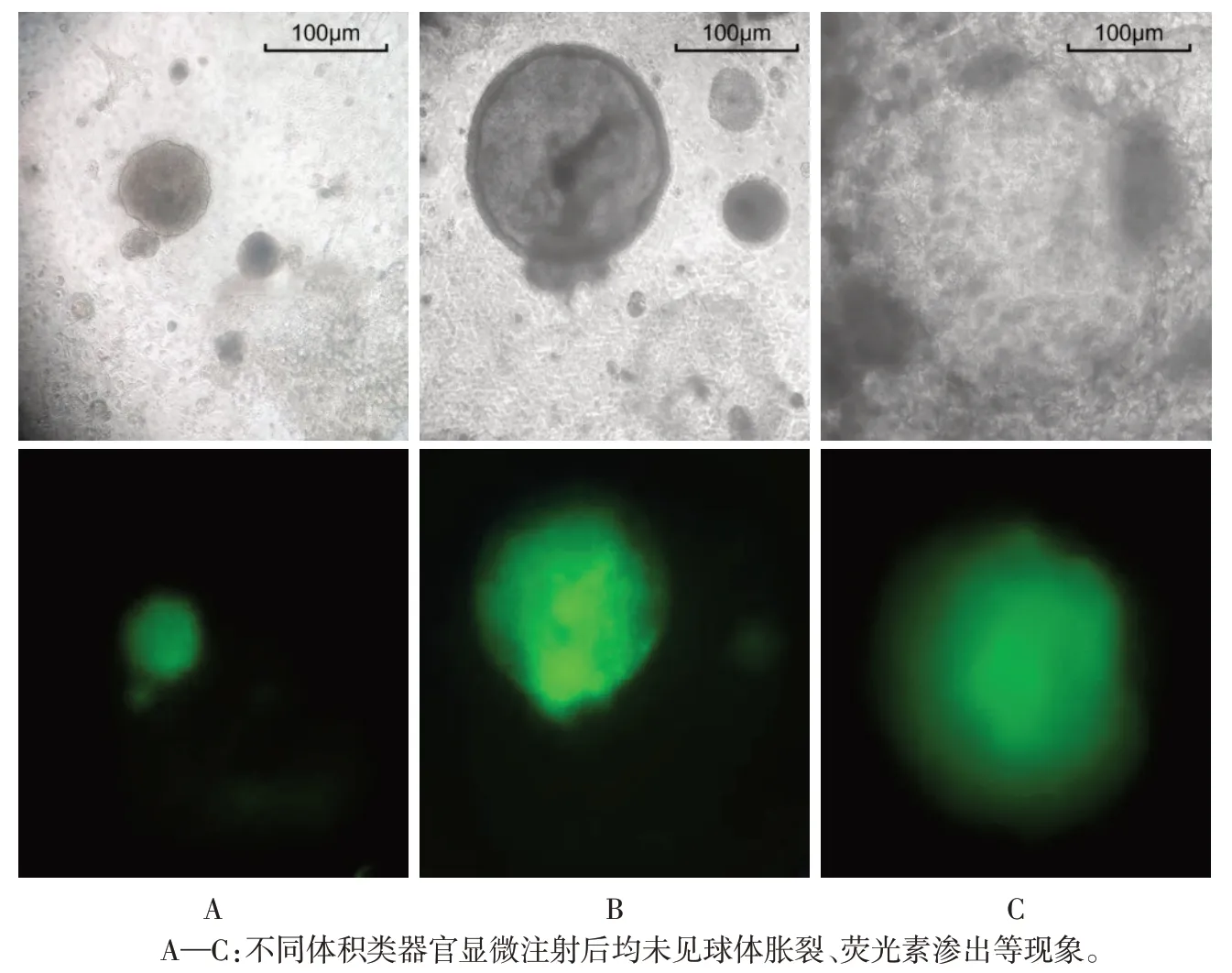
Fig.2 Observation of organoid imaging characteristics under a fluorescence microscope after microinjection图2 荧光显微镜下观察显微注射后的类器官显像特点
2.2 显微注射GFP-PR8 病毒感染类器官特点 见图3、4。在培养基中添加GFP-PR8 病毒,类器官上皮细胞感染效率很低,当显微注射GFP-PR8病毒到类器官腔内,细胞感染率显著增加,表现为极性向内的纤毛区域GFP荧光更明显,而α-tubulin的表达明显减弱;HE 染色提示显微注射后的类器官结构松散,细胞间连接明显破坏,细胞内较多空泡形成。注射GFP-PR8 后,类器官内的细胞表达的ZO-1 较注射PBS 的表达量显著减少,提示细胞间连接遭到的明显破坏是由GFP-PR8感染,而非显微注射引起。
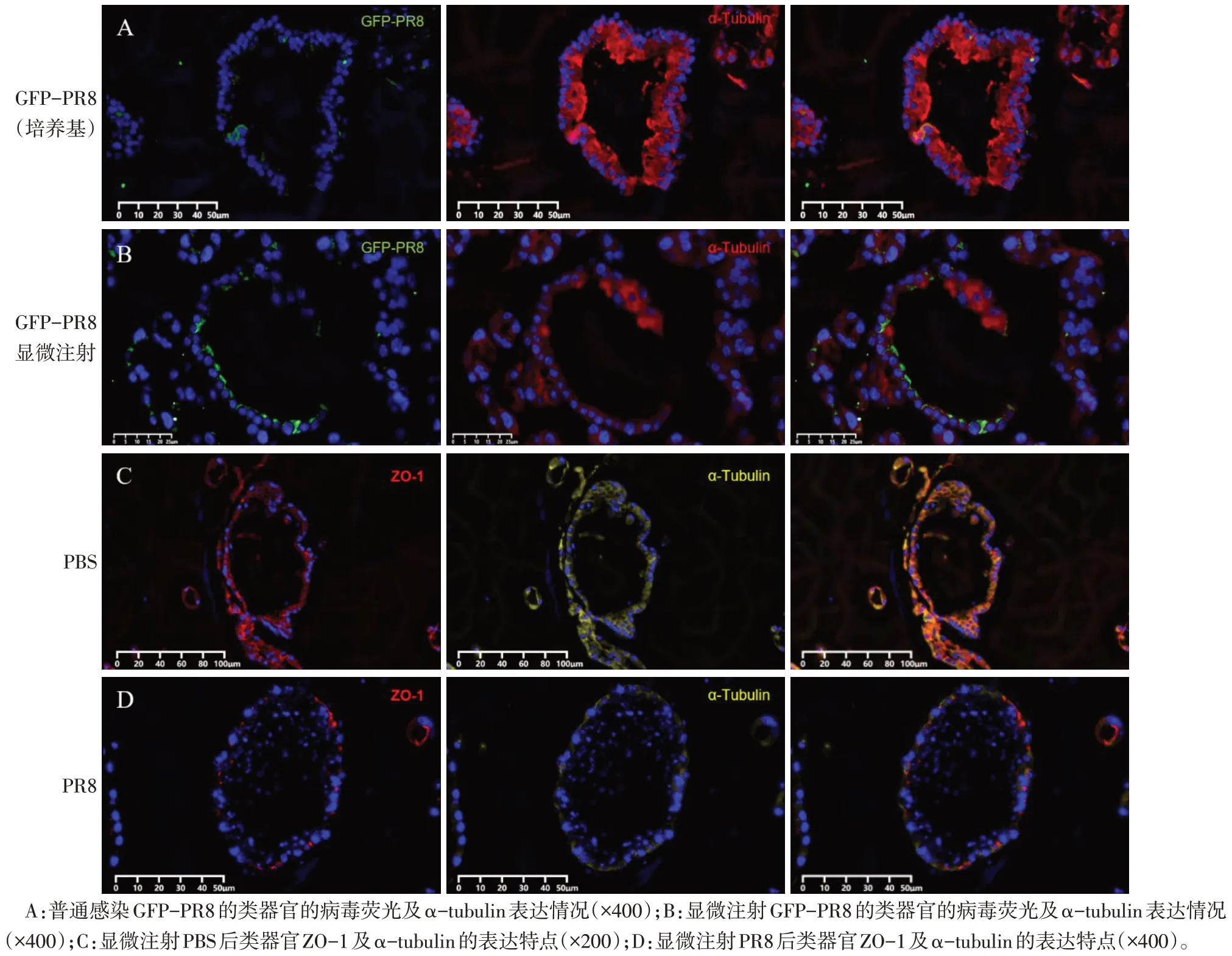
Fig.3 Expression characteristics of specific proteins in organoids after microinjection of GFP-PR8(immunofluorescence staining)图3 显微注射GFP-PR8后类器官特定蛋白表达特点(免疫荧光染色)
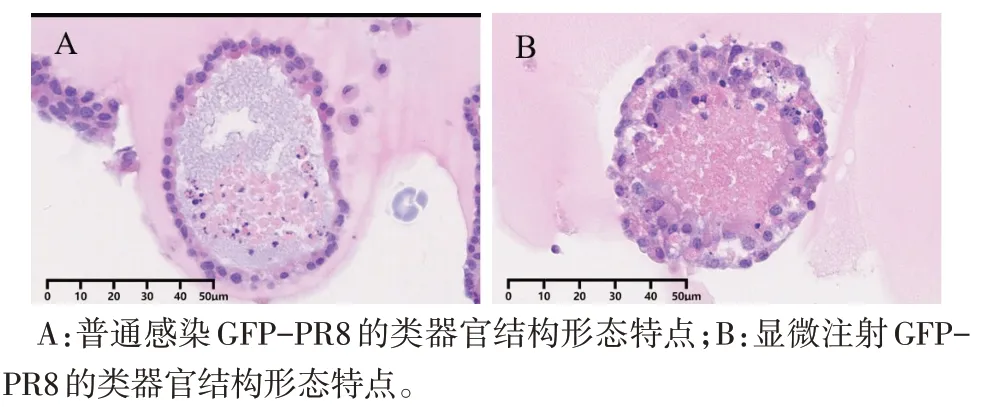
Fig.4 Expression characteristics of specific proteins in organoids after microinjection of GFP-PR8(HE staining,×400)图4 显微注射GFP-PR8后类器官特定蛋白表达特点(HE染色,×400)
2.3 类器官极性反转后的形态学特点 类器官内部细胞核向中央腔偏移、纤毛反转向外的类器官逐步增多,且类器官间的黏附程度增加。反转后的类器官大小稳定,未出现新的增殖、分化。纤毛细胞极性随时间逐渐反转向外,于第6 天起反转比例趋于稳定。见图5—7。
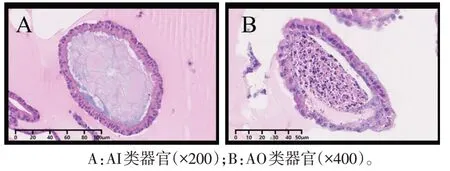
Fig.5 Morphological comparition of AI and AO organoids(HE staining)图5 AI及AO类器官形态学特点比较(HE染色)
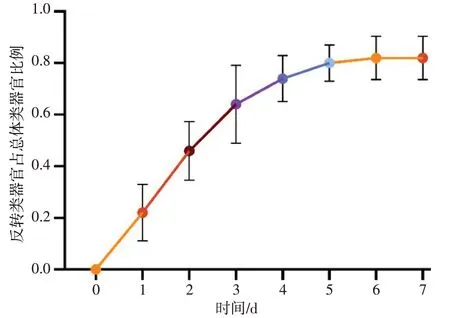
Fig.6 The proportion of organoids with polarity reversal in the upper chamber of transwell to the total population of organoids图6 Transwell上层小室中极性反转的类器官占总体类器官的比例
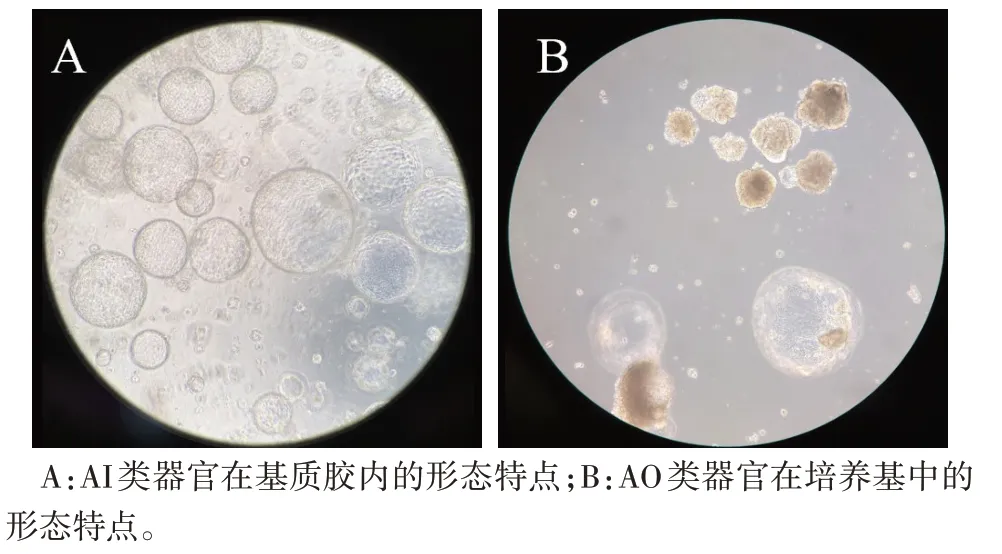
Fig.7 Morphological characteristics of organoids under different culture conditions(×100)图7 类器官在不同培养条件下的形态特点(×100)
2.4 极性反转增加GFP-PR8 病毒感染类器官效率 GFP-PR8感染两种类器官后,通过荧光显微镜观察AO 类器官GFP 的荧光明显强于AI 类器官,提示AO 类器官PR8 感染效率更高,见图8。通过HE染色可观察到AO类器官内部有较多坏死物质堆积,外层纤毛排列紊乱,细胞连接松散,细胞质疏松,有空泡形成,见图9。
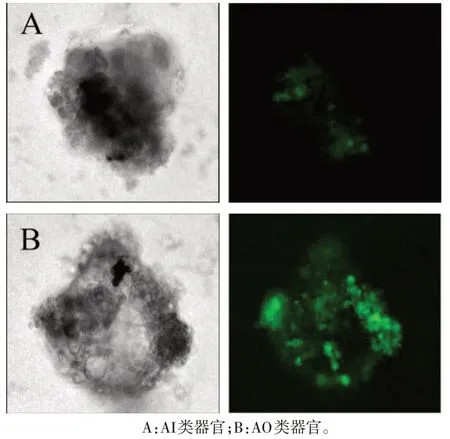
Fig.8 Characteristics of organoidafter infection with GFP-PR8(×100)图8 类器官感染GFP-PR8后的特点(×100)
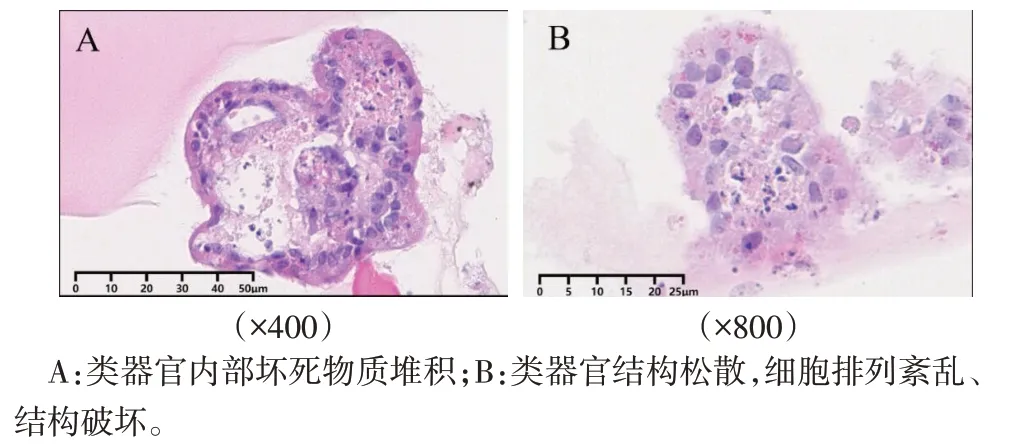
Fig.9 Morphological characteristics of AO organoids infected by PR8(HE staining)图9 PR8感染AO类器官后的形态学特点(HE染色)
2.5 极性反转增强类器官对病毒感染的致伤效应 见图10。在低浓度时(MOI=0.001),两种方式类器官内IL-1β、CCL2、SCGB1A1、SCGB3A2、MUC5B 的mRNA 水平差异均无统计学意义。中浓度时(MOI=0.01),类器官的上述基因表达水平AO均显著高于同浓度刺激下的AI 类器官。而高浓度时(MOI=0.1),上述因子的表达水平AO较AI均有降低趋势,而AI在浓度升高后mRNA水平还有继续升高的趋势。FOXJ1的表达水平在AO和AI间差异有统计学意义(P<0.05)。
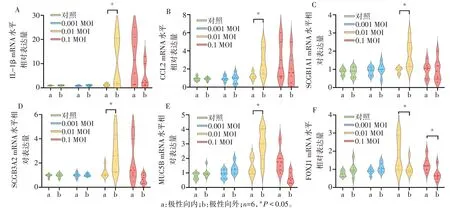
Fig.10 Gene expression characteristics in AI and AO organoids after stimulation with different virus concentrations图10 不同浓度病毒感染AI及AO类器官后的基因表达特点
3 讨论
构建真实模拟呼吸道病毒感染体外模型对肺部感染性疾病防治具有重要科学意义和临床价值[13-14]。本研究中,笔者描述了两种新的气道类器官研究方法,目的是加强干预因素与类器官极性表面的直接接触。两种方法利用了内源性干细胞的强大增殖能力,以及它们聚集并生成类器官的能力。这些类器官的组成细胞具有显著的紧密连接,并由club细胞以及分化的纤毛细胞组成。纤毛细胞显示出类似于体内观察到的形态特性,即纤毛处于极化段,细胞核位于尾端。由于小鼠及人类支气管上皮对流感病毒均敏感,所以类器官是研究急性肺损伤的良好体外模型。
3.1 类器官极性反转对模拟病毒感染意义重大 细胞极性在人甲型流感病毒(influenza A virus,IAV)感染中起重要作用。人气道上皮细胞,包括纤毛细胞和杯状细胞,是IAV的易感细胞,与非极化的细胞相比,极化的上皮细胞特征独特,位于这些细胞的顶端和基底层的IAV特异性受体的差异表达和细胞蛋白的极化运输,这些在体内系统中对塑造病毒的感染性起着重要作用[15]。使用类器官来研究微生物与宿主相互作用的一个挑战是,上皮的顶端表面被封闭在球体内,而外层基底膜封闭性较强,病原体难以进入内部[16]。笔者设计了一种方法来扭转类器官的上皮极性,使顶端表面向外。通过去除培养系统中的ECM 蛋白,使类器官悬浮生长,并保持了3D结构。上皮极性逆转可能是蛋白质和细胞器从一极迁移到另一极的结果,也有可能存在其他机制,如对机械力的响应,有助于调节肠样外翻和极性,本研究描述的方法提供了一个平台,以进一步研究协调上皮形态发生。Co等[17]的研究也发现,反转后类器官Ki67 的表达有降低趋势,提示反转过程对增殖和分化有影响。
3.2 类器官极性反转后黏附性增加 在悬浮培养的过程中,难免会出现类器官聚集黏附的现象。一方面是由于类器官极性反转后,极性向外的区域具有分泌黏液蛋白成分的特性,导致相互接触后产生粘连;另一方面,类器官外部的基质胶若未完全消化,残留的成分也会导致相互粘连[18]。因此,后续的改良实验需要尽量减少类器官之间的黏附,避免聚集成团后影响病原体与所有上皮的有效接触。
3.3 显微注射的应用范围可进一步拓展 类器官显微注射模型的显著特征包括保持类器官形态的完整性,可防止顶端分泌的产物扩散到培养基中,并能够选择性地感染极化上皮的顶端。因此,该模型允许对微生物、上皮细胞及其分泌产物之间的相互作用进行广泛研究[19]。目前,已有多项研究证实了显微注射技术在肠道及呼吸道类器官中关于病原体-宿主相互作用、急性损伤等方面的可行性及价值[19-21]。未来更有前景的研究方法是将类器官与免疫细胞及基质细胞共培养,从而更加贴近实景下实现各种病理条件下的细胞相互作用,这对于深入探索复杂生态位的分子病理机制具有重要意义。

