中草药黄嘌呤氧化酶抑制剂的筛选与作用机制研究
钟瑜萍,许鑫鑫,肖 迪,朱贤娜,林雪仪,刘志伟
(1.嘉应学院 生命科学学院,广东 梅州 514015;2.嘉应学院 广东省山区特色农业资源保护与精准利用重点实验室,广东 梅州 514015)
痛风作为单钠尿酸盐沉积所致的晶体相关性关节病,与嘌呤代谢紊乱和尿酸排泄减少所致的高尿酸血症(hyperuricemia,HUA)直接相关[1].它们为同一疾病的不同恶化时期,当HUA 患者的血尿酸浓度超过了其溶解度的最大值,尿酸将会结晶,沉积于关节滑膜、滑囊、软骨等组织,导致急性痛风发作[2].黄嘌呤氧化酶(xanthine oxidase,XO)是引起痛风的关键因素,它可以通过促进次黄嘌呤的合成进而促进尿酸的产生[3],同时生成超氧自由基,产生过氧化氢分子,引起氧化应激损伤等反应[4-6].而XO 可被黄嘌呤氧化酶抑制剂(xanthine oxidase inhibitor,XODI)抑制,故XODI 在痛风治疗中具有重大意义.XODI 如别嘌呤醇、非布索坦等使绝大多数患者的症状得到控制[7],已作为临床治疗痛风的一线药物.但在治疗的同时,也会带来一些副作用,如别嘌呤醇带来的胃肠道症状、非布索坦带来的心血管疾病[8-10].因此迫切需要寻找具有低不良反应、更经济的XODI 药物来治疗痛风.
传统中草药在痛风治疗方面具有临床疗效确切且副作用相对较小的优势[11-12],从中草药中发现天然的XODI 是目前研发的重要领域.梅州客家中草药的种类丰富,民间常用品种近200 种,常用于药用、药膳、凉茶等.本文根据各药材功效应用,再结合梅州客家中草药市场调查研究[13]中的用药习惯选择8 种梅州客家地区常用作药膳的药食同源的药材(茵陈[14]、白茅根[15]、粉葛[16-17]、鸡骨草[18-19]、五指毛桃[20]、石参[21]、地菍[22-24]和三月泡[25-26])作为研究对象.一方面从抑制尿酸生成的角度出发初步评价上述8 种中草药体外抑制XO 的作用,另一方面从中草药中总黄酮的角度出发,评价其抗氧化活性,筛选活性优良的中草药,再借助网络药理学对其治疗HUA 潜在分子作用机制进行分析,为相关客家中草药药效物质基础的进一步研究及其应用提供科学参考.
1 仪器与材料
1.1 仪器
BP211D 分析天平(赛多利斯贸易有限公司);CP1100D Crest 超声波清洗机(美国CREASTAUDIO公司);FD-1A-50 真空冷冻干燥机(北京博医实验仪器有限公司);RE-2000B 真空旋转蒸发仪(上海亚荣仪器有限公司);T6 新世纪紫外分光光度计(北京普析通用仪器有限责任公司);ULUO-Ⅰ-10T 超纯水机(四川优普超纯科技有限公司).
1.2 药材
所有药材均购买于梅州市梅江区瓜园市场,经鉴定:茵陈为菊科植物茵陈蒿的干燥地上部分;白茅根为禾本科植物白茅的干燥根茎;粉葛为豆科植物甘葛藤的干燥根;鸡骨草为豆科植物广州相思子的干燥全株;五指毛桃为桑科植物裂掌榕的根;石参为豆科狸尾豆属植物猫尾草的干燥根;地菍为野牡丹科植物地菍的干燥全草;三月泡为蔷薇科悬钩子属植物山莓的干燥根.
1.3 试剂
别嘌呤醇(阳性对照,No:428A021,纯度≥98%)、黄嘌呤(No:111E041,纯度≥98%)、芦丁(No:1215I021,HPLC≥98%)和黄嘌呤氧化酶(No:427W011,纯度≥99%)均购自北京索莱宝科技有限公司,1,1-二苯基-2-三硝基苯肼(DPPH,No:C12169642,HPLC≥98.5%)购自上海麦克林生化科技有限公司,5%亚硝酸钠(NaNO2)溶液、10%硝酸铝(Al(NO3)3)溶液和4%氢氧化钠(NaOH)溶液均为实验室自制,水为超纯水.
2 方法
2.1 提取物的制备
分别称取茵陈250 g,石参330 g,粉葛280 g,五指毛桃290 g,鸡骨草250 g,三月泡230 g,白茅根260 g,地菍250 g,加水煮沸1 h,料液比1∶3(g/mL),重复2 次,合并滤液,用真空旋转蒸发仪在80 ℃下旋转蒸发至粘稠状后真空冷冻干燥为粉末,避光保存备用.
2.2 总黄酮含量测定
精确称取0.017 0 g 芦丁,无水乙醇溶解定容至50 mL,依次等比稀释得到浓度为340、170、85、42.5、21.25 和10.63µg/mL 的芦丁标准品溶液,以质量浓度为横坐标(X),吸光度值为纵坐标(Y)绘制标准曲线和回归方程.分别吸取100 μL 8 种样品溶液(无水乙醇溶解药材提取物,浓度为2 mg/mL)于试管中,并向试管中分别加入900 μL 的无水乙醇,向试管内分别加入0.5 mL 5%NaNO2溶液,震荡混匀放置6 min 后,加入0.5 mL 10%Al(NO3)3溶液,摇匀后继续放置6 min,再加入4 mL 4%NaOH 溶液摇匀静置20 min.以无水乙醇代替样品作为空白对照.510 nm 波长处测定吸光度.通过标准曲线回归方程计算样品中总黄酮含量.
2.3 黄嘌呤氧化酶抑制活性筛选体系优化
将100 μL 75 mM 磷酸盐缓冲液加入96 孔板,待加入50 μL 0.1 U/mL XOD,37 ℃孵育3 min 后分别加入50 μL 浓度为500、400、300、200、100、50、25 和12.5 μM/mL 的黄嘌呤溶液,启动反应,在295 nm 的波长处每间隔20 s 记录1 次吸光度的数值,直至各浓度平台期.每组设置三个平行.
2.4 8 种药材提取物黄嘌呤氧化酶抑制活性
具体方法参考文献[11],简述如下:检测8 种药材对XOD 的抑制活性,以黄嘌呤为底物,XOD 抑制剂别嘌呤醇作为阳性对照,使用酶标仪进行测定,重复2 次.实验分为空白组、酶反应组、抑制剂组和对照组.分组及剂量见表1.将100 μL 样品溶液(无水乙醇溶解药材提取物)和50 μL 酶溶液混合均匀,37 ℃预孵15 min,加入50 μL 最适浓度的黄嘌呤底物溶液来启动反应,于37 ℃孵育15 min,再用酶标仪检测其在波长为295 nm 下的OD 值.每样品需做3 个复孔,重复操作3 次.抑制率(%)=[1-(抑制组OD 值-对照组OD 值)/(酶反应组OD 值-空白组OD 值)]×100%.
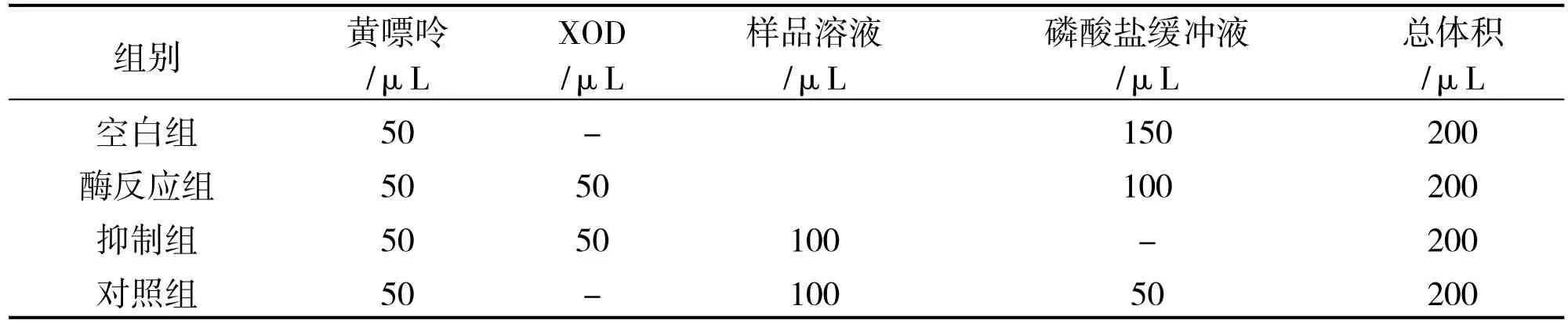
表1 分组与剂量
2.5 IC50的计算
通过Graphpad prism 7.0 软件对这8 种药材提取物进行数据分析.横坐标选取提取物浓度(C)的对数、纵坐标为其相应的吸光值,进行线性拟合,计算XOD 的抑制活性到达一半时的药物浓度,即IC50.
2.6 抗氧化活性测定
分别以0.05 g/mL 的8 种药材溶液作为样品溶液(无水乙醇溶解药材提取物).实验分为3 组:2 mL样品溶液+2 mL DPPH 溶液(抗氧化组,B2);2 mL 无水乙醇+2 mL DPPH 溶液(空白组,B1);2 mL样品溶液+2 mL 无水乙醇(对照组,B3).避光反应25 min 后于517 nm 处测量OD 值.
2.7 网络药理学分析
2.7.1 鸡骨草靶点的收集
利用中药系统药理学数据库与分析平台(TCMSP)及BATMAN-TCM 数据库获取鸡骨草的活性成分及靶点,将两个数据库收集的药物靶点取并集后,导入UniProt 数据库进行标准化处理.TCMSP 数据库检索筛选标准设置为口服利用度(OB)≥30%及类药性(DL)≥0.18;BATMAN-TCM 数据库筛选标准设置分数截止(Score cutoff)≥20,P值<0.05.数据库网址见表2.
表2 数据库及软件平台网址
2.7.2 药物-成分-靶点网络构建
将筛选后的中药成分名称进行重新编号,导入Cytoscape 3.6.0 软件绘制鸡骨草药物-成分-靶点网络.利用软件内置的network analyzer 插件进行网络特征分析.根据自由度值(degree)的大小,筛选确定鸡骨草中最重要的化学成分.
2.7.3 疾病相关靶点的收集及交集靶点的筛选
在DisGeNET,GeneCards 数据库中分别以“hyperuricaemia”和“HUA”为检索词获取疾病相关靶点,合并两数据库结果,得到疾病靶标数据集.将鸡骨草药物靶点与HUA 疾病靶点导入在线韦恩图绘制平台Venny 2.1 获取交集靶点,并绘制韦恩图.
2.7.4 蛋白质-蛋白质相互作用(PPI)网络构建
将交集靶点录入STRING 数据库构建PPI 网络,选择分类人类Homo sapiens,置信度>0.4.导出为.tsv文件后,使用Cytoscape3.6.0 软件对其进行可视化处理.
2.7.5 药物-靶点-疾病网络构建与分析
使用Cytoscape 3.6.0 软件中内置的merge 功能对复方药物成分,药物靶点,疾病靶点,取交集构建药物成分-靶点-疾病网络,使用network analyzer 功能进行网络特征分析.
2.7.6 基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)通路分析
将交集靶点按“degree≥2 倍度值中位数”筛选出14 个核心靶点,应用MetaScape 数据平台对筛选出的核心靶点进行GO 功能注释和KEGG 通路富集分析,包括生物过程和信号通路分析.选择种族人类homo sapiens,设定P<0.05,其余选项保持默认值,分析鸡骨草治疗HUA 潜在的生物过程和信号通路.利用微生信在线平台绘制GO 分析条状图和KEGG 富集气泡图.
2.7.7 药物成分-靶点-通路网络构建与分析
药物成分-靶点-通路网络构建与分析使用Cytoscape 3.6.0 软件中内置的merge 功能对药物成分,药物靶点,疾病靶点及GO 富集中的BP 通路,取交集构建药物-成分-靶点-通路网络,使用network analyzer功能进行网络特征分析.
3 结果
3.1 芦丁标准曲线
以芦丁质量浓度340、170、85、42.5、21.25 和10.63µg/mL 为横坐标,吸光度为纵坐标,绘制标准曲线,得线性回归方程为Y=0.002 059X+0.008 036,相关系数为R2=0.999 3.表明芦丁浓度在5.31~340 μg/mL 和吸光度呈良好的线性关系见图1.

图1 芦丁标准曲线
3.2 总黄酮含量和抗氧化活性
药材总黄酮含量如表3 所示:地菍、茵陈、石参、粉葛、五指毛桃、鸡骨草、三月泡和白茅根的总黄酮含量分别为4.33、0.19、0.18、0.42、0.17、0.18、4.58 和0.17 mg/g.
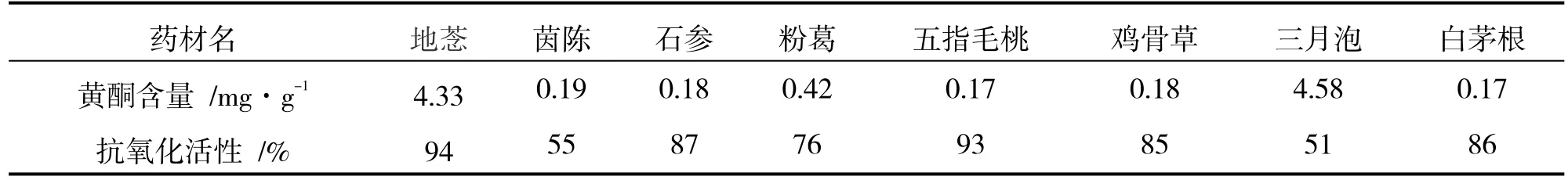
表3 总黄酮含量和抗氧化活性
药材(无水乙醇溶解药材提取物,浓度为0.05 g/mL)的抗氧化作用如表3 所示,地菍、茵陈、石参、粉葛、五指毛桃、鸡骨草、三月泡和白茅根的抗氧化活性分别为94%、55%、87%、76%、93%、85%、51%和86%.这8 种药材对自由基的清除效果良好,都大于50%,其中五指毛桃和地菍的抗氧化活性均大于90%.
3.3 黄嘌呤氧化酶抑制活性筛选体系优化
在酶浓度一定的条件下加入不同浓度的黄嘌呤,可以直接观察反应达到平台期的时间会随底物浓度的增加而增加,而其反应速率基本没变化.由图2 可知,当底物终浓度为500 μmoL 时,其OD 值信号的检测窗口为0.8~1.4,3 min 内达到平台期,这种情况下的系统误差小,又能保证足够的运算时间,故选择这个条件进行以下研究.
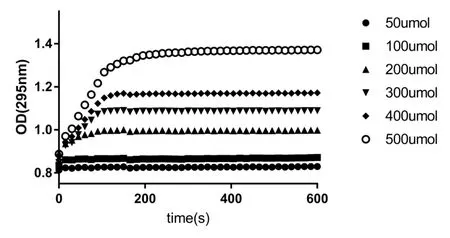
图2 不同浓度底物下黄嘌呤氧化酶动力学
3.4 8 种药材提取物黄嘌呤氧化酶抑制活性
8 种药材提取物在不同浓度时对黄嘌呤氧化酶的抑制作用如表4.结果表明,在0.1~0.4 mg/mL 浓度时,8 种药材提取物均对黄嘌呤氧化酶具有不同程度的抑制作用,且随着浓度的增加,黄嘌呤氧化酶抑制活性增加.茵陈、石参、三月泡、五指毛桃、粉葛、地菍、鸡骨草和白茅根的IC50分别为255.9、287.6、160.1、249.6、296.6、139.2、201.2 和288.9 μg/mL.

表4 8 种不同浓度的药材提取物对黄嘌呤氧化酶抑制活性
3.5 鸡骨草成分及药物靶点的筛选
筛选得鸡骨草中的化学成分有10 个.利用获得的10 个成分去筛选靶点,去重后共得142 个.将上述所得的成分和靶点数据导入到Cytoscape 3.6.0 进行网络构建,获得鸡骨草药物成分-靶点网络,该网络包含153 个节点,310 条边.绿色箭头代表鸡骨草化学成分,橙色圆形代表化学成分相应靶点,如图3.药物-成分-靶点网络分析结果显示,自由度排名前5 的化学成分如表5.
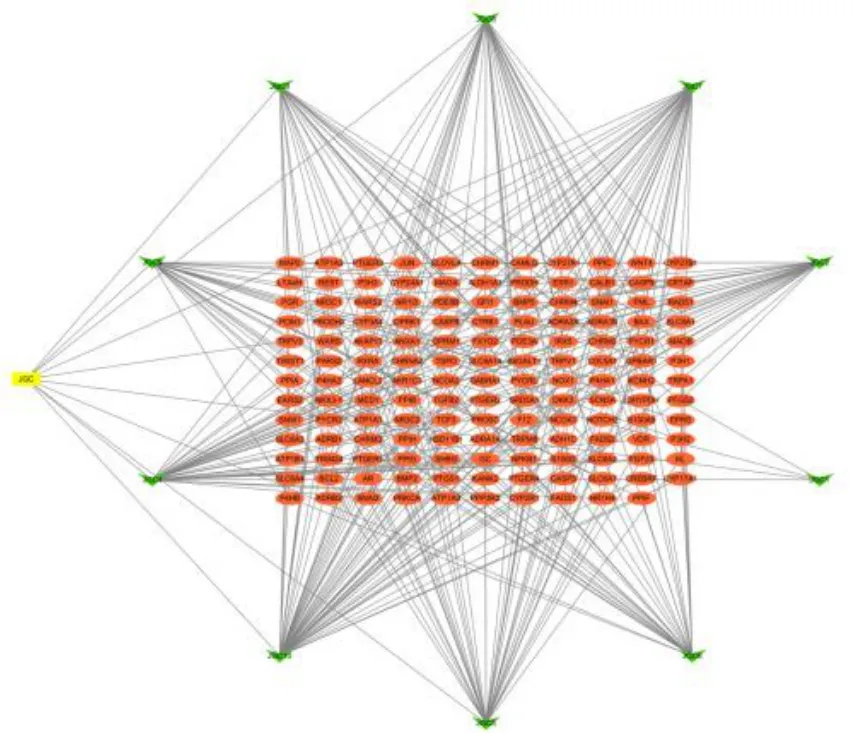
图3 药物-成分-靶点网络
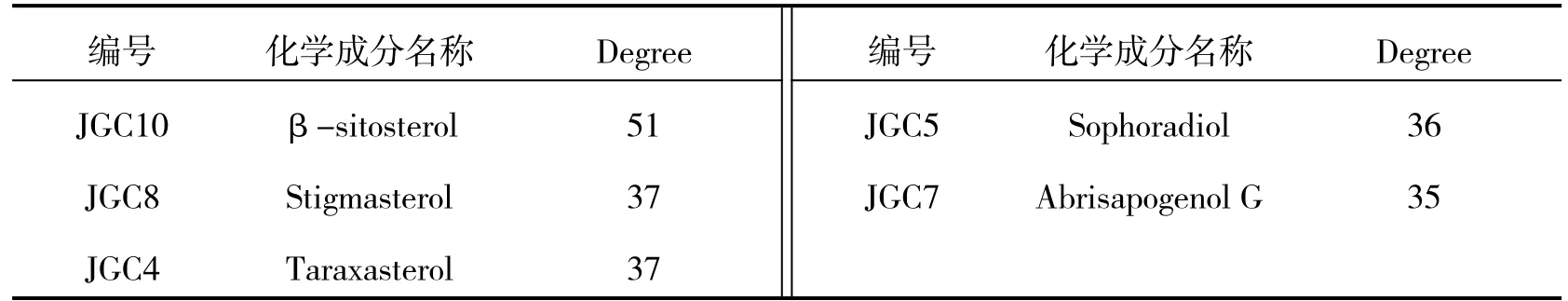
表5 药物自由度(Degree)前五活性成分
3.6 药物与疾病交集靶点的收集
以“hyperuricaemia”和“HUA”为关键词,分别在DisGeNET 数据库检索到205 个靶点,在GeneCards数据库获取751 个,经合并去重后,得疾病靶点824 个.将药物靶点与疾病靶点取交集,得28 个共有靶点,该交集靶点即为鸡骨草治疗HUA 的靶点.韦恩图如图4 所示.
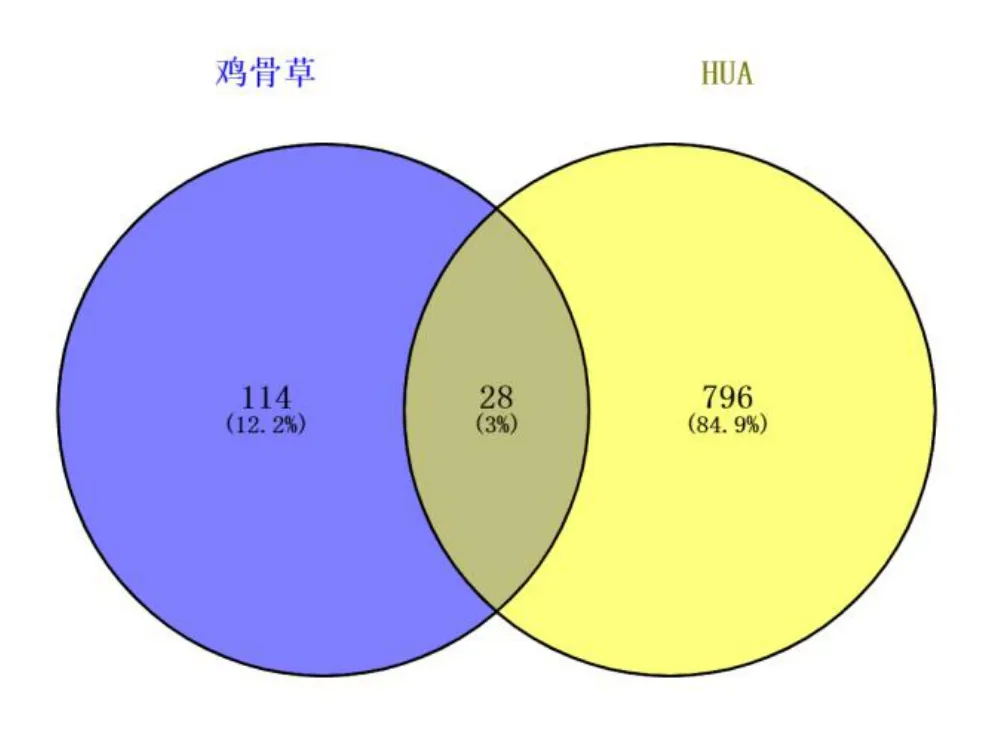
图4 鸡骨草与HUA 的靶点交集
3.7 交集靶点PPI 网络构建
将28 个交集靶点导入STRING 平台构建PPI 网络图,如图5.根据靶点的相关属性信息,并以“degree”大于或等于中位数为筛选条件,最终获得鸡骨草治疗HUA 的核心靶点14 个.Degree 前五名为雌激素受体1(ESR1)、雄激素受体(AR)、Jun 原癌基因(JUN)、胱天蛋白酶3(CASP3)、胱天蛋白酶8(CASP8).
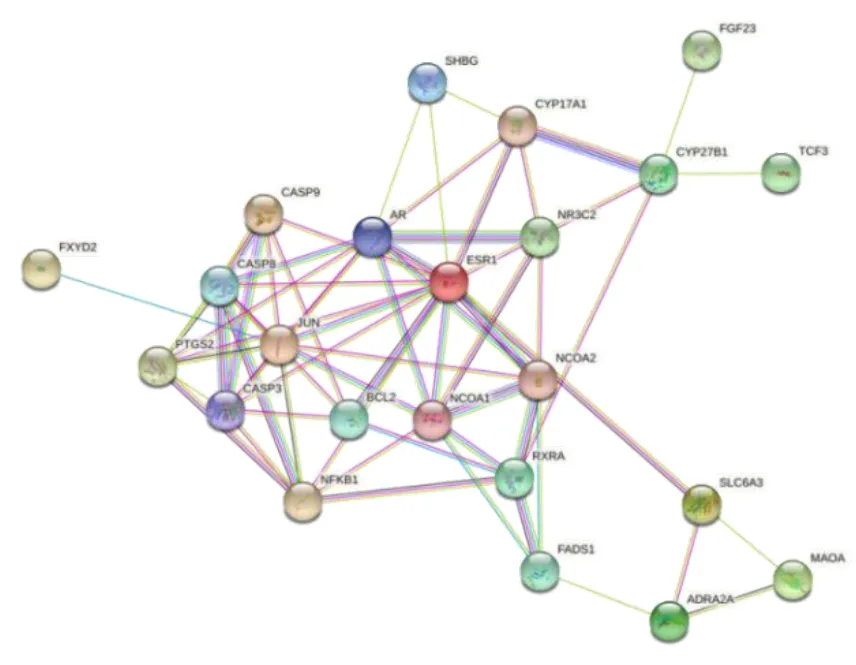
图5 鸡骨草治疗HUA 的蛋白质相互作用网络(PPI)
3.8 药物-靶点-疾病网络构建
“药物-靶点-疾病”网络如图6 所示,该网络包括38 个节点,61 条边.绿色菱形代表药物成分,橙色椭圆代表药物与疾病的交集靶点.化学成分中degree 值排名前5 的依次为:β-sitosterol、Stigmasterol、Taraxasterol、Sophoradiol 和Abrisapogenol G、degree 值排名前5 的靶点分别为:维甲酸X 受体α(RXRA)、雌激素受体1(ESR1)、成纤维细胞生长因子23(FGF23)、转录因子3(TCF3)、β-1,4-半乳糖基转移酶1(B4GALT1).

图6 药物-靶点-疾病网络
3.9 GO 富集分析和KEGG 通路分析
通过MetaScape 数据平台对鸡骨草治疗HUA 的14 个核心靶点进行GO 富集分析和KEGG 通路分析.GO功能富集分析共得到186 个GO 条目(P<0.05),其中包含共获149 条生物过程(BP)条目,27 个分子功能(MF)条目,10 个细胞组成(CC)条目.采用相似度度量对获取的条目进行聚类分析时,采用相似度度量,相似度>0.3 的子树被认定为聚类.选择集群中最具统计学意义的术语来表示集群并作图,GO 分析结果见图7.

图7 鸡骨草治疗HUA 靶标的GO
KEGG 通路分析共获57 条信号通路(P<0.05),依据P值和Count 进行排序,选取可能性最高的聚落进行可视化分析,所得KEGG 气泡富集图共7 条通路,通路富集基因越多,气泡越大,P值越小,颜色越红,如图8.
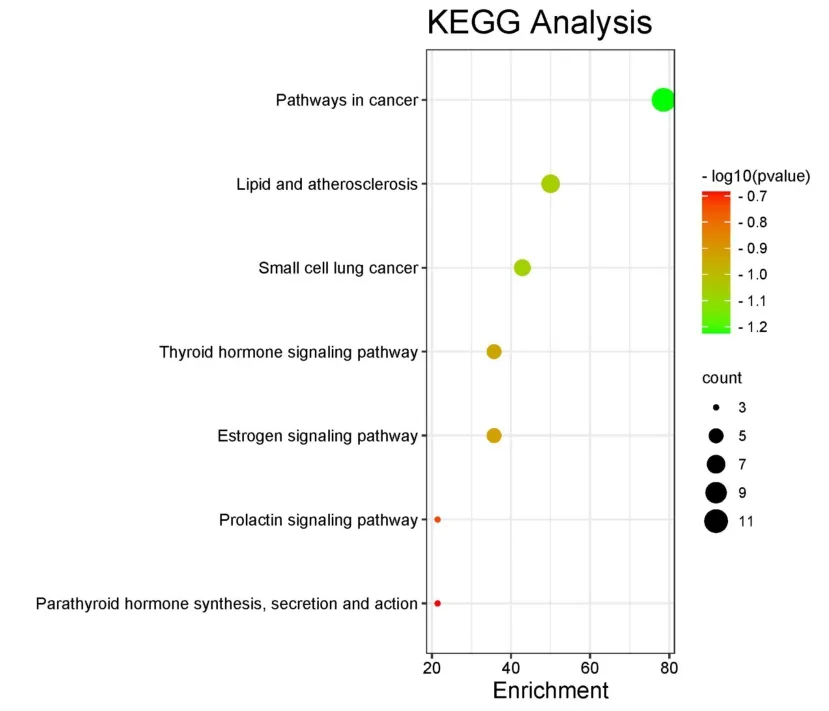
图8 鸡骨草治疗HUA 靶标的KEGG
3.10 药物成分-靶点-通路网络的构建
将中药成分,药物靶点,疾病靶点,评分前14 的BP 通路导入Cytoscape 3.6.0 软件中取交集,获得“药物成分-靶点-通路”网络进行网络分析,结果见图9,包括37 个节点109 条边.绿色箭型代表药物成分,黄色椭圆型代表交集靶点,橙色方形代表BP 通路.有效成分degree 值最大5 个成分分别是β-谷甾醇(β-sitosterol)、槐二醇(Sophoradiol)、相思子酚G(Abrisapogenol G)、豆甾醇(Stigmasterol)、蒲公英甾醇(Taraxasterol).degree 值最大的5 个靶点分别是雌激素受体1(ESR1)、前列腺素内过氧化物合酶2(PTGS2)、视网膜X 受体α(RXRA)、细胞色素P450 家族27 亚家族B 成员1(CYP27B1)、雄激素受体(AR).
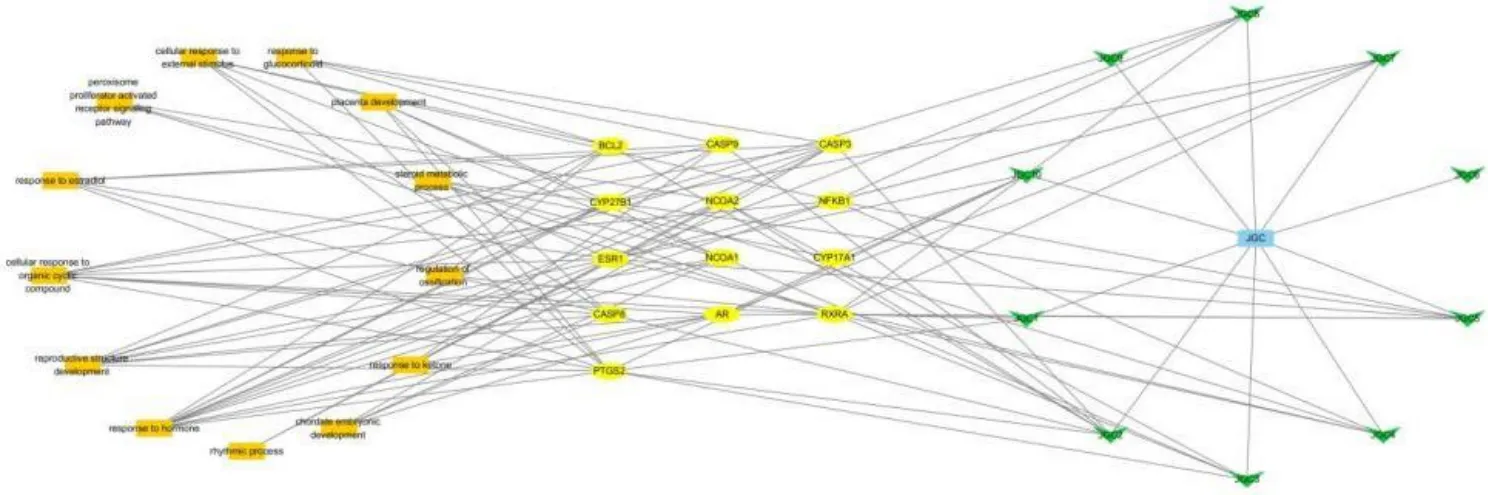
图9 药物成分-靶点-通路网络
4 讨论
脾肾亏虚;外感风、寒、湿、热等邪气和饮食不节、情志不畅等因素都可能诱发痛风.中药的散风、逐塞、祛湿、清热、通络、活血、行气、补虚这8 种方式对痛风的治疗具有显著效果[27].本研究依据梅州客家地区用药习惯及药材功效,选取8 种常用的分别具有清热利湿、利尿、通经活络、健脾化湿等功效的中草药(茵陈、白茅根、粉葛、鸡骨草、五指毛桃、石参、地菍和三月泡),通过XO 抑制活性评价其潜在痛风治疗作用,发现这8 种中草药水提物对XO 具有不同程度的抑制作用,其中鸡骨草抑制效果最好.其中,葛根和石参的活性分别与林娜[28]、蓝梓华[29]的报道相似,此前未见茵陈、白茅根、鸡骨草、五指毛桃、地菍和三月泡的XO 抑制活性报道.郝悦[30]还证实许多黄酮类物质具有XO 抑制活性,从上述实验结果来看,8 味中草药都含有总黄酮,但能否作为降尿酸的物质基础还需进一步研究.因此,本研究借助网络药理学对鸡骨草对抗HUA 的潜在作用机制进行了分析,得出鸡骨草通过多成分、多靶点、多通路抗HUA的结果.研究结果提示鸡骨草有5 种重要有效成分,可能作用于ESR1、PTGS2、RXRA、CYP27B1 和AR等靶点,通过调控多种生物过程来实现抗HUA 的作用.这表明鸡骨草可能通过β-sitosterol、Sophoradiol、Abrisapogenol G、Stigmasterol 和Taraxasterol 这些有效成分成为治疗HUA 的潜在药物.本文得到的实验结果为揭示这些中草药降尿酸功效提供了科学依据,同时需进一步用现代质谱技术对鸡骨草提取物中主要成分进行分离和鉴定,分析其可能的物质基础,以及相关靶点之间的相互作用还待进一步实验验证.

