新型大鼠腰部慢性骨骼肌复合损伤模型的建立
卢晶晶,张弛,张驰名,许铛瀚,林煜翔,谢炜星
(1. 广州中医药大学第一附属医院针推康复中心,广州 510000;2. 北京中医药大学第二临床医学院,北京 100105;3. 广州中医药大学,广州 510000;4. 广州中医药大学第一附属医院骨伤中心,广州 510000)
在各种类型创伤中,肌肉组织损伤所占的比例相对最高[1]。 损伤后肌肉组织血肿机化、瘢痕组织产生,对活动能力、生活质量构成现实的威胁[2];因此研究骨骼肌损伤的发病机制,了解其病理特点和临床转归,探讨相关的预防、治疗和康复措施等,一直是医学研究的一项重要课题[3]。 慢性骨骼肌损伤是一种常见的运动损伤,它可以导致肌肉疼痛、功能障碍和活动受限[4]。 需要注意的是慢性骨骼肌损伤往往是急性骨骼肌损伤后康复不彻底,同时局部再次遭受反复打击而成。 长时间不活动[5]、固定骨骼肌或太空飞行也会导致肌肉骨骼质量、大小和力量的显著损失,最终导致肌肉萎缩[6]。
检索文献发现在骨骼肌损伤的模型制备方面主要是急性期的模型比较成熟:如垂直打击造模[7-8]、布比卡因注射造模[9]等。 而在慢性骨骼肌损伤方面传统的模型一般采用手术切除或切割肌肉组织的方式,例如切除肌腱或者神经[10]、阻断血流[11]等方法,以达到慢性损伤的效果。 有研究者选择经典的大鼠下坡跑离心收缩模型诱导动物的慢性骨骼肌损伤模型[12-13],该模型由Schwane 等[14]设计建立,然而需要注意的是该文发表时间是1983年,距今已40 年。 其只能模拟部分慢性肌肉损伤情况:尽管该方法可以模拟骨骼肌的长期负荷和运动过程,但并不能完全模拟所有慢性肌肉损伤情况,因此需要结合其他模型和方法进行综合研究。 传统的慢性骨骼肌损伤模型局限性在于无法模拟真实的骨骼肌疾病,因为病理机制简单,与具有持久的肌肉疼痛、功能障碍的原发病有较大区别。 此外,传统的方法还可能导致非特异性的细胞死亡和炎症反应,从而难以评估慢性肌肉损伤的分子机制。
另外,骨骼肌损伤模型在动物实验中往往采用的是针对腓肠肌、股四头肌进行定位打击,本实验更换损伤肌群同时结合人体工程力学提出构建腰部慢性骨骼肌复合损伤模型新思路:急性损伤后的大鼠腰部肌肉在长期过度负重的条件下不断缺血、痉挛、机化等达到慢性非特异性腰痛的损伤时间则可以构建完整的复合模型。 2022 年,研究显示非特异性腰痛是全球最普遍和最致残的疾病,在慢性患者人群中,较少患者能自行缓解(约30%)[15]。 而其病因常常是因肌肉和韧带等软组织在急性损伤的基础上进一步慢性劳损(如久坐、久立)而导致病情迁延不愈[15]。 慢性骨骼肌损伤对肌肉组织的修复和再生能力有严重影响,而建立新型大鼠腰部慢性骨骼肌复合损伤模型可以为肌肉组织再生提供更真实的模型,促进肌肉组织的再生和修复研究;可以更真实地模拟肌肉长期受损状态,有助于深入探究慢性骨骼肌损伤的病理机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级健康8 周龄雄性SD 大鼠28 只,体重250 ~ 300 g,购自北京华阜康生物科技股份有限责任公司【SCXK(粤)2022-0063】,动物饲养于广州中医药大学实验动物中心【SYXK(粤)2018-0001】,大鼠自由进食及饮水,温度为20 ~ 22℃,湿度50% ~60%,模拟自然光照周期(每日8:30 开灯,每日20:30 关灯),大鼠按组分笼,定期消毒清理饲养盒,更换垫料。 本实验由广州中医药大学实验动物伦理委员会审核通过(20220331007)。
1.1.2 主要试剂与仪器
3%戊巴比妥钠(上海化学试剂采供供应站分装厂,120505);4%多聚甲醛溶液(BL539A)购自北京沃格东方科技有限公司,品牌:biosharp。 单钩砝码打击器(500 g):购自沧州辰龙精密机械有限公司。自制固定圆桶杯:定制圆桶PVC(底部直径12 cm,高度30 cm),购自温州钱森包装有限共公司;网格卡扣:购自河北稳固丝网制品有限公司(丝径0.4 mm 丝网宽90 cm);Slide-Viewer 图像采集系统:应用程序,版本:2.5.0.143918。 NovaSeq 6000 测序平台:仪器名称,DNBseq-T7RS,武汉华大智造科技有限公司生产的仪器,仪器编号R1100600210010。
1.2 方法
1.2.1 实验改进思路
为解决上述问题,本文综合文献对方法进行了优化。 复合损伤模型组参考垂直打击模型[7-8],经过预实验选择对大鼠打击合理范围内的打击次数(连续2 次),然后采用自制坐位模具,将大鼠固定在各个鼠格中强迫坐姿制造静力压,通过体位及力学的改变,加重肌肉负担减少肌肉修复,并使用转录组测序进行验证[16]。 参考文献[17]记载人类1 h约等同于大鼠生命周期的30 h 以上(不同年龄段有差异),结合预实验观察动物耐受程度,将强迫坐姿时间安排在打击后持续1 h。 人类慢性非特异性腰痛的发病时间,为腰痛急性(6 周内)、亚急性(6 ~12 周)和慢性(12 周以上)[18],大鼠的发病时间则相应缩短[17]。 人类的1 h 约等同于成年期大鼠生命周期的34.8 h[16](即大鼠一个月相当于人类的3年,相较人类更快地衰老)。 在60 h 的造模方案中,间歇(打击+ 强迫坐姿)训练时间,符合慢性腰肌劳损的要求。 单纯打击伤模型组则符合急性损伤要求:造模时间约28 h。 静力压会影响足部、尾部等组织的血流及细胞代谢,要定期检查相应部位,谨慎控制坐位姿势时长,减轻脚部和爪子的压力,并尽可能减少伤害。
1.2.2 分组造模
在实验前进行1 周的适应性饲养。 采用随机数字表法将28 只SD 大鼠随机分为3 组,分别为对照组(Control group),单纯打击伤模型组,简称打击组(HIM group),复合损伤模型组,简称复合组(CDM group)。 其中,对照组10 只,打击组9 只(行垂直打击),复合组9 只(垂直打击结合强迫长时坐位),标记编号。 用3%戊巴比妥钠按0.5 mL/100 g 的计量,腹腔注射麻醉。 本实验中打击组参考侯懿烜等[19]垂直下落打击的造模方法构建,而复合组在打击后使SD 大鼠强迫持续坐姿,以模拟人类疾病腰肌劳损。
进行分笼适应性喂养7 d 后,剪除大鼠打击处被毛,打击组大鼠俯卧位并在打击点做标记同时打击器激光锚定打击部位(见图1),打击部位在俯卧位大鼠第五腰椎水平双侧竖脊肌[10],触碰局部时有躲避反射。 每次击打左右腰部各1 次,垂直打击标记部位(2 d 内共打击3 组),打击器与损伤处接触面积约为1 cm × 1 cm,动能为2.352 J(打击器总重量为500 g,由48 cm 处自由落体)。 观察打击部位无骨折,表皮无破损,有散在红色斑点,皮下暗红,不作任何处理,形成背部肌群急性钝挫伤动物模型。 复合组2 d 内共打击2 组(左右腰肌各1 次为1 组), 随后使用自制固定圆桶杯及网格卡扣固定大鼠,使其模仿人体坐位姿势强迫坐位1 h 造模(见图2)。 造模成功后将实验大鼠放回笼中继续进行常规饲养,按实验时间表和流程图进行(见图3)。

图1 垂直打击图Figure 1 Vertical strike diagram

图2 强迫坐姿模型示意图Figure 2 Diagram of a forced sitting posture model
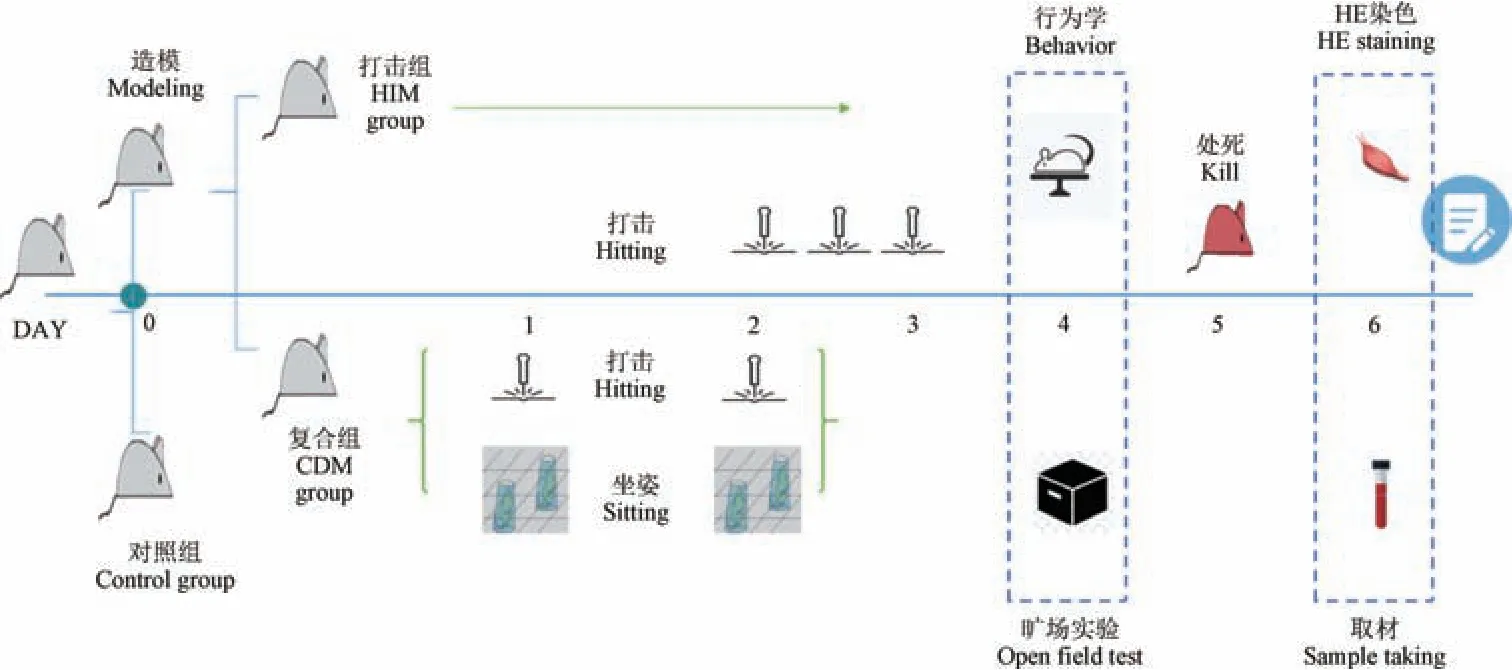
图3 实验流程图Note. HIM group was hit 3 times in two days.Figure 3 Experimental flowchart
1.2.3 行为学——旷场实验
(1)实验开始之前,先确保实验箱干净无味,需要注意清理上一次测试遗留下来的粪便、尿液等。(2)实验人员在软件中设置好相应的参数,记录好动物的编号、日期、状态等信息。 (3)将实验动物迅速放置于实验箱的中央区域,并立即离开。 (4)打开动物行为学分析软件,自动记录动物在箱体内的活动,实验时间通常为15 min。 旷场实验完成后处死大鼠。
1.2.4 标本准备
每次取材前,大鼠禁食禁水12 h,分别称重,大鼠腹腔注射3%戊巴比妥钠(1 mL/kg)麻醉,固定后除毛备皮,暴露竖脊肌,锐性切取L4/L5 节段肌组织,右侧部分置于4%多聚甲醛溶液中固定,部分切成小块放入1.5 mL RNase-free 螺纹冻存管中再置于-80℃液氮中冷冻保存用于测序,左侧置于液氮冷冻后保存于-80℃冰箱,用于后续实验。
1.2.5 组织病理染色
取材固定、修块、染色、水化、包埋、烤片等处理。 病理观察:使用Slide-Viewer 图像采集系统对腰部的肌肉形态进行观察与描述。
1.2.6 测序
从对照组和复合组各选取3 只进行测序,按体重分层,随后按随机数字选择三层中的任意1 只大鼠进行标本测序。 其中根据体重差值每25 g 为一层,随机数字表法在第一层选择的大鼠作为对照组1/复合组1;第二层作为对照组2/复合组2;第三层作为对照组3/复合组3。 取新鲜竖脊肌,按照ABclonal mRNA-seq Lib Prep Kit(爱博泰克生物科技有限公司,中国)说明书制备PE 文库。 纯化PCR产物,并使用Agilent Bioanalyzer 4150 评估文库质量。 最后,使用NovaSeq 6000 测序平台PE150 读长进行测序。
1.2.7 数据分析
高通量测序得到的原始图像数据文件经CASAVA 碱基识别(base calling)分析转化为原始测序序列(sequenced reads),并经测序错误率分布检查评估样本数据质量,利用FeatureCounts 软件计算出每个基因在各个样本中的表达量每千碱基的片段映射读取数(fragments per kilobase per million mapped reads,FPKM)。 运用中科新生命云平台(网址https:/ /bio-cloud.aptbiotech.com/tool)绘制主成分分析图(principal component analysis,PCA)、差异基因分布火山图、差异基因热图、功能富集(gene ontology,GO)分析上下调通路。
1.3 统计学分析
2 结果
2.1 一般观察结果
对大鼠实验前观察发现,各组大鼠均表现为容易受到惊吓,对抓取刺激反应强烈,放置笼子30 min后各大鼠均活动自由,正常饮水进食。 随着造模次数的增多,模型组大鼠表现为活动量、体重、饮食、饮水的减少;造模和干预过程中有2 只模型组大鼠死亡。 解剖取材时发现对照组的大鼠肌肉筋膜是十分平整且呈鲜红颜色,表明其血液供应较充足,筋膜无粘连,触摸无结节。 造模前各组大鼠皮毛光泽度好,正常进食饮水和排便,活动自如,对大鼠进行体重的称量(P< 0.05),见图4A:结果显示组间不存在显著性差异。 随着造模实验不断进行, 除对照组体重基本未见明显变化外,打击组及复合组大鼠体重均有不同程度下降,但是两组之间下降趋势一致。 行为学旷场实验结果见图4B,图4C。

图4 造模前体重与旷场实验Note. A. Body weight trend of 3 groups of rats before modeling. B. Distance of rat open field. C. Open field trajectory map.Figure 4 Weight and open field test
2.2 HE 染色
各组大鼠骨骼肌组织HE 染色结果如图5 所示,对照组:骨骼肌组织排列整齐,肌膜结构清晰,肌间隙正常,肌纤维改变未见明显异常,纤维着色均匀,细胞分界清楚,走行一致,无炎症细胞浸润。打击组:大鼠骨骼肌结构不清,纤维紊乱,可见多处肌纤维断裂(黑色箭头),肌纤维着色均匀,细胞分界清楚,肌间隙明显增宽,肌核分布不均,可见充血。 复合组:骨骼肌组织细胞分界清楚,与对照组相比,结构紊乱(蓝色箭头),纤维着色不均,可见肌纤维断裂,肌间隙稍增宽,肌间可见炎症细胞浸润。与打击组对比,复合组在肌纤维断裂周围,有肌纤维核聚集(绿色箭头)。

图5 造模后三组HE 染色Figure 5 Three groups of HE staining after molding
2.3 复合组与对照组测序数据分析
6 个样本数据质量较高,错误率低(见表1)。设定每千碱基的片段映射读取数FPKM 大于10 为高表达,筛选FPKM 大于10 的基因绘制主成分分析图(Principal Component Analysis, PCA)评估组间差异对照组组间差异小,与复合组有明显差异,可进一步分析差异基因(见图6)。

表1 各样本数据质量一览表Table 1 Overview of data quality for each sample

图6 主成分分析(PCA)Figure 6 Principal component analysis (PCA)
结合火山图(见图7A)与热图(见图7B)筛选差异基因,可得出下调的差异基因包括:Tob2、Rgcc、Timp4、Ckmt2。 而上调的差异基因包括:Pf4、Ankrd23。 下调的Tob2 基因差异最为显著:其属于抑制蛋白家族(BTG/TOB 蛋白家族),涉及细胞周期、细胞分化等多个生物学过程。BTG/TOB基因家族对早期肌纤维增殖有显著影响,BTG1 有刺激成肌细胞中多种转录因子的活性的能力[20]。

图7 差异基因火山图与热图Note. A. Volcano plot of differentially expressed genes between CDM group and control group. B. Heat map of differentially expressed genes between CDM group and control group.Figure 7 Volcano map and heat map of differentially expressed genes
Ckmt2 的下调影响细胞能量代谢和线粒体功能。Pf4 是上调基因中差异最为显著的基因,是一种由血小板释放的细胞因子,参与凝血反应和血小板功能,Pf4 可能与损伤的严重程度有关[21]。
在GO 分析中(见图8)下调通路的前20 包括细胞外基质成分分泌的调节、磷酸肌酸合成及代谢过程等(P< 0.05)。 细胞外基质(extracellular matrix,ECM)是由多种蛋白质和多糖组成的复杂结构,为细胞提供支持和定向,同时也在信号传递和细胞运动中发挥重要作用[22]。 ECM 成分的分泌和降解是由多种分子调节的,包括生长因子、基质金属蛋白酶[23]、组织因子等。 这些分子在细胞外环境中形成一个复杂的调节网络,可以通过多种信号通路调控ECM 成分的合成和降解,从而影响细胞的行为和功能。 磷酸肌酸(phosphocreatine, PCr)是肌肉细胞中的一个重要能量储备物质,可以在高强度运动时迅速转化为ATP,为肌肉提供能量。 磷酸肌酸代谢过程包括磷酸肌酸的合成和降解,这些过程是由多个酶催化和调控的,包括肌酸激酶、磷酸肌酸酶等。 同时,磷酸肌酸的合成和降解也受多种因素的影响,如锻炼强度、营养状况等。 胶原是ECM 中的主要成分之一,在细胞外环境中形成纤维状结构,为组织提供强度和支持。 胶原生物合成过程包括多种酶的催化和调控,如蛋白多肽前体的加工、胶原纤维的组装等。 这些过程受多种因素的影响,如生长因子、细胞外基质分子等,可以通过多种信号通路调节胶原的生物合成和分解。

图8 复合组下调基因GO 分析Figure 8 Analysis of down-regulated gene GO in CDM group
前10 位的GO 分析上调通路包括突触修剪、氧结合、氧气输送、氧载体活性、分子载体活性等(P<0.05)(见图9)。 突触修剪是指神经元之间的突触连接在发育和学习过程中会被调整和重塑的过程。突触修剪的异常可能导致神经元和肌肉之间的不恰当连接,从而导致肌肉的收缩和骨骼肌的受损。而氧气结合和氧载体活性的异常侧面反映了本模型中所出现肌肉缺氧和细胞死亡,这些都是与骨骼肌损伤相关的生物学过程。 分子载体活性是指分子(如蛋白质和其他生物分子)在细胞和组织内转运和传递物质的能力。 在骨骼肌损伤过程中,分子载体的异常可能导致物质的不适当运输和转运,从而导致细胞和组织的功能受损。

图9 复合组上调基因GO 分析Figure 9 Analysis of up-regulated gene GO in CDM group
3 讨论
选择合适的实验动物模型对实验研究尤为重要。 本研究建立了一种新型大鼠慢性骨骼肌复合损伤模型:该动物模型选择了SD 大鼠作为实验对象,通过打击损伤的方式模拟了复合型腰部骨骼肌损伤的病理过程,从转录组测序、运动学评估等多角度综合评估损伤质量、模型契合度。 本模型的行为学改变为活动能力下降,病理生理学变化包括炎症改变、肌腱断裂、肌肉萎缩等。 这些变化与人类腰部骨骼肌损伤,如腰肌劳损具有相似性。 本实验动物模型采用测序技术进行评价,而Timp4 基因在大鼠肌肉再生过程中的表达水平下调;Ckmt2 参与肌肉细胞的能量代谢过程,其变化可能会影响肌肉损伤后的修复;Pf4 在炎症反应和肌肉修复过程的启动会被释放到血液中,进入损伤区域,并与其他细胞因子相互作用。 因此本模型测序结果中以上基因的变化侧面提示本模型造模成功。
另外本研究也为今后探究骨骼肌损伤和修复过程中的分子机制和生物学过程提供了参考方向:GO 分析提示BP 突触剪切、氧输送、蛋白质激活级联;MF 氧载活性、氧集合、触珠蛋白结合;细胞定位(cellular component,CC)触珠蛋白血红蛋白复合物、细胞外区等在总差异通路排序的前15 位。 以上通路有助于理解骨骼肌物理模型基因调控的生物学机制,推断肌肉修复和再生过程中的分子细节。
本模型具有以下3 个方面的优势:(1)创新性:采用的损伤方式包括重物外力打击造成肌膜撕裂和长时静力压导致肌肉萎缩等多种方式,尽可能地模拟复杂的腰部骨骼肌损伤情况。 (2)简便性:模型相对简单,通过查阅文献[16-17]获得较为精密的计算模型操作时间,有序的建立慢性模型,一方面人为外力影响因素较少,具有可复制性和实用性。 另一方面,下坡跑离心收缩模型方案需要长达5 ~28 d[12,14]的造模时间,对比而言本模型方案只需要3 d, 节省人力物力。 (3)影响因素少:与注射布比卡因[9]等药物方式造模相比,本复合模型基于物理造模方式,如该模型用于评价新药治疗骨骼肌损伤等疾病,不涉及药物相互作用及药物代谢等,干扰因素少,应用潜力广。 当然本模型也存在局限性:大鼠强迫坐位固定器的机械标准化仍需精细,减少误差因素。
本研究为未来的骨骼肌损伤相关研究提供了一种新的模型创新方向,期望新的实验模型能提高人类腰部骨骼肌损伤的治疗效果,大鼠模型骨骼肌肌肉测序结果可以为骨骼肌损伤和修复的分子机制和生物学过程研究提供重要信息,并为研究和治疗肌肉疾病提供潜在的靶点。

