单核细胞与高密度脂蛋白比值、高迁移率族蛋白B1对脓毒症患者心肌损伤的预测价值
于昕冉, 冯 兵
(承德医学院附属医院 重症医学科, 河北 承德, 067000)
脓毒症是由感染造成的全身炎症反应综合征,为临床常见的急危重症之一,老年患者病情极易恶化为脓毒症休克,导致重要脏器功能异常甚至死亡,严重影响生命健康[1-2]。细菌感染可造成心肌细胞间质结构受损,引发心肌酶代谢异常和心肌细胞损伤,降低免疫能力,抑制机体对炎性因子的调节作用[3]。心肌损伤是脓毒症的常见并发症之一, 30%~80%的脓毒症患者死亡原因为心血管系统受损[4]。单核细胞与高密度脂蛋白比值(MHR)是一种复合生物标志物,已被证实与全身炎症反应及氧化应激相关,可作为临床预后不良风险的预测指标[5]。高迁移率族蛋白B1(HMGB1)是机体中一种较重要的促炎细胞因子,可促进炎症级联反应,影响脓毒症心肌损伤患者的病情严重程度[6]。本研究观察MHR、HMGB1在脓毒症患者血清中的表达变化及其对心肌损伤的预测价值,以期为该病的预估和临床治疗提供参考依据。
1 对象与方法
1.1 研究对象
选取2021年1月—2022年1月承德医学院附属医院收治的100例脓毒症患者作为研究对象。纳入标准: ① 符合《中国脓毒症/脓毒性休克急诊治疗指南(2018)》[7]中脓毒症相关诊断标准者; ② 年龄≥18岁者; ③ 入住重症监护室(ICU)时间>24 h者; ④ 临床资料保存完整者。排除标准: ① 合并恶性肿瘤者; ② 存在急性或慢性肝病者; ③ 免疫抑制药物使用时间>30 d者; ④ 入组后接受降血脂治疗者; ⑤ 放弃治疗者; ⑥ 处于妊娠期或哺乳期者; ⑦ 因其他原因死亡或失访者; ⑧ 伴有心肌病史、心脏病史、心力衰竭、自身免疫性疾病、心胸外科手术史等患者。心肌损伤判断标准: 排除急性冠状动脉综合征(ACS), 心脏超声检测显示左心室射血分数(LVEF)较基础水平下降50%, 双心室收缩/舒张功能障碍,心电图显示心律失常或心动过速,心肌标志物心肌肌钙蛋白I(cTnI)、氨基末端脑钠肽前体(NT-proBNP)超2倍人体正常水平。随访并记录脓毒症患者的30 d预后转归情况,并根据是否合并心肌损伤将患者分为合并心肌损伤组40例、未合并心肌损伤组60例。未合并心肌损伤组男37例,女23例,年龄35~88岁,平均(67.63±7.32)岁; 合并心肌损伤组男18例,女22例,年龄36~89岁,平均(70.15±7.53)岁。另选取同期90例健康体检人员作为对照组,男50例,女40例,年龄36~88岁,平均(68.46±7.67)岁。3组基本资料比较,差异无统计学意义(P>0.05), 具有可比性。本研究所有受试者及其家属知情同意。
1.2 血清MHR、HMGB1水平检测
嘱所有受试者完善血常规及血脂检查,并根据单核细胞、高密度脂蛋白(HDL)检测结果计算MHR。收集脓毒症患者(确诊当天)和对照组健康体检人员(体检当天)空腹静脉血3 mL, 3 000转/min离心处理10 min, 提取清液存储于-80 ℃冰箱待检。采用酶联免疫吸附法(ELISA)检测HMGB1水平,先将测定卡标为对照组、未合并心肌损伤组、合并心肌损伤组,再将清液样本、稀释缓冲液、测定卡放置于平台,恒温24~26 ℃, 按1∶10比例对标准液进行稀释,向酶标板中加100 μL待测样本、标准液,混匀,恒温下放置0.5 h, 洗板,加蒸馏水、一抗,混匀,于恒温箱中储存,洗板,加酶标抗体,常温放置15 min, 洗板,加底物液,避光放置20 min, 加终止液,使用酶标仪(型号HBS-1096A, 南京德铁实验设备有限公司)于酶标板470 nm处检测吸光度值。检测各组血清HMGB1水平,试剂盒购自北京义翘神州科技股份有限公司,货号10326-H07E。
1.3 资料收集
收集所有患者的临床资料,包括年龄、性别(男、女)、疾病分期(脓毒症期、脓毒症休克期)、基础疾病(糖尿病、高血压病、慢性阻塞性肺疾病、肾功能不全)、感染部位(腹腔、泌尿系统、皮肤软组织、肺部、其他)、急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分、序贯器官衰竭评估(SOFA)评分和实验室指标[NT-proBNP、cTnI、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)]。APACHEⅡ评分[8]包括急性生理学评分(APS)、慢性健康评分、年龄评分,其中APS含12项生理参数,前11项为生命体征、血液生化、血常规、血气分析指标,各项指标按其偏离正常值的程度分别计1~4分, 0分为正常,第12项为反格拉斯哥昏迷评分(GCS), 评分越高说明病情越轻,以满分15分减去GCS实际得分后计入APS, APACHEⅡ评分越高提示病情越重。SOFA评分[9]可评估患者器官功能障碍/衰竭的程度,包含呼吸系统、肝脏、心血管系统、肾脏、凝血系统、神经系统6项,分别评0~4分,总分最高24分,评分越高表示患者预后情况越差。
1.4 统计学分析

2 结 果
2.1 各组血清MHR、HMGB1水平比较
未合并心肌损伤组、合并心肌损伤组血清MHR、HMGB1水平高于对照组,合并心肌损伤组血清MHR、HMGB1水平高于未合并心肌损伤组,差异有统计学意义(P<0.05),见表1。
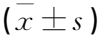
表1 3组血清MHR、HMGB1水平比较
2.2 不同预后脓毒症患者临床资料比较
合并心肌损伤组患者的年龄、性别、疾病分期、基础疾病、感染部位与未合并心肌损伤组比较,差异无统计学意义(P>0.05); 合并心肌损伤组患者的APACHEⅡ评分、SOFA评分和NT-proBNP、cTnI、IL-6、TNF-α水平高于未合并心肌损伤组,差异有统计学意义(P<0.05), 见表2。

表2 2组脓毒症患者临床资料比较
2.3 脓毒症患者心肌损伤的影响因素分析
以脓毒症患者是否合并心肌损伤作为因变量,以临床资料中P<0.05的变量作为自变量进行多因素Logistic回归分析,结果显示, APACHEⅡ评分、SOFA评分、NT-proBNP、cTnI、TNF-α、IL-6、MHR、HMGB1为脓毒症患者心肌损伤的独立影响因素(P<0.05), 见表3。

表3 脓毒症患者心肌损伤的多因素Logistic分析
2.4 MHR、HMGB1对脓毒症患者心肌损伤的预测价值
MHR与HMGB1联合预测脓毒症患者心肌损伤的价值高于MHR、HMGB1单独预测(P<0.05), 见表4、图1。

图1 MHR、HMGB1预测脓毒症患者心肌损伤的ROC曲线

表4 MHR、HMGB1对脓毒症患者心肌损伤的预测效能
3 讨 论
脓毒症是临床较为常见的一种感染性疾病,机体受感染后炎症级联反应加重,引发代偿性抗炎及全身炎性反应,降低机体免疫能力,增强感染易感性,最终导致多器官功能异常。老年脓毒症患者因机体功能减弱,免疫能力下降,抵抗致病菌能力较差,病死率较高[10-11]。
血清单核细胞是参与脓毒症免疫损伤过程的重要细胞,脓毒症心肌损伤患者单核细胞中趋化因子、促炎因子及转录因子水平上升,发挥免疫反应调控作用[12]。脓毒症患者发生心肌损伤后, HDL可与脂质代谢酸、脂多糖及ATF3相结合对感染、炎症产生调节作用,还可对免疫反应进行调节,减少中性粒细胞扩散、黏附及迁移,减少白细胞黏附于内皮细胞,抑制前列环素、环氧化酶形成血栓,发挥保护内皮功能的重要作用[13]。脓毒症患者发生心肌损伤时,因有机物性质恶化、毛细血管穿透性受损及线粒体功能异常等状况,呼吸能力下降,抗氧化剂及氧化剂紊乱,进而引发多器官功能异常,且单核细胞是氧化应激时氧化介质及促炎介质的主要来源。脓毒症心肌损伤早期,血液循环中单核细胞迁移至血管内皮并发展为巨噬细胞,释放炎性因子,使T淋巴细胞及较多的单核细胞被激活,而HDL可减缓单核细胞的转化、活化,进而减轻炎症反应。MHR是一种复合预测因子,可反映单核细胞的氧化应激及炎症与HDL的平衡性,预测临床结局的效果优于单核细胞、HDL单项预测,具有一定的成本效益[14]。本研究发现,未合并心肌损伤组患者MHR水平显著高于对照组,且合并心肌损伤组患者的MHR水平显著高于未合并心肌损伤组,即MHR水平升高提示患者病情加重,与既往研究[15]结论相似。因此,观察MHR在脓毒症患者血清中的表达变化,或可为临床早期评估患者有无心肌损伤提供参考依据。
HMGB1是一种在多数组织细胞核内均有所表达的DNA结合蛋白,可平衡细胞结构和调控基因转录,通过主动分泌活化或释放坏死细胞等方式从细胞核内侵入血液循环,从而发挥激活趋化、炎症反应、代谢、免疫反应调节等功能,激活的HMGB1具有较强的致炎效果,参与心血管疾病的病理过程[16]。研究[17]发现, HMGB1通过在炎性反应中引发血管重构参与ACS, 可反映病情严重程度。本研究发现,脓毒症患者血清HMGB1水平显著高于对照组,且合并心肌损伤的脓毒症患者血清HMGB1表达水平显著上升,提示HMGB1与脓毒症患者心肌损伤存在关联。分析可能原因为, HMGB1是真核生物细胞中的一种非组蛋白,在心肌损伤发生时可与细胞膜受体相结合进而促使炎性因子释放,进一步加重炎性反应症状。
心肌损伤标志物包括cTnI、NT-proBNP等,主要分布于心肌细胞中,当心肌细胞受到损伤时, CTNI、NT-proBNP被释放至血液中,血清表达水平上升,严重影响心肌功能[18]。心室容量变化、心肌缺氧及室壁压力升高可影响NT-proBNP分泌水平,而NT-proBNP可有效调控血压水平及体内水钠代谢平衡,反映心室容量负荷及压力变化情况,并反映机体心功能变化情况[19]。APACHEⅡ评分是预测危重患者病症及预后情况的重要指标,具有较强的实用性及可靠性[20]。IL-6、TNF-α是与心肌功能异常有关的重要炎症因子,可一定程度加重机体炎性细胞浸润程度,其中TNF-α为释放较早的内源性炎症因子,可损伤血管中内皮细胞,还可介导IL-6细胞因子产生[21]。有效控制促炎介质的释放,可降低机体炎症反应程度,有效减轻患者病情。
综上所述, MHR、HMGB1在脓毒症心肌损伤患者血清中表达升高,两者联用可有效预测脓毒症患者心肌损伤。依据脓毒症患者心肌损伤的主要危险因素制订针对性措施并实施,对改善患者预后具有积极的临床意义。

