异丙肾上腺素诱导小鼠急性心肌梗死模型制备方法研究
钱 铭, 程 龙, 熊 媛, 杨 慧1, , 吉 利
(1. 南京大学医学院附属鼓楼医院 药学部, 江苏 南京, 210008;2. 南京中医药大学 鼓楼临床医学院, 江苏 南京, 210008;3. 中国药科大学 基础医学与临床药学学院, 江苏 南京, 210008;4. 南京大学医学院附属鼓楼医院 老年医学科, 江苏 南京, 210008)
急性心肌梗死(AMI)因冠状动脉部分或完全阻塞,导致流向心肌的血液阻塞。冠状动脉闭塞时,心肌缺血、缺氧引起心肌细胞死亡。患者表现为胸部不适或压力增大,并可辐射至颈部、下颌、肩部或手臂。据调查[1]显示, 2019年全世界有超过200万的AMI新发患者,相较于过去10年增加了7倍,急需进一步基础和临床研究来应对这种严峻挑战。建立合适的AMI动物模型是推进研究的重要环节。目前,常用的AMI模型构建方法包括药物诱导法和手术结扎法[2], 手术结扎法操作难度较大、存活率较低,且存在操作者手法上的差异。药物诱导操作简单,对小鼠损伤较小,存活率高,且实验人员操作导致的差异较小[3-4]。常用的药物为异丙肾上腺素(ISO), ISO是β受体激动剂,可激动小鼠心脏β受体,导致心脏血管剧烈收缩,血管灌注不足,大大降低平均动脉压和舒张压,引起心脏功能障碍[5]。目前,国内外多采用大鼠皮下注射ISO的方式诱导AMI模型,已有的报道[6-8]中小鼠ISO给药剂量为10~160 mg, 给药频次和取材时间也各不相同,尚无统一的造模方式。由于高剂量ISO给药的成模率较高[9], 因此本研究选用高剂量150 mg/kg ISO皮下注射的方式,探究不同ISO注射的次数和时间对心肌损伤的影响,以期明确ISO诱导的AMI模型的最佳造模方式,为临床AMI的研究提供合适的造模方法。
1 材料与方法
1.1 试剂与材料
异丙肾上腺素(货号15627)购自美国Sigma公司,该药物用于小鼠AMI模型的构建。4%多聚甲醛固定液(BL539A)购自中国Biosharp公司,用于小鼠心脏组织固定。
1.2 模型的构建
实验动物为无特定病原体(SPF)级8周龄雄性C57BL/6小鼠(购自浙江维通利华实验动物技术有限公司),体质量约23 g。动物饲养环境为12 h昼夜节律,自由饮食饮水,恒温、恒湿。小鼠自购买后,适应性喂养1周后,随机分为单次注射组及单次空白组, 2次注射组及2次空白组,每组各5只。设计2种不同方案诱导AMI模型,如图1所示。ISO单次注射组: 小鼠一次皮下注射剂量为150 mg/kg的ISO(生理盐水配置),分别于注射后2、4、8、16、24取小鼠血样和心脏组织; 单次空白组给予相同体积的生理盐水注射。ISO 2次注射组: 小鼠连续2 d间隔24 h皮下注射150 mg/kg的ISO, 于第2次注射后2、4、8、16、24、48、72 h取小鼠血样和心脏组织; 2次空白组给予相同体积的生理盐水注射。本研究涉及到的所有动物实验均通过了南京鼓楼医院动物伦理委员会的批准(伦理号2023AE01032)。

图1 AMI小鼠模型构建流程图
1.3 小鼠生化指标检测
通过摘眼球取血的方式,收集小鼠血样置于1.5 mL EP管中,血液静置2 h后,置于4 ℃离心机中4 000转/min离心5 min, 将上清转移到另一个1.5 mL EP管中。在生化仪中检测每个样本中肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)、心肌肌钙蛋白T(cTnT)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、白细胞介素-6(IL-6)、C反应蛋白(CRP)、降钙素原(CT)的含量。
1.4 小鼠心脏苏木素-伊红(H&E)染色
取小鼠心脏后,置于4%多聚甲醛固定液中,石蜡包埋,沿心脏横切面切取5 μm厚度切片。石蜡切片在二甲苯-无水乙醇-75%酒精中脱腊, H&E染色,无水乙醇-二甲苯脱水,封片后在切片扫描仪中进行图像采集。
1.5 统计学分析

2 结 果
2.1 单次ISO刺激对小鼠心肌损伤的影响
小鼠单次皮下注射ISO, 于注射后不同时间点取小鼠血样。生化检测结果显示,与空白组相比, CK在2 h时浓度最高,差异有统计学意义(P<0.05), 而后随时间延长逐渐降低至正常水平; CK-MB无显著变化; LDH于2 h应激性升高,差异有统计学意义(P<0.05), 降低后于8 h开始再次升高,并在16 h达到最高浓度,差异有统计学意义(P<0.01), 随后浓度降低,见表1。
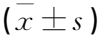
表1 单次注射ISO小鼠血清生化指标 U/L
2.2 2次ISO刺激对小鼠心肌损伤的影响
小鼠连续2次间隔24 h皮下注射ISO 150 mg/kg, 在末次注射后不同时点取小鼠血样,结果显示, CK、CK-MB和LDH均在注射后16 h升高至最高浓度,差异有统计学意义(P<0.05或P<0.01), 随后浓度降低。此外,在2 h时, CK、CK-MB和LDH均有一过性的升高,见表2。
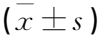
表2 2次注射ISO小鼠血清生化指标 U/L
2.3 AMI模型小鼠生化指标改变
本研究选择连续2次皮下注射ISO 150 mg/kg建立小鼠AMI模型,末次注射16 h后取样进行后续研究,并设模型组(2次注射ISO 150 mg/kg)和对照组(给予相同体积的生理盐水注射)。结果显示,相较于对照组,模型组小鼠的血清中cTnT、AST和ALT均升高,差异有统计学意义(P<0.05或P<0.01)。但炎症指标IL-6、PCT和CRP比较,差异无统计学意义(P>0.05), 见表3。
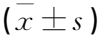
表3 2次注射ISO后16 h小鼠血清生化指标
2.4 AMI模型小鼠心脏病理性改变
连续2次皮下注射ISO 150 mg/kg建立小鼠AMI模型后,本研进一步探究小鼠心肌组织病理结构变化,H&E染色结果显示,对照组小鼠室间隔心肌细胞排列整齐、致密; 模型组小鼠心肌组织发生病理学改变,室间隔细胞排列紊乱、疏松,心肌细胞肿胀,细胞膜溶解(图2)。相较于对照组,模型组室间隔厚度增加,差异有统计学意义(P<0.01), 见表4。

表4 2次注射ISO后16 h小鼠心室壁厚度改变 μm

A: 对照组; B: 模型组。
3 讨 论
心血管疾病是发达国家和发展中国家的主要死亡原因,每年约占全世界死亡总数的20%[10]。由于发展中国家,特别是城市地区生活方式改变,AMI发病率不断上升,在心血管疾病死亡中的占比越来越大[10-11]。因此,有必要建立合适、便捷、可重复的AMI动物模型,不仅可以有助于研究心血管疾病的发病机制和病理生理学,也可以为新药的研发提供评价药效的重要工具。AMI是由于冠状动脉供血与心肌需求不平衡而导致的心肌坏死的急性状态,围绕此原理,目前国内外制备AMI动物模型的方法包括药物诱导法、手术结扎法、低温冷冻法、冠状动脉微栓塞法等。其中较常用的方法是手术结扎法和药物诱导法[2, 12]。手术结扎法主要应用于大鼠及更大体积的实验动物,通过结扎实验动物冠状动脉左前降支造成心室AMI[13]。据报道[14], 在手术过程中,由于麻醉剂、气管插管、开胸、肺损伤、伤口感染、心力衰竭等多种因素造成的动物死亡率高达40%。此外,这种方法所造成的梗死面积的大小变异性也较大,结扎位置的轻微变化即可导致梗死面积较大的差异,结扎位置偏上和进针过深则易造成较大的梗死面积和实验动物的死亡,结扎位置偏下或进针过浅则易导致模型不成功[15-16], 不稳定性对实验进展和结果可造成严重影响。冷冻法是通过超低温造成与冠状动脉结扎法相似的AMI效果,但其造成的损伤集中在心外膜,与正常临床上AMI集中在心内膜有所不同[16-17], 不能很好的模拟临床上AMI患者的病理状态。冠状动脉微栓塞法一般用于大型动物,该技术使用定制的导管选择性地插入左冠状动脉,通过导管注入微球引起栓塞。这个过程同时产生多个微梗死,类似于经皮冠状动脉介入治疗后的临床栓塞,虽然该技术不需要胸外科手术,但实验操作难度较大,对研究人员技术要求较高[18]。
药物诱导法操作便捷,可以避免气管插管、冠状动脉结扎等手术操作对实验动物造成的创伤和感染,实验周期短,因此有较高的实用性、可靠性和较低的实验动物死亡率,造模成功率高[19]。药物诱导法使用ISO、阿霉素、血管加压素等药物[20]。阿霉素是临床上的一种蒽环类抗肿瘤药,具有心脏毒性,因此用作心肌损伤模型的制备,但有研究报道阿霉素腹腔注射胃肠道毒性大,易导致注射部位皮肤坏死,模型死亡率较高[4]。ISO是一种合成儿茶酚胺和β肾上腺素能激动剂,广泛用于诱导实验性心血管疾病,在实验动物中引起心肌严重应激,导致心肌梗死样坏死[21]。ISO诱导的实验动物心肌病理生理变化与人类AMI的病理生理变化相似[10], 且与其他动物模型相比, ISO诱导心肌损伤动物模型具有死亡率低、可重复性高等优点[22]。因此ISO诱导的动物模型是一个容易较常使用的标准化的AMI动物模型,相关研究将其用于评价AMI药物的疗效。但目前ISO诱导心肌损伤动物模型相关研究主要集中于大鼠,给药方式有皮下注射、腹腔注射等,具体药物剂量不一,且小鼠相关研究较少[6-9]。故本研究探讨了ISO不同给药次数以及给药时间对小鼠AMI模型造模程度的影响。
cTnT、CK-MB、LDH等指标是AMI发生心肌损伤的标志物[23-24], 也是评价本试验造模成功与否的指标。据报道, ISO单次皮下注射1 d后,小鼠心脏短暂性收缩功能增强,舒张功能不变,约10%心肌细胞膜损伤,但损伤的心肌细胞很少出现坏死; 循环中cTnT水平升高,表明心肌细胞受到损伤[25]。本研究选取了ISO较适宜的中间剂量150 mg/kg进行研究,发现单次皮下给药后小鼠血清中CK、CK-MB和LDH都在2 h出现了应激性的升高,随后降低,仅LDH在16 h时出现2次升高。而连续2次皮下给药除在2 h时出现应激性升高外, CK、CK-MB和LDH均在16 h达到了最高浓度,且2次给药后最高浓度高于单次给药后最高浓度。因此, 2次连续给药的方式要优于单次给药。在2次给药后16 h, 血清中cTnT、ALT和AST也显著升高。ISO诱导的心肌梗死与人类心肌梗死具有相似的形态学改变。据报道[7], ISO诱发的心肌坏死发生在左心室心内膜下区和室间隔。本研究通过病理结果发现, ISO刺激16 h时的小鼠心肌组织发生显著病理学改变,室间隔厚度增加,细胞排列紊乱、疏松,心肌细胞的细胞肿胀,细胞膜溶解。上述结果表明在2次给药方式下,选择16 h取材优于其他时点,此时的模型损伤指标升高更显著、更稳定,探究药物治疗研究的窗口更大。
相对其他造模方法, ISO皮下注射诱导AMI模型实验操作简单,对其他脏器无明显毒性,无创,动物存活率高,重复率高,缺点是不能精确定位损伤部位,但相较于其他模型显著的实验局限性, ISO诱导的AMI模型较为成熟稳定[3]。本研究通过进一步探索该模型给药次数和取材时点,发现在小鼠模型中,连续2 d间隔24 h皮下注射150 mg/kg剂量的ISO,可以比较成功地建立小鼠AMI模型,且发现造模后16 h取材优于其他时点,这为临床研究AMI的发病进程和作用机制提供更简易、高效的模型制备方法。

