鸡胚卵巢表观修饰酶基因的动态表达研究
张玉清,王宜,杜志强,杨彩侠
(长江大学动物科学技术学院,湖北 荆州 434025)
鸡ZZ/ZW 染色体遗传体系异于哺乳动物的XY/XX 体系,其雌性还具有独特的两侧性腺不对称发育方式[1]。鸡胚胎孵化到E6.5 期性腺分化,E8.5期雌性胚胎的左右卵巢开始出现差异,左侧卵巢继续发育,而右侧卵巢逐步退化。鸡原始生殖细胞(Primordial germ cell, PGC)是卵子的始祖细胞,其通过血流迁移到达并定植于生殖嵴。于E8.0~E10.0期,PGC 开始迅速增殖并形成卵原细胞,E12.5 期增殖减慢,减数分裂相关基因开始表达。E15.5 期卵原细胞开始进入第一次减数分裂,至E17.5 期多数卵母细胞进入减数分裂,E18.5 期绝大部分卵母细胞进入减数分裂,且多个卵母细胞会形成细胞簇,其后卵母细胞停滞在第一次减数分裂前期的双线期,直至孵化出雏[2]。
表观修饰是不改变序列顺序,通过修饰DNA/RNA/组蛋白, 从而改变染色质结构,影响基因的表达活性,这种效应可以遗传[3]。研究表明表观修饰在生理、病理等多方面发挥重要作用,例如配子发生与早期胚胎生长发育过程[4]。DNA 5mC 甲基化发生在胞嘧啶的C5 位置(C5-methylcytidine,5mC), 主要由DNA 甲基转移酶 (DNA methyl-transferase,DNMT)催化S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)作为甲基供体,将CG 两个核苷酸的胞嘧啶选择性地添加甲基,而其去甲基则由TET(teneleven translocation)酶催化。DNA 5mC 甲基化广泛存在于真核生物细胞核中,调控基因表达,参与卵子发生和早期胚胎发育[5-6]。DNMT1、DNMT3A 和TET 酶影响雌性动物卵母细胞减数分裂和早期胚胎发育[7-9]。RNA 的m6A 甲基化发生在腺嘌呤的N6位置(N6-methyladenosine, m6A),由甲基转移酶METTL3 和METTL14 催化添加、去甲基化酶ALKBH5 和FTO 去除甲基,参与调控性腺发育、雌性生殖和卵子减数分裂等生殖生理过程[10-12]。组蛋白H3 在其不同赖氨酸残基位点可以添加1~3 个甲基进行修饰,由甲基转移酶和去甲基化酶催化其动态调节,影响多种生物学过程,包括性腺发育[13-14]。
本研究旨在研究鸡胚左侧卵巢卵母细胞由开始到全部进入减数分裂,其后阻滞,直至孵化出雏前的时间段,DNA/RNA/组蛋白H3 甲基化修饰酶基因的动态表达规律,结果为揭示鸡胚卵巢中卵母细胞减数分裂进入和阻滞的表观调控提供基因表达基础信息,从而为优化家禽种业的扩繁系统提供理论支撑。
1 材料与方法
1.1 材料
1.1.1 试验动物
AA 肉鸡种蛋,购自汤阴县全达家禽育种有限公司。
1.1.2 试验仪器
孵化箱(KFZ528,德州科裕孵化设备有限公司)、分光光度计(Nano-400A,杭州奥盛仪器有限公司)、梯度PCR 仪(Nexus gradient,德国Eppendorf)、电泳仪(HS120,北京莱普特科学仪器有限公司)、荧光定量PCR 仪(CFX96,美国Bio-Rad)。
1.1.3 试验试剂
Trizol(15596026,Thermo Scientific)、反转录试剂盒(Revert Aid First Strand cDNA Synthesis Kit,K1622,Thermo Scientific)、PCR 引物合成(上海生物工程有限公司)、DEPC 水(Biosharp)、琼脂糖(Biosharp)、定量PCR 试剂(ChamQ Universal SYBR qPCR Master mix,Q711- 02,诺唯赞)。
1.2 方法
1.2.1 准备
孵化前,种蛋消毒并标记称重。蛋重在65.0±5.0 g 范围内的种蛋置于温度37.8 ℃、相对湿度为60%的孵化箱孵化。于孵化第5 d、9 d 和13 d 照蛋去除未受精蛋和死胚。于鸡胚孵化的E12.5 期、E15.5 期、E17.5 期、E18.5 期和E20.5 期各收集6个鸡胚左侧卵巢放至冻存管中,液氮速冻后,置于-80 ℃保存。
1.2.2 RNA 提取及反转录
采用Trizol 和酚氯仿抽提法提取鸡胚左侧卵巢RNA,检测RNA 纯度和浓度。取1 μg RNA 反转录成cDNA。反转录条件为:37 ℃2 min,55 ℃15 min,85 ℃5 min。cDNA 稀释10 倍,-20 ℃保存。
1.2.3 定量PCR
采用Premier5.0 设计表观修饰相关基因的引物(表1),所设引物均跨外显子,防止基因组DNA对PCR 结果的影响,NCBI (National Center for Biotechnology Information)上比对引物扩增区域的唯一性和位置正确性。引物用DEPC 水稀释至10μM。普通PCR 扩增产物经1.5%琼脂糖凝胶电泳检测目的条带的唯一性和片段大小的正确性(图1)。普通PCR 条件:94 ℃2 min;94 ℃30 s,60 ℃60 s,35 循环,72 ℃5 min。定量PCR 采用10 μL的反应体系,包括:5 μL 2× ChamQ Universal SYBR qPCR Master mix,3.4 μL 水,1 μL cDNA,0.6 μL 10 μM 上下游引物。定量PCR 反应条件为:95 ℃10 min;95 ℃15 s, 60 ℃60 s,40 个循环。评价定量PCR 的溶解曲线确定扩增产物为单峰。每个样品点3 个重复孔,以内参基因EEF1A 和RPL15 对结果进行矫正(两个内参基因分别标准化后的几何平均值),用2-ΔΔCt方法计算基因的相对表达水平。

图1 琼脂糖凝胶电泳检测RT-PCR 产物的唯一性和片段大小的正确性
1.3 统计分析
使用SPSS25.0 软件中的单因素方差分析和Duncan 检验对定量PCR 结果进行统计分析。当P<0.05、0.01 或0.001 时,分别以*、**或***表示差异显著、0.01 或0.001 水平上的差异极显著。
2 结果与分析
2.1 DNA 5mC(去)甲基化酶基因的表达
对于DNA 5mC 甲基化酶基因的表达,RTqPCR 结果表明,DNMT1 和DNMT3A 在鸡胚孵化到E12.5~E20.5 期时左侧卵巢中的表达无显著的变化(P>0.05;图2A)。DNMT3B 在E12.5 期表达最高,跟E12.5 期相比,E15.5 期(1.00 vs. 0.58; P<0.05), E17.5 期(1.00 vs. 0.42; P<0.01),E18.5 期(0.57 vs. 1.00; P<0.05)和E20.5 期(0.34 vs. 1.00;P<0.001)的表达均显著下降(图2A)。DNA 5mC 去甲基化酶基因TET1 和TET3 在鸡胚卵巢发育的E12.5~E20.5 期mRNA 的表达无显著变化(P>0.05),而TET2 在E18.5 期的表达显著高于E12.5期(2.06 vs. 1.00; P<0.05)(图2B)。
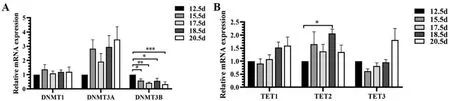
图2 DNA 5mC(去)甲基化酶基因的mRNA 表达
2.2 RNA m6A(去)甲基化酶基因的表达
RNA m6A 甲基化酶METTL3 在鸡胚左侧卵巢发育的E12.5~E20.5 期mRNA 表达无显著变化(P>0.05),METTL14 的表达E12.5~E15.5 期没有显著变化,其后到E20.5 期逐渐上升到最高值,E20.5 期相较于E12.5 期(1.91 vs. 1.00; P<0.05)、E15.5 期(1.91 vs. 0.90; P<0.01)和E17.5 期(1.91 vs. 1.16;P<0.05)表达呈现显著上升(图3A)。RNA m6A 去甲基化酶ALKBH5 的表达E12.5~E15.5 期没有显著的变化,到E17.5 期(0.78 vs. 1.00; P>0.05)有轻微的下降,E18.5~E20.5 期再逐步升高,其中E20.5期相对E17.5 期表达有显著差异(1.49 vs. 0.78;P<0.05)(图3B)。RNA m6A 去甲基化酶FTO 的表达E12.5~E18.5 期没有显著的变化,到E20.5 期显著升高,与E12.5 期(2.31 vs. 1.00; P<0.01)、E15.5期(2.31 vs. 0.90; P<0.01)、E17.5 期(2.31 vs. 0.74;P<0.001)和E18.5 期(2.31 vs. 1.37; P<0.05)相比均有显著上升(图3B)。
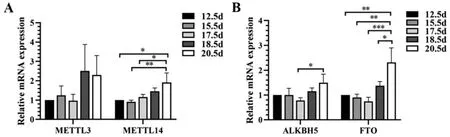
图3 RNA m6A(去)甲基化酶基因的mRNA 表达
2.3 组蛋白H3 赖氨酸(去)甲基化酶基因的表达
组蛋白H3 赖氨酸甲基化酶基因MLL2、SUV39H2、EED 和SETD2 的表达在鸡胚左侧卵巢发育的E12.5~E20.5 期无显著变化(P>0.05;图4A)。组蛋白H3 赖氨酸去甲基化酶基因KDM4A 的表达在E12.5~E20.5 期也无显著变化(P>0.05),但KDM1B 的表达在E20.5 期相较于E12.5 期呈显著上升(3.29 vs. 1.00; P<0.05),KDM1A 在E15.5 期相较于E12.5 期呈显著下降(0.60 vs. 1.00; P<0.05)(图4B)。
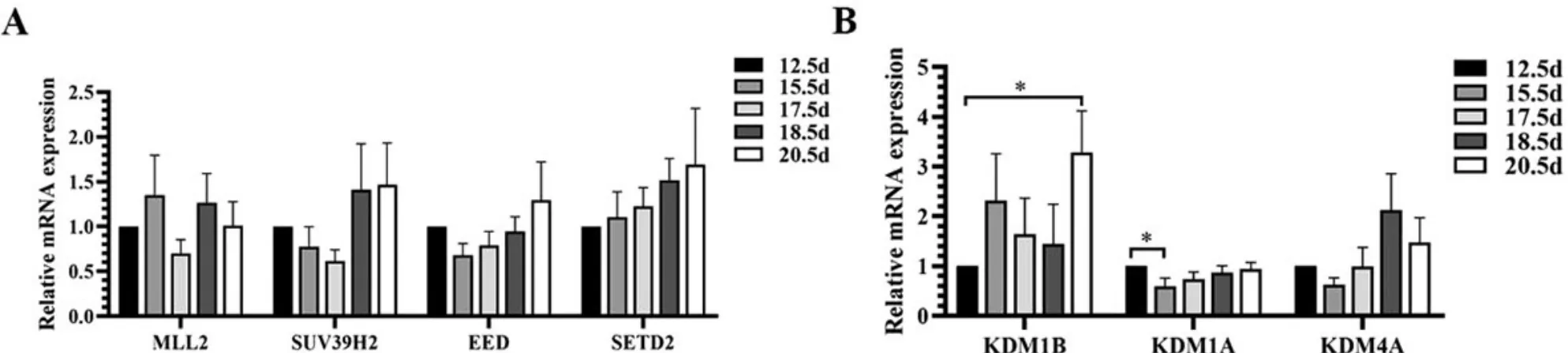
图4 组蛋白H3 赖氨酸(去)甲基化酶的mRNA 表达
3 讨论
有研究显示,随小鼠年龄增长,DNA 5mC 甲基化酶DNMT1 的mRNA 表达在卵巢中逐渐降低[15],而DNMT3A 和DNMT3B 表达水平显著升高[16]。敲低DNMT 酶损害胚胎发育,导致胚胎停滞[7]。RNA m6A 修饰参与了非洲爪蟾减数分裂与胚胎发育[17]。敲除RNA m6A 甲基化酶METTL3 导致小鼠胚胎致死,卵泡发育缺陷、雌性不育[18]。RNA m6A 甲基化酶METTL3/14 和去甲基化酶ALKBH5/FTO 在猪卵母细胞中表达,L-抗坏血酸处理显著降低METTL14 mRNA 水平[19]。卵巢早衰病人卵巢的FTO 表达显著降低,RNA m6A 修饰水平升高[20]。本研究表明,鸡胚左侧卵巢在孵化的E12.5 ~E20.5 期DNMT1/3A/3B 和TET1/2/3 均表达, 其中DNMT3B 和TET2 mRNA 表达呈现显著变化; RNA m6A (去)甲基化酶基因和组蛋白H3赖氨酸(去) 甲基化酶基因在鸡胚孵化E12.5~E20.5 期的左侧卵巢表达,其中METTL14、FTO、ALKBH5、KDM1A 和KDM1B 呈显著的动态变化。但是,在鸡胚发育中,DNA、RNA 和组蛋白甲基化表观修饰酶基因的表达和调控功能缺乏报道,因此,本研究在鸡胚E12.5~E20.5 期卵巢中鉴定具有表达和表达显著变化的表观修饰酶基因的调控功能有待进一步研究。
4 结论
本研究表明DNA 5mC、RNA m6A 和组蛋白H3赖氨酸(去)甲基化表观修饰酶基因在鸡胚E12.5~E20.5 期左侧卵巢中表达,且DNMT3B、TET2、METTL14、FTO、ALKBH5、KDM1A 和KDM1B 呈显著的动态变化,为进一步解析这些基因在鸡胚左侧卵巢发育、卵子减数分裂进入和阻滞过程中的表观调控功能提供了重要的表达信息。□

