大剂量二联方案与含铋剂四联方案根除幽门螺杆菌的疗效观察
段 萌 李佳颖 霍丽娟
全球约有50%人口感染幽门螺杆菌(Hp)[1],中国的Hp感染率较高[2]。含铋剂四联疗法(BQT)是目前国内外共识推荐的一线Hp根除方案[3-5]。然而,由于全球抗生素耐药情况日益严重,Hp对抗生素的耐药性已成为影响根除治疗效果的关键因素[6]。传统PPI 存在起效慢、抑酸效果不持久及患者基因多态性等局限性。20 世纪80年代末,PPI联合阿莫西林的二联疗法被首次提出用于Hp根除治疗[7],但之后的临床研究发现常规剂量二联疗法的根除率并不理想[8]。近年来的国内外研究发现,调整给药剂量和给药频率的大剂量二联疗法(HDDT)根除Hp的效果不逊于甚至优于标准四联疗法,并且不良反应较少[9-11]。PPI 是Hp根除方案中的抑酸剂,包括第一代PPI——奥美拉唑、泮托拉唑、兰索拉唑和第二代PPI——雷贝拉唑、艾司奥美拉唑和艾普拉唑。艾司奥美拉唑受患者基因多态性的影响较小且抑酸作用较强,是HDDT 中的抑酸剂。此外,新型抑酸药物——伏诺拉生(VPZ)因其强大的抑酸作用而在根除Hp治疗的相关研究中引起广泛关注。目前日本的VPZ 相关临床研究较多,日本Hp管理指南已将其作为替代PPI 的抑酸剂引入所有Hp根除方案[12],但将其与BQT 的根除疗效对比的相关研究仍较少。本研究比较了含VPZ、含PPI 的HDDT 和BQT 这3 种Hp根除方案的疗效及安全性等,以期为优化Hp根除治疗方案提供参考依据。
1 研究对象与方法
1.1 研究对象
选择2022年1月至2022年10月在山西医科大学第一医院消化内科门诊首次诊断为Hp感染的177 例患者作为研究对象。纳入标准:(1)年龄为18~75 岁;(2)13C 尿素呼气试验、14C 尿素呼气试验或胃镜下活体组织学检查结果示Hp阳性;(3)未曾接受Hp根除治疗;(4)近4 周内未曾使用抗生素或有抗菌作用的中药;(5)近2 周内未曾使用抑酸药或黏膜保护剂;(6)签署知情同意书。排除标准:(1)合并严重的心、肺、肝、肾疾病;(2)合并恶性肿瘤;(3)处于慢性疾病活动期;(4)对本研究中使用的药物过敏;(5)曾接受Hp根除治疗;(6)有胃部手术史;(7)妊娠期或哺乳期妇女;(8)合并严重精神疾病。治疗终止事件:(1)治疗期间出现严重不良反应;(2)治疗期间疾病出现进展或恶化。本研究经医院医学伦理委员会审核批准 (批件号K152)。
1.2 研究方法
1.2.1 治疗方案 将177 例患者采用简单随机抽样法分为3 组:含伏诺拉生大剂量二联组(VPZ-HDDT 组)58 例(VPZ 20 mg/次,2 次/d+阿莫西林750 mg/次,3 次/d);含PPI 大剂量二联组(PPI-HDDT 组)62 例(艾司奥美拉唑40 mg/次,2 次/d+阿莫西林750 mg/次,3 次/d);BQT 组57 例(艾司奥美拉唑40 mg/次,1 次/d+阿莫西林1 000 mg/次,2 次/d+呋喃唑酮100 mg/次,2次/d+胶体果胶铋150 mg/次,3 次/d)。3 组均连续治疗14 d。
1.2.2 药物与材料 药物:富马酸伏诺拉生片(批号J20200011,天津武田药品有限公司生产);艾司奥美拉唑镁肠溶片(批号H20046380,阿斯利康制药有限公司生产);阿莫西林胶囊(批号H44021351,珠海联邦制药有限公司生产);呋喃唑酮片(批号H12020160,天津力生制药股份有限公司生产);胶体果胶铋胶囊(批号:H20065925,上海现代哈森药业有限公司生产)。材料:尿素13C胶囊、尿素14C 胶囊、气体收集袋、13C 尿素呼气试验检测仪及14C 尿素呼气试验检测仪(均购自深圳市中核海德威生物有限公司)。
1.2.3 服药注意事项 (1)VPZ、艾司奥美拉唑、胶体果胶铋均于餐前0.5 h 口服;(2)阿莫西林和呋喃唑酮均于餐后口服;(3)服药期间忌饮酒;(4)服药期间若出现粪便浅黑及尿色偏黄均属正常现象,无需停药;(5)服药期间若出现皮疹等严重不良反应,应立即停药并就诊。
1.2.4 随访观察 治疗第7 天和第14 天进行电话或门诊随访,记录患者的服药情况和不良反应发生情况等。于疗程结束至少4 周后复查13C 或14C尿素呼气试验。
1.3 Hp 感染和Hp 根除疗效的判定标准
Hp感染判定标准:13C 尿素呼气试验、14C 尿素呼气试验和组织学检查中的任意一项结果阳性即判定为Hp阳性。Hp根除疗效:Hp根除治疗结束至少4 周后,在复查前4 周内未服用抗菌药物或黏膜保护剂、复查前2 周内未服用抑酸药的前提下,复查13C 尿素呼气试验或14C 尿素呼气试验结果阴性则判定为Hp阴性。
1.4 结果分析
主要终点是Hp根除率,次要终点包括患者的依从性和不良反应发生率。采用遵循研究方案(PP)分析和意向性治疗(ITT)分析这2 种方法比较各组的Hp根除率。PP 分析包括依从性≥80%并复查13C或14C尿素呼气试验的患者。在ITT分析中,失访、未按要求服药或未复查13C 或14C 尿素呼气试验的患者均被视为治疗失败。
1.5 统计学方法
应用SPSS 26.0 软件进行统计学分析。计数资料以例(%)表示,组间比较采用χ2检验。正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用t检验,3 组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组的一般资料比较
VPZ-HDDT 组中男性25 例,女性33 例,年龄22~72 岁,平均年龄为(42.5±11.5)岁;PPIHDDT 组中男性32 例,女性30 例,年龄23~72 岁,平均年龄为(46.7±13.8)岁;BQT 组中男性25 例,女性32 例,年龄23~73 岁,平均年龄为(47.8±15.3)岁。3 组的性别、年龄、吸烟史及饮酒史差异均无统计学意义(P均>0.05)。见表1。

表1 3 组的一般资料比较/例(%)
2.2 3 组的依从性比较
177 例患者中,失访6 例(VPZ-HDDT 组1 例,PPI-HDDT 组3 例,BQT 组2 例)。VPZ-HDDT 组中,2 例未按要求服药,1 例未按要求复查,最终完成54 例;PPI-HDDT 组中,1 例未按要求服药,2 例未按要求复查,最终完成56 例;BQT 组中,2 例未按要求服药,最终完成53 例。3 组的依从性差异无统计学意义(P>0.05)。见表2。
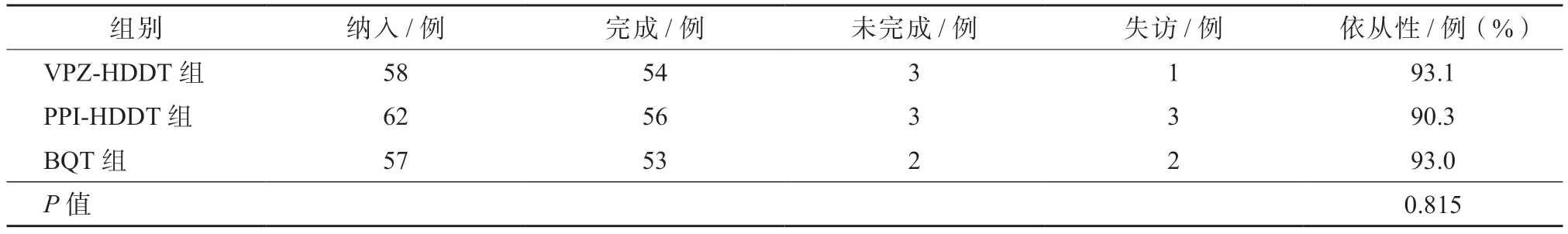
表2 3 组的依从性比较
2.3 3 组的Hp 根除率比较
在PP 分析中,VPZ-HDDT 组、PPI-HDDT 组、BQT 组根除率分别为90.7%(49/54)、89.3%(50/56)、90.6%(48/53);在ITT 分析中,上述3 组根除率分别为84.5%(49/58)、80.6%(50/62)、84.2%(48/57)。在2 种分析方法中,3 组的根除率差异均无统计学意义(P均>0.05)。见表3。
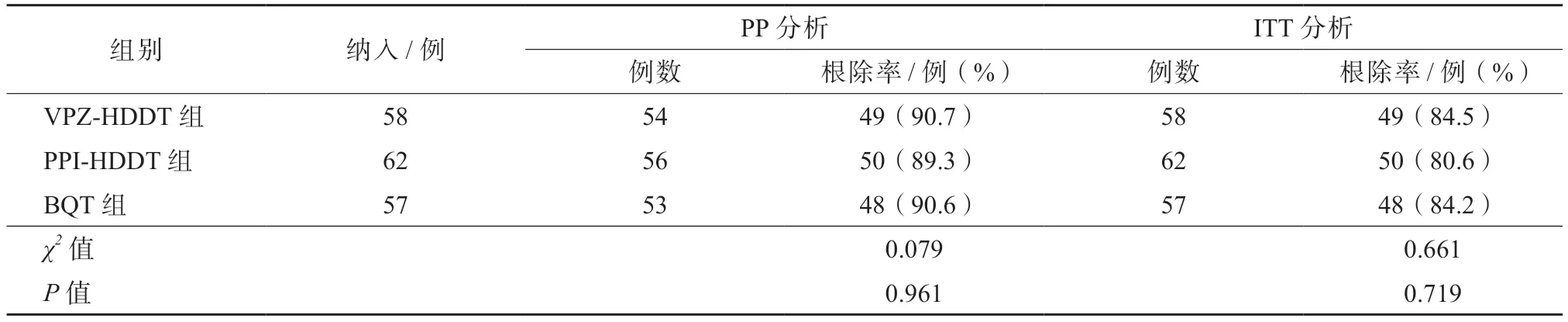
表3 3 组的Hp 根除率比较
2.4 3 组的不良反应发生情况比较
常见的不良反应有恶心、腹痛、腹胀、腹泻、便秘、口干、口苦、嗳气等。VPZ-HDDT 组、PPIHDDT 组、BQT 组不良反应发生率分别为7.4%(4/54)、5.4%(3/56)、18.9%(10/53),VPZ-HDDT组和PPI-HDDT 组不良反应发生率均显著低于BQT 组(χ2=6.110,P=0.046)。3 组中发生不良反应的患者均在停药后2 周内缓解,无严重不良反应发生。3 组的不良反应发生情况详见表4。
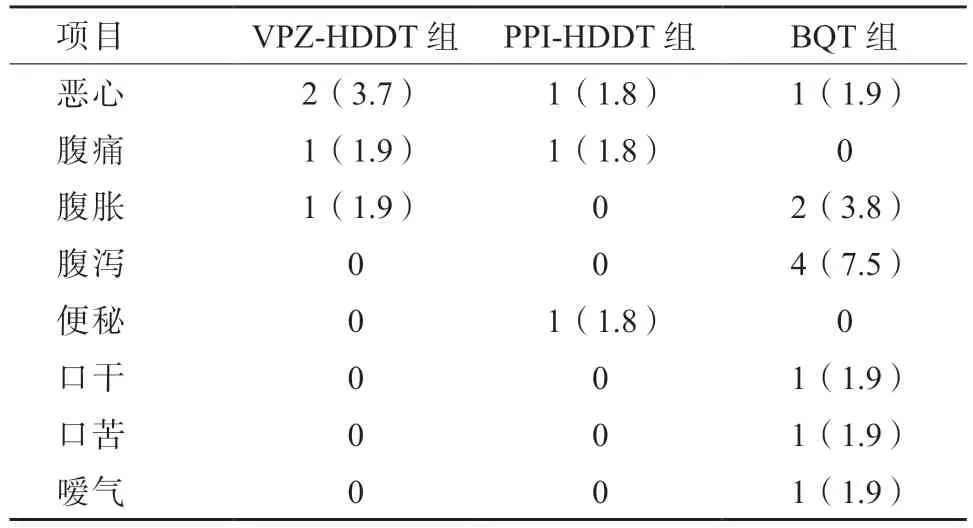
表4 3 组的不良反应发生情况/例(%)
3 讨论
Hp感染与慢性胃炎、消化性溃疡、胃癌等疾病密切相关,根除Hp可改善胃黏膜炎症,延缓或阻止胃黏膜萎缩和肠上皮化生,降低胃癌发生风险[13]。目前根除Hp的四联疗法存在用药方法较复杂、药物不良反应较多及患者依从性较差等局限性。一项台湾地区的Hp根除治疗研究采用埃索美拉唑(40 mg/次,3 次/d)联合阿莫西林(750 mg/次,4 次/d)的二联疗法,结果显示ITT 分析根除率为91.7%,PP 分析根除率为95.7%[14]。Song 等[15]的研究将Hp感染的初治患者随机分组后,分别采用埃索美拉唑(20 mg/次,4 次/d)联合阿莫西林(750 mg/次,4 次/d)的二联方案和BQT 治疗14 d,结果显示二联疗法的Hp根除率较高(92.4%比87.8%;P=0.039),不良反应发生率较低(17.6%比25.5%;P=0.008)且患者依从性较好(96.3%比92.3%;P=0.019)。Xu 等[16]的荟萃(meta)分析评估了现有一线Hp根除方案,基于概率排序结果显示,PP 分析和ITT 分析中HDDT 的Hp根除率均最高且不良反应发生率均最低。VPZ 是一种新型钾离子竞争性酸阻滞剂,其根除Hp的优势是以药物原型发挥作用,不需要酸活化,并且不受CYP2C19 基因多态性影响,因此其抑酸作用更快、更强且更持久,这种快速、持续的抑酸作用可使抗生素在适宜的pH 值条件下有效根除Hp。一项在美国和欧洲进行的研究比较了含VPZ 二联和三联疗法与标准三联疗法根除Hp的疗效,结果显示在两地的人群中,VPZ 二联和三联疗法的Hp根除率均高于兰索拉唑三联疗法(77.2%、80.8%比68.5%)[17]。2022年的一项meta 分析结果显示,含VPZ 二联疗法的ITT 分析根除率为87.5%,PP 分析根除率为89.6%,与含VPZ 三联疗法根除率的差异均无统计学差异(P均>0.05),并减少了抗生素的使用剂量[18]。此外,Suzuki 等[19]的研究发现,对于克拉霉素耐药患者,VPZ(20 mg/次,2 次/d)联合阿莫西林(750 mg/次,2 次/d)治疗7 d 可获得较高的Hp根除率(92.3%)。本研究结果显示,2 个HDDT 组的Hp根除率均与BQT 组相当,3 组的Hp根除率差异均无统计学意义(P均>0.05)。上述研究均表明,HDDT 可作为一线Hp根除治疗方案。
抗生素耐药率较高是Hp根除治疗的棘手问题,在中国Hp对阿莫西林的耐药率较低,约为0~5%[20]。阿莫西林是时间依赖性抗生素,其通过作用于青霉素结合蛋白(PBP)抑制细菌细胞壁的合成,从而导致细菌死亡,其杀菌作用主要取决于血浆药物浓度高于最低抑菌药物浓度的持续时间。阿莫西林在服用后可迅速被吸收入血浆,约6~8 h后排出体外,提高给药频率可维持其有效血浆浓度,以确保药物的疗效。此外,阿莫西林也是pH 依赖性抗生素,胃内pH 值越高则其作用越稳定,杀菌作用越强。Yun 等[21]的研究发现,HDDT 中的阿莫西林剂量多采用2.0~3.0 g/d。与其他研究中阿莫西林0.75 g/次、4 次/d 或1g/次、3 次/d 相比,本研究中的HDDT 中阿莫西林采用0.75 g/次、3 次/d,既减少了药物不良反应,也获得了较满意的Hp根除率。然而,Wang 等[22]在对含VPZ 二联疗法和三联疗法的meta 分析中,进行了抗生素剂量的亚组分析,结果显示在二联和三联疗法中,低剂量抗生素(阿莫西林1.5 g/d)组的Hp根除率均显著高于高剂量抗生素(阿莫西林3.0 g/d)组(P均<0.05)。因此,今后还需进一步研究探讨HDDT 方案中抗生素的最佳给药剂量和频率。
本研究结果还发现,与BQT 组相比,VPZHDDT 组和PPI-HDDT 组的不良反应发生率均显著低于BQT 组(χ2=6.110,P=0.046),推测这可能与BQT 用药种类较复杂有关。进一步分析3 组的不良反应症状,发现与2 个HDDT 组患者相比,BQT 组患者腹泻发生较多,这可能是BQT 使用抗生素种类较多,对肠道微生态影响较大所致。本研究中3 组的不良反应均较轻,且在治疗结束不久后症状均消失,表明3 个方案的药物安全性均较好。
综上所述,本研究结果显示,HDDT 与BQT根除Hp的疗效相当,且减少了患者的不良反应,患者的依从性也较好,提示HDDT 可作为临床一线Hp根除治疗方案。本研究存在不足之处,如为单中心研究,样本量较小,未对纳入患者进行药敏实验等。今后需开展大样本、多中心临床研究,以明确HDDT 中药物的最佳给药剂量和给药频率,以提高其Hp根除疗效。

