4-辛基衣康酸抑制脂多糖诱导的小鼠颅骨炎性骨吸收的效果研究
温从鹏, 童无忧, 陈旭卓, 赖林锋
(1.温州市中心医院口腔科,温州 325000;2.浙江中医药大学,杭州 310000;3.上海交通大学医学院附属第九人民医院口腔外科,上海 200011)
骨代谢是一个动态的过程,通常由成骨细胞介导的骨形成和破骨细胞介导的骨吸收共同调控[1]。骨稳态是维持骨骼完整性和正常功能的必要条件[2]。然而机体内的炎症、氧化应激和激素等因素的共同影响,常导致破骨细胞的过度形成,引起骨吸收增强,尤其在口腔颌面部,可诱发包括类风湿性关节炎、种植体周围炎和牙周炎等在内的各类骨溶解性疾病,严重损害患者的生理和心理健康[3-4]。目前对于骨溶解性疾病的治疗,主要包括非甾体类抗炎药、雌激素类药物、双膦酸盐和各类单抗药物等,然而这些药物因副作用大、价格昂贵等,各自都存在临床应用的局限性[5]。因此,近年来出现了一系列针对抑制破骨细胞及其炎症反应的相关新型药物研究,开发一种安全且高效的药物治疗方法势在必行。
骨溶解通常伴发炎症反应,其特征是大量浸润的免疫细胞和破骨细胞[6]。在众多的免疫细胞中,巨噬细胞为分泌炎症因子的主要来源,在骨溶解过程中起到了关键作用。在核因子κB 受体活化因子配体(RANKL)的刺激下,巨噬细胞可以分化为体内唯一具有骨吸收功能的细胞——破骨细胞。已有越来越多的证据[7-8]表明,包括肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6 和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)在内的炎症因子,可以在没有RANKL 的情况下直接诱导破骨细胞分化。同时,TNF-α、IL-1β等炎症因子与RANKL 具有较强的协同作用,亦可通过刺激RANKL 及其受体RANK 的表达,上调破骨细胞形成,促使炎性骨溶解的发生[9]。因此,鉴于炎症因子和RANKL 之间的紧密联系,在骨溶解微环境中,有必要对BMMs 介导的炎症反应和破骨细胞介导的骨吸收进行联合干预。
衣康酸(itaconate,ITA)是一种由巨噬细胞自身合成的小分子代谢物产物,在细胞的免疫调节中起到重要作用[10]。然而ITA 作为一种羧酸,极性较强且不易穿透细胞膜,在大多数情况下难以被实际应用。4-辛基衣康酸(4-OI)作为ITA 的衍生物,具有较强的细胞膜渗透性,因此是研究ITA 生物学功能的理想替代物[11]。近年来,已有广泛研究[12-14]证实,ITA 可通过多种途径发挥其抗炎作用:①ITA可通过上调转录因子ATF3 的表达,干扰IκB 的降解,进而抑制炎症反应核心信号NF-κB 通路的激活;②ITA 可通过与泛素连接酶kelch 样环氧氯丙烷相关蛋白1(kelch-like ECH-associated protein-1,KEAP1)发生反应,激活细胞内的抗氧化枢纽蛋白——核因子E2 相关因子2(nuclear factor erythroid 2-related factor-2,Nrf 2)的释放和入核,进而增加其下游抗炎及抗氧化产物的表达;③ITA 可通过激活Nrf 2,在转录水平直接抑制炎症相关基因的表达;④ITA 可通过抑制三羧酸循环中的琥珀酸脱氢酶的活性,降低线粒体活性氧(ROS)的产生。此前研究[15-17]曾报道,4-OI 可有效激活Nrf 2 发挥抗炎、抗氧化的作用,在关节炎、腹膜炎、急性肺损伤及骨质疏松等疾病中都有较好的治疗效果。然而目前尚不清楚4-OI 是否对炎性骨溶解具有相似的治疗效果。本研究旨在探讨4-OI 对脂多糖(LPS)诱导的小鼠颅骨溶解的治疗效果。
1 材料和方法
1.1 主要实验试剂
4-OI(Selleck 公司,美国);大肠埃希菌来源的LPS(InvivoGen 公司,美国);重组小鼠巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)、重组小鼠RANKL(RD 公司,美国);α-MEM培养液(HyClone 公司,美国);胎牛血清(Avantor 公司,美国);青霉素-链霉素(Gibco 公司,美国);CCK-8 试剂盒、ROS 检测试剂盒(DCFH-DA)、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(上海碧云天生物技术有限公司,中国);逆转录试剂盒、实时荧光定量PCR 试剂(TaKaRa 公司,日本);iNOS 一抗、免疫荧光二抗(CST 公司,美国)。
1.2 细胞培养
RAW 264.7 小鼠巨噬细胞系购买于中国科学院细胞库。使用含10%胎牛血清、100 U/mL 青霉素-链霉素的α-MEM 培养液,于37 ℃、5%的CO2恒温培养箱内培养细胞系。当细胞汇合度达到80%~90%时,需进行传代或种板。为了避免对细胞系造成刺激,常使用直接吹打或细胞刮收集细胞,而不使用胰蛋白酶。
使用全骨髓法提取小鼠原代骨髓来源巨噬细胞(BMMs)。简而言之,从4~6 周龄C57/BL6 雄性小鼠的股骨和胫骨中收集骨髓细胞,重悬于含有30 ng/mL M-CSF 的完全α-MEM 培养液中,于37 ℃、5%的CO2恒温培养箱培养原代细胞。培养液每2 d 换液1 次,当细胞汇合度达到80%~90%时,需使用含0.25%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰蛋白酶消化,随后进行传代或种板。
1.3 细胞毒性实验
将RAW 264.7巨噬细胞和BMMs以8×103个/孔的密度种于96 孔板。待细胞贴壁后,加入不同浓度(6.25、12.5、25、50、100 µmmol/L)4-OI。继续培 养RAW 264.7 巨噬细胞24 h 和48 h;而对于BMMs,则继续培养48 h 和96 h。随后向每个孔中加入10 µL的CCK-8 溶液。避光孵育2 h 后,于酶标仪上检测450 nm 波长处的吸光度值。将空白对照组细胞活力设定为100%,以此为基准计算每组的细胞活力百分比。
1.4 实时定量聚合酶链反应(RT-qPCR)
将RAW 264.7 巨噬细胞以5×105个细胞/孔的密度种于6 孔板。待细胞贴壁后,分别加入100 ng/mL 的LPS 及不同 浓度的4-OI(12.5、50 µmmol/L)作用24 h。根据说明书,使用RNA提取试剂盒(Axygen 公司,美国)提取细胞中的总RNA。使用PrimeScriptTMRT Reagent Kit(TaKaRa公司,日本)进行逆转录(1 000 ng 总RNA 体系)。使用TB Green®Premix Ex TaqTMKit(TaKaRa 公司,日本)配制反应体系。随后使用ABI7500 实时荧光定量PCR 仪(Applied Biosystems 公司,美国)进行RT-qPCR。以β-actin 作为内参基因,用2-ΔΔCt来计算基因的相对表达量。引物序列见表1。
1.5 细胞免疫荧光
将RAW 264.7 细胞以5×104个细胞/孔的密度接种于共聚焦皿,待细胞贴壁后,分别加入100 ng/mL的LPS 及不同浓度(12.5、50 µmmol/L)4-OI 作 用24 h。随后依次使用4%多聚甲醛固定、含0.5%Triton X-100 的磷酸盐缓冲液(phosphate buffered saline,PBS)通透及免疫荧光封闭液封闭。使用免疫荧光一抗稀释液稀释一抗(iNOS 一抗使用比例为1∶100),4 ℃下过夜孵育。第2 天使用PBS 稀释二抗(山羊抗兔荧光二抗,使用比例为1∶500),室温摇床孵育1 h。使用5 μg/mL 的DAPI 避光孵育5 min。随后于共聚焦显微镜下观察(DAPI:405 nm激发光;iNOS:488 nm激发光)。拍摄完毕后,在Image J 软件上对阳性细胞进行统计,算得各组的阳性细胞相对百分率(阳性细胞数/DAPI 数×100%)。
1.6 ROS 检测
将RAW 264.7 细胞以5×104个细胞/孔的密度接种于共聚焦皿,待细胞贴壁后,分别加入100 ng/mL的LPS 及不同浓度(12.5、50 µmmol/L)4-OI 作用24 h。随后使用ROS 检测试剂盒(DCFH-DA)检测细胞内ROS 水平。按照 1∶1 000 的比例用无血清培养液稀释DCFH-DA 探针,于37 ℃、5%CO2的恒温培养箱中避光孵育20 min,在共聚焦显微镜下观察细胞荧光强度。拍摄完毕后,在Image J 软件上对荧光强度进行统计,计算各组细胞的相对荧光强度(实验组荧光强度/对照组荧光强度×100%)。
1.7 抗酒石酸酸性磷酸酶(TRAP)染色
将小鼠BMMs 以1×104个/孔的密度接种于96 孔板,待细胞贴壁后,分别加入50 ng/mL 的RANKL 及不同浓度(12.5、50 µmmol/L)4-OI,隔天换液,持续诱导5 d。待破骨细胞形成后,使用4%多聚甲醛室温固定15 min,用PBS 漂洗2 次后,加入TRAP 染液,于37 ℃下染色1 h。随后用PBS 漂洗2 次,于倒置显微镜下,每孔随机选取5 个视野拍照。拍摄完毕后,将照片导入Image J 软件中,统计各孔破骨细胞(细胞核≥3 个)的数量和面积。
1.8 LPS 诱导的小鼠颅骨溶解模型的建立
本研究中的动物实验已获得上海交通大学医学院附属第九人民医院动物伦理委员会批准(批准号:SH9H-2020-A1-1),并严格遵循实验动物管理条例进行实验。实验动物为6 周龄C57BL/6 雄性小鼠[体质量约(20±2)g],共 15 只,将实验动物平均分为3 组:假手术组(PBS)、LPS 组(10 mg/kg LPS)、4-OI 治疗组(10 mg/kg LPS+5 mg/kg 4-OI)。实验动物由上海交通大学医学院附属第九人民医院实验动物中心提供,手术及取材均在实验动物中心进行。
腹腔注射2%戊巴比妥以麻醉小鼠,使用脱毛膏脱除小鼠头部毛发,切开皮肤,暴露颅骨,使用剥离子剥开骨膜,在人字缝中间植入浸泡过200 μg LPS 的明胶海绵(4 mm×4 mm×2 mm)。对于假手术组,则植入PBS 浸泡的明胶海绵(4 mm×4 mm×2 mm);3 d 后待创口愈合,LPS 组于小鼠颅顶处局部注射200 μg 的LPS;4-OI 组则分别于小鼠颅顶处局部注射200 μg 的LPS,以及腹腔注射100 μg的4-OI,隔天注射,直到造模第14 天,对小鼠进行安乐死并取材。将取材后的颅骨于4%多聚甲醛中固定48 h,流水过夜后,保存于75%乙醇中。
1.9 Micro-CT 检测
使用高分辨率micro-CT 扫描机(Scanco Medical AG 公司,瑞士)对样本进行扫描(分辨率10 µm,扫描电压70 kV,电流200 μA,曝光时间300 ms)。扫描后对标本进行三维重建和分析。
1.10 组织切片染色
将样本置于10%的EDTA 溶液(pH=7.4)中,在室温下脱钙,每3 天更换1 次脱钙液,连续脱钙4 周。随后将样本进行脱水、浸蜡、包埋、切片,再分别进行苏木精-伊红(hematoxylin and eosin,HE)、TRAP及组织免疫荧光染色处理。使用Image J 软件对iNOS 阳性细胞百分比及TRAP 阳性细胞数量进行统计。
1.11 统计学分析
使用GraphPad Prism 8.0 软件包进行统计学分析。正常分布的计量资料以均数±标准差(x±s)表示。使用独立样本t检验进行2 组间差异分析,使用单因素方差分析(one-way analysis of variance,ANOVA)进行多组间差异分析,组间差异比较采用Tukey 检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 4-OI 对RAW 264.7 巨噬细胞及小鼠原代BMMs的细胞毒性检测
如 图1A 所 示,4-OI 含有典型的α、β-不 饱和羧酸结构,提示该化合物具有较活泼的化学性质。CCK-8 结果显示,4-OI 在100 µmmol/L 的浓度范围内不会影响RAW 264.7 巨噬细胞的细胞活性(图1B)。对于小鼠原代BMMs,在48 h 培养后,100 µmmol/L 浓度范围内的4-OI 无明显细胞毒性,而培养96 h 后,100 µmmol/L 的4-OI 则表现出明显的细胞毒性(图1C)(P<0.001)。因此,我们选取对细胞无毒性的2 组(12.5、50 µmmol/L 4-OI)进行后续实验。
2.2 4-OI 可有效抑制LPS 诱导的巨噬细胞促炎相关基因表达
RT-qPCR 结果(图2A)显示,在LPS 的刺激下,促炎相关基因如TNF-α、IL-1β、IL-6 和iNOS 的mRNA 表达量均显著增加,提示炎症反应体系构建成功。而对于12.5 µmmol/L 和50 µmmol/L 的4-OI 处理组,促炎相关基因的表达水平较LPS 组均显著降低,且具有浓度依赖性。随后,我们通过免疫荧光进一步观察4-OI 对巨噬细胞炎症的抑制效果。如图2B 和图2C 所示,在LPS 的刺激下,炎症巨噬细胞表面标志物iNOS 的表达显著升高,而在12.5 µmmol/L 和50 µmmol/L 的4-OI 处理下,iNOS表达均显著下降(P<0.001)。以上结果均提示4-OI对LPS 诱导的巨噬细胞促炎相关基因的表达具有较为高效的抑制效果。
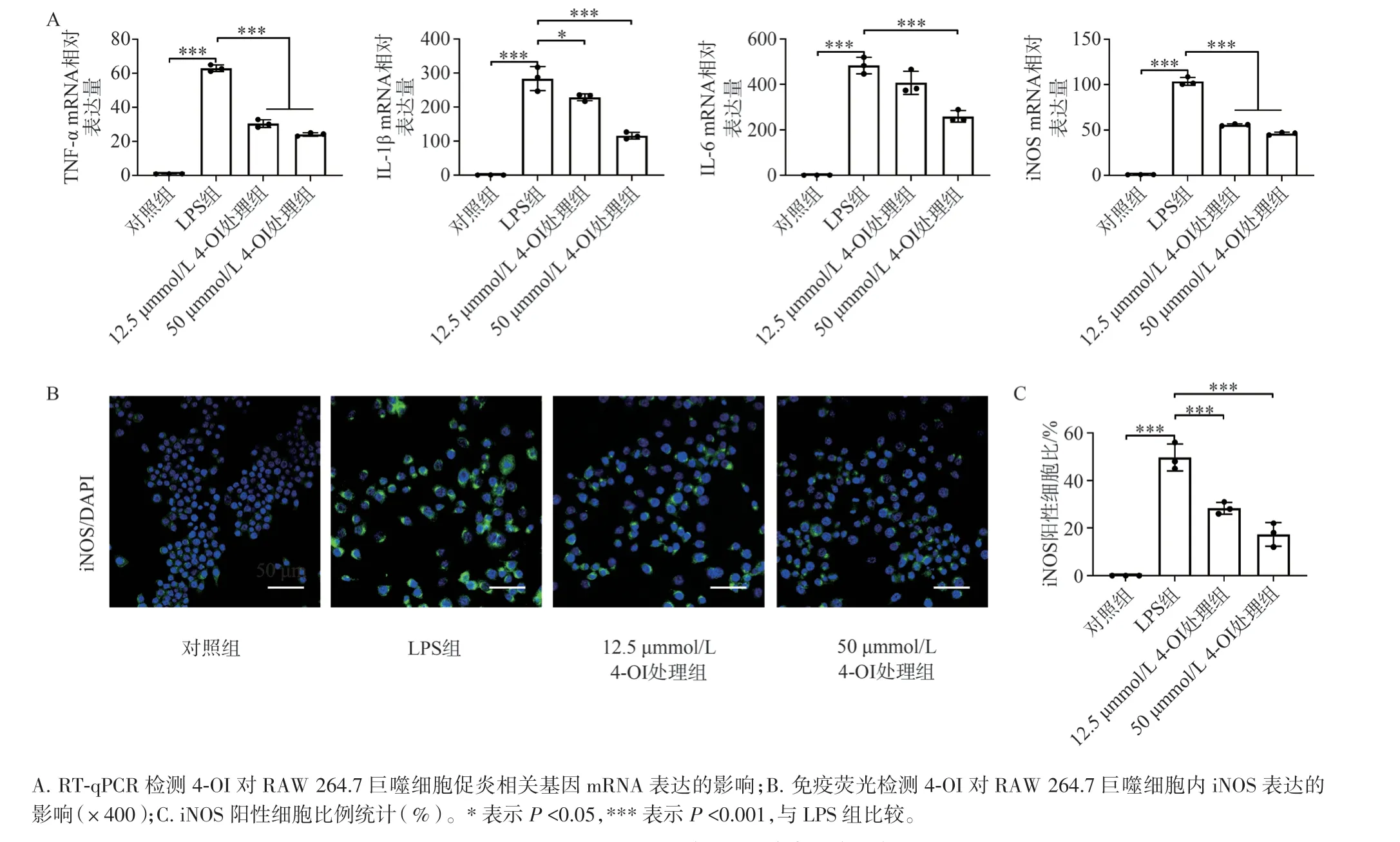
图2 4-OI 对LPS 诱导的巨噬细胞炎症的影响Figure 2 The effect of 4-OI on LPS-induced inflammation of macrophage
2.3 4-OI 可有效降低炎症巨噬细胞内的ROS 水平
如图3A 所示,经100 ng/mL 的LPS 诱导后,RAW 264.7 巨噬细胞内的ROS 水平显著上升。而在不同浓度4-OI 的作用下,细胞内ROS 水平均显著下降(P<0.01),且高浓度(50 µmmol/L)的4-OI较低浓度(12.5 µmmol/L)降低得更为明显(图3B)。
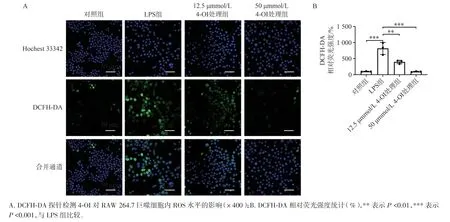
图3 4-OI 对LPS 诱导的炎症巨噬细胞内ROS 水平的影响Figure 3 The effect of 4-OI on ROS level in inflammatory macrophages
2.4 4-OI 可有效抑制RANKL 诱导的破骨细胞分化
图4A 中TRAP 染色结果显示,经50 ng/mL 的RANKL 刺激5 d 后,可见大量TRAP 阳性的多核破骨细胞形成,而不同浓度4-OI 处理组中,TRAP 阳性细胞的数量(图4B)及面积占比(图4C)则显著减少(P<0.01),提示4-OI 具有较为理想的破骨分化抑制效果。
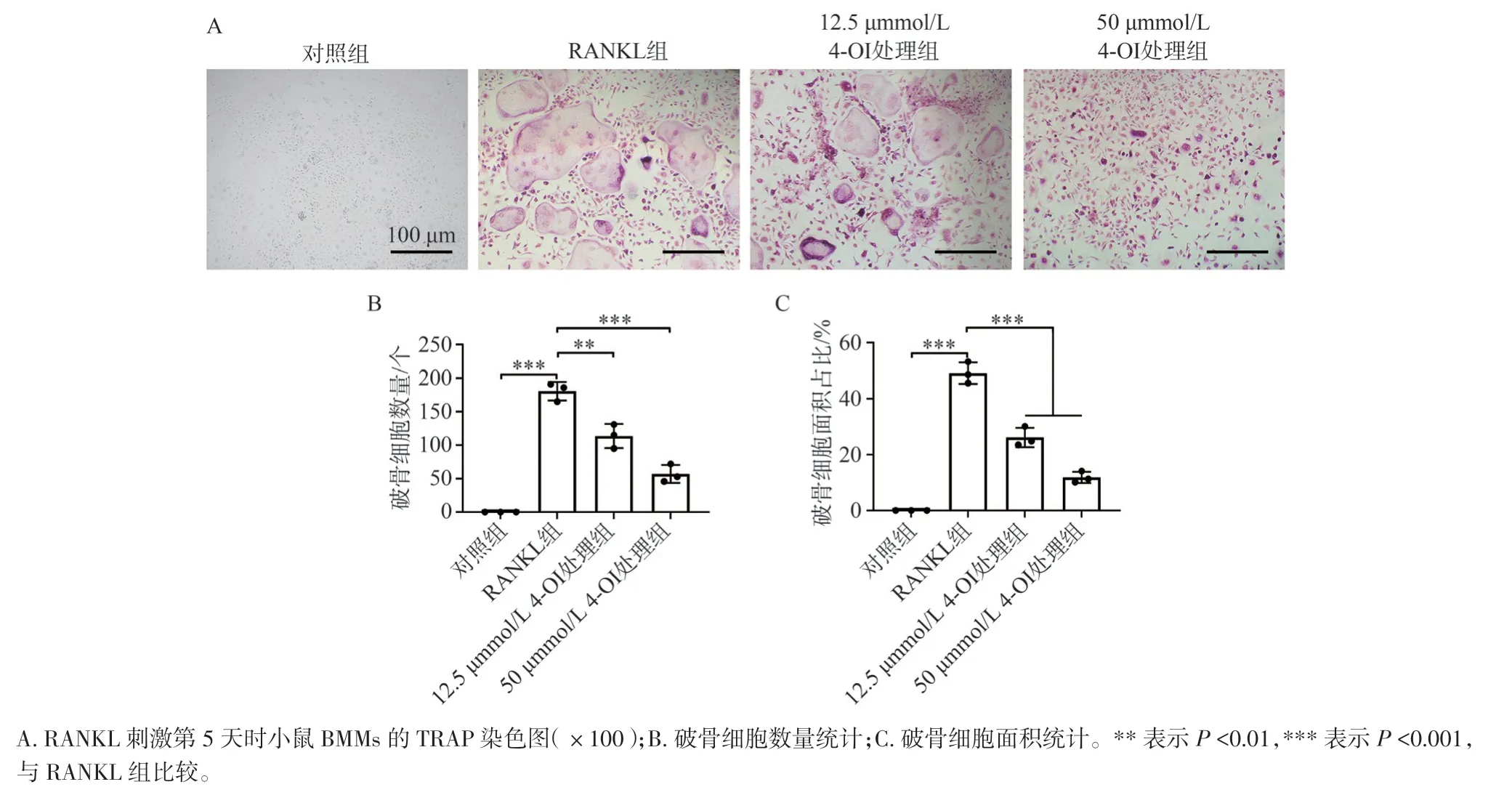
图4 4-OI 对RANKL 诱导的破骨分化的影响Figure 4 The effect of 4-OI on RANKL-induced osteoclastogenesis
2.5 4-OI 可有效抑制LPS 诱导的小鼠颅骨溶解
Micro-CT 扫描的重建结果显示,LPS 组的颅骨表面出现了广泛性的骨溶解,具体表现为深而大的骨吸收坑。相比之下,4-OI 治疗组中的小鼠骨溶解范围明显局限,骨吸收坑较LPS 组浅而小(图5A)。Micro-CT 定量分析结果显示,4-OI 治疗组的骨体积分数(bone volume/tissue volume,BV/TV)与LPS组相比,得到显著改善(图5B,P<0.05)。同时,经4-OI 治疗后,颅骨表面骨溶解的孔隙率明显降低(图5C,P<0.05),与LPS 组相比,孔隙率降低超过35%,提示4-OI 具有明显的骨溶解抑制效果。

图5 Micro-CT 检测4-OI 对LPS 诱导的小鼠颅骨溶解的治疗效果Figure 5 Micro-CT detection of the effect of LPS-induced murine calvarial osteolysis treated by 4-OI
如图6A 所示,HE 和TRAP 染色均显示,LPS组的小鼠颅骨具有广泛的溶骨性破坏,提示模型构建成功。HE 染色可见LPS 组内炎症细胞的浸润及组织缺损程度较假手术组明显增加,而4-OI 治疗组有效抑制了炎症浸润及组织破坏的水平。组织免疫荧光染色亦显示,LPS 组内iNOS 阳性细胞百分比较假手术组显著增加,而4-OI 治疗组内iNOS 阳性细胞百分比显著降低(图6B,P<0.01)。TRAP染色结果可见LPS 组中骨小梁的边缘存在大量TRAP 阳性的破骨细胞,而在4-OI 组中,TRAP 阳性破骨细胞的数量则显著降低(图6C,P<0.001),提示4-OI 对炎性骨溶解病变中的破骨细胞具有较好的抑制效果。
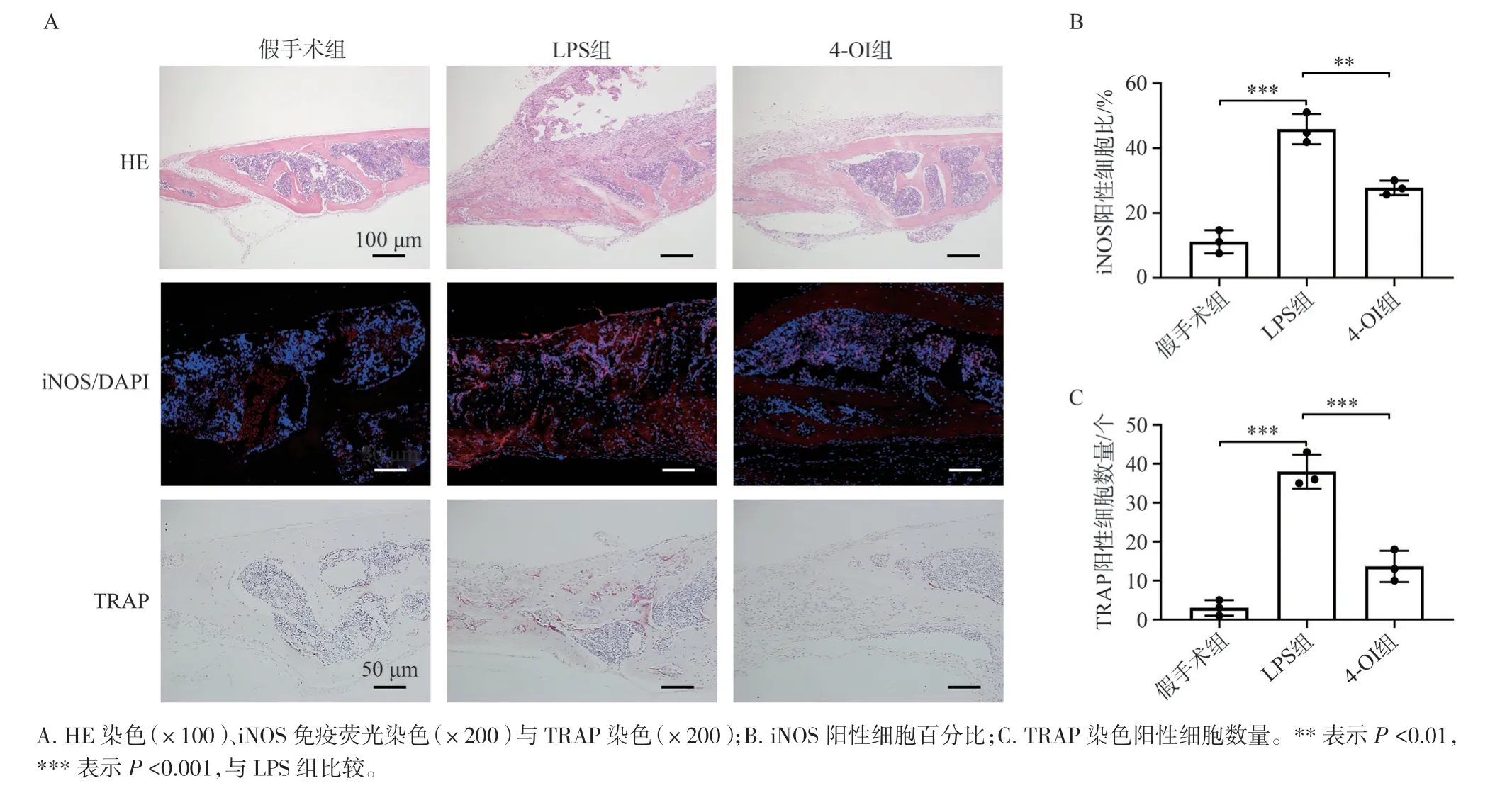
图6 组织学检测4-OI 对LPS 诱导的小鼠颅骨溶解的治疗效果Figure 6 Histology detection of the effect of LPS-induced murine calvarial osteolysis treated by 4-OI
3 讨论
一般而言,骨溶解与炎症反应关系密切。炎症反应和骨吸收的过度激活可引发包括骨关节炎、类风湿性关节炎、骨质疏松、牙周炎和种植体周围炎等一系列骨溶解性疾病。然而,目前临床上应用的药物存在骨坏死、肾毒性及易过敏等副作用。因此有必要开发一种可预防和治疗炎性骨溶解的新型药物。作为细胞内的一种免疫代谢产物,衣康酸具有α,β-不饱和羧酸结构,可通过迈克尔加成反应烷基化内源性蛋白中的半胱氨酸残基,发挥其生物学作用[10]。在此,本研究探究衣康酸衍生物4-OI 对炎性骨溶解的治疗效果,以期进一步扩大衣康酸及其衍生物在生物医学领域的应用范围。
在本研究中,我们首先对4-OI 的细胞毒性进行了检测。使用不同浓度的4-OI 分别处理RAW 264.7 巨噬细胞和小鼠原代BMMs,并分别于24、48 h 和48、96 h 进行CCK-8 检测。结果显示4-OI对RAW 264.7 巨噬细胞和小鼠原代BMMs 的安全浓度 分别为100 µmmol/L 和50 µmmol/L,因此我们选取了对细胞无毒性的2 组浓度(12.5、50 µmmol/L)进行后续实验。在确定了4-OI 的细胞安全浓度后,我们进一步探究了4-OI 对LPS 诱导的巨噬细胞炎症反应的抑制效果。首先,使用100 ng/mL 的LPS 刺激RAW 264.7 巨噬细胞24 h,与此同时加入浓度为12.5 µmmol/L 和50 µmmol/L 的4-OI 进行处理。结果显示,4-OI 可以在不影响细胞活性的情况下,有效地抑制LPS 诱导的巨噬细胞炎症反应,以浓度依赖性的方式降低TNF-α、IL-1β、IL-6 和iNOS 的转录表达水平,同时有效抑制iNOS的蛋白表达水平。巨噬细胞在炎症因子的作用下可发生呼吸爆发,导致线粒体氧耗量迅速增加,产生大量的ROS,进而导致氧化应激的发生,氧化应激进一步促进炎症因子的产生,引发炎症-氧化应激-炎症的恶性循环[18-19]。在本研究中,我们发现在50 µmmol/L 4-OI 作用下的炎症巨噬细胞中,DCFHDA 荧光强度与未加LPS 刺激的对照巨噬细胞相当,提示此时4-OI 对ROS 具有强效的抑制作用,具体可能通过降低线粒体ROS 产生、抑制炎症因子表达和增加抗氧化产物生成而实现。随后,我们进一步对4-OI 对破骨细胞分化的作用效果进行探究。TRAP 染色结果显示,4-OI 可以有效抑制破骨细胞的分化,降低破骨细胞数量及面积。以上结果均提示,4-OI 具备良好的体外抗炎、抗氧化和抗破骨细胞分化功能。
为了进一步探究4-OI 的体内治疗效果,我们构建了LPS 诱导的小鼠炎性骨溶解模型。在造模后第3 天,于治疗组小鼠腹腔注射4-OI,隔天注射,并于造模后第14 天取材。LPS 即内毒素,是革兰氏阴性菌细胞壁的主要组成部分,可作为一种有效的炎症诱导剂,在体内模拟炎性骨溶解的发生[20]。LPS可通过激活巨噬细胞表面的Toll 样受体4(toll-like receptor 4,TLR4),进而诱导NF-κB 通路和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)通路的激活,产生持续的炎症反应[21]。Micro-CT 结果显示,4-OI 可有效改善LPS 所诱导的颅骨溶解,BV/TV 及孔隙率指标较LPS 组相比,均有显著改善。与Micro-CT 结果相似,组织学切片染色及定量分析亦表明,4-OI 可有效地抑制LPS 诱导的骨溶解进展,骨溶解处周围炎症浸润和组织缺损程度明显降低,同时iNOS 阳性细胞百分比显著下降,提示4-OI具有理想的体内炎症骨溶解治疗效果。
然而,本研究也存在一定的局限性。首先,本研究尚未对4-OI 抑制巨噬细胞炎症及破骨细胞分化进行更深一步的机制研究。其次,4-OI 能否通过口服用药的方式有效抑制炎性骨溶解疾病的进展,亦是下一步需要探究的一个重要问题。最后,4-OI是否可能会影响成骨细胞行为,也需要在后续的研究中进一步探讨。
综上所述,本研究证实衣康酸的衍生物4-OI 在体外可以有效地降低炎症巨噬细胞内促炎因子的表达,降低细胞内ROS 水平,抑制RANKL 诱导的破骨细胞分化,在体内亦可以有效地缓解LPS 诱导的小鼠炎性颅骨溶解,对于口腔颌面部骨溶解相关疾病的治疗具有极大的应用前景。

