miR-129-5p 通过靶向SALL4 抑制肝癌细胞增殖、迁移和侵袭的实验研究
张华,范松,刘冀琴,张学军
(1.天津医科大学基础医学院免疫学系,天津 300070;2.武警特色医学中心检验科,天津 300162;3.武警河北省总队医院检验科,石家庄 050000)
肝细胞癌(HCC)是最常见的原发性肝癌类型,也是全球癌症相关死亡的第四大原因[1]。在大多数情况下,HCC 是由肝硬化肝脏的慢性炎症发展而来,并与乙型和丙型病毒性肝炎感染、长期饮酒或摄入黄曲霉毒素等病因相关[2]。大多数患者确诊时已处于晚期,可选择的治疗方案非常有限。目前,手术切除仍是HCC 的主要治疗手段,但高达70%的HCC 患者在接受手术切除5 年后复发[3],此外,对于大多数晚期HCC 患者,索拉非尼似乎是临床上最有效的化疗药物,但其使用和功能受到许多不确定因素的限制[4]。因此,HCC 的总体5 年生存率低于18%,迫切需要新的治疗方法来提高诊断效率,延长患者的生存期。miRNA 是一种长约22 个核苷酸的非编码RNA,可调控多种癌症的进展。越来越多的研究报道功能性miRNA 在肿瘤组织和细胞系中表达失调,在多种肿瘤的发生、发展中发挥重要作用[5]。近年来研究发现,miR-129-5p 在多种肿瘤中异常表达,如胶质瘤[6]、前列腺癌[7]、肺癌[8]、肝癌[9]、肾癌[10]等。然而,miR-129-5 在HCC 中的确切表达和功能仍有待确定。人类婆罗双树样基因-4(SALL4)是一种与肿瘤细胞恶性增殖不可分割的锌指转录因子,本研究旨在探讨miR-129-5p 在HCC 中的表达和功能,并分析其潜在机制。
1 材料与方法
1.1 细胞培养与转染 正常人肝细胞株(LO2)和人肝癌细胞株(HCCLM3、SK-Hep-1、SMMC-7721、PLC/PRF/5、HepG2、HepG2-luc、Huh7、Hep3B)均购自中国科学院中国细胞库(上海)。LO2、HCCLM3、SK-Hep-1、SMMC-7721、PLC/PRF/5、HepG2、HepG2-luc、Huh7 和Hep3B 在DMEM 培养基中培养。所有培养基均含有10%胎牛血清(FBS)(Gibco)、1%青霉素和链霉素(Gibco)。在37℃含5% CO2的培养箱中培养所有细胞系。细胞转染miR-129-5p mimic 或mimic control(Gene-Pharma),使用Lipofectamine 3 000(Thermo Fisher)按说明书步骤转染48 h,用于后续实验。
1.2 样本收集 本研究收集了2021 年1 月到12月武警特色医学中心接受手术的20 例HCC 患者及正常人对照血清。所有患者在手术前均未接受化疗或放疗。
1.3 CCK8 检测细胞存活率 收集各组细胞,将细胞种于96 孔板中,密度为5×103个/孔,分别经过24、48、72 h 培养后加入10 μL 的CCK-8 溶液,37℃孵育4 h,用酶标仪测定吸光度(450 nm)。
1.4 细胞克隆形成检测 在克隆形成实验中,将1 000 个转染后的细胞接种在6 孔板中,在37℃、5% CO2条件下培养14 d 后,用PBS 清洗细胞,4%多聚甲醛固定20 min,0.1%结晶紫溶液再染色20 min,显微镜下计数克隆形成情况。
1.5 细胞划痕实验 通过划痕实验来评估肝癌细胞的迁移能力。将各种细胞接种于6 孔板,待细胞融合度达到80%~90%,用20 μL 移液管尖端在底部划出一条直线。37℃培养箱培养24 h 后,光学显微镜下观察细胞迁移距离。
1.6 Transwell 小室检测细胞侵袭 在涂有基质胶的Transwell 小室中进行细胞侵袭实验。将细胞接种在6 孔板中进行转染。转染48 h 后,将细胞接种到涂有基质胶的侵入室的上隔室。孵育16 h 后,将侵入插入物底部的细胞染色并在显微镜下计数。
1.7 荧光素酶实验验证miR-129-5p 与SALL4 的靶向关系 使用StarBase 数据库(https://starbase.sysu.edu.cn/index.php)预测miR-129-5p 的靶基因。实验分为4 组:pmirGLO/SALL4-UTR+mimics control、pmirGLO/SA-LL4-UTR+miR-129-5p mimics、pmir-GLO/SALL4-mUTR+mimics control 和pmirGLO/SALL4-mUTR+miR-129-5p mimics。将携带SALL4 野生型(pmirGLO/SALL4-UTR)、突变型(pmirGLO/SALL4-mUTR)的质粒分别转入细胞中,或同时转入miR-129-5p 模拟物,均培养48 h,随后吸去培养液,并洗涤细胞,加入细胞裂解液处理5~10 min,然后以3 000 r/min 离心5 min,取上清液进行发光测定。
1.8 RT-qPCR 按照总RNA 提取试剂盒的说明从血清或细胞中提取总RNA,并测定其浓度和纯度。然后根据逆转录试剂盒将提取的RNA 全部反转录为cDNA,进行PCR 扩增,检测基因表达水平。
1.9 Western 印迹法 采用RIPA 裂解缓冲液(Beyotime),从细胞中分离总蛋白。采用BCA 试剂盒(Beyotime)定量总蛋白。使用10%SDS-PAGE 分离蛋白,然后将蛋白转移到PVDF 膜上(Thermo Fisher)。用5%脱脂牛奶封闭1 h 后,细胞膜与一抗孵育过夜:anti-SALL4(1 ∶1 000)、anti-PD-L1(1 ∶1 000)和抗anti-GAPDH(1 ∶10 000)。之后用相应的二抗孵育,最终使用ECL 试剂盒来观察蛋白条带,Image J 软件进行蛋白条带的灰度分析。
1.10 统计学处理 采用GraphPad Prism 软件进行统计分析。所有数据符合正态分布,资料采用表示。组间比较采取SNK-t检验,多组间均数比较采用单因素方差分析(One way ANOVA)。P<0.05 为差异有统计学意义。
2 结果
2.1 miR-129-5p 在HCC 患者血清及肝癌细胞系中的表达水平 与正常对照组相比,HCC 患者血清miR-129-5p 表达量显著降低(t=13.32,P<0.001)。与LO2 细胞相比,HepG2、Hep3B、HCCLM3、BEL-7402 和QGY-7703 的miR-129-5p 表达量均显著降低(t=30.35、33.08、37.11、32.87、8.2,均P<0.05)。
2.2 miR-129-5p 过表达抑制肝癌细胞增殖、侵袭和转移 CCK-8、集落实验和划痕实验表明过表达miR-129-5p 可抑制HCCLM3 细胞的增殖和迁移能力(P<0.05)。Transwell 侵袭实验显示,与对照组相比,miR-129-5p mimics 显著抑制Hep3B 和HCCLM3 细胞的穿膜数量(P<0.05),见图1 和表1。
表1 各组细胞活力、克隆形成数、凋亡率、迁移、侵袭率比较(n=3,)Tab.1 Comparison of cell viability,number of clone formation,migration and invasive rate of each group(n=3,)
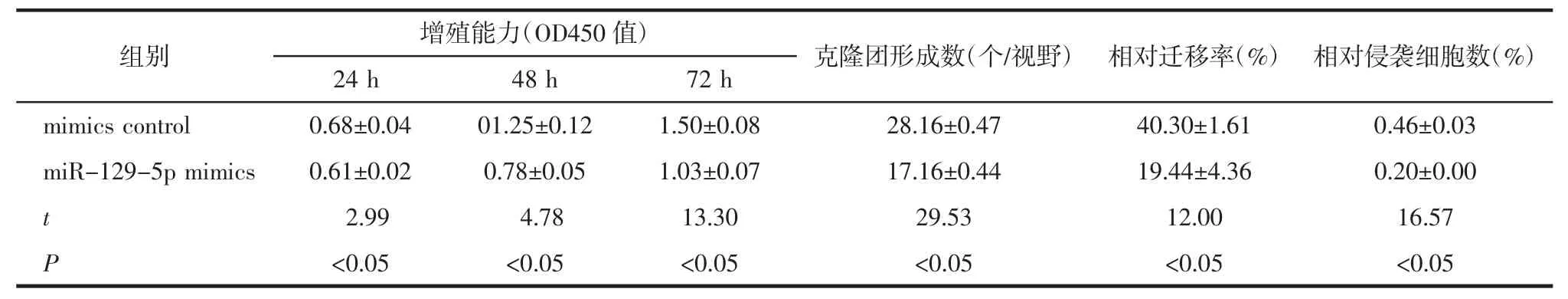
表1 各组细胞活力、克隆形成数、凋亡率、迁移、侵袭率比较(n=3,)Tab.1 Comparison of cell viability,number of clone formation,migration and invasive rate of each group(n=3,)
?

图1 过表达miR-129-5p 抑制肝癌细胞侵袭和转移(200×)Fig.1 Overexpression of miR-129-5 inhibited invasion and metastasis of HCC cells(200×)
2.3 SALL4 是miR-129-5p 在HCC 中的下游靶点StarBase 预测结果显示,miR-129-5p 与SALL4 有潜在结合位点,见图2。随后,通过荧光素酶实验以确认miR-129-5p 与SALL4 3′-UTR 区之间的直接结合序列,与pmirGLO/SALL4-UTR+mimics control组相比,pmirGLO/SALL4-UTR+miR-129-5p mimics组相对荧光素酶活性降低[(9.47±0.38)vs.(5.36±0.32),t=13.75,P<0.05];pmirGLO/SALL4-mUTR+mimics control 组与pmirGLO/SALL4-mUTR+miR-129-5p mimics 组相对荧光素酶活性差异无统计学意义[(9.24±0.30)vs.(9.37±0.43),t=0.228,P>0.05]。

图2 StarBase 预测miR-129-5p 和SALL4 的结合位点Fig.2 The binding sites of miR-129-5p and SALL4 predicted by StarBase
2.4 过表达miR-129-5p 对靶基因SALL4 蛋白以及HCC 免疫治疗相关PD-L1 表达的影响 在HCCLM3 细胞中转染miR-129-5p mimics 后,检测SALL4 和PD-L1 的蛋白相对水平,结果显示上调miR-129-5p 表达后SALL4 [(0.83±0.08)vs.(0.31±0.01),t=12.68,P<0.05]和PD-L1[(0.64±0.08)vs.(0.36±0.02),t=8.798,P<0.05)的蛋白水平明显降低,见图3。

图3 各组HCCLM3 细胞中SALL4 和PD-L1 蛋白表达Fig.3 SALL4 and PD-L1 protein expression in HCCLM3 cells of each group
2.5 miR-129-5p 通过调控SALL4 的表达抑制HCC 细胞的增殖、迁移和侵袭 与mimics control组相比,miR-129-5p mimics+pcDNA3.1 组细胞活力降低,克隆形成数减少,迁移和侵袭率降低(均P<0.05)。与miR-129-5p mimics+pcDNA3.1 组相比,miR-129-5p mimics+pcDNA3.1-SALL4 组细胞活力增加,克隆形成数增多,迁移和侵袭率升高(均P<0.05),见表2 和图4。
表2 各组细胞活力、克隆形成数、凋亡率、迁移侵袭率比较(n=3,)Tab.2 Comparison of cell viability,number of clone formation,migration and invasive rate of each group(n=3,)
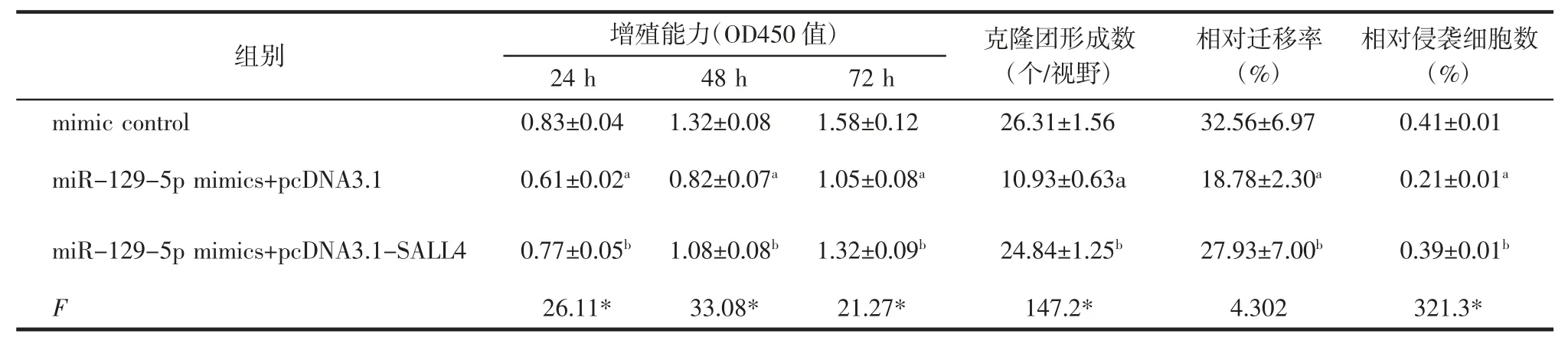
表2 各组细胞活力、克隆形成数、凋亡率、迁移侵袭率比较(n=3,)Tab.2 Comparison of cell viability,number of clone formation,migration and invasive rate of each group(n=3,)
注:*P<0.05;与mimic control 组比较,aP<0.05;与miR-129-5p mimics+pcDNA3.1 组比较,bP<0.05
?

图4 MiR-129-5p 通过调控SALL4 的表达抑制HCC 细胞的侵袭和迁移(200×)Fig.4 MiR-129-5p inhibited the invasion and migration of HCC cells by regulating the expression of SALL4(200×)
3 讨论
HCC 细胞的侵袭和转移是影响患者治疗效果及导致死亡的主要原因[11]。miRNAs 作为HCC 的调控基础,其研究进展为HCC 的发生、发展提供了新的见解。miR-129-5p 通过调控细胞周期、增殖、凋亡、迁移、侵袭和血管生成等生理和病理过程,对多种肿瘤的发生和发展发挥调控作用[12]。在肾癌细胞中,miR-129-5p 促进细胞增殖和侵袭,并通过调控SOX4 通路抑制肾癌细胞[10]。之前有研究报道miR-129-5p 通过靶向TRPM7 和抑制NLRP3 炎症小体激活缓解心肌细胞缺氧复氧损伤[13]。此外,miR-129的表达可能是前列腺癌患者无生化复发生存的独立预后标志物,并且miR-129 的过表达通过调节细胞周期调节蛋白的表达水平显著减弱前列腺癌细胞的增殖[7]。MiR-129-5p 在HCC 中通过直接靶向肝癌来源的生长因子(HDGF)发挥Wnt 信号依赖性的抑瘤功能[14]。本研究发现miR-129-5p 可以靶向SALL4,调控HCC 细胞周期、增殖、凋亡、迁移和侵袭,从而促进HCC 的进展,为HCC 的研究和治疗提供了新的治疗靶点。
本研究通过生物信息学数据库分析确定了miR-129-5p 的潜在靶基因为SALL4,并通过荧光素酶报告基因检测技术发现miR-129-5p 可与SALL4 3′UTR 上的靶点结合。此外,通过检测转染miR-129-5p 模拟物后细胞中SALL4 的蛋白表达水平降低,证明SALL4 是miR-129-5p 的靶基因。miR-129-5p 在转录后水平调控SALL4 的表达。SALL4 是一种对胚胎干细胞自我更新和维持多能性至关重要的癌胚蛋白[15],具有阻止干细胞分化和增强干细胞自我更新的能力,因此被认为在多种类型的癌症中发挥重要作用[16]。据报道,SALL4 高表达的肝癌祖细胞样亚型与临床侵袭性和不良预后相关[17]。因此,SALL4 目前被认为是一种新兴的候选癌症生物标志物。研究发现SALL4 和T 细胞共抑制配体PD-L1 的表达水平均与miR-200c 水平呈负相关。通过大样本肝癌患者生存期回顾分析,发现低表达SALL4 或PD-L1 及高表达miR-200c 的患者具有更长的生存期[18]。
综上所述,本研究发现miR-129-5p 可通过抑制HCC 细胞的增殖、迁移和侵袭,发挥抑癌基因的作用,miR-129-5p 通过靶向SALL4 抑制HCC 进展。因此,miR-129-5p/SALL4 可能成为HCC 治疗的一个有吸引力的靶点。虽然本研究揭示了miR-129-5p/SALL4 轴在HCC 中的抗肿瘤作用,但在未来的研究中仍有一些问题需要改进,例如需要更多的HCC 癌组织和对照组织样本来证实miR-129-5p 在HCC 中的表达水平,需要在更多的细胞系中再次证实miR-129-5p/SALL4 轴在HCC 中的作用。

