乳腺癌转移演进的关键分子ALDH2 体外可视化研究
牛琛,付丽
(天津医科大学肿瘤医院乳腺病理科,国家肿瘤临床医学研究中心,天津 300060)
乳腺癌的发病率已经上升为全球恶性肿瘤的第一位,肿瘤的复发和转移是患者死亡的主要原因[1-3]。如何能术前精准标记出具有播散和转移潜能的肿瘤细胞,是解决肿瘤复发和转移的关键[4-5]。目前,组织病理学是诊断肿瘤的金标准,但是其有创、滞后、取材有限导致不能观察到肿瘤的全貌[6-7]。如果能够通过分子影像技术准确预判肿瘤范围及转移潜能,不但可以指导精准取材,也可以实时指导手术,避免病灶残留,对患者的诊断、治疗以及预后极为重要。近红外光学成像因其灵敏度高、背景荧光干扰小、组织光损伤较低、无辐射、成本低等优点,在肿瘤诊断、光学手术导航和实时可视化评价疗效等方面做出了显著贡献[8-10]。
乙醛脱氢酶2(ALDH2)属于醛脱氢酶家族[11],在维持肿瘤细胞干性和介导微管抑制剂抗性中起关键作用[12-14]。前期研究表明,ALDH2 在浸润性微乳头状癌(IMPC)这种高转移的乳腺癌组织中高表达,其表达水平与肿瘤细胞的播散、迁移和转移能力成正比,是患者死亡的独立风险因素[15]。因此,ALDH2是识别具有播散和转移潜能肿瘤细胞的重要分子。设计并合成一种脂质体纳米探针ALDH2-Cy7@LPFA,评估其在肿瘤细胞中的表达水平,实现在体、无创、精准、高效诊断具有高侵袭和转移特性的乳腺癌,可为精准诊疗方案的制定及患者的预后预测提供依据。
1 材料与方法
1.1 实验材料与仪器 人乳腺癌细胞系BT474、MDA-MB-231、T47D、MCF-7 和人正常乳腺细胞MCF-10A 均购自Procell 公司;ALDH2 抗体和GAPDH 抗体购于美国Abcam 公司;DMEM 培养基、胎牛血清和青霉素-链霉素双抗购于美国Gibco 公司;Cy7 购自北京范博生化;超干二甲基亚砜(DMSO)、三乙胺(TEA)购自北京百灵威科技有限公司;乙醚购自国药集团化学试剂有限公司;无水甲醇(CH3OH)购自天津天力化学试剂有限公司;(2,3-二油酰基-丙基)-三甲胺(DOTAP)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(DOPC)、1,2-二硬脂基-sn-甘油-3-磷酸乙醇胺-N-[叶酸(聚乙二醇)](DSPEPEG2k-folate)、胆固醇(Chol) 购自Avanti Polar Lipids 生物公司。
紫外可见分光光度计(北京普析通用仪器有限责任公司,TU-1900)、荧光光谱仪(爱丁堡仪器公司,FLS1000)、磁力搅拌器(郑州长城科工贸有限公司,DF-101S)、混匀仪(上海仙象仪器有限公司,ELEMS100)、纳米粒径电位分析仪(Malvern,ZEN3690)、台式高速离心机(eppendorf,5810R)、脂质体薄膜挤出器(加拿大ATS 工业系统有限公司,LEPEX)。
1.2 方法
1.2.1 探针合成及制备 参照文献方法[16-17],先将叶酸-NHS 和DSPE-PEG2000-NH2 溶解于PBS中,TEA 为催化剂,室温搅拌12 h。用透析袋对反应液透析3 次,去除未反应的叶酸,真空冷冻干燥得到Folate-PEG2000。然后,采用薄膜水化法合成脂质体纳米颗粒,将二棕榈酰磷脂胆碱(DPPC)、胆固醇和Folate-PEG2000 混合溶于甲醇/氯仿(9/1,v/v)混合液中,减压去除有机溶剂,形成脂质干膜。分别将含有ALDH2-Cy7 与ALDH2-Cy5 的PBS 溶液加入脂质干膜中,50℃水化1 h,得到多层脂质体,再用脂质体挤出器(聚碳酸酯膜100 nm)挤出多层脂质体10 次后,得到纳米脂质体,最后用透析袋透析3次,去除未包封的ALDH2-荧光基团原料,得到脂质体纳米探针ALDH2-Cy7@LP-FA。
1.2.2 细胞培养 人乳腺癌细胞系BT474、MDAMB-231、T47D、MCF-7 和人正常乳腺细胞MCF-10A 在补充有10%胎牛血清的DMEM 中培养,37℃下在5%CO2的培养箱中培养。
1.2.3 免疫组化染色 采用免疫组织化学染色方法分析ALDH2 在肿瘤组织和癌旁组织中的表达情况。4%的多去甲醛(PFA)固定肿瘤组织,连续切取5 μm 厚度的组织切片进行免疫组化染色。染色步骤和评分标准详见前期实验步骤[15]。
1.2.4 蛋白质印迹 采用蛋白质印迹法分析ALDH2 在乳腺癌细胞BT474、T47D、MDA-MB-231、SKBR3、MCF-7 和人正常乳腺细胞MCF-10A 中的表达水平。使用苯基甲磺酰氟(PMSF)(#8553,CST)的细胞裂解缓冲液(#9803,CST)裂解乳腺癌细胞。SDS-PAGE 凝胶(10%)分离蛋白质,转移到聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉封闭。将PVDF 膜与ALDH2(ab133306,Abcam,1 ∶1 000)一抗在4℃下孵育过夜。与HRP 耦联的抗兔IgG(7074 s,CST,1 ∶5 000)在室温下孵育1 h,使用ECL 检测试剂盒(P90719,Immobilon)分析蛋白质表达。
1.2.5 流式细胞实验 将BT474 细胞以2×104密度平铺到12 孔板,并设置空白对照组。待细胞贴壁后,去除旧培养基,在空白对照组中加入新鲜培养基,实验组中加入对应的探针,孵育不同时间(0、2、4、6 h)后,再次去除旧培养基,PBS 清洗3次,500 μL 胰酶消化2 min,然后加入500 μL 培养基终止消化。将细胞1 000 r/min 离心3 min,去除上清,然后200 μL PBS 重悬。吹打均匀,流式细胞仪对细胞进行荧光定量。MDA-MB-231 和MCF-10A 细胞组处理方法类似。
1.2.6 激光共聚焦成像实验 以BT474、MDA-MB-231 细胞作为实验组,MCF-10A 细胞作为对照组。将BT474 细胞以20 000 个/皿的密度平铺到共聚焦小皿(35 mm×10 mm)上,5%CO2,37℃培养箱中孵育过夜。待细胞贴壁生长后,去除旧培养基,加入含有ALDH2-Cy7@LP-FA(5 μmol/L)的培养基孵育4 h。随后去除培养基,PBS 清洗3 次,加入含有Mito Tracker Green FM(50 nmol/L)的培养基孵育20 min以进行线粒体染色,然后PBS 清洗3 次,使用500 μL Hoechst 33 342 溶液孵育10 min 进行细胞核染色,最后PBS 清洗3 次,将各共聚焦小皿分别置于激光共聚焦显微镜下观察拍摄。MDA-MB-231 和MCF-10A 细胞组处理方法类似。
1.2.7 细胞毒性实验 采用CCK8 法检测纳米脂质体探针的细胞毒性。将传代培养至对数期的乳腺癌细胞BT474、MDA-MB-231 消化、离心、吹匀,以每孔5×103密度平铺至96 孔板,在37℃培养箱孵育。随后去除旧培养基,对照组加入新鲜培养基,实验组加入用培养基配置的不同浓度的探针(浓度分别为0、5、10、15、20、30 μg/mL),然后分别以100 μL/孔加入96 孔板,在恒温培养箱中培养48 h。孵育结束后,加入10 μL/孔的CCK8 溶液,将培养板放入培养箱中孵育4 h,之后使用酶标仪检测每孔的吸光度值(OD),波长设置为450 nm,对肿瘤细胞的存活率进行计算,检测探针对肿瘤细胞毒性的影响。
1.3 统计学处理 使用GraphPad Prism 6.0 统计软件进行统计分析,符合正态分布的计量资料以均数±标准差表示,蛋白质印迹及其他实验差异分析,采用独立样本的t检验,P<0.05 为差异统计学意义。
2 结果
2.1 探针的表征 制备得到粒径均一分布的叶酸靶向脂质体FA-Lipo,其粒径大小为(155±2)nm(图1A)。在不同pH 值条件下均为电中性(zeta 电势<10 mV)(图1B)。由于需要递送的ALDH2 抗体的等电点为7.49,在中性条件下也为电中性。因此通过超声法制备含有ALDH2-Cy7 的脂质体ALDH2-Cy7@LP。粒径分析表明其粒径与原脂质体FA-Lipo 相当,为(155±4)nm(图1C)。进一步对ALDH2-Cy7@LP 的紫外吸收光谱和荧光发射光谱进行表征,结果表明,脂质体的包载使得标记抗体的紫外吸收和荧光发射分别发生了4 nm 和5 nm的蓝移。光谱性质表明(图1D),Cy7 对ALDH2 的抗体标记成功,脂质体的包载实现了抗体纳米化,同时对标记抗体的光谱性质影响很小(图1E)。
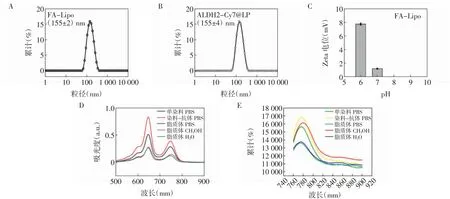
图1 ALDH2-Cy7@LP-FA 的表征结果Fig.1 Characterization results of ALDH2-Cy7@LP-FA
2.2 ALDH2 蛋白在不同乳腺癌细胞系中的表达免疫组化对比IMPC 组织与癌旁组织中ALDH2 的蛋白表达差异,发现ALDH2 在IMPC 组织中显著高表达(图2A)。通过蛋白质印迹实验检测ALDH2 蛋白在6 种乳腺细胞中的表达水平,发现ALDH2 在人正常乳腺细胞MCF-10A 极低表达,在乳腺癌细胞BT474 和MDA-MB-231 中高表达,在T47D、SKBR3、MCF-7 细胞中较低表达(图2B,BT474:t=29.123,P<0.001;T47D:t=9.512,P<0.01;MDA-MB-231:t=27.162,P<0.001;SKBR3:t=21.279,P<0.001;MCF-7:t=3.628,P<0.05)。
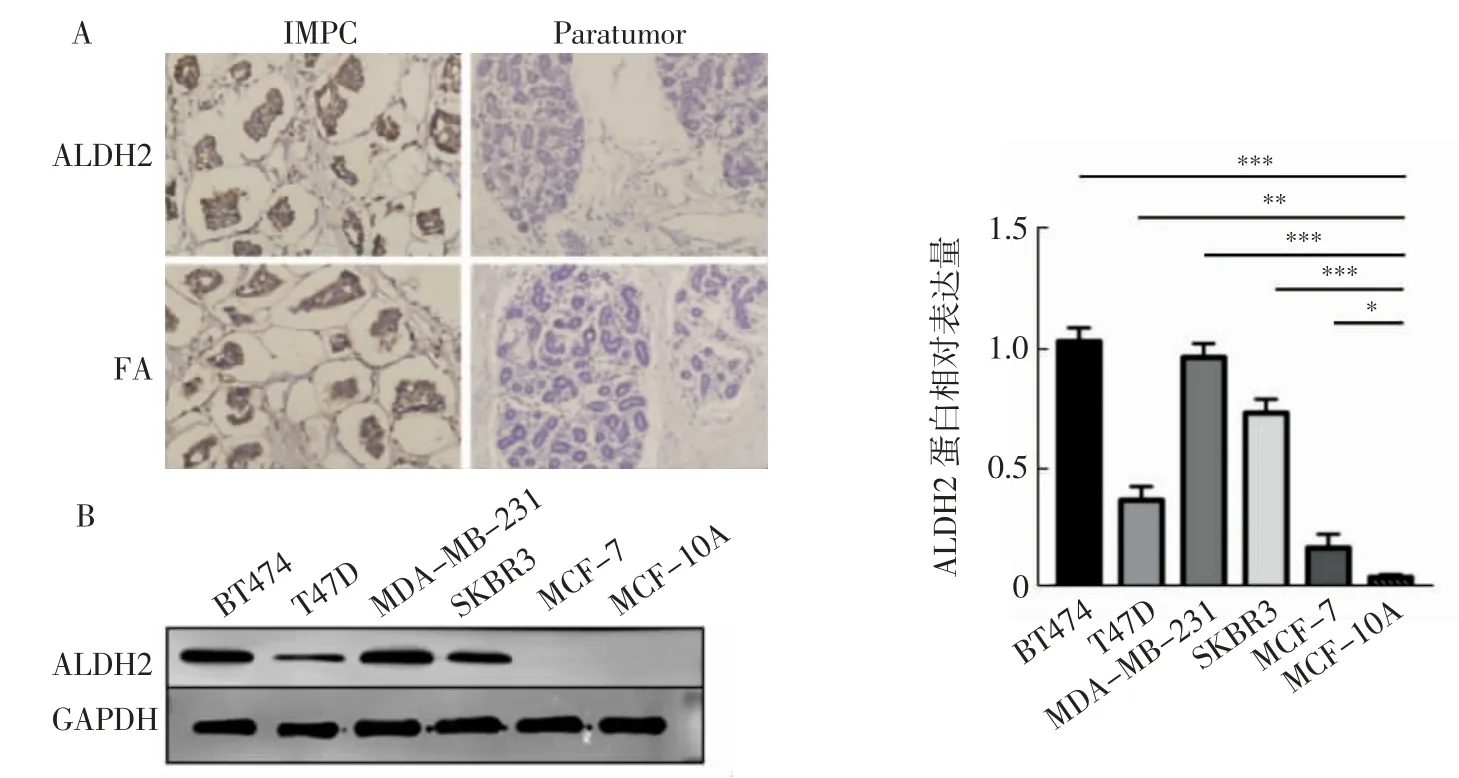
图2 ALDH2 在乳腺癌组织和细胞的表达水平Fig.2 ALDH2 expression levels in breast cancer tissues and cells
2.3 探针的体外摄取及成像结果 采用流式细胞术分析探针在肿瘤细胞中的摄取情况,将探针与BT474 和MDA-MB-231 细胞共孵育,发现结合率随时间逐渐增高,在4 h 后达到饱和(图3A)。流式细胞术检测MCF-10A、MDA-MB-231 和BT474 细胞的ALDH2-Cy7@LP-FA 探针结合率,与MCF-10A细胞相比,在高表达ALDH2 的BT474 细胞中的结合率最高,MDA-MB-231 细胞次之(BT474:t=9.976,P<0.01;MDA-MB-231:t=12.026,P<0.05)。CCK8 结果显示,ALDH2-Cy7@LP-FA 探针在浓度高达30 μg/mL 时,BT474 和MDA-MB-231 的细胞存活率仍在80%以上,与对照组相比无统计学差异,并未发现明显的细胞毒性(图3B)。
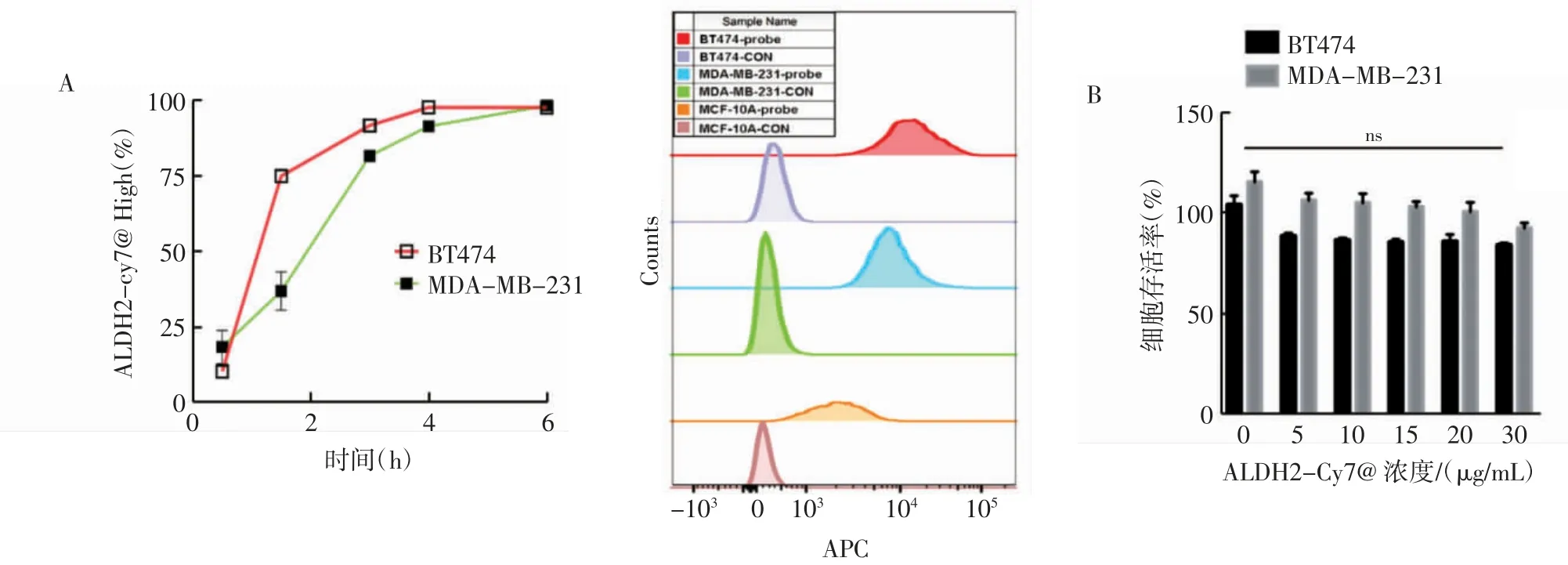
图3 ALDH2-Cy7@LP-FA 对细胞的摄取及毒性Fig.3 Cellular uptake and toxicity of ALDH2-Cy7@LP-FA
共聚焦显微镜结果显示,ALDH2-Cy7@LP-FA探针荧光与Mito Tracker 线粒体发光高度重叠,提示主要定位在胞浆线粒体。探针BT474 中呈强荧光着色,在MCF-10A 中呈极弱荧光着色,与蛋白质印迹结果一致(图4A)。共定位实验表明,探针与线粒体染料Mito Tracker 高度重合,在BT474、MDA-MB-231 中的Pearson相关系数分别高达0.88 和0.78,成功释放和定位在线粒体(图4B)。

图4 ALDH2-Cy7@LP-FA 的成像效果Fig.4 Imaging effect of ALDH2-Cy7@LP-FA
3 讨论
2020 年全球确诊了230 万例乳腺癌新病例(占所有肿瘤的11.7%),其已超过肺癌,成为全球最常见的肿瘤,是女性肿瘤死亡的主要原因。乳腺癌的局部复发或远处转移是临床致死的主要原因,寻找肿瘤特异性靶向分子,利用分子影像学技术实现在体、精准标记播散及转移细胞是提高患者生存率的关键。
在过去的几十年里,医学成像技术飞速发展,在临床肿瘤学中发挥着核心作用。分子成像不仅可以可视化肿瘤在体内的位置,而且能够可视化影响肿瘤行为或治疗反应的特定分子的表达以及生物过程(如凋亡、血管生成和转移)[16]。其中,近红外荧光分子影像技术具有高灵敏度、高分辨率、无辐射、低成本等优点,能够在多水平对关键分子靶标进行体内成像,在术前提供肿瘤的精准定位信息,并适用于手术导航,实现对肿瘤的实时监测和精准切除[19-20]。菁染料是近红外荧光染料中最常用的一类荧光染料,其摩尔吸光系数在荧光染料中是最高的,其中Cy7 的吸收在近红外区背景非常低,是荧光强度最高、最稳定的长波长染料[21-22],特别适合代替放射性元素用于活体小动物体内成像[23-24]。
课题组前期对IMPC 肿瘤细胞团全基因组测序,发现IMPC 组织中具有高转移潜能的肿瘤转移种子细胞,并鉴定出了肿瘤转移种子细胞演进的3个关键分子:ALDH2、免疫球蛋白超级家族9 号成员(immunoglobulin superfamily member 9,IGSF9)和PR结构域家族16 号成员(PR-domain containing 16,PRDM16)。其中,ALDH2 在IMPC 组织中高表达,提示ALDH2 是促进IMPC 高侵袭和转移的种子基因。因此,设计ALDH2 靶向荧光探针标记体内高转移潜能的肿瘤细胞,可实现在体肿瘤细胞的定位,并可评估肿瘤细胞的转移潜能。
ALDH2 属于醛脱氢酶家族,位于线粒体。早期研究表明其主要功能是将乙醛代谢成无毒的乙酸,参与乙醇氧化代谢过程[25]。近年来,多研究表明ALDH2 在肿瘤发生、发展过程中发挥重要作用,ALDH2 失活或活性降低使乙醛在体内蓄积,过量的乙醛与谷胱甘肽结合抑制抗氧化防御系统,增加体内的活性氧簇(ROS),促进氧化应激反应,从而导致肿瘤的侵袭与转移[26]。多项研究表明,ALDH2 在多种不同类型的肿瘤中表达增加,且与不良预后显著相关。Chen 等[12]研究表明,ALDH2 高表达可增强肝癌细胞的增殖和侵袭能力。Ramakrishnan 等[27]研究发现,在浸润性膀胱癌中ALDH2 高表达的亚群具有侵袭性表型。Aboulouard 等[28]通过对子宫内膜癌和其前哨淋巴结的临床样本进行空间蛋白组学测序分析,发现了高表达分子ALDH2 更多在子宫内膜癌的Ⅱ级和Ⅲ级中表达,故被认为是肿瘤转移的关键分子之一。
ALDH2 不仅在IMPC 这种高转移的乳腺癌中高表达,还与肿瘤细胞的转移能力成正比。ALDH2在乳腺正常组织中低表达,在乳腺癌中高表达,其蛋白表达水平与肿瘤细胞的淋巴结转移呈正相关,与患者的极差预后呈负相关,是患者死亡风险的独立预后因素。以上研究结果均显示ALDH2 是识别具有转移潜能肿瘤细胞的重要候选分子,使ALDH2体内成像,评估其在肿瘤细胞中的表达水平,可实现精准高效的病理诊断。另外,ALDH2 体内成像可为术中精准、彻底地切除肿瘤提供依据。
本研究依据前期研究鉴定出肿瘤转移的关键分子ALDH2,对脂质体纳米表面修饰Folate 并包载ALDH2 抗体,构建高灵敏、高特异性的线粒体靶向荧光分子探针,并借助近红外分子影像技术,识别具有高侵袭转移潜能的肿瘤干细胞。同时选取人源乳腺癌细胞系具有高侵袭/转移能力强的MDAMB-231(三阴型)和BT474(Luminal B 型)与探针共孵育,评估探针的体外靶向结合能力。结果显示,ALDH2-Cy7@LP-FA 可特异性靶向线粒体中的ALDH2,选择性结合ALDH2 高表达癌细胞,共定位分析显示该探针在线粒体中特异性积累,其线粒体定位能力优异。且探针对细胞的毒性极低,具有良好的生物相容性。未来将进一步完善在体内实验的验证。希望可以精准显像具有转移潜能的肿瘤细胞和癌灶边界,实现检测ALDH2 过表达的早期乳腺癌,对肿瘤和转移灶进行精准全切除。此外,ALDH2同样在子宫内膜癌、肺癌、肝癌等中参与肿瘤细胞的增殖、转移过程,被认为是肿瘤转移的关键分子之一。因此,基于ALDH2 合成的靶向分子探针可能在多种肿瘤中具有广泛的应用价值。

