山羊GPR35基因表达特性分析及对皮下脂肪细胞分化作用的研究
孟秋赤,卢光玉,陈定双,林亚秋,王瑞龙,钟朝崧,王 永,刘 伟,王友利,李艳艳*,李志雄*
(1.西南民族大学畜牧兽医学院,成都 610041;2.青藏高原动物遗传资源保护与利用教育部/四川省重点实验室,成都 610041)
随着人们生活水平的提高,羊肉因其肉质鲜美、营养丰富和低胆固醇的特点受到广大消费者的青睐,消费者们对羊肉的需求量与日俱增[1]。简州大耳羊是由四川省简阳市本地山羊与欧美的努比山羊杂交培育形成的我国新型肉用山羊品种,具有体格大、体型发育匀称和早期生长速度快等特点[2]。山羊的皮下脂肪与肌内脂肪含量是评价肉类鲜美程度的重要标准之一,其中肌内脂肪的含量与肉类口味风味等呈正相关,而报道显示皮下脂肪组织中含有较高的脂肪酸,如果摄入过多的脂肪酸可能会增加动脉硬化和冠心病等疾病的发生风险,因此如何利用分子育种来提升山羊肉质和品质,让消费者吃的开心、吃的放心成为当前畜牧工作者的工作重点[3-5]。
G蛋白偶联受体(G protein-coupled receptors,GPCRs)是一大类膜蛋白受体家族的统称,其成员有1 000多个[6]。据报道显示,G蛋白偶联受体只存在于真核生物中,G蛋白偶联受体能结合细胞周围环境中的化学物质(气味、费洛蒙、激素、神经递质和趋化因子)并激活细胞内的一系列信号通路,最终引起细胞状态的改变,因此它广泛的参与了生理与病理过程,从而一直是新药发现及研究的最重要靶点[7-8]。GPR35是于1998年在人类基因组DNA筛查中发现的孤儿受体[9](孤儿受体是指与其它已确认的受体结构上明显相似,但其内源配体还未发现的受体),近来有报道表明其配体可能是溶血磷脂酸(lysophosphatidic acids, LPA)、犬尿酸(kynurenic acid, KYN)和趋化因子17(chemokine ligand 17, CXCL17)[9-11]。其中CXCL17已经被证明为GPR35的特异性配体,而CXCL17在多种不同类型的肿瘤细胞中表达,尤其是在人结肠癌和乳腺癌细胞中的表达最为活跃[12-13]。有报道显示,GPR35的表达与血管疾病、炎症、免疫和肿瘤等疾病的发生和发展密切相关[14-15]。郑燕森等[16]利用最新基因敲除技术CRISPR/Cas9构建GPR35全身性基因敲除小鼠,通过Western blot方法检测了炎症后小鼠肠组织的ERK、AKT信号通路,发现GPR35基因敲除型小鼠的组织磷酸化AKT信号更强,这表明GPR35基因通过影响肠上皮细胞稳态能够促进肠炎的发生发展。李一芷[17]利用免疫组化TCGA数据库分析等方法发现,CXCL17和GPR35的表达与胃癌发生发展的多阶段过程有关,是潜在的胃癌监测指标,并指出CXCL17-GPR35在功能上可能与CCL20有关。Schneditz等[18]的研究表明,GPR35可能会与钠钾泵结合促进糖酵解,会增强致癌转导信号从而导致肿瘤的发生发展几率增加。
最近有研究表明,GPR35基因的表达可能与肥胖、糖尿病等身体代谢异常引发的疾病密切相关,如Agudelo等[19]在小鼠上发现GPR35在KYN的作用下能提高脂肪组织能量利用率,作为KYN受体的GPR35能刺激脂肪组织中的脂质代谢、产热和抗炎基因表达。Shrimpton等[20]发现,人的GPR35基因缺失会导致葡萄糖耐受不良和进行性体重增加,并且对高脂饮食极为敏感,患者出现生长发育异常,包括超重以及腹型肥胖等。上述研究表明,GPR35在动物的脂肪合成以及代谢过程中发挥调控作用。但其对山羊脂肪细胞分化的影响尚未见报道。
本研究以简州大耳羊为试验对象,使用RT-PCR法获得山羊GPR35基因序列,并进行生物信息学分析,利用qRT-PCR检测其在山羊不同组织和分化阶段皮下脂肪细胞的表达情况,过表达或干扰GPR35探究该基因在山羊皮下脂肪细胞分化过程中的作用及可能的机制。本试验将为深入研究GPR35基因在山羊中的生物学功能提供参考,为山羊定向分子育种提供潜在靶点。
1 材料与方法
1.1 试验材料
1.1.1 试验样品采集 试验动物选自四川天地羊生物工程有限责任公司的成年(1周岁)健康雄性简州大耳羊(n=4),清晨空腹时对其进行屠宰并快速采集山羊心脏、臂三头肌、脾脏、小肠、肾脏、背最长肌、肝脏、股二头肌、大肠、肺脏、皮下脂肪和肌间脂肪等组织,用DEPC水冲洗干净后放入标记好的2 mL冻存管中,迅速将其置于液氮中储存。山羊皮下前体脂肪细胞在无菌条件下从7日龄的雄性简州大耳羊腹部皮下脂肪组织中分离获得。具体分离步骤参照实验室前期建立的方法[21]。
1.1.2 主要试剂与仪器 逆转录试剂盒(reverse transcription Kit)购自美国Thermo公司;2×Taq PCR Master MixⅡ、质粒小提试剂盒(plasmid small extraction kit)、胶回收试剂盒(glue recovery kit)、DNA Marker DL2000购自北京天根生化科技有限公司;感受态细胞、p Clone007 Versatile Simple Vector购自擎科梓熙生物技术有限公司;氨苄青霉素钠、卡那霉素购自Biosharp 公司;2×SYBR Green Fast qPCR Mix购自北京百迈客生物科技有限公司;青链霉素、胰蛋白酶、DEME/F12培养基、胎牛血清购自Gibco公司;Trizol试剂、BCA试剂盒(BCA Kit)购自江苏康为世纪生物科技股份有限公司;甘油三酯试剂盒(Triglyceride kit)购自北京普利莱基因技术有限公司;Versa Doc 1000凝胶成像系统、Sub-Cell水平电泳槽购自美国Bio-Rad公司;iQ5实时荧光定量PCR仪、TC-96基因扩增仪购自杭州博日科技有限公司;H1650-W台式微量高速离心机购自湖南湘仪离心仪器有限公司。
1.2 方法
1.2.1 RNA的提取与cDNA的合成 将约0.1 g的组织放入研钵,加入液氮后对其进行充分研磨并转入无酶的EP管中,按照Trizol法[22]提取RNA,每管加入1 mL trizol后使用涡旋仪震荡使其充分裂解并迅速置于冰上静置5 min,每管加入200 μL氯仿剧烈震荡20 s,静置2 min,在4 ℃下离心(12 000 r·min-1)15 min后将上清转移至新的无酶EP管中,随后加入0.5 mL异丙醇,混匀后静置5 min,然后在4 ℃下离心(12 000 r·min-1)10 min后保留沉淀弃去上清并加入1 mL 75%无水乙醇洗涤沉淀,4 ℃下离心(12 000 r·min-1)5 min后弃去上清并置于工作台干燥7 min,最后加入20 μL无酶水溶解RNA沉淀。测定RNA的浓度后并使用1%的琼脂糖凝胶电泳检测RNA的完整性。将符合试验要求的RNA(OD260 nm/OD280 nm在1.8~2.0之间的RNA)取1 μg 根据逆转录试剂盒说明书逆转录为cDNA,逆转录反应体系(20 μL)为:RNA 1 μg,2×RT Buffer Mix 10 μL,20×Enzyme Mix 1 μL, ddH2O补充体系至20 μL,随后在PCR仪上进行逆转录反应程序;逆转录反应程序为42 ℃ 60 min,70 ℃ 5 min,4 ℃终止反应。置于-20 ℃备用。
1.2.2 引物设计和基因表达检测 根据GenBank中牛的GPR35基因序列(登录号:XM_005 205 069.4),使用Primer premier 5软件设计RT-PCR上下游引物以及用于检测脂肪相关标志基因的引物(表1),由上海生物工程股份有限公司合成。利用qRT-PCR检测GPR35过表达和干扰效率以及脂肪相关标志基因的表达。
1.2.3 山羊GPR35基因克隆及测序 以山羊的脾组织cDNA为模板,利用RT-PCR技术扩增得到山羊GPR35基因序列。RT-PCR反应总体系(25 μL)为:2×Super Pfx Master Mix 酶12.5 μL,上游、下游引物各1 μL,cDNA 1 μL,ddH2O 9.5 μL。PCR 扩增程序:98 ℃预变性3 min;98 ℃变性1 min,57 ℃退火15 s,72 ℃延伸20 s,循环数为35次,72 ℃延伸 5 min,4 ℃保温。PCR产物经10 g·L-1琼脂糖凝胶电泳法检测,扩增结果显示出预期大小的条带后,按照胶回收试剂盒的说明书对克隆出的目的基因PCR产物进行回收和纯化,将纯化产物与p Clone007 Versatile Simple Vector载体在25 ℃金属浴中连接5 min,连接产物转化到DH5α感受态细胞中,后将感受态细胞均匀接种到含有氨苄西林(AMP+)抗生素的LB固体培养基上,置于37 ℃恒温培养箱中过夜培养。挑取平板上肉眼可见的单一菌落于干净的离心管中,加入含有氨苄西林(AMP+)抗生素的LB液体培养基置于摇床恒温培养 4~6 h,进行菌液PCR和10 g·L-1琼脂糖凝胶电泳鉴定后,将鉴定结果呈阳性的菌液送至成都擎科生物技术有限公司测序并提取质粒。
1.2.4GPR35基因序列分析 对克隆得到的山羊GPR35序列进行生物信息学分析,分析的项目及使用的工具见表2。
1.2.5GPR35基因组织表达差异性分析 根据克隆得到的山羊GPR35基因完整的CDS区设计上下游引物,以TBP作为内参基因用来矫正基因的相对表达水平[23],以前面提取的组织cDNA为模板进行qRT-PCR,qRT-PCR反应体系:10 μmol·L-1上、下游引物各 0.5 μL,SYBR Premix Ex TaqTM(2×)5 μL,cDNA 0.5 μL,ddH2O 3.5 μL。qRT-PCR反应条件:预变性(95 ℃ 3 min) ;变性(95 ℃ 10 s),退火(60 ℃ 10 s),延伸(72 ℃ 15 s),共 38 个循环。
1.2.6 山羊皮下脂肪细胞培养、转染及诱导分化 将实验室前期保存的皮下前体脂肪细胞复苏后在 CO2培养箱中进行常规培养(90% DMEM/F-12 基础培养基,10%胎牛血清,1%青霉素-链霉素),当细胞融合度达到 80%时进行传代。至F3代时将山羊皮下前体脂肪细胞以8×104个·孔-1接种在6孔板中,24 h后进行转染,每孔转染体系为:2 μg质粒,6 μL转染试剂,400 μL的无血清培养基,混匀后在室温孵育15 min后加入6孔板中。转染12 h更换50 μmol·L-1油酸诱导液,培养48 h后收集细胞。
1.2.7GPR35基因在山羊皮下脂肪细胞不同分化阶段的表达差异分析 细胞接种到12孔板,当细胞融合度达到 80%时用油酸(50 μmol·L-1)诱导液诱导分化,分别收集0、24、48、72、96和120 h 的细胞并提取RNA,反转录成cDNA。利用qRT-PCR 检测GPR35基因在不同分化阶段皮下脂肪细胞中的表达水平,内参基因为UXT[24],qRT-PCR 体系建立及运行程序与组织定量相同。
1.2.8 过表达载体pEGFP-N1-GPR35的构建和干扰序列合成 根据克隆的GPR35基因CDS区序列和pEGFP-N1载体的多克隆位点,选择EcoR Ⅰ和KpnⅠ为上下游酶切位点并设计出亚克隆引物(表2),以上述测序成功的菌液提取的质粒为模板进行亚克隆,PCR体系与程序同上。将亚克隆产物与pEGFP-N1 载体分别进行双酶切并回收纯化,使用T4连接酶将目的基因片段与载体16 ℃过夜连接后转化,挑取阳性菌落并以菌液为模板进行PCR鉴定后测序,对鉴定结果正确的菌液提取质粒。si-GPR35序列(5′→3′)为Sense:AAGGGAGUCU-UGCUCACCUTT和Anti-Sense:AGGUGAGCA-AGACUCCCUUTT,由吉玛基因公司合成。
1.2.9 Bodipy染色、油红O染色及半定量分析 用于染色的细胞以8×103个·孔-1接种在48孔板中,转染体系为:0.25 μg质粒,1 μL转染试剂,50 μL的无血清培养基,其余处理同“1.2.6”。诱导分化48 h后用PBS洗涤细胞2~3次,用4%甲醛固定15 min后用PBS洗涤2~3次。然后在室温下用油红O或Bodipy工作液染色30 min。用PBS洗涤后,用光学显微镜对细胞进行观察和拍照。对Bodipy染色的荧光面积使用ImageJ软件进行量化。对油红O结果进行半定量分析,向每个孔中加入1 mL 100%异丙醇以提取染料,取200 μL提取液加入96孔板中,在490 nm处测定其吸光度。
1.2.10 甘油三酯含量测定 用于甘油三酯含量测定的细胞处理同“1.2.8”所述,收集细胞后按照甘油三酯含量测定试剂盒说明书进行操作。细胞裂解后取10 μL上清与190 μL工作液在96孔板中混匀,随后在550 nm处测定其吸光度。余下的裂解液用BCA试剂盒测定蛋白浓度,以每毫克蛋白浓度校正样本甘油三酯的含量。
1.2.11 统计及分析 qRT-PCR数据采用 2-ΔΔCt进行分析[25]。显著性检验通过SPSS 17 软件中One-way ANOVA 分析的 Games-Howell 检验,利用GraphPad Prism 9.0 绘制山羊GPR35基因的组织表达谱。参照One-way ANOVA法分析结果,对数据进行差异显著性标记,*表示差异显著 (P<0.05) ;**表示差异极显著(P<0.01);所有样本均设置3个生物学样本重复和3个技术重复。
2 结 果
2.1 GPR35基因克隆与序列分析
以山羊的脾组织cDNA为模板,用RT-PCR法体外扩增山羊GPR35基因序列。结果显示克隆得到山羊GPR35基因序列1 167 bp(图1A),包括CDS区906 bp,其终止密码子为TAG,编码301个氨基酸残基(图1B)。通过DNAMAN软件将测序结果与标准序列进行对比后发现,共有6个碱基发生突变,分别为第80位G>C,第222位A>G,第225位G>C,第234位A>G,第244位C>T,第459位G>A(图1C),其对应的氨基酸共有5个发生了突变,分别为第74位R>G,第75位E>Q,第78位K>E,第81位F>L,第153位G>S,将测序序列上传到GenBank,获得基因登录号为ON930035。

A. 山羊GPR35基因克隆结果(M.DL2000 DNA Marker; 1.GPR35 基因);B. 山羊GPR35核苷酸序列及其编码的氨基酸序列(三角形(▲)为丝氨酸磷酸化位点,五角星(★)为苏氨酸磷酸化位点,菱形(◆)为酪氨酸磷酸化位点,ATG为起始密码子,TAG为终止密码子);C. 山羊GPR35突变位点(GPR35克隆序列与NCBI中 GPR35基因标准序列(XM_018040014.1)对比,↓标记处的碱基为突变位点)A. Cloning results of goat GPR35 gene (M.DL2000 DNA Marker; 1.GPR35 gene); B. The nucleotide sequence and encoded amino acid sequence of goat GPR35 (triangle (▲) is serine phosphorylation sites, pentagram (★) is threonine phosphorylation sites, diamond (◆) is tyrosine phosphorylation sites, ATG is the start codon, TAG is the stop codon); C. Goat GPR35 mutation sites (GPR35 clone sequence is compared with the GPR35 gene standard sequence in NCBI (XM_018040014.1), the base at the ↓ mark is the mutation site)图1 GPR35基因克隆、ORF及ORF编码的氨基酸序列、差异性对比结果Fig.1 GPR35 gene cloning, ORF and ORF encoded amino acid sequence, difference comparison results
2.2 GPR35蛋白亲疏水性、磷酸化位点、信号肽及跨膜结构预测分析
通过ProtScale在线工具对GPR35蛋白进行亲疏水性验证,结果如图2A所示,GPR35蛋白中的第200位氨基酸为最低分值(-2.300),故其亲水性最强,第223位氨基酸为最高分值(为3.344),故其疏水性最强。经分析可知该蛋白为疏水性蛋白。

A. 山羊GPR35蛋白亲疏水性预测;B. 山羊GPR35蛋白磷酸位点预测;C. 山羊GPR35信号肽序列预测;D. 山羊GPR35蛋白跨膜结构预测(紫色矩形为跨膜螺旋结构,蓝色线段是位于膜内结构,黄色线段是位于膜外结构)A. Prediction of hydrophilicity and hydrophobicity of goat GPR35 protein; B. Phosphoric acid site prediction of goat GPR35 protein; C. Prediction of GPR35 signal peptide sequence of goat; D. Prediction of the transmembrane structure of goat GPR35 protein(the violet rectangles are the transmembrane helix structure, the blue line segments are the structure inside the membrane, and the yellow line segments are the structure outside the membrane)图2 GPR35亲疏水性、磷酸化位点、信号肽及跨膜结构预测Fig.2 Prediction of GPR35 hydrophilicity and hydrophobicity, phosphorylation site, signal peptide and transmembrane structure
通过在线软件Netphos对GPR35蛋白进行磷酸化位点预测,结果如图1B和2B所示,山羊的GPR35氨基酸序列共有30个潜在的磷酸化位点,其中丝氨酸有17个位点,苏氨酸有12个位点,酪氨酸有1个位点。
利用在线工具signaIP 4.1进行信号肽预测,结果显示GPR35蛋白S平均值为0.211,低于0.5,表示山羊 GPR35蛋白没有信号肽,属于非分泌蛋白(图2C)。通过TMHMM 2.0在线工具对山羊GPR35蛋白跨膜结构预测分析,结果显示该蛋白存在6个跨膜螺旋结构(图2D)。
2.3 GPR35蛋白二级结构、三级结构、理化性质、氨基酸组成及亚细胞定位预测分析
利用SWISS-MODEL对GPR35氨基酸序列进行二级结构预测,结果显示其可能会形成α-螺旋结构的氨基酸有148个(49.17%),可能会形成无规卷曲结构的氨基酸有86个(28.57%),可能会形成延伸链结构的氨基酸有65个(21.59%),可能会形成β转角结构的氨基酸有2个(0.66%)(图3A)。山羊GPR35蛋白三级结构的预测结果如图3B所示。
通过在线工具ExPASy对山羊的氨基酸序列进行理化性质分析,结果表明GPR35由301个氨基酸组成,各种氨基酸占比如图3C所示,其携带负电荷的天冬氨酸和谷氨酸残基15个,而携带正电荷的精氨酸和赖氨酸残基有27个,故山羊GPR35蛋白携带正电。
使用Psort Ⅱ在线工具对GPR35氨基酸序列进行亚细胞定位预测,结果显示其主要分布在细胞膜占52.2%,其次是内质网占21.7%、液泡占13.0%、细胞核占4.3%、高尔基体占4.3%、线粒体占4.3%(图3D)。
2.4 氨基酸序列相似性对比及系统进化树构建
通过NCBI查询不同物种GPR35基因编码的氨基酸序列并进行氨基酸相似性对比,结果发现简州大耳羊的氨基酸序列与绵羊(登录号:XP_027822798.1)、白长角羚(登录号:XP_040087940.1)、马鹿(登录号:XP_043734443.1)、牛(登录号:XP_002686637.1)、水牛(XP_019813588.1)、鼠海豚(登陆号:XP_032492598.1)、人(登录号:AAI17454.2)的氨基酸序列相似性分别达到98.34%、95.68%、86.36%、86.75%、87.40%、77.91%、68.68%(图4A)。表明山羊GPR35与绵羊、白长角羚同源性最高,该蛋白在这两个物种间有较高保守性。
使用MEGA7.0软件构建系统进化树,结果如图4B所示,山羊GPR35与绵羊的亲缘关系最为接近,而牛、长白角羚与羊类都为反刍动物,故处于进化树同一分支上,与人的亲缘关系最远,说明GPR35在反刍动物中具有较高的保守性,符合物种的进化规律。
2.5 组织表达结果分析
为探究GPR35基因在不同组织中的表达水平,利用qRT-PCR技术来检测该基因在山羊内脏组织(心脏、肝脏、脾脏、肺脏、肾脏、瘤胃、大肠、小肠),肌肉组织(背最长肌、股二头肌、臂三头肌、咬肌)以及脂肪组织(内脏脂肪、皮下脂肪、肌间脂肪、肠系膜脂肪、心包膜脂肪)的表达水平。结果显示,在山羊各组织中均检测到GPR35基因的表达,其在背最长肌中的表达显著高于山羊的其它肌肉组织(P<0.01,图5A);在皮下脂肪中的表达显著高于山羊的其它脂肪组织(P<0.01,图5B);在脾脏中的表达显著高于山羊的其它内脏组织(P<0.01,图5C)。
2.6 时序表达结果分析
因山羊GPR35基因在皮下脂肪组织中表达量较高,故采用qRT-PCR技术检测其在山羊皮下脂肪细胞分化过程中的表达。结果如图6所示,与诱导分化前相比(0 h),山羊GPR35基因的相对表达量均呈上调趋势,其中48、72、120 h极显著上调(P<0.01),推测GPR35可能参与调控山羊皮下前体脂肪细胞分化。

图6 GPR35基因时序表达图谱Fig.6 Time series expression results of goat GPR35 gene
2.7 过表达GPR35抑制山羊皮下前体脂肪细胞分化
qRT-PCR检测结果显示,过表达(OE)组GPR35基因的表达量上调约为对照(NC)组的104倍(图7A)。油红O染色和Bodipy染色结果显示,过表达GPR35后OE组的皮下脂肪细胞脂滴含量和聚集程度明显下降(图7B,图7C),油红O染色量化结果显示OE组的490 nm吸光值显著极降低(图7D),Bodipy染色量化结果显示OE组的相对荧光面积极显著降低(图7E),甘油三酯含量检测结果显示OE组的甘油三酯相对含量极显著降低(图7F)。过表达GPR35后标志基因检测结果显示,甘油三酯合成标志基因AP2、SREBP1表达极显著下调(图7G),甘油三酯分解代谢标志基因HSL表达极显著上调(图7H),脂肪分化标志基因C/EBPα、C/EBPβ、PPARγ表达极显著下调(图7I)。综上所述,过表达GPR35抑制山羊皮下前体脂肪细胞分化。
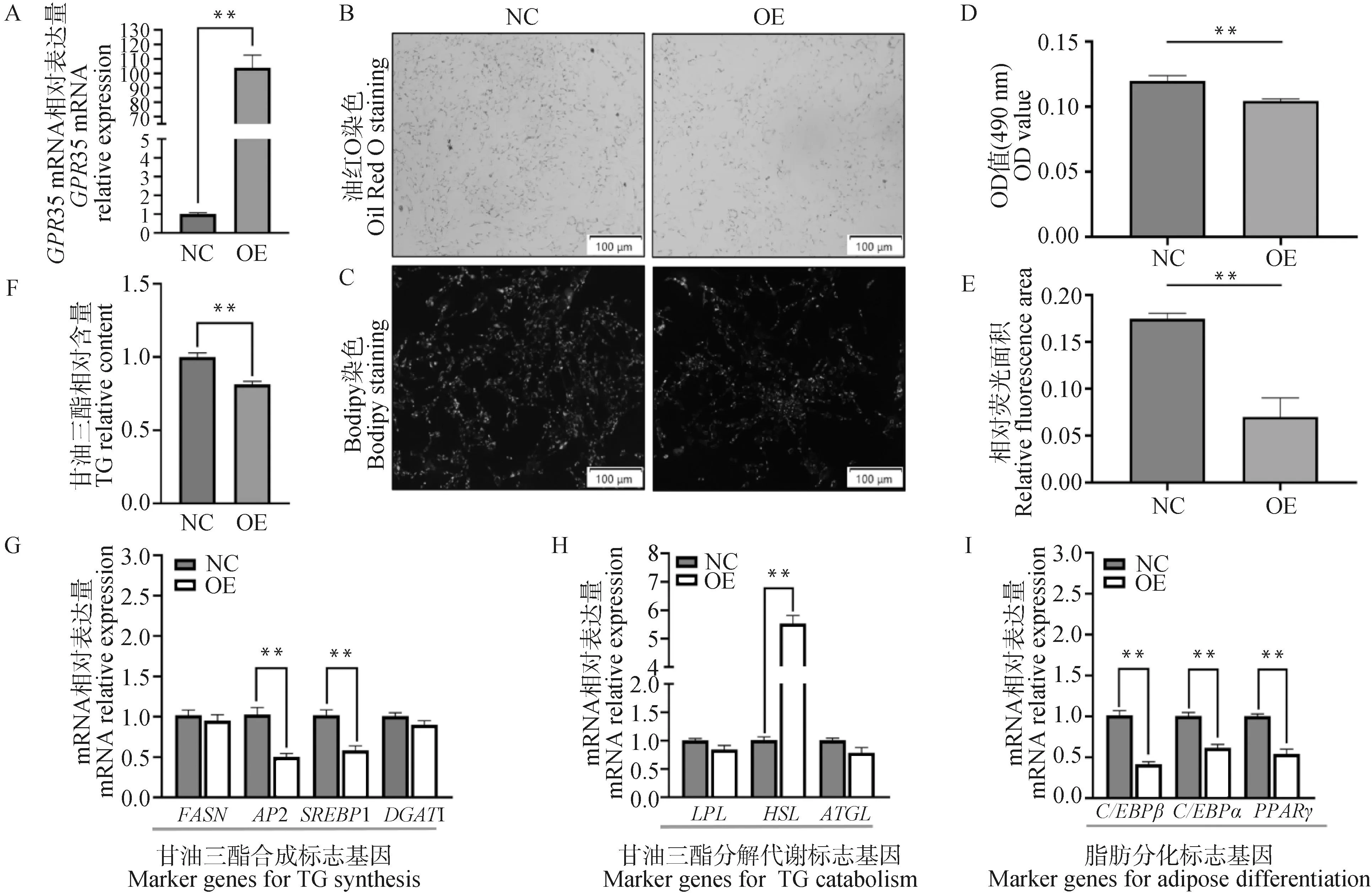
A.GPR35过表达效率检测;B. 油红O染色结果(100×);C. Bodipy染色结果(100×);D. 油红量化OD值;E. Bodipy相对荧光面积;F. 甘油三酯相对含量;G.甘油三酯合成标志基因的表达;H.甘油三酯分解代谢标志基因的表达;I.脂肪分化标志基因的表达A. GPR35 overexpression efficiency detection; B. Oil Red O staining results (100×); C. Bodipy staining (100×); D. OD value quantified by Oil Red; E. Relative fluorescence area of Bodipy; F. Relative triglyceride content; G. The expression of marker genes for triglyceride synthesis; H. The expression of marker genes for triglyceride catabolism; I. The expression of marker genes for adipose differentiation图7 过表达GPR35对皮下脂肪细胞分化的影响Fig.7 The influence of overexpression of GPR35 on subcutaneous adipocytes differentiation
2.8 干扰GPR35促进山羊皮下前体脂肪细胞分化
qRT-PCR检测结果显示,转染Si-GPR35组的细胞干扰效率约为47%(图8A)。油红O染色和Bodipy染色结果显示干扰GPR35后Si-GPR35组的皮下脂肪细胞脂滴含量和聚集程度明显升高(图8B,图8C),油红O染色量化结果显示Si-GPR35组的490 nm吸光值显著升高(图8D),Bodipy染色量化结果显示Si-GPR35组的相对荧光面积极显著升高(图8E),甘油三酯含量检测结果显示Si-GPR35组的甘油三酯相对含量极显著升高(图8F)。干扰GPR35后,甘油三酯合成标志基因AP2、SREBP1、DGAT1表达极显著上调,FASN表达极显著下调(图8G),脂肪分化标志基因C/EBPα、C/EBPβ表达极显著上调(图8I)。综上所述,干扰GPR35促进山羊皮下前体脂肪细胞分化。
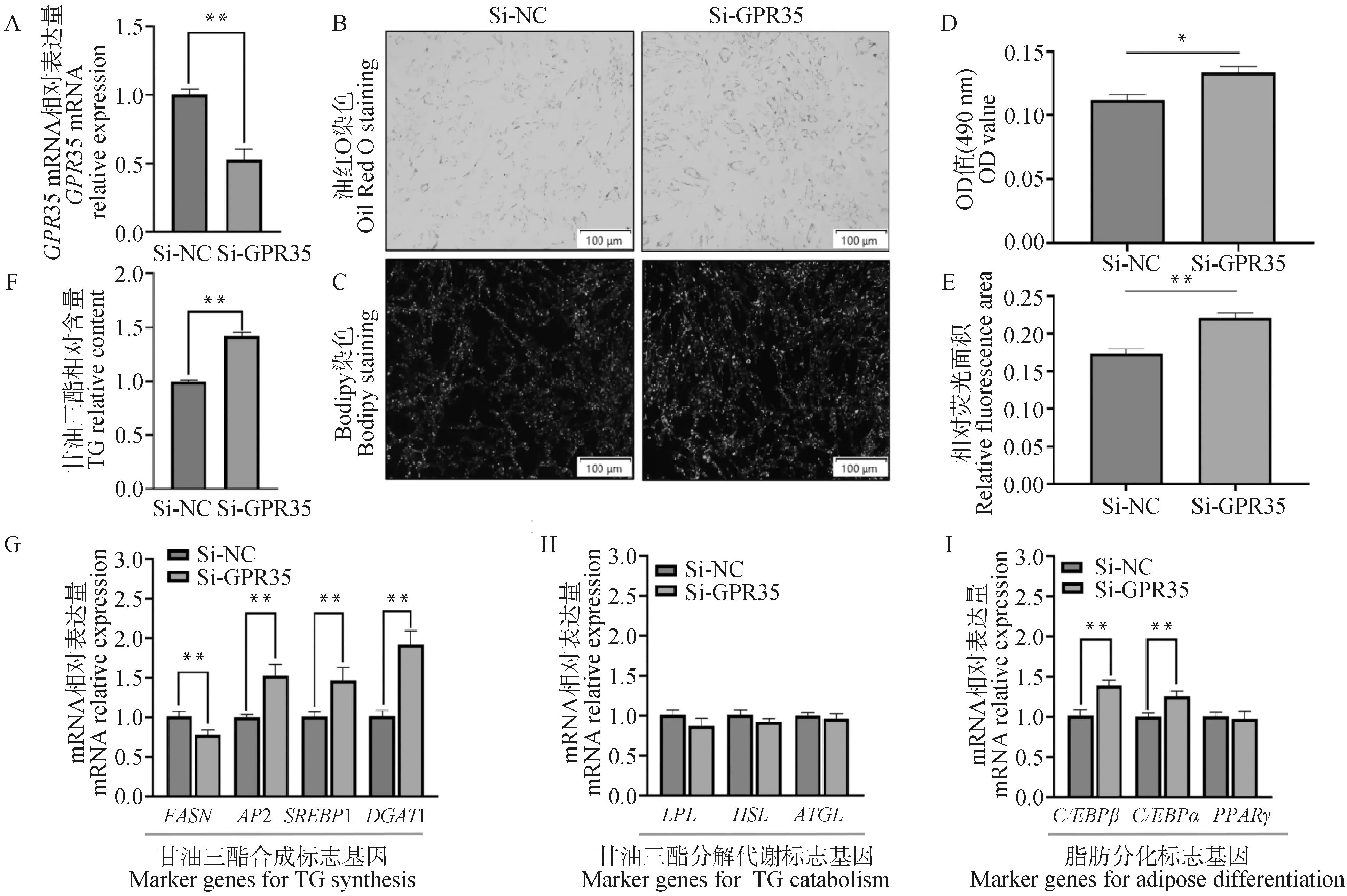
A.GPR35干扰效率检测;B. 油红O染色结果(100×);C. Bodipy染色结果(100×);D. 油红量化OD值;E. Bodipy相对荧光面积;F. 甘油三酯相对含量;G.甘油三酯合成标志基因表达;H.甘油三酯分解代谢标志基因表达;I.脂肪分化标志基因表达A. GPR35 overexpression efficiency detection; B. Oil Red O staining results (100×); C. Bodipy staining results(100×); D. OD value quantified by Oil Red; E. Relative fluorescence area of Bodipy; F. Relative triglyceride content; G. The expression of marker genes for triglyceride synthesis; H. The expression of marker genes for triglyceride catabolism; I. The expression of marker genes for adipose differentiation图8 干扰GPR35对皮下脂肪分化的影响Fig.8 The influence of interfering GPR35 on subcutaneous adipocytes differentiation
2.9 蛋白互作预测
为了探究GPR35调控山羊皮下脂肪细胞分化的分子机制,利用STRING在线网站进行蛋白作用分析,结果显示山羊GPR35蛋白可能与CXCL17、KYAT1、KYNU、KMO、ARRB2、BCNT、CAPN10、RNPEPL1、WDR64、ST6GAL2等蛋白间存在相互作用(图9)。

图9 蛋白互作预测Fig.9 Protein interaction prediction
3 讨 论
据报道,人GPR35基因定位于染色体2q37.3上,分为GPR35a和GPR35b两个转录异构体,其中GPR35a亚型cDNA全长930 bp,编码309个氨基酸[26-27]。本研究以简州大耳羊脾组织为模板,以亲缘物种牛GPR35基因的mRNA序列为参照设计引物,并成功克隆简州大耳羊GPR35基因序列,其中CDS区长906 bp,共编码301个氨基酸残基,说明该基因在人与山羊间存在一定的差异性。磷酸化位点预测表明山羊GPR35蛋白存在多个潜在的磷酸化位点,而蛋白质磷酸化在细胞信号转导过程中有着重要作用,这与G蛋白偶联受体激活并介导下游信号通路密切相关[28-29]。同时亚细胞定位和跨膜结构预测表明该蛋白可能是一个位于细胞膜上且功能活跃的跨膜蛋白,该结果与G蛋白偶联受体家族被报道为一大类膜受体统称一致[30]。
Shore和Reggio[31]研究表明,GPR35基因在人的肾上腺、胃肠道、肺、肝、子宫、膀胱、肾脏等组织中均有表达。为了探究GPR35基因在山羊各组织中的表达规律,利用qRT-PCR技术对山羊内脏组织、肌肉组织、脂肪组织进行检测分析。结果表明,该基因在所检测的17种组织中均有表达,因此该基因具有广谱表达的特征,该结果与前人研究结果一致。该基因在脾脏组织的相对表达量最高,而在大肠、小肠以及瘤胃中较低,这与Okumura等[32]的研究表明的GPR35高表达于人的肠胃和肺中存在差异,推测是该基因在不同物种中具有表达差异性。
前人的相关研究表明,GPR35对脂肪有一定的调控作用,如在GPR35被敲除的小鼠肝细胞中基础脂质水平升高,GPR35抑制肝细胞中的脂质积聚[33],同时有研究表明敲除小鼠的GPR35基因会减少小鼠运动诱导的脂肪组织褐变[19]。脂肪主要分为白色脂肪和褐色脂肪,脂肪组织褐变即让白色脂肪变为褐色脂肪,而褐色脂肪负责产热和耗能,能够有效降低葡萄糖和脂质水平[34]。在山羊中肌内脂肪的含量与肉质风味呈正相关,脂肪沉积的顺序为内脏脂肪、皮下脂肪,最后是肌间和肌内脂肪[34-36]。因此综合前人的研究,猜想该基因在山羊上可能具有同样的效果,即GPR35基因可能对山羊皮下脂肪细胞分化存在调控作用。构建的山羊皮下脂肪时序表达谱的结果表明,与诱导分化前相比(0 h),诱导分化后山羊GPR35基因的相对表达量呈上调趋势,因此推测其对山羊皮下脂肪细胞分化有一定的调控作用。
为探究GPR35在山羊皮下脂肪细胞分化过程中发挥的具体作用,本试验过表达山羊GPR35后发现皮下脂肪细胞脂滴含量和聚集程度明显下降。而干扰GPR35后皮下脂肪细胞脂滴含量和聚集程度明显提升,该结果与前人的研究结果一致,即GPR35的表达会抑制脂质的积累和生成[19,33]。C/EBPα和C/EBPβ为CCAAT-增强子结合蛋白家族的一员[37],该家族和过氧化物酶体增殖物激活受体(PPAR)家族在脂肪分化过程中具有促进作用,其中C/EBPα与PPARγ在脂肪分化过程中协同作用通过上调LPL、FABP4、PLIN1的表达来促进脂肪细胞分化,而C/EBPβ参与PPARγ的诱导表达[38-40],即C/EBPα、C/EBPβ、PPARγ的表达与脂肪细胞的分化呈正相关。SREBP1是类固醇调节元件结合蛋白家族的一员,该家族与胆固醇、脂肪酸、三酰甘油和磷脂合成息息相关,在脂肪细胞中过表达SREBP1会导致细胞的甘油三酯水平升高,降低胰岛素的作用,该基因的表达与脂肪生成呈正相关[41]。AP2被称为脂肪酸结合蛋白4(FABP4),在小鼠和兔中敲除FABP4会减少高脂环境诱导的肥胖模型相关代谢功能对其的影响并增加其对胰岛素的敏感性[42-43]。本研究在过表达和干扰GPR35后,C/EBPα、C/EBPβ、AP2、SREBP1的表达量分别显著下调和上调,该结果表明GPR35对山羊皮下脂肪细胞分化存在抑制作用,该作用可能是通过调控C/EBPα、C/EBPβ、AP2、SREBP1的表达来实现的,但其具体的调控机制还需进一步试验来探究。
为进一步探索GPR35抑制山羊皮下前体脂肪细胞分化的作用机制,利用STRING在线网站进行蛋白互作预测分析,结果显示GPR35蛋白可能与CXCL17 、KYNU、KYAT1等蛋白存在相互作用。值得关注的是作为GPR35配体的CXCL17在蛋白互作预测显示它们存在相互作用,因此推测山羊GPR35可能与CXCL17通过蛋白互作调节山羊脂肪细胞分化。而山羊CXCL17是否会对脂肪细胞分化有影响以及CXCL17和GPR35是否会共同调控脂肪细胞的分化还未知,这也是本课题组下一步研究的方向。
4 结 论
总而言之,本研究试验结果表明过表达山羊GPR35基因抑制山羊皮下脂肪细胞的分化,干扰山羊GPR35基因促进山羊皮下脂肪细胞的分化,GPR35是山羊皮下脂肪细胞分化过程中的一个负向调控因子,这种作用可能是通过调控C/EBPα、C/EBPβ、AP2、SREBP1的表达或与CXCL17蛋白相互作用来实现的。本试验结果将为深入研究山羊脂肪细胞脂质沉积和分子育种提供基础,为完善山羊GPR35的调控网络与机制提供新的理论依据。

