ALOX15B-JNK在热应激诱导支持细胞氧化应激和凋亡中的作用
薛鸿雁,杨孟雨,杨 欢,董丽君,蔡霞清,赵泽民,王鲜忠
(西南大学动物医学院,重庆 400715)
睾丸支持细胞(sertoli cells,SCs)为精子的生成提供了必需的营养和结构支持[1],睾丸支持细胞的数量决定了精子的数量[2]。脂质代谢在睾丸支持细胞中发挥了重要作用[3]。SCs中氧化还原反应失衡时,可促使细胞内脂质和不饱和脂肪酸进行氧化反应形成大量的脂质过氧化物[4]。热应激是影响养猪产业的重要因素,对公猪生精功能影响很大[5-6]。越来越多的证据表明,热应激促进了脂质过氧化物的产生[7-8],而过量脂质过氧化物的生成会影响细胞的存活[9]。在脂质过氧化物的产生过程中,花生四烯酸脂氧合酶(arachidonic acid lipoxygenase, ALOX)发挥了重要作用[10]。ALOX广泛存在于哺乳动物体内,哺乳动物体内有包括花生四烯酸脂氧合酶15B(arachidonic acid lipoxygenase 15-lipoxygenase type B, ALOX15B)等6个类型,能够对细胞中花生四烯酸等多不饱和脂肪酸进行双加氧反应, 产生8-HETE、15-HETE等脂质过氧化物[11]。在脂质过氧化物及其副产物MDA的共同作用下可诱发ROS的进一步聚集[12],而大量的ROS也加速了细胞凋亡。但ALOX15B在热应激条件下是否诱发氧化应激并影响睾丸支持细胞凋亡尚不清楚。
c-Jun氨基末端激酶(jun amino terminal kinase, JNK)是MAPK家族的成员之一[13],也是参与细胞凋亡的重要因子[14],在热应激条件下被激活[15]。抑制花生四烯酸脂氧合酶12可减少12-HETE的产生并抑制JNK依赖性凋亡[16]。p53作为肿瘤抑制因子,在睾丸组织高度表达并影响生精细胞的生存[17],在JNK信号通路下游受其调控进而影响凋亡[18]。然而,在热应激条件下,ALOX15B通过JNK信号通路影响睾丸支持细胞凋亡的机制还需进一步探究。胆囊收缩素引起的肝脏炎症过程中,抑制JNK信号通路降低了12-LOX的表达与12-HETE的含量[19]。但在JNK信号通路参与热应激下ALOX15B调节支持细胞凋亡中是否存在反馈作用还需进一步验证。
本试验利用体外培养的仔猪睾丸支持细胞的热应激模型研究ALOX15B对氧化应激以及细胞凋亡的影响,及JNK在ALOX15B诱导细胞凋亡中的作用,进一步探寻JNK对ALOX15B和8-HETE、15-HETE与氧化应激是否存在反馈作用。深入理解热应激下JNK在ALOX15B影响支持细胞凋亡调控中的作用机制。
1 材料与方法
1.1 材料
1.1.1 试验动物 睾丸组织采自重庆北碚某猪场3周龄的三元仔猪,取睾丸组织置于含有5%青霉素与链霉素的PBS中,使用4 ℃冰盒进行运输,在2 h之内带回实验室,以便后续细胞的体外分离培养。
1.1.2 试验试剂 胎牛血清(FBS)、DMEM/F12培养基、青链霉素(Gibco公司);磷酸盐缓冲液(Phosphate Buffered Saline, PBS)粉末(武汉赛维尔生物科技有限公司);Lipofectamine2000转染试剂(Invitrogen公司);Annexin V-FITC/PI细胞凋亡双染试剂盒(北京索莱宝科技有限公司);RIPA裂解液(Thermo Scientific公司);ECL化学发光液(Millipore公司);BCA试剂盒、活性氧检测试剂盒、山羊抗鼠二抗、山羊抗兔二抗(上海碧云天生物技术公司);β-actin一抗(北京博奥森生物技术公司);ALOX15B一抗、p53一抗(武汉三鹰生物技术公司);JNK一抗、磷酸化JNK一抗(Santa Cruz公司);猪8-HETE ELISA检测试剂盒、猪15-HETE ELISA检测试剂盒(上海凡科维生物公司);丙二醛检测试剂盒(南京建成生物工程研究所有限公司);SP600125(Sigma公司)。黄芩素(上海陶素生化科技有限公司);磷酸酶抑制剂、蛋白酶抑制剂(MCE公司)。其余试剂均为国产分析试剂。
1.2 方法
1.2.1 细胞的培养与处理 睾丸支持细胞的分离按照本实验室前期方法进行操作[20],当细胞纯度鉴定为90%,即可用于后续试验。睾丸支持细胞置于含有10%FBS的DMEM/F12培养基中,在含有5%CO2的32 ℃恒温培养箱中培养。把睾丸支持细胞接种于6孔板,培养48 h后,弃去培养基,每孔加入1 mL的PBS洗涤后,用不同抑制剂或者转染相应时间,在44 ℃恒温培养箱中热处理30 min后进行相关试验。
1.2.2 ALOX15B的siRNA转染 ALOX15B的两对siRNA序列如表1所示。将分离后的睾丸支持细胞(1×106个·mL-1)接种于6孔板,培养24 h,当细胞密度达到60%~80%时即可进行转染。转染前2 h,去除完全培养基,加入无血清培养基使细胞处于饥饿状态利于后续转染。首先,按照每孔7 μL的siRNA与250 μL的Opiti-MEM培养基混合、每孔5 μL的siRNA和250 μL的Opiti-MEM培养基混合,在37 ℃下孵育5 min后,将含有siRNA和Lipofectamine 2000的Opiti-MEM培养基混合,在37 ℃下再继续孵育20 min,然后分别将500 μL的混合液体加入到每个孔中。转染8 h后更换培养基,然后继续培养56 h后,在44 ℃恒温培养箱中热处理30 min(热应激模型)后对相应物质进行分析。
1.2.3 细胞凋亡的检测 睾丸支持细胞进行相应处理后,用0.25%胰酶消化细胞2 min,300 g离心5 min,弃上清。然后用1 mL的Binding Buffer重悬细胞沉淀,300 g离心10 min。用1 mL的Binding Buffer缓冲液轻轻重悬细胞沉淀。然后,取100 μL以上液体(细胞数达1×106个·mL-1)混合5 μL的V-FITC,25 ℃孵育20 min,在检测之前,样本轻轻混合5 μL的PI溶液,25 ℃孵育5 min。再加入400 μL的PBS溶液充分混匀,用流式细胞仪1 h内进行检测。
1.2.4 蛋白表达的检测 用含有1%磷酸酶抑制剂与1%蛋白酶抑制剂的RIPA裂解液提取睾丸支持细胞的蛋白,用BCA试剂盒测定总的蛋白浓度,在8%~12%SDS-PAGE聚丙酰胺凝胶电泳后分离蛋白,将蛋白转移PVDF膜。用5%脱脂牛奶或5%牛血清白蛋白孵育膜2 h,然后用一抗在4 ℃孵育过夜。与山羊抗兔或山羊抗小鼠二抗25 ℃孵育2 h后,使用ECL发光液在凝胶成像系统中显影。
1.2.5 ROS水平检测 用96孔板培养细胞,当细胞按照试验要求进行处理后,用冷的PBS溶液清洗细胞3次。按照制造商说明书进行操作,以ROS荧光探针:无血清培养基=1∶1 500的比例进行稀释荧光探针,每个孔加入100 μL的含ROS荧光探针的培养基,在37 ℃避光孵育2 h。弃去原有培养基,加入100 μL新鲜的无血清培养基。用荧光酶标仪在激发波长488 nm,发射波长525 nm处测量荧光值。
1.2.6 MDA水平检测 当细胞按照试验要求进行处理后,用冷的PBS溶液清洗细胞3次。按照制造商说明书,每个培养皿加入100 μL的MDA裂解液,用超声波破碎仪将细胞完全破碎。设置空白组、标准品组和试验组。再向各个管子中加入1 mL的MDA工作液。在95 ℃水浴中煮沸40 min。3 000×g离心10 min,取上清200 μL加入96孔酶标管中,在酶标仪的532 nm处检测吸光度。
1.2.7 脂质过氧化物检测 细胞(细胞计数为1×106个·mL-1)裂解于200 μL的PBS中,超声破碎获得上清液,7 260×g离心10 min。50 μL的标准样品加入标准孔。10 μL的上清液溶于40 μL样品稀释液中。每孔用100 μL酶标试剂,37 ℃孵育60 min。每孔清洗5次后,加入显色剂A、B各50 μL,37 ℃孵育15 min。每孔中加入50 μL的终止液,在15 min内用酶标仪450 nm处检测样品的吸光度。
1.3 统计分析
运用GraphPad Prism和SPSS25进行统计分析。单因素方差分析用于分析3个组以上的数据。采用Tukey试验多重比较各组间的差异。所有数据均以“平均值±SEM”表示。P<0.05被认为是有统计学意义即差异显著,P<0.01被认为是差异极显著。
2 结 果
2.1 黄芩素对热应激条件下脂质过氧化物、氧化应激水平与细胞凋亡的影响
热应激后睾丸支持细胞中8-HETE和15-HETE的水平上升,与对照组相比,分别升高了53.37%(P<0.01)、42.25%(P<0.01);与热应激组相比,黄芩素与热应激共同作用下8-HETE和15-HETE的水平分别下降了15.13%(P<0.01)、62.10%(P<0.01)(图1A、1B)。从图1C、1D可以看出,热应激提高了睾丸支持细胞中MDA与ROS水平,与对照组相比,分别升高了32.32%(P<0.01)、422.82%(P<0.01);与热应激组相比,在黄芩素与热应激共同作用下MDA、ROS的水平分别下降了65.31%(P<0.01)、43.60%(P<0.01)。图1E结果显示,与对照组相比,热应激组的细胞凋亡率显著提高了475.77%(P<0.01); 黄芩素与热应激共同作用于睾丸支持细胞后凋亡率发生了显著的下降,相比于热应激组,降低了318.97%(P<0.01)。
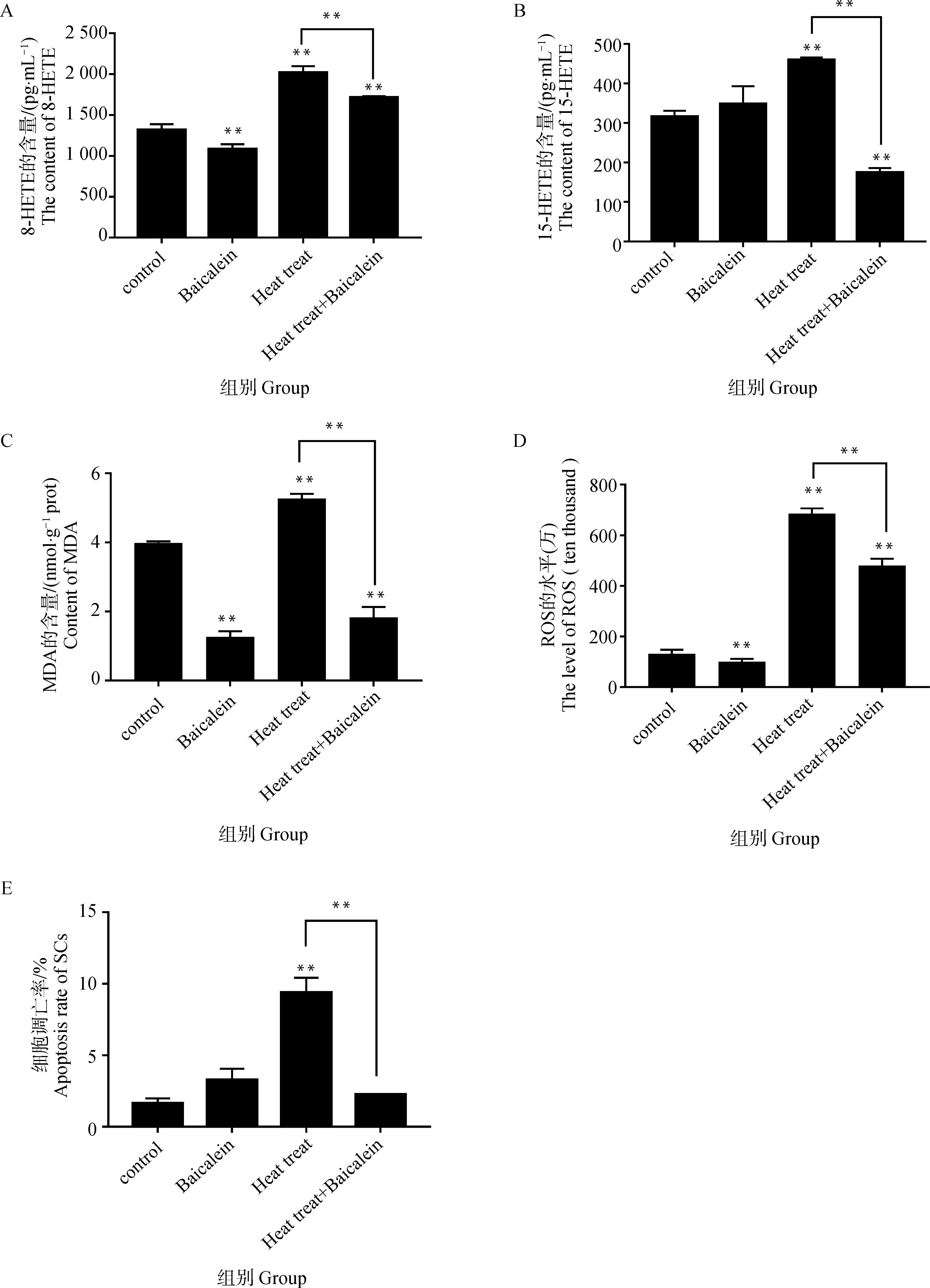
A.黄芩素对热应激条件下8-HETE含量的影响;B.黄芩素对热应激条件下15-HETE含量的影响;C.黄芩素对热应激条件下MDA的影响;D.黄芩素对热应激条件下ROS的影响;E.黄芩素对热应激条件下睾丸支持细胞凋亡的影响。*. P<0.05;**. P<0.01;无标注表示P>0.05,下同A.Effects of baicalein on the content of 8-HETE under heat stress; B. Effects of baicalein on the content of 15-HETE under heat stress; C.Effect of baicalein on MDA under heat stress; D.Effects of baicalein on ROS under heat stress; E. Effects of baicalein on apoptosis of sertoli cells under heat stress. *. P<0.05;**. P<0.01; Unlabeled indicates no significant difference (P>0.05), the same as below图1 黄芩素对热应激条件下脂质过氧化物、氧化应激水平与细胞凋亡的影响Fig.1 Effects of baicalein on lipid peroxides, oxidative stress levels and cell apoptosis under heat stress
2.2 黄芩素和 ALOX15B的siRNA对热应激条件下JNK激活的影响
从图2A可以看出,热处理显著提高了磷酸化JNK的蛋白水平。与对照组相比,磷酸化JNK提高了30.15%(P<0.01)。与单独热处理组相比,50 μM的黄芩素使热处理条件下支持细胞中磷酸化JNK的蛋白水平降低了34.11%(P<0.01)。为了进一步验证ALOX15B对热处理条件下JNK激活的影响,通过siRNA抑制ALOX15B表达,图2B结果发现,ALOX15B的siRNA1和siRNA2也有类似的效果,与热处理组相比,二者使磷酸化JNK的蛋白水平分别下降了59.72%(P<0.01)、33.46%(P<0.01)。
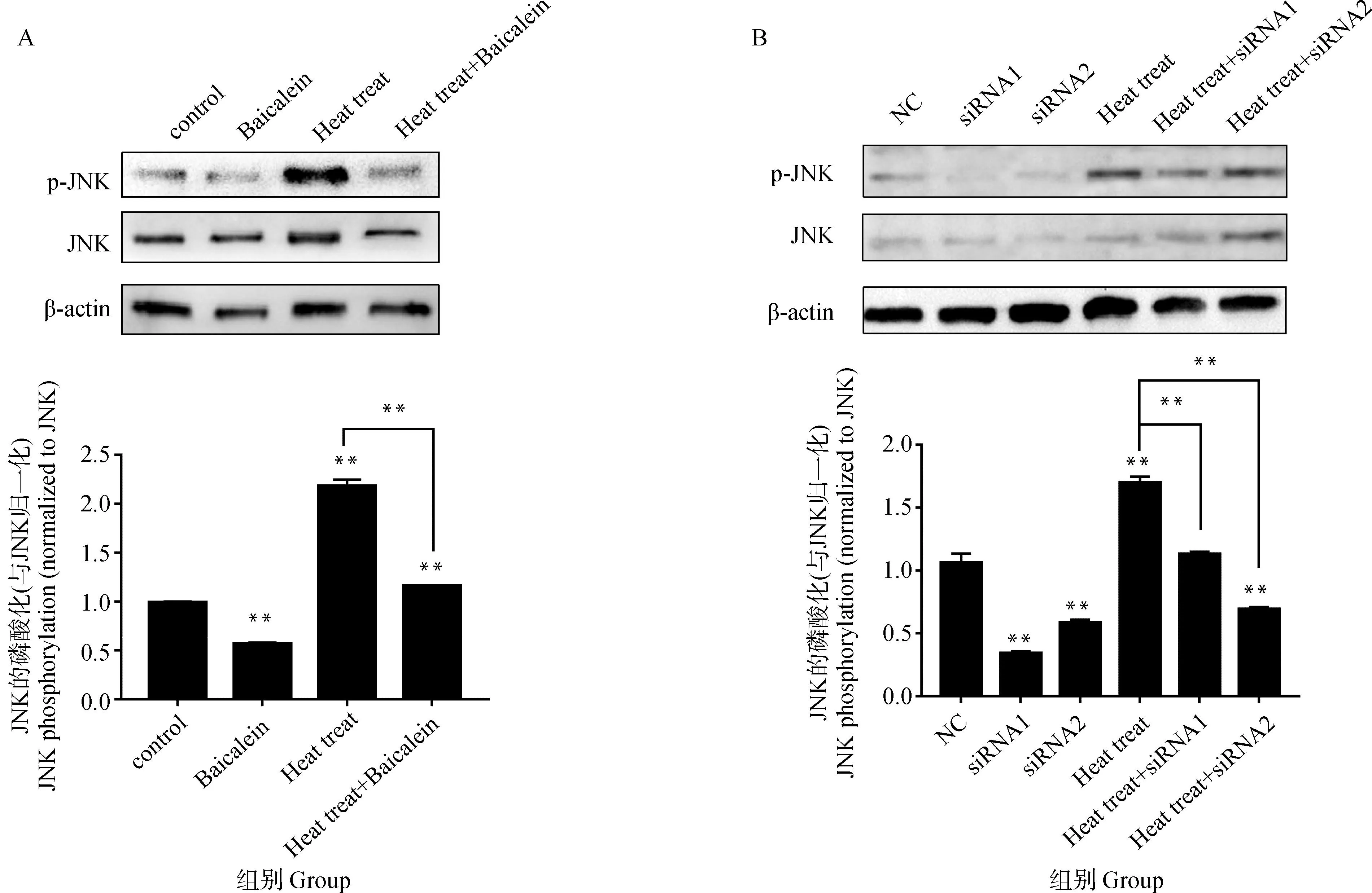
A.黄芩素对热应激条件下支持细胞中JNK和磷酸化JNK的蛋白水平的影响;B.ALOX15B的siRNA对热应激条件下支持细胞中JNK和磷酸化JNK的蛋白水平的影响A.Effects of baicalein on JNK and phosphorylated JNK protein levels in sertoli cells under heat stress; B.Effects of ALOX15B siRNA on levels of JNK and phosphorylated JNK proteins in sertoli cells under heat stress图2 黄芩素与ALOX15B siRNA对热应激条件下JNK激活的影响Fig.2 Effects of baicalein and ALOX15B siRNA on JNK activation under heat stress
2.3 JNK抑制剂SP600125对热应激条件下JNK激活、p53和细胞凋亡的影响
从图3A可以看出,与对照组相比,SP600125降低了磷酸化JNK的蛋白水平,降低了57.33%(P<0.01)。SP600125与热应激的共同作用也减少了磷酸化JNK的蛋白水平,与单独热应激组相比,降低了46.72%(P<0.01);热应激提高了p53的蛋白水平,与对照组相比,上升了89.16%(P<0.01)。与热应激组相比,p53的蛋白水平在SP600125和热应激的共同作用下,降低了16.97%(P<0.01)。从图3B可以看出,与对照组相比,热应激组的细胞的凋亡率显著提高了475.77%(P<0.01)。与单独热应激组相比,SP600125和热应激的共同作用下的细胞凋亡率显著降低了133.17%(P<0.01)。
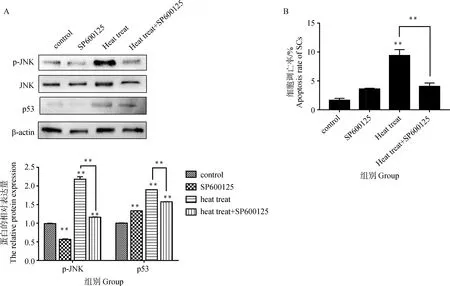
A.SP600125对热应激条件下睾丸支持细胞中JNK、磷酸化JNK和p53蛋白水平的影响;B.SP600125对热应激条件下睾丸支持细胞凋亡率的统计图A.Effects of SP600125 on JNK, phosphorylated JNK and p53 protein levels in sertoli cells under heat stress; B.Statistical graph of the apoptosis rate of sertoli cells by SP600125 protein levels under heat stress图3 SP600125对热应激条件下睾丸支持细胞中JNK激活、p53和细胞凋亡的影响Fig.3 Effects of SP600125 on JNK activation, p53 and apoptosis in Sertoli cells under heat stress
2.4 JNK抑制剂SP600125对热应激条件下ALOX15B蛋白表达与脂质过氧化物8-HETE、15-HETE的影响
从图4A可以看出,热应激提高了ALOX15B的蛋白水平,与对照组相比,上升了103.10%(P<0.01);SP600125与热应激共同作用下睾丸支持细胞中ALOX15B的蛋白水平发生了显著的下降,与热应激组相比,ALOX15B的蛋白水平降低了45.89%(P<0.01)。从图4B、4C可以看出,热应激提高了细胞中脂质过氧化物8-HETE、15-HETE的含量,与对照组相比,分别提升了37.89%(P<0.01)、13.86%(P<0.05);与热应激组相比,SP600125和热应激的共同作用下,ALOX15B的脂质过氧化物8-HETE、15-HETE的含量分别降低了16.48%(P<0.01)、13.47%(P<0.05)。
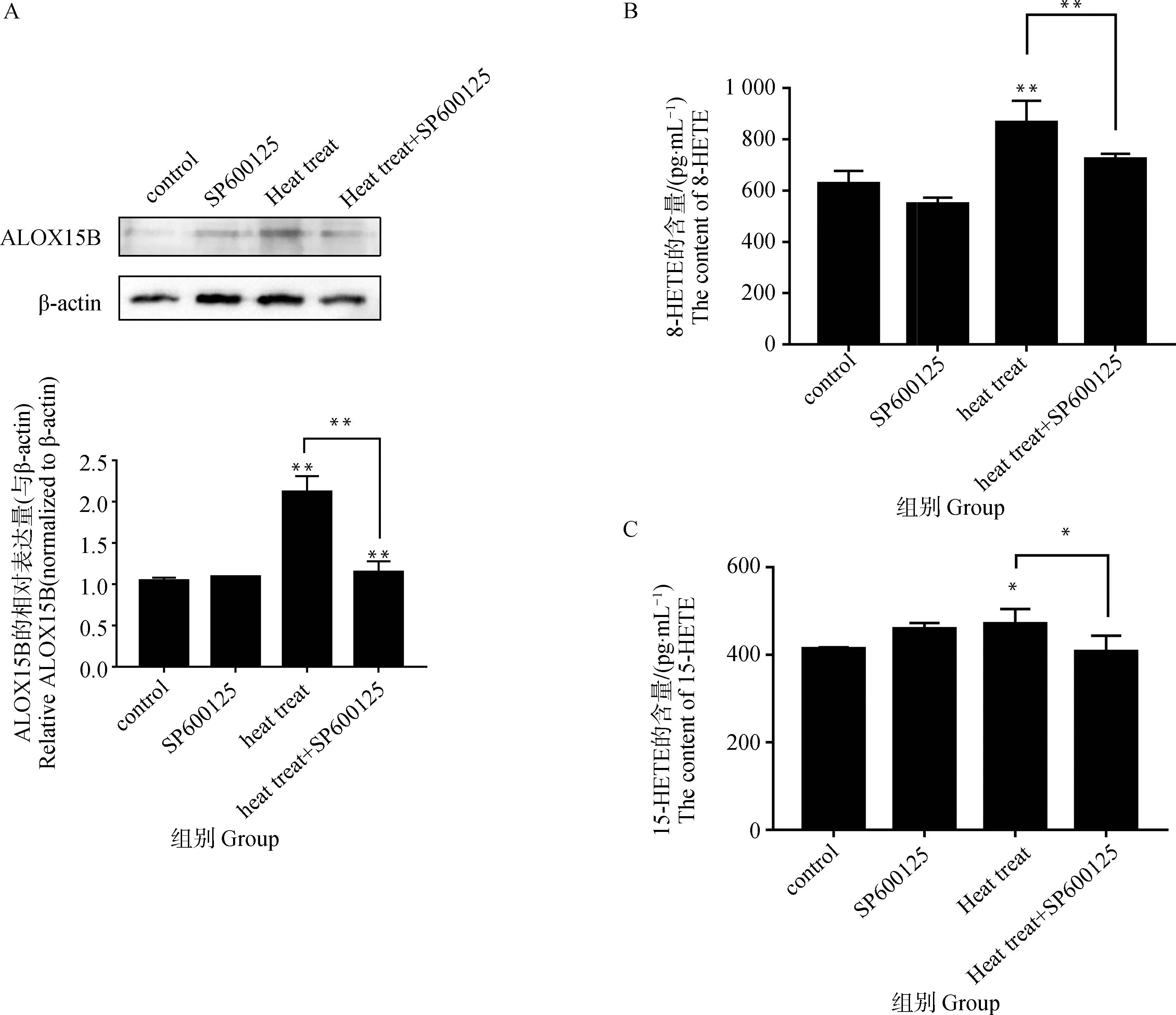
A.SP600125对热应激条件下睾丸支持细胞中ALOX15B蛋白水平的影响;B.SP600125对热应激条件下睾丸支持细胞中8-HETE含量的影响;C.SP600125对热应激条件下睾丸支持细胞中15-HETE含量的影响A.Effects of SP600125 on ALOX15B protein levels in sertoli cells under heat stress; B.Effects of SP600125 on the content of 8-HETE in sertoli cells under heat stress; C.Effects of SP600125 on the content of 15-HETE in sertoli cells under heat stress图4 SP600125对热应激条件下睾丸支持细胞中ALOX15B蛋白水平、8-HETE与15-HETE的影响Fig.4 Effects of SP600125 on ALOX15B protein levels, 8-HETE and 15-HETE in sertoli cells under heat stress
2.5 JNK抑制剂SP600125对热应激条件下MDA、ROS的影响
从图5A、5B可以看出,与热应激组相比,SP600125和热应激的共同作用下细胞中MDA和ROS都发生了显著的下降,MDA水平降低了21.15%(P<0.01),ROS的水平降低了205.35%(P<0.01)。
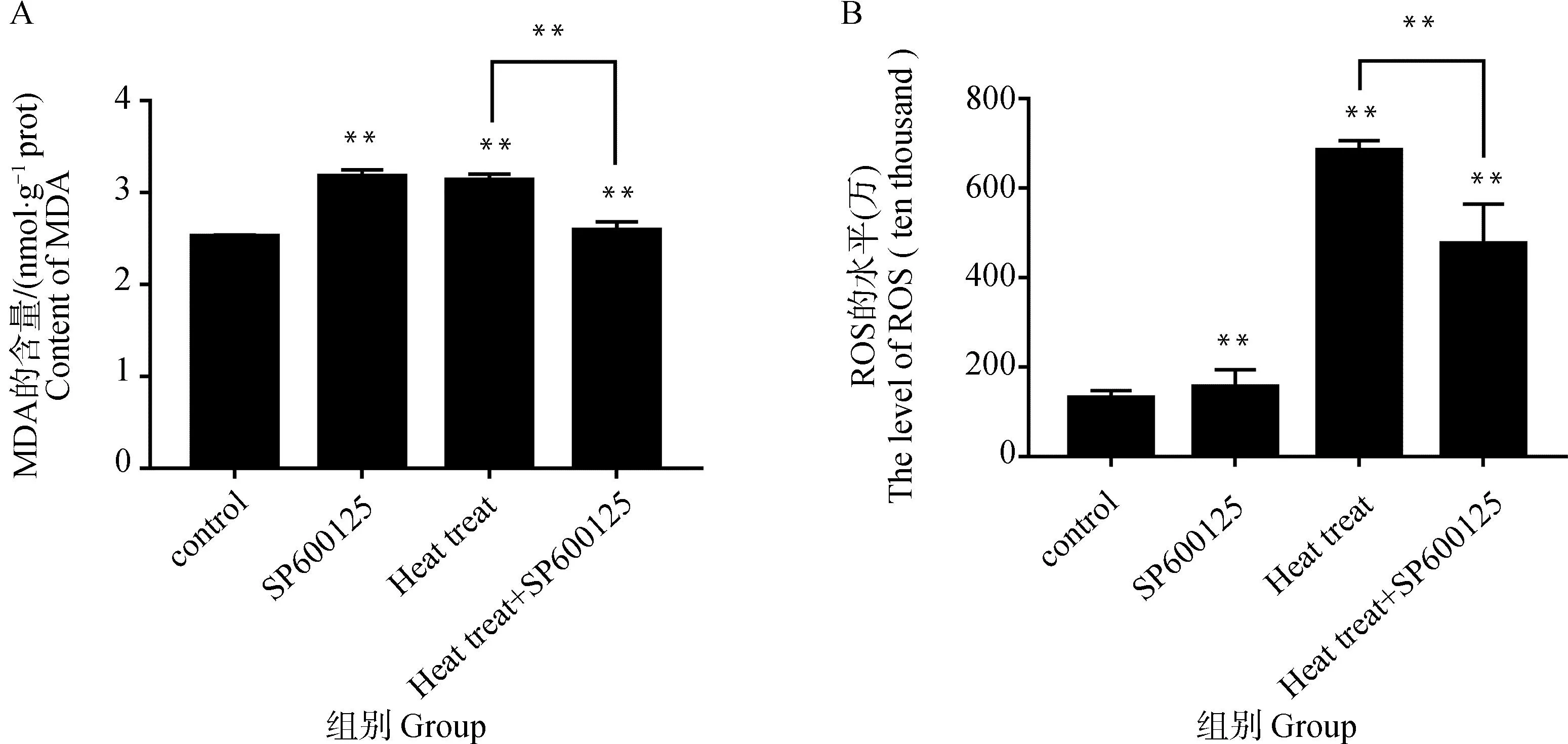
A.SP600125对热应激条件下睾丸支持细胞中MDA的影响;B.SP600125对热应激条件下睾丸支持细胞中ROS的影响A.The effect of SP600125 on MDA in sertoli cells under heat stress; B.Effects of SP600125 on ROS in sertoli cells under heat stress图5 SP600125对热应激条件下睾丸支持细胞中MDA、ROS的影响Fig.5 Effects of SP600125 on MDA and ROS in sertoli cells under heat stress
3 讨 论
ALOX15B是睾丸支持细胞中形成脂质过氧化物的主要酶。猪ALOX15B基因与人和小鼠的ALOX15B基因高度同源,主要形成8-HETE、15-HETE等过氧化物[21-22]。ALOX15B产生的脂质过氧化物15-HETE可诱导K-562细胞发生氧化应激,进而引发细胞凋亡[23]。在本试验中,热应激增强了睾丸支持细胞中ALOX15B的表达,同时增加了8-HETE与15-HETE水平,进而诱发了氧化应激,促进了细胞的凋亡。在热应激条件下,抑制睾丸支持细胞中ALOX15B的表达不仅降低了8-HETE、15-HETE、MDA和ROS的产生,而且减少了细胞凋亡。出现这一现象可能是因为脂质过氧化物一方面能够促进ROS的进一步产生[24-25];另一方面它们的降解会导致产生大量的丙二醛,从而诱发氧化应激[26],进而加速细胞凋亡[27-29]。因此,ALOX15B通过其过氧化产物在细胞中加速氧化应激的发生,进而在热应激诱导的细胞凋亡中发挥了重要作用。
热应激可激活小肠上皮细胞中的JNK信号通路[30]。本试验结果证明,在热应激条件下,睾丸支持细胞中的JNK磷酸化蛋白水平升高。Mitra等[31]的试验结果证明,JNK信号通路参与了由雷公藤甲素诱导的小鼠睾丸支持细胞凋亡。有研究结果也表明,ALOX5、ALOX12、ALOX15及其产生的脂质过氧化物5-HETE、12-HETE、15-HETE均可激活JNK信号通路[32-33]。本试验发现,在热应激条件下,通过黄芩素或ALOX15B的siRNA抑制ALOX15B的表达后,均可降低JNK磷酸化水平,并抑制细胞凋亡,这表明在热应激条件下睾丸支持细胞中ALOX15B可调控JNK的激活,进而诱导细胞凋亡。p53是著名的肿瘤因子[34],多种不利因素诱导可引发p53水平增加[35-36],影响着细胞的存活[37],而磷酸化的JNK能够激p53[38]。在PC-12细胞,JNK-p53参与了粘菌素诱导的细胞凋亡[39]。本试验结果发现,在热应激条件下仔猪睾丸支持细胞中p53表达增加,JNK抑制剂则可以抑制热应激条件下p53的表达和仔猪睾丸支持细胞的凋亡,这表明,在热应激下,ALOX15B通过JNK-p53调节热应激条件下支持细胞凋亡。
本试验还发现,当JNK抑制剂抑制热应激诱导的凋亡时,JNK能够反馈抑制ALOX15B的表达,降低8-HETE、15-HETE的含量,减少脂质过氧化的副产物丙二醛和细胞中ROS的水平,改变细胞的氧化应激水平,进而影响细胞凋亡,这表明,JNK可能通过反馈ALOX15B的表达负向调节细胞的凋亡,这与银松素诱导脂多糖预处理后的白细胞凋亡中JNK抑制剂可抑制ALOX15的表达并减少白细胞凋亡的结果一致[40]。这暗示,在本试验的热应激条件下,JNK信号通路一方面能促进细胞凋亡,另一方面能通过负反馈作用调节细胞中的脂质稳态,从而将凋亡控制在一定水平,以防止细胞的过度凋亡,本课题组前期研究的结果发现,撤除热应激后细胞的活力能逐渐恢复也证明了这一点。
4 结 论
热应激条件下,ALOX15B的表达促进了睾丸支持细胞中脂质过氧化物的产生,并增加MDA和ROS的产生,诱导细胞的氧化应激,进而激活JNK-p53通路并诱导细胞凋亡;JNK信号通路可反馈抑制ALOX15B的表达及脂质过氧化物的产生,改变细胞的氧化应激状态,进而对细胞凋亡起到负反馈作用。

