肿瘤相关中性粒细胞和上皮-间质转化在结直肠癌中的临床病理意义▲
吴共发 邱丽浈 曾宇婷 刘钰君 赖剑龙 姚金科
广州医科大学附属第四医院 1 病理科,2 健康管理中心,3 肝胆外科,广东广州市 511300
结直肠癌(colorectal cancer,CRC)作为一种常见的消化系统恶性肿瘤,近年来,随着人们饮食习惯和社会环境的不断变化,其发病率逐年增高,目前已经成为全世界死亡率第二的肿瘤,严重威胁人们的身体健康和生命安全[1]。其中,CRC远处转移是导致患者预后差和死亡率高的主要原因,也是影响CRC 5年生存率的最强独立预后因素之一[2]。研究发现[3],肿瘤相关中性粒细胞(tumor-associated neutrophil, TAN)是CRC的独立危险因素。既往研究证实[4-6],上皮-间质转化(epithelial-mesenchymal transition, EMT)可通过特定程序将上皮细胞转化为具有间质表型的细胞,上皮钙黏素(E-cadherin)表达减弱甚至缺失和波形蛋白(vimentin)表达增加是判断是否发生EMT的金标准。EMT与CRC的侵袭、发展和转移有紧密联系,可以作为新的治疗策略和途径。因此,本研究对TAN和EMT在CRC中的临床病理意义进行探讨,现报告如下。
1 资料与方法
1.1 研究对象 回顾性分析本院2013年9月至2015年12月期间经结直肠癌手术治疗的100例患者的病历,收集患者的癌组织和癌旁正常组织(距离癌组织5cm以上的正常肠黏膜组织)。纳入标准:(1)所有患者均经过病理证实为腺癌;(2)患者术前均未进行放化疗和靶向治疗。排除标准:(1)有其他恶性肿瘤病史;(2)合并其他肝肾疾病、心脑血管疾病者;(3)不能配合者。纳入研究的患者中,男性57例,女性43例;年龄20~91(62.41±12.65)岁;TNM分期[7]:Ⅰ期22例,Ⅱ期34例,Ⅲ~Ⅳ期44例;分化程度:低分化10例,中分化78例,高分化12例;淋巴结转移40例,无淋巴结转移60例;生存随访从术后的第一天开始,本研究的观察终点时间为2021年6月4日或该终点时间点之前因任何原因死亡,平均生存期为(57.26±26.25)个月。本研究经我院伦理委员会审核并批准。
1.2 方法
1.2.1 苏木精-伊红(hematoxylin-eosin, HE)染色检测TAN浸润情况 所有病理标本经过4%中性缓冲甲醛进行固定,经全自动组织脱水机进行固定、脱水、透明和浸蜡,自动包埋机进行石蜡包埋制作成石蜡组织块,4.0 μm厚切片,全自动染色机进行常规HE染色,中性树胶封片,由高级职称病理医师使用显微镜进行观察。观察病变范围及程度、黏膜上皮是否完整、腺体排列是否规则、隐窝结构是否正常、炎症细胞浸润是否增多,以及腺上皮细胞是否有变化。
1.2.2 免疫组化检测结果判定 即用型E-cadherin抗体(货号MAB-0738)和vimentin抗体(货号MAB-0735)均购自福州迈新生物技术开发有限公司,免疫组化检测试剂盒(货号GK500710)购自丹麦Dako公司。免疫组化检测操作严格按照试剂盒说明进行。E-cadherin阳性对照为阑尾腺上皮组织、阴性对照为阑尾平滑肌组织,vimentin阳性对照为阑尾间质组织、阴性对照为阑尾腺上皮组织。免疫组化染色完成后,由2名病理医师盲法判读。判断标准[8]:观察高倍(400×)视野下阳性细胞数及染色强度。随机选取5个高倍视野,计数至少200个细胞。细胞未染色为0分、淡黄色为1分、棕黄色为2分、棕褐色为3分。总评分=不同染色状态的细胞数×对应的染色评分。将E-cadherin评分<200分称为表达下降,vimentin评分>30分称为表达上调。
1.3 统计学分析 采用SPSS 20.0和GraphPad Prism 5.0 软件对数据进行统计学分析。计量资料用(x±s)表示,组间的比较采用t检验和t′检验。计数资料用例数和百分数表示,比较采用χ2检验。采用Kaplan-Meier分析进行生存分析,采用Spearman相关性分析进行TAN和EMT与CRC的相关性分析。P<0.05为差异具有统计学意义。
2 结 果
2.1 CRC患者癌组织和癌旁正常组织TAN浸润情况 在100例CRC患者中,29例CRC组织中有TAN浸润,癌旁正常组织的腺体底部均未见中性粒细胞,见图1。
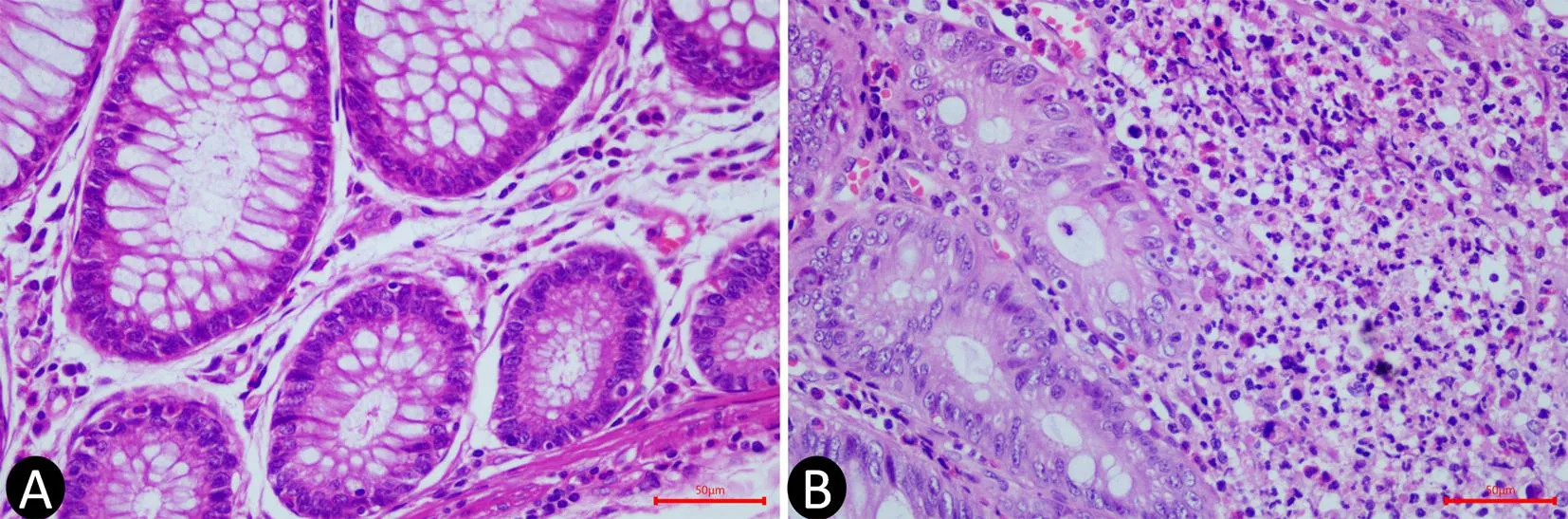
A:癌旁正常组织无TAN浸润;B:CRC组织有TAN浸润(×400)
2.2 不同TAN浸润情况CRC患者临床资料的比较 在CRC患者中,有TAN浸润者TNM分期、淋巴结转移情况较无TAN浸润者差,差异均有统计学意义(均P<0.05),见表1。
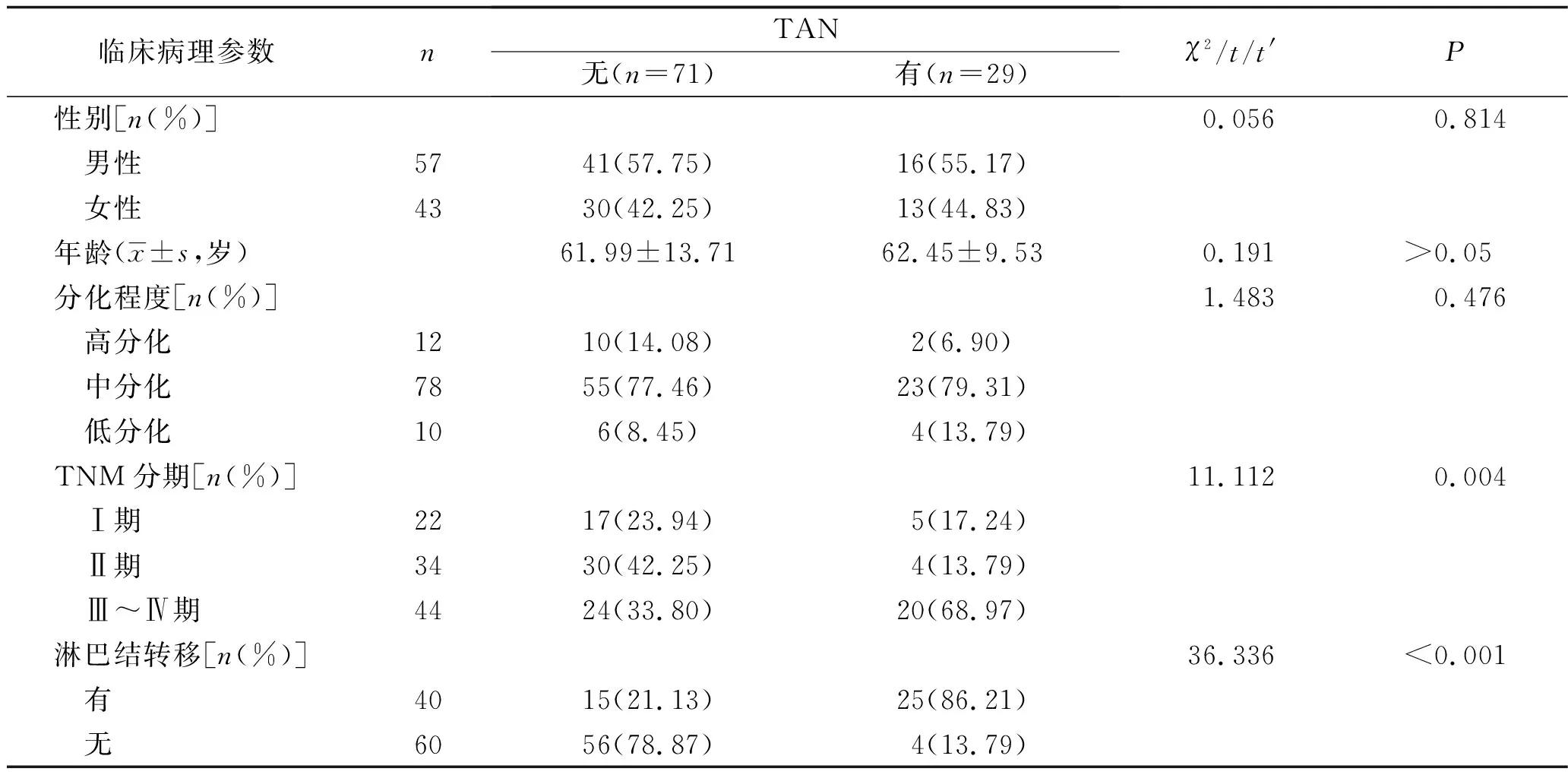
表1 不同TAN浸润情况CRC患者临床资料的比较
2.3 不同TAN浸润情况CRC患者的生存情况的比较 共100例患者,经过随访后删失8例。Kaplan-Meier分析发现,有TAN浸润患者的中位生存时间为28个月,无TAN浸润患者的累积生存率高于有TAN浸润患者,差异具有统计学意义(χ2=46.436,P<0.001),见图2。
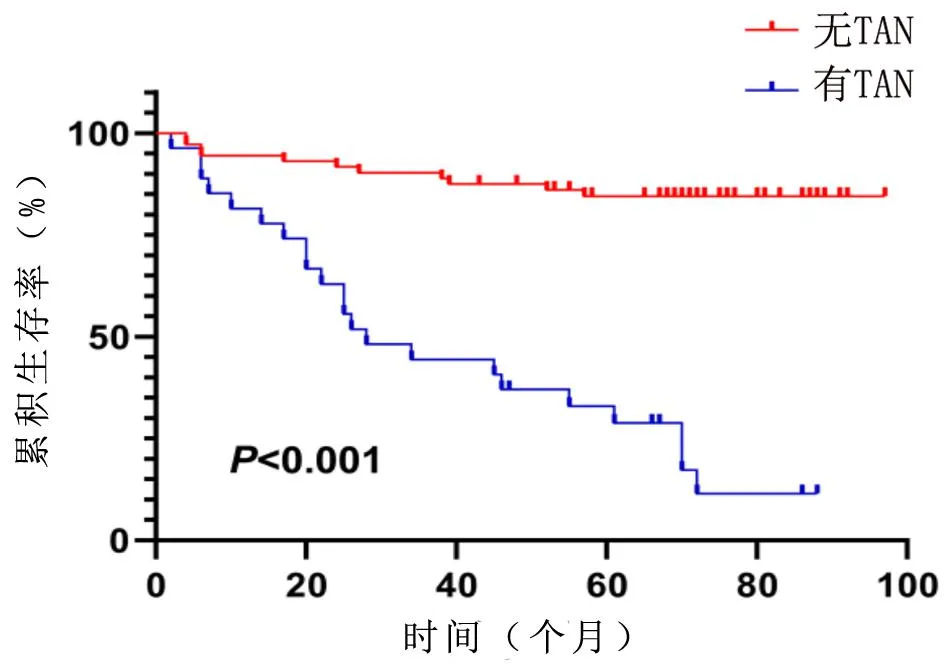
图2 不同TAN浸润情况CRC患者的Kaplan-Meier生存曲线
2.4 CRC组织和癌旁正常组织E-cadherin和vimentin的表达情况的比较 在CRC患者中,E-cadherin免疫组化染色总评分低于癌旁正常组织,vimentin免疫组化染色总评分高于癌旁正常组织(均P<0.05),见图3、表2。
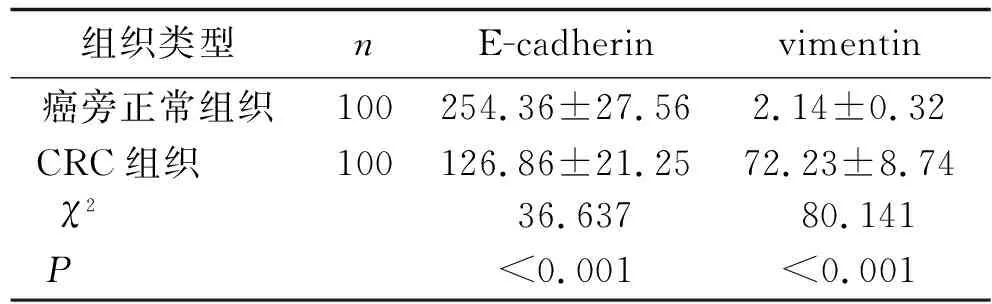
表2 CRC组织和癌旁正常组织E-cadherin和vimentin的表达情况的比较 [n(%),分]
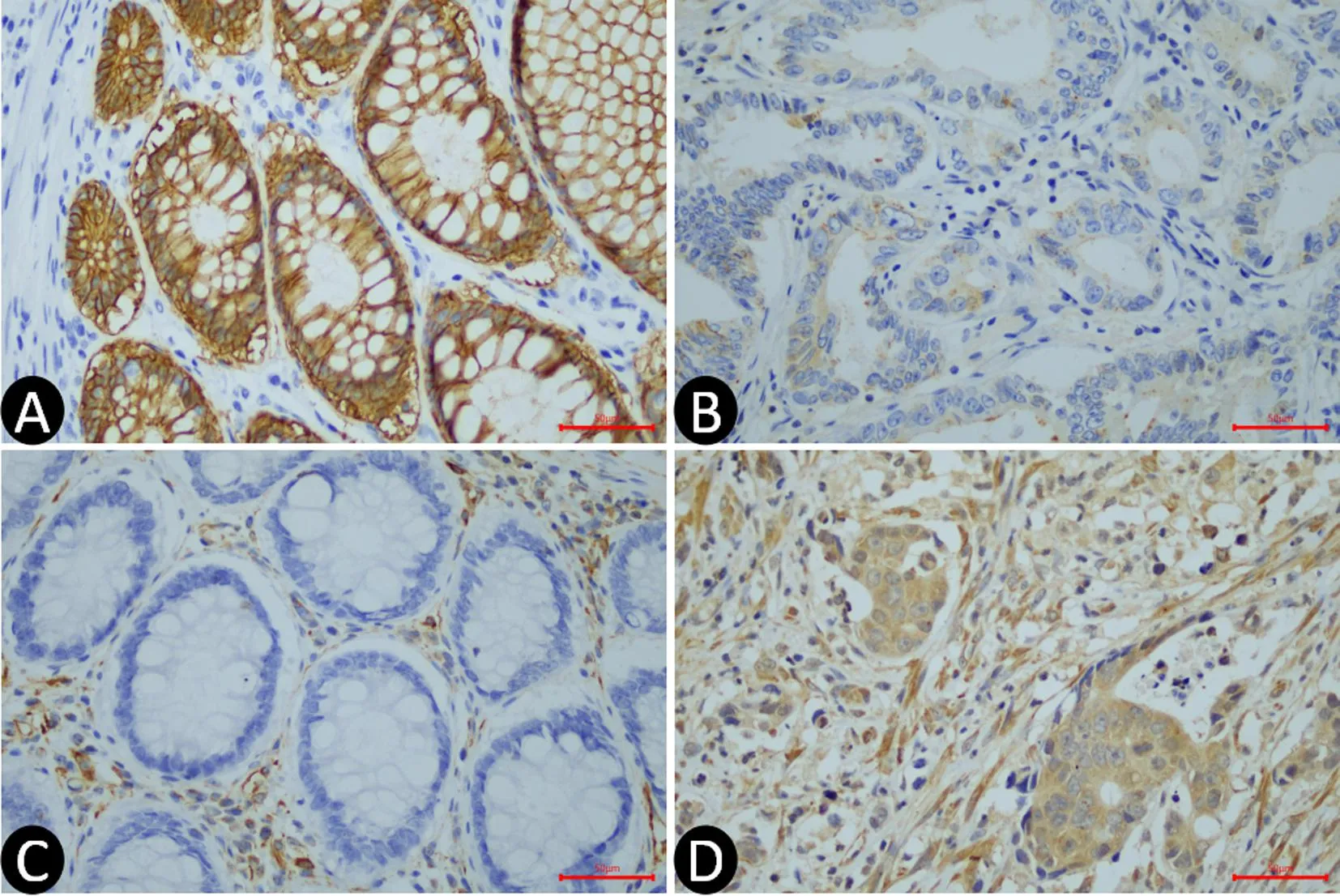
A:E-cadherin在癌旁正常组织中阳性表达;B:E-cadherin在CRC组织表达明显减弱;C:Vimentin在癌旁正常组织中阴性表达;D:Vimentin在CRC组织中阳性表达(×400)
2.5 CRC患者EMT标志物与TAN浸润的相关性分析 Spearman相关性分析结果显示,TAN浸润与E-cadherin表达呈负相关(rs=-0.498,P<0.001),与vimentin表达呈正相关(rs=0.611,P<0.001),见表3。
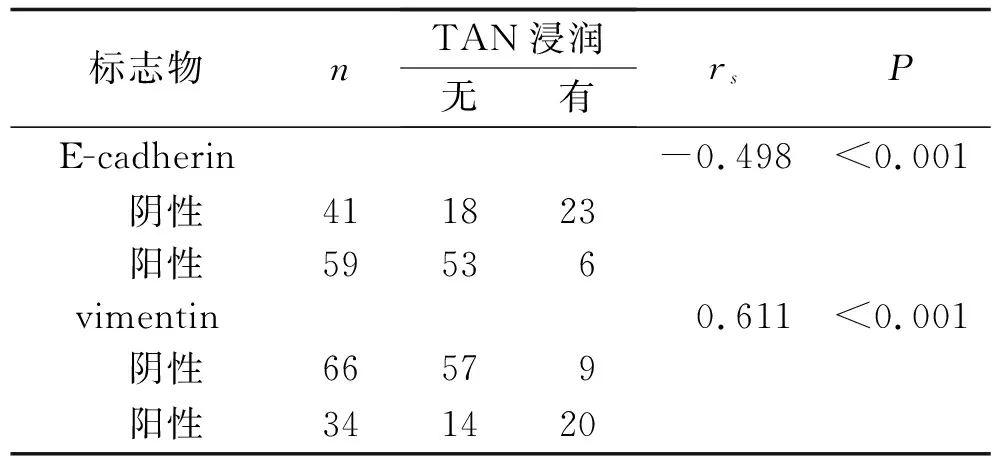
表3 CRC患者EMT标志物与TAN浸润的相关性分析 [n(%)]
3 讨 论
中性粒细胞是保护机体免受微生物感染并消除病原体的主要免疫细胞,具有促进肿瘤和抑制肿瘤的双重作用[9]。研究发现[10-11],TAN可促进肿瘤的发生、发展和转移,且可通过作用于不同细胞因子产生不同分化表型,如分化成具有对抗肿瘤作用的N1表型和具有促生肿瘤作用的N2表型。尽管两种分型的功能差异较大,但目前尚未有明确的表面标志物能够对N1和N2表型促成的TAN进行有效的区分。研究显示[12-13],N1表型的TAN可以通过生成肿瘤坏死因子-α、活性氧类、细胞间黏附分子1、死亡受体等,减少精氨酸酶表达,增强细胞毒性,起到抗肿瘤的作用;而N2表型的TAN则通过表达精氨酸酶、血管内皮生长因子、基质金属蛋白酶9等多种趋化因子,促进肿瘤的生长和扩散。TAN作为一种重要的炎症细胞,在肿瘤微环境下,可通过生产释放活性氧类、分泌促肿瘤细胞因子和趋化因子,以及免疫抑制等促进肿瘤发生,影响肿瘤患者的生存情况[14]。本研究发现,不同TAN浸润情况CRC患者TNM分期、淋巴结转移情况和生存情况存在差异。这可能是因为肿瘤分期越严重、淋巴结转移情况越多,治疗难度越大,CRC患者生存情况越差。尹小平[15]等报告CRC患者外周血中TAN表达水平高,TAN或具有促进肿瘤细胞侵袭、转移的作用,在组织学层面水平进一步验证了TAN在CRC中的作用。
肿瘤的发生与转移首先需要打破与周围细胞之间的连接,通过破坏基底膜障碍,侵入周围间质,从而进入血液循环,造成癌细胞的扩散。EMT是癌细胞在机体内发生侵袭和迁移的重要机制,E-cadherin表达水平下降和vimentin表达水平增加是判断EMT发生的重要标志[16]。本研究结果显示,和癌旁正常组织比较,CRC组织中E-cadherin表达下降,vimentin表达上调,说明CRC组织中存在EMT现象。本研究还发现,TAN与EMT相关蛋白表达存在密切关系。Berry等[17]的研究发现,高水平的TAN与CRC患者的总体生存改善有关,这可能是因为高水平的TAN能够抑制肿瘤的分化。研究显示[18-20],TAN可促进CRC侵袭、转移,造成患者的预后不良,提示TAN可促进EMT的发生与发展,进而诱发了CRC的侵袭、转移,且CRC的发展部分可能是TAN通过参与EMT过程实现的。
综上所述,TAN浸润与E-cadherin表达呈负相关,与vimentin表达呈正相关;TAN可能通过参与EMT过程,促进CRC的发生和转移。

