亚硒酸钠通过活性氧(ROS)/谷胱甘肽(GSH)/谷胱甘肽过氧化物酶4(GPX4)轴诱导非小细胞肺癌A549细胞铁死亡
时 杰 王永安 孙基泽 石 慧 盛 洁 姚 姚 嵇 姗*
(1.无锡市惠山区人民医院,江苏 无锡 214000;2.安徽医科大学,合肥 230000;3.东华理工大学,南昌 330000)
肺癌是导致癌症死亡的主要原因之一[1]。其中非小细胞肺癌(NSCLC)约占肺癌发病率的85%,其5 年生存率在4%~17%[2]。目前,肺癌的临床治疗仍以手术与化疗为主,然而部分患者因为身体差等原因而不适合化疗。因此,开发高效低毒治疗肺癌的药物迫在眉睫。
硒作为人体必需的微量元素,具有抗癌、抗氧化、增强免疫力及抗病毒等重要功能[3-4]。据报道,生理水平的硒具有一定的生物学效应,例如对心脏疾病及消化系统疾病等具有强大的保护作用[5]。此外,其他研究表明,在适当的剂量范围内,超营养剂量的硒可以抑制癌细胞增殖而对正常细胞的副作用较小[6]。因此,硒是一种潜在的抗癌药物,对癌细胞的增殖具有抑制作用,但硒抑制A549细胞增殖的作用机制仍不明确。
铁死亡是一种新的细胞程序性死亡模式,在细胞形态、生化特征和遗传水平上与凋亡、坏死和自噬不同,其特征是铁依赖性的脂质过氧积累达到致死水平[7-9]。铁是人体微量元素之一,过量的亚铁离子会催化芬顿反应产生ROS,进而促进细胞脂质氧化损伤导致细胞发生铁死亡[10]。研究表明,在肺癌的发生发展过程中存在铁代谢失调[11],诱导细胞发生铁死亡可以抑制癌细胞增殖[12]。此外,在低剂量下,硒表现出抗氧化特性,保护细胞免受氧化损伤,而高剂量的硒通过增加活性氧(ROS)水平诱导卵巢癌细胞发生铁死亡[12]。目前尚未有研究探讨亚硒酸钠是否能诱导肺癌A549细胞发生铁死亡。因此,本研究以A549细胞为研究对象,通过检测亚硒酸钠对A549细胞增殖及铁死亡的影响,进而探究亚硒酸钠是否能诱导A549细胞铁死亡及其相关机制,为其临床辅助治疗肺癌提供理研究基础。
1 实验部分
1.1 细胞培养
将A549细胞(武汉普诺赛)置于5 mL的DMEM培养基(武汉普诺赛)(90%DMEM+10%胎牛血清+1%双抗)中,在细胞培养箱(上海一恒科学仪器有限公司)中培养24 h(5% CO2、37 ℃)。
1.2 细胞增殖抑制率检测
将A549细胞以104/孔的密度接种于96孔板中。细胞贴壁后,分别加入含不同浓度亚硒酸钠(0、5、10、15和20 μmol/L)的DMEM培养基继续培养24 h。然后每孔加入100 μL CCK-8溶液(日本同仁化学研究所,10 μL CCK-8+90 μL DMEM)在细胞培养箱中孵育2 h,用酶标仪(美国ThermoFisher公司)测定450 nm处的OD值。然后计算细胞增殖率,绘制细胞增殖曲线,得到半数抑制浓度值用于以下实验。每个实验重复三次,数据以Mean±SD的形式表示。
1.3 细胞计数实验
将肺癌A549细胞按照5×105/孔的密度接种于细胞培养瓶中,细胞贴壁后,治疗组加入10 μmol/L的亚硒酸钠继续培养24 h。然后消化、离心、收集细胞于离心管中,每管加入1 mL含有10%台盼蓝染液(索莱宝生物科技有限公司)的DMEM培养基并吹匀,随后用自动细胞计数仪(上海瑞宇生物科技有限公司)进行细胞计数,每个实验重复三次,数据以Mean±SD的形式表示。
1.4 亚铁离子含量检测
将肺癌A549细胞按照5×105/孔的密度接种于细胞培养瓶中,细胞贴壁后,治疗组加入10 μmol/L的亚硒酸钠继续培养24 h。然后消化、离心、收集细胞于离心管中,按照细胞亚铁离子检测试剂盒(武汉伊莱瑞特生物科技有限公司)说明,测定对照组与治疗细胞内亚铁离子含量。
1.5 ROS水平检测
将肺癌A549细胞按照5×105/孔的密度接种于细胞培养瓶中,细胞贴壁后,治疗组加入10 μmol/L的亚硒酸钠继续培养24 h。然后消化、离心、收集细胞于离心管中,参照ROS检测试剂盒(碧云天生物科技研究所)说明,每管加入10 μmol/L 活性氧荧光探针(DCFH-DA)重悬细胞并避光孵育30 min,采用FACSVERSE流式细胞仪(美国BD公司)对样本进行分析。每个实验重复三次,数据以Mean±SD的形式表示。
1.6 MDA水平检测
将肺癌A549细胞按照5×105/孔的密度接种于细胞培养瓶中,细胞贴壁后,治疗组加入10 μmol/L的亚硒酸钠继续培养24 h。然后消化、离心、收集细胞于离心管中,按照MDA检测试剂盒(碧云天生物科技研究所)说明,测定对照组与治疗细胞内MDA水平。
1.7 GSH与GPX4水平检测
将肺癌A549细胞按照5×105/孔的密度接种于细胞培养瓶中,细胞贴壁后,治疗组加入10 μmol/L的亚硒酸钠继续培养24 h。然后消化、离心、收集细胞于离心管中,按照GSH(南京建成生物工程试剂公司)与GPX4(江苏酶免实业有限公司)检测试剂盒说明,测定对照组与治疗细胞内GSH与GPX4水平。
1.8 MMP检测
肺癌A549细胞按照5×105/孔的密度接种于细胞培养瓶中,细胞贴壁后,治疗组加入10 μmol/L的亚硒酸钠继续培养24 h。然后消化、离心、收集细胞于离心管中,参照MMP检测试剂盒说明,每管加入500 μL JC-1染液重悬细胞,采用FACSVERSE流式细胞仪对样本进行分析。每个实验重复三次,数据以Mean±SD的形式表示。
1.9 数据处理
数据分析用Origin 6.0及Prism5.0软件,数据用均数±标准差Mean±SD表示,组间的数据采用两独立样本t检验分析),P<0.05表示具有显著差异。
2 结果
2.1 亚硒酸钠抑制肺癌A549细胞增殖
CCK-8结果显示,亚硒酸钠对A549细胞的半数抑制浓度(IC50)为10 μmol/L(图1a),细胞计数实验结果显示对照组与治疗组的总细胞数分别为(396.3±12.6)万及(162.3±2.8)万(图1b),上述结果提示亚硒酸钠显著抑制A549细胞的增殖。
2.2 亚硒酸钠诱导肺癌A549细胞内铁过载
亚铁离子累积是细胞发生铁死亡的重要标志,本实验采用比色法检测细胞内的亚铁离子含量。结果显示治疗组的亚铁离子含量为对照组的(2.28±0.25)倍(图2),上述结果提示亚硒酸钠显著诱导A549细胞内铁过载。
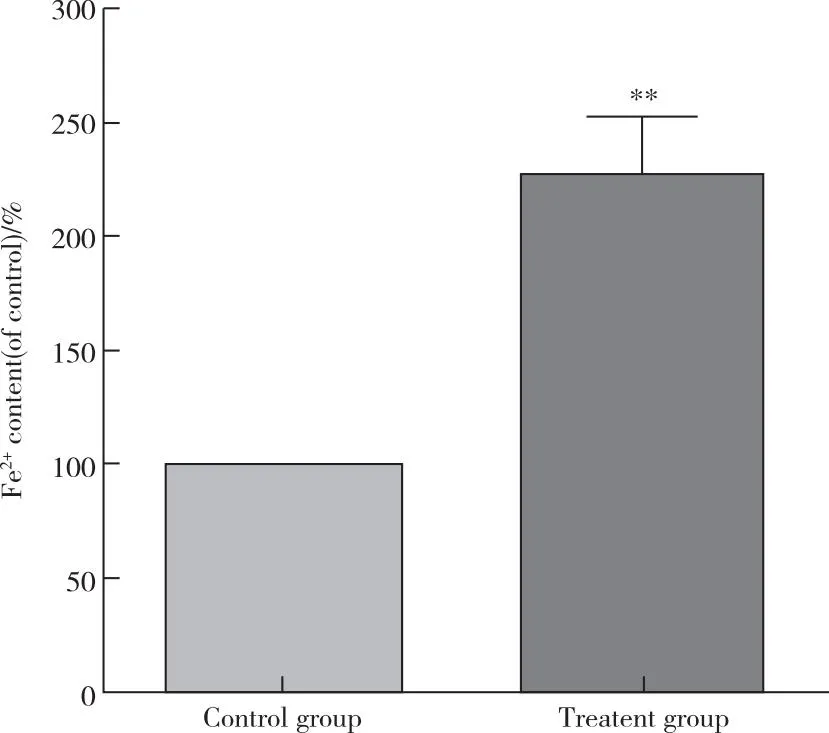
图2 分光光度法检测亚硒酸钠对A549细胞亚铁离子含量的影响Figure 2 Effects of sodium selenite on ferrous ion content of A549 cells detected by spectrophotometry.
2.3 亚硒酸钠升高肺癌A549细胞内ROS水平
流式结果显示治疗组的ROS含量为对照组的(2.3±0.12)倍(图3),上述结果提示亚硒酸钠显著升高A549细胞内ROS水平。
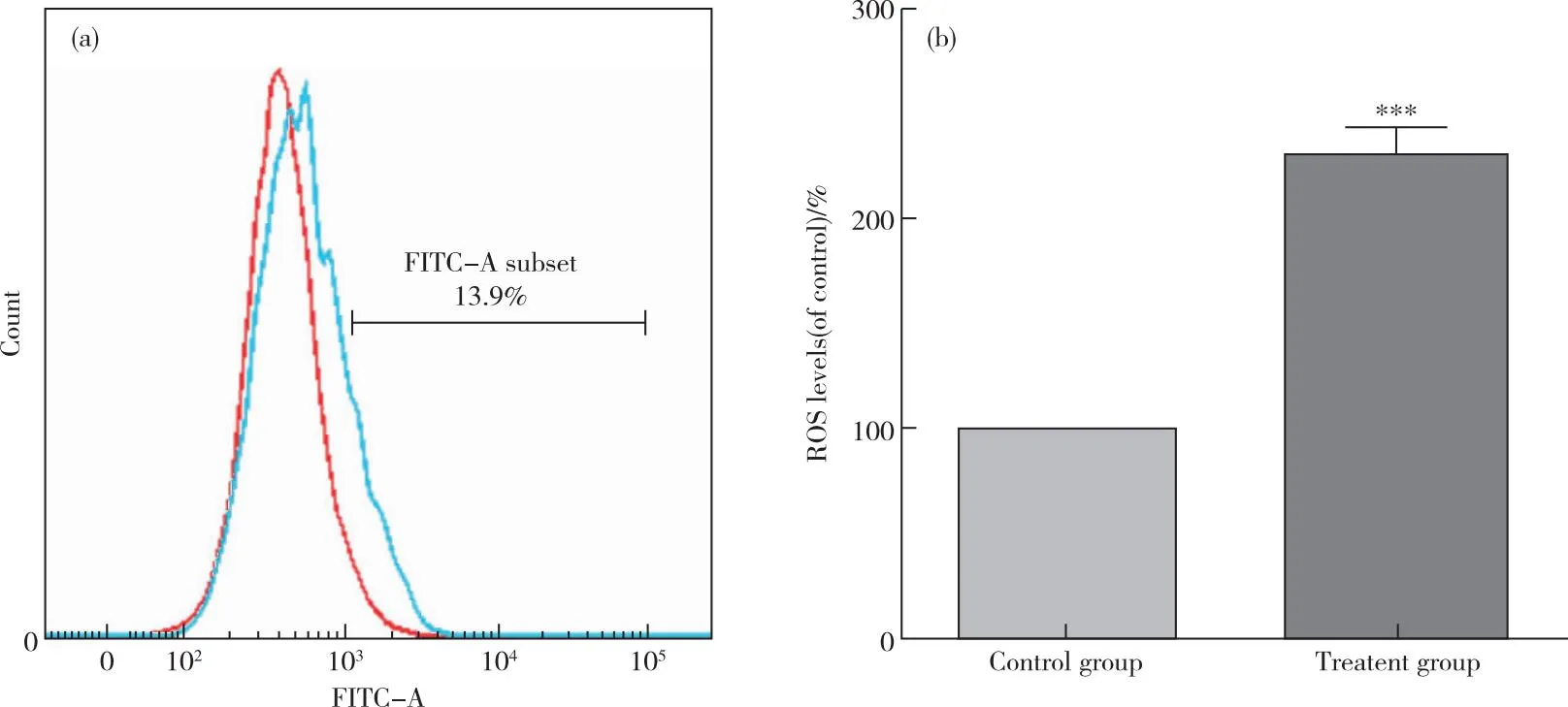
图3 流式细胞仪检测A549细胞ROS含量(a)亚硒酸钠处理细胞24 h,DCFH-DA染色后应用流式细胞仪检测细胞ROS含量;(b)以对照组百分比计算A549细胞内ROS含量Figure 3 ROS content of A549 cells detected by flow cytometry(a)The cells were treated with sodium selenite for 24 h,and the ROS content was detected by flow cytometry after DCFH-DA staining;(b)The ROS content in A549 cells was calculated as the percentage of the control group.
2.4 亚硒酸钠升高肺癌A549细胞内MDA水平
MDA水平升高是细胞发生铁死亡的重要标志,为进一步分析细胞膜脂质氧化情况,本实验采用分光光度法检测细胞内的MDA水平。结果显示治疗组的MDA含量为对照组的(1.87±0.27)倍(图4),上述结果提示亚硒酸钠显著升高A549细胞内MDA水平。
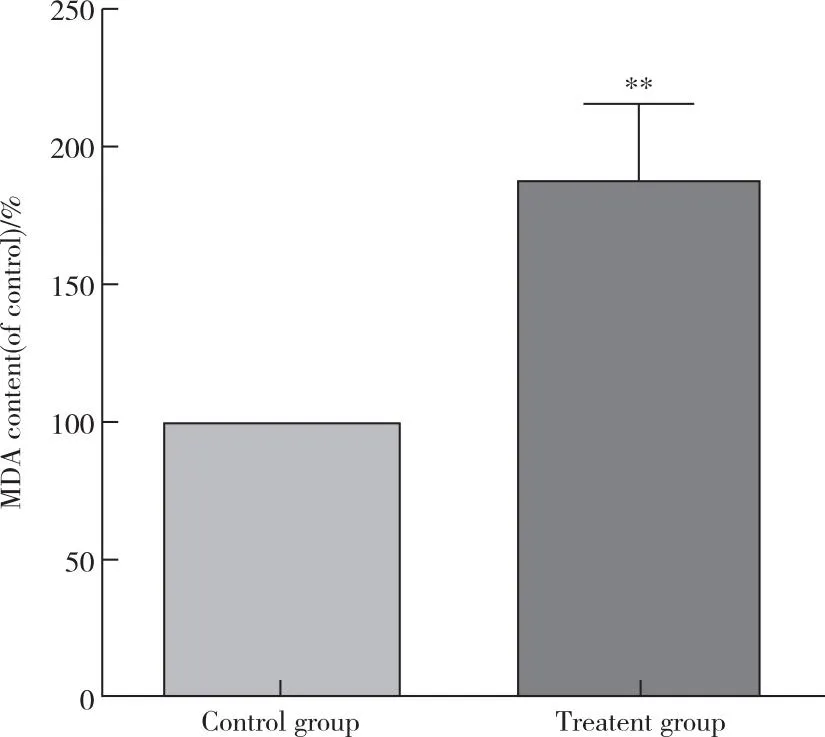
图4 分光光度法检测亚硒酸钠对A549细胞MDA含量的影响Figure 4 Effect of sodium selenite on MDA content of A549 cells detected by spectrophotometry.
2.5 亚硒酸钠降低肺癌A549细胞内GSH与GPX4水平
GSH是细胞内主要的抗氧化物质,为进一步分析细胞内GSH水平,本实验采用分光光度法检测细胞内的GSH含量。结果显示治疗组的GSH含量为对照组的(0.77±0.04)倍(图5a);此外,GPX4含量为对照组的(0.69±0.03)倍(图5b)。上述结果提示亚硒酸钠显著降低A549细胞内GSH与GPX4水平。
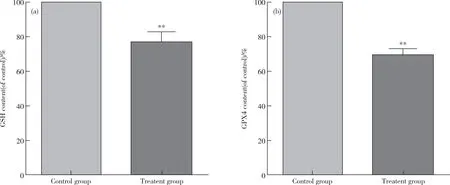
图5 分光光度法检测亚硒酸钠对A549细胞GSH与GPX4水平的影响Figure 5 Effect of sodium selenite on GSH and GPX4 levels in A549 cells by spectrophotometry.
2.6 细胞线粒体膜电位变化
流式结果显示治疗组的MMP含量为对照组的(0.13±0.04)倍(图6),上述结果提示亚硒酸钠显著降低A549细胞内MMP水平。

图6 流式细胞仪检测A549细胞MMP(a)亚硒酸钠处理细胞24 h,JC-1染色后应用流式细胞仪检测细胞MMP水平;(b)红色/绿色荧光的比值用于衡量MMP水平Figure 6 Flow cytometry detection of MMP in A549 cells (a)The cells were treated with sodium selenite for 24 h,and the MMP level was detected by flow cytometry after JC-1 staining;(b)The ratio of red/green fluorescence was used to measure MMP levels.
3 讨论
本研究通过细胞增殖实验、细胞计数实验、流式细胞术、亚铁离子及MDA检测等实验表明亚硒酸钠可以抑制A549细胞增殖,同时还表明亚硒酸钠抑制A549细胞增殖与细胞发生铁死亡有关。
亚硒酸钠属于无机硒,具有广泛的抗癌活性。有研究显示亚硒酸钠可以通过增加氧化物的产生、降低线粒体膜电位及激活自噬等方式诱导癌细胞凋亡[12-15]。铁死亡是一种铁依赖性的细胞死亡形式,其主要特征为铁过载及脂质过氧化。诱导肿瘤细胞发生铁死亡相对于传统肿瘤治疗具有其独特的优势,近年来逐步成为研究热点。此外,最近研究报道亚硒酸钠可以通过增加活性氧(ROS)水平诱导卵巢癌细胞发生铁死亡[12]。本研究通过CCK-8及细胞计数实验表明亚硒酸钠可以抑制A549细胞的增殖,并且随着亚硒酸钠浓度的升高,其抑制活性不断增强。此外,通过分光光度法检测细胞内亚铁离子、MDA及其GSH含量,流式细胞仪检测MMP及ROS水平,Western Blot检测GPX4水平发现亚硒酸钠可以诱导A549细胞发生铁死亡,上述结果提示亚硒酸钠可以通过诱导A549细胞铁死亡从而抑制细胞增殖。
GSH是细胞抗氧化系统内主要的抗氧化物质,而GPX4是内源性抑制铁死亡的脂质过氧化物酶,起到抑制脂质过氧化的作用[16]。有研究表明GPX4在铁死亡过程中的表达依赖于GSH的存在[17]。因此,细胞内GSH耗竭会降低GPX4的表达,GPX4的降低是细胞发生铁死亡的重要标志[18]。本研究结果表明亚硒酸钠可以引起A549细胞内GSH与GPX4表达水平降低,提示亚硒酸钠可以通过ROS/GSH/GPX4信号轴诱导A549细胞发生铁死亡。
4 结论
综上所述,亚硒酸钠通过抑制肺癌A549细胞增殖,降低细胞内线粒体膜电位水平,调节ROS/GSH/GPX4信号轴诱导A549细胞发生铁死亡。上述研究对亚硒酸钠在肺癌防治方面提供一定的指导意义。此外,本实验初步探索了亚硒酸钠诱导肺癌A549细胞铁死亡作用及其可能机制,为亚硒酸钠在肺癌的临床辅助治疗提供了一定的理论依据。