细菌介导重金属转化过程及金属组学研究方法
唐寅寅 刘丽红 何 滨,3 胡立刚,3*
(1.中国科学院 生态环境研究中心,环境化学与生态毒理学国家重点实验室,北京 100085;2.中国科学院大学,北京 100049;3.国科大杭州高等研究院 环境学院,杭州 310024)
重金属被定义为相对原子质量在63.5~200.6,比重大于5.0的金属以及类金属元素[1],常见重金属有锌(Zn)、铜(Cu)、铁(Fe)、锰(Mn)、砷(As)、镉(Cd)、铅(Pb)、汞(Hg)、铬(Cr)[2-5]。由于重金属在环境中具有顽固性、持久性、易传递和难以生物降解等特点,导致其在环境中累积,污染食物链,影响环境的健康秩序和人类生产生活,并不断对生物生存和人类文明发展造成威胁[6]。如硬岩开采造成的重金属污染在采矿作业停止后仍会持续数百年,重金属污染的危害程度可见一斑,因此重金属污染在世界范围内受到特别且广泛的关注。同时随着工业化、城市化进程加快,环境中重金属排放量也持续增加,重金属污染在当下已是全球最严峻的环境问题之一。
1 重金属污染及危害
1.1 重金属污染来源
普遍认为环境中重金属的来源包括自然来源和人为来源两类。自然来源主要包括火山喷发、矿物风化、森林火灾,人为来源作为重金属污染的更重要来源主要包括燃煤发电、供热、采矿和其他冶金活动[7]。此外,工业化加剧了人为因素的影响,包括不合理的农药和化肥使用、未经处理的工业排放和汽车尾气排放[8-10]。针对人为来源中的具体因素,目前有研究利用正定矩阵因子分解模型(PMF)和Unmix模型共同识别了地质、交通、农业和工业来源。根据模型得到的结果可知,Ni和Cr主要来源于工业排放,Cd和Pb主要来自交通排放,As主要来自地质开采,Hg主要来源于工农业发展的影响。来源解析结果表明,金属、化工、煤炭、机械和纺织工业等对Ni、Cr、Zn和Cd等金属含量有显著的负向影响,应成为控制和缓解措施的重点[11]。
1.2 重金属污染的危害
重金属浓度过高会导致植物和作物生长不良,动物群落数量减少[12],重金属还可以通过食物摄入对人类健康构成威胁,导致呼吸系统、心血管系统、免疫系统和生殖系统等功能的紊乱[13]。例如,重金属铅会损害肾脏和消化系统,扰乱肾小管重吸收或使胃肠功能紊乱,甚至引起肾炎、肾病综合征和消化系统疾病[14]。同时,铅可通过抑制血红蛋白的形成而诱发贫血。已有研究报道,重金属汞无论是短期接触还是长期接触都会显著影响人的认知、感觉和运动功能,尤其会对新生儿发育中的神经系统产生极大影响[15]。一项对900名法罗群岛儿童(其父母主要通过鲸肉接触甲基汞)的研究表明,父母产前接触甲基汞会导致儿童7岁时的神经心理缺陷[16-17]。另外,在长期慢性暴露砷的地区,皮肤癌、肺癌和膀胱癌的风险也有所增加[18]。
2 细菌介导的重金属转化机制
目前已有多种环境中重金属污染的处理方法,比如物理修复法(包括工程措施、电动修复、热解吸、超声波加热等)、化学修复法(包括化学浸出法、氧化还原法等)和一些生物修复法等[19-20]。其中传统的物理和化学修复法存在一些缺点,如能耗较大、成本高、易形成二次污染等[21]。生物修复法中的微生物处理具有明显优势:1)处理能力强,可通过吸附、活化以及转化等多种方式降低环境中的重金属浓度;2)适应能力强,可迅速适应环境,应用领域广泛;3)收益成本高,易管理,不易造成二次污染[22-24];4)细菌种属多、分布广,是微生物中的最大群体;5)各种细菌具有独特的潜力,可以采取不同的代谢策略及建立不同程度的耐受性和抗性机制来适应被污染环境中的金属威胁[25-26]。因此,细菌转化相对于其他方式,具有实施方便、资源丰富、环保经济等优点,同时具有原位转化的潜力,已成为环境重金属污染转化领域中新技术探索的热点之一[27-28]。以下是细菌在重金属转化中的常见途径。
2.1 生物吸附
细菌可产生生物膜为一些重金属离子提供缓冲的环境,降低重金属对细菌本身的侵害作用,还可以利用多种碳源合成并向胞外释放有助于隔离污染物的胞外聚合物质(EPS)[29]。EPS最初被描述为“胞外多糖”,包含多种成分,如蛋白质、核酸、脂质和腐殖质等[30-31],EPS对金属的吸附可能与细胞表面性质及其官能团(如羧基、羟基、磷基)有关,这些官能团可以与重金属发生反应从而达到去除重金属的目的[32]。有研究称细菌生物膜表面分泌的胞外聚合物中携带大量负电荷,可吸附重金属离子[33]。目前,关于细菌产生的胞外聚合物对于重金属的吸附作用已经被广泛地研究与应用[34-35]。如有研究表明,金黄色葡萄球菌和假单胞菌主要利用生物吸附来改善镉污染,它们的吸附率分别可达25%和27.8%[36]。有研究将EPS从副土地杆菌Parapedobactersp. ISTM3中提取出来,研究EPS对重金属混合物的生物吸附,发现在酸性条件下,EPS对Cr(Ⅵ)具有极强的吸附能力[37]。同时有研究发现,枯草芽孢杆菌Bacillussubtilis和恶臭假单胞菌Pseudomonasputida在去掉EPS后,细菌对重金属镉的吸附能力下降[38]。另一方面,已有研究发现细菌的细胞膜和细胞壁是细菌进行重金属吸附的重要场所,细菌细胞壁中的重要成分几丁质和壳聚糖对重金属离子有吸附能力,可以将重金属离子络合或螯合在细菌表面导致金属浓度降低[39]。浑浊红球菌与铜绿假单胞菌被发现均可以通过细胞壁的吸附作用进行重金属铅的固定[40-41]。除以上两种吸附方法以外,细菌还可以通过体内外的阳离子与环境中的重金属离子发生交换来达到固定重金属的目的,蜡样芽孢杆菌在含镉环境中被发现在细菌表面与Ca(Ⅱ)发生了离子交换,从而降低了环境中镉的浓度[42]。
2.2 生物转化
生物转化主要是通过氧化还原反应和甲基化、去甲基化反应将金属离子转化,以降低其生物毒性。如兼性厌氧菌佐吕间湖生芽孢八叠球菌SporosarcinasaromensisW5菌株已被证明可以将Cr(Ⅵ)还原为Cr(Ⅲ)。好氧条件下,Cr(Ⅵ)还原主要发生在细胞质中,最终产物为可溶性有机Cr(Ⅲ)配合物。厌氧条件下,Cr(Ⅵ)还原主要发生在细胞质中,还原产物为可溶性有机Cr(Ⅲ)配合物和Cr(Ⅲ)沉淀物[43]。同时有研究发现,细胞表面的羟基、羧基和酰胺基等官能团可以将Cr(Ⅵ)转化为Cr(Ⅲ)(主要是CrCl3)[44]。大肠杆菌EscherichiacoliATCC 33456,在好氧和厌氧条件下也均具有还原Cr(Ⅵ)的能力[45]。另一种被广泛研究的生物转化方式为汞的甲基化与去甲基化,在自然环境中,汞通常以无机汞(零价汞、一价汞、二价汞)和有机汞[CH3Hg+、(CH3)2Hg]的形式存在。而有机汞的毒性大于无机汞的毒性,尤其是甲基汞具有高神经毒性和高生物蓄积性,许多具有mer操纵子的细菌被证明具有将甲基汞还原为汞的能力,对细菌的二价汞结合、转运、还原、解毒起到精确的调控作用[46]。
2.3 胞外沉淀
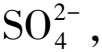
2.4 胞内累积
微生物可以将重金属离子通过自身存在的特定通道运送到细胞内,并在细胞内与蛋白结合形成不活跃的金属结合蛋白,降低金属离子活性的同时减少金属的毒性。例如,金属硫蛋白(MTs)是一种低分子量、富含半胱氨酸的重金属结合蛋白,由于半胱氨酸可与金属离子发生络合反应,从而将重金属沉淀于体内。因此金属硫蛋白被认为参与了重金属解毒、储存、氧化损伤等生物学过程并发挥重要作用[53-54]。已有研究进一步发现,MTs基因的转录实际上是重金属通过金属反应元件诱导的,MTs基因暴露于金属离子后的过表达是细菌抵抗重金属毒性的原因[55]。
3 重金属转化过程的分析流程
细菌介导重金属转化过程的研究主要涉及细菌分子生物学的表征与鉴定以及利用金属组学探究重金属转化形态的检测与鉴定(图1)。
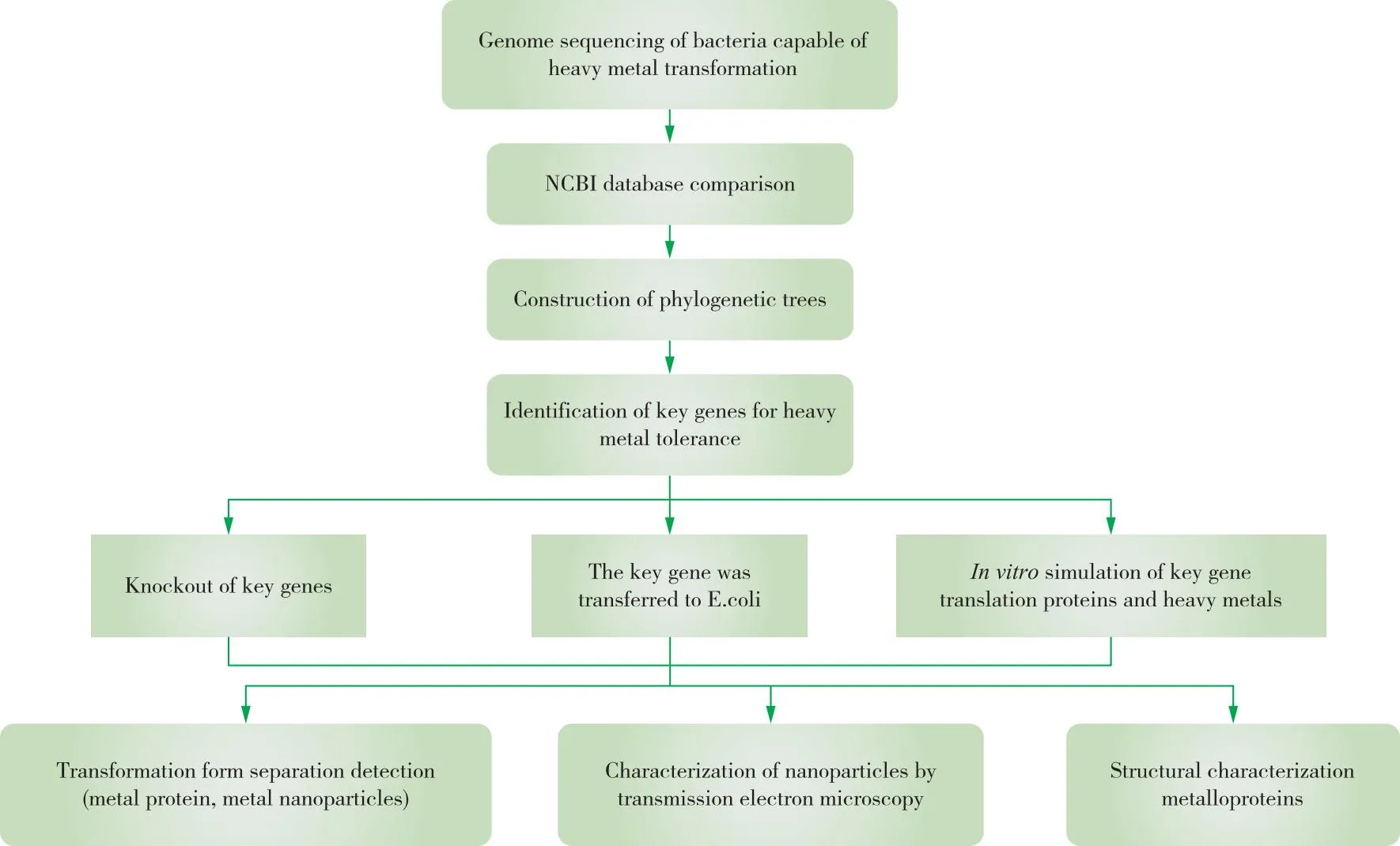
图1 研究细菌介导重金属转化流程Figure 1 The process of heavy metal transformation mediated by bacteria.
4 细菌介导重金属转化过程中的相关金属组学技术
4.1 纳米颗粒与金属蛋白分离技术
尺寸排阻色谱(SEC)由于分离时间快、分离过程温和等优势被广泛应用于纳米颗粒和金属蛋白的分离中[56-57]。其分离原理基于不同水力学直径的分子流经填料时的孔道路径差异,利用该差异将不同大小的分子分离,类似于分子筛效应。如图2所示,不同水力学直径的分子进入管柱后,以一定速度流动的流动相流经色谱柱的同时,带动样品分子在色谱柱内的迁移。样品与固定相之间不发生相互作用,管柱中的填料是由高分子交联而成,内部本身具有三维网状筛孔的固体颗粒,大分子无法进入凝胶孔洞,而只流经凝胶和管柱间的孔隙,所以总体运行路径较短,从色谱柱入口到出口所需时间较短(如图2中实心圆分子和五边形分子);中等大小的分子能进入凝胶中一些适当的孔洞,但不能进入更小的微孔,在柱中受到滞留作用,较慢地从色谱柱洗脱出来,在管柱中的停留时间比较久(如图2中菱形分子);较小的分子可以自由进入凝胶内的筛孔,在柱中受到更强的滞留,总体运行路径较长,所以在管柱内的停留时间较长(如图2中空心圆分子和三角形分子)。基于此原理可以区分大小不同的分子,亦可与已知大小的分子作比较而确定未知样品的分子量。由此可知,尺寸排阻色谱可以将尺寸不同的分子按照保留时间分开,分子量越大的分子保留时间越短,相反,分子量越小的分子保留时间越长。
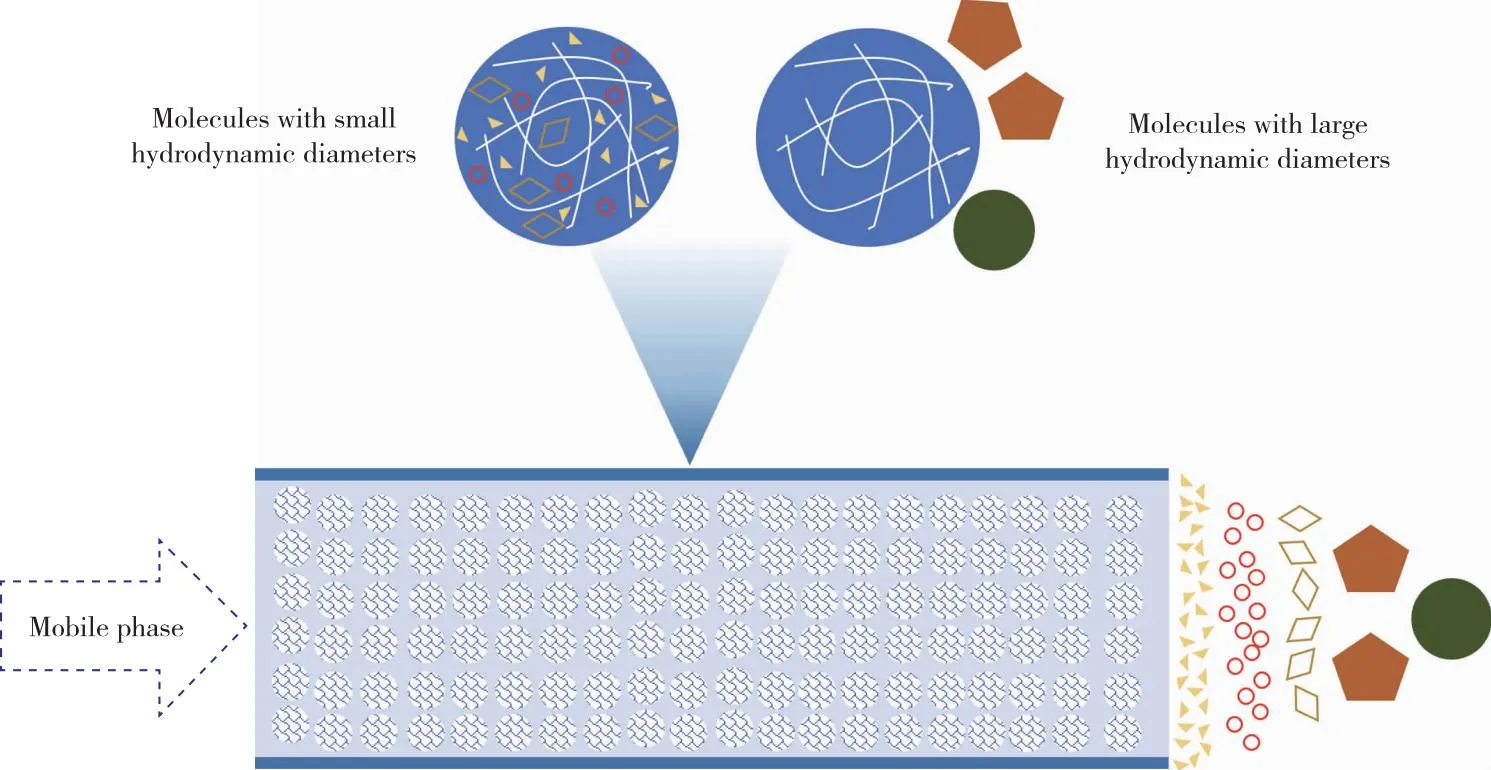
图2 SEC中分离不同水动力直径分子的示意图Figure 2 Schematic diagram for the separation of various molecules with different hydrodynamic diameters in SEC.
4.2 纳米颗粒与金属蛋白检测技术
电感耦合等离子体质谱(ICP-MS)因为其高灵敏度,多元素同时检测等优势而被应用于联用系统,包括与液相色谱[58]、离子色谱[59]、毛细管电泳[60]、凝胶电泳等体系的联用[61]。其中,SEC-ICP-MS已应用于不同生物样品中金属纳米颗粒和金属蛋白的检测。例如,已有研究[62-63]利用SEC-ICP-MS联用技术对金属纳米颗粒及其对应的金属离子进行了形态分析,并在实际样品检测中表现出良好的方法性能,验证了方法的有效性。另一方面,为了更好地阐明金属在生物体内的健康和毒性作用,分析生物体内与必需金属和有毒金属结合形成的金属蛋白是至关重要的,SEC-ICP-MS已经应用于不同人体体液、植物和细胞中金属蛋白的检测,为了解金属蛋白的环境效应和生物毒性提供了有力工具[64-66]。
4.3 纳米颗粒与金属蛋白鉴定、表征技术
在进行纳米颗粒与金属蛋白分离检测后,还需要进行纳米颗粒的形貌表征和未知蛋白的结构鉴定,获得纳米颗粒与金属蛋白的性质信息,进而研究细菌介导重金属的形态转化过程和转化机制。
4.3.1 纳米颗粒表征技术
透射电子显微镜(TEM)为纳米颗粒的结构表征提供了高分辨率的直接成像方法。与原子力显微镜(AFM)、扫描隧道显微镜(STM)和各种X射线方法等其他原位技术相比,TEM不仅具有高分辨率的优势,还提供了多尺度成像功能表征颗粒密度,获得目标区域内有关颗粒大小和形态分布的统计信息,与电子能谱(EDS)相结合,还可以确定原子组成信息或实现元素分布的直接可视化[67-72]。已有研究通过TEM对合成的腐植酸(HA)包覆Fe3O4纳米粒子(Fe3O4/HA)进行了物理化学表征,验证了Fe3O4/HA在重金属去除中的适用性[73]。还有研究利用TEM对鲸类动物肝脏中汞结合态进行表征,发现Hg-NPs是鲸类动物肝脏中重要的汞形态。同时鉴定出小尺寸(5~40 nm)和大尺寸(100 nm)的Hg-NPs主要与硒(Se)、硫(S)以及少量镉(Cd)、铅(Pb)和银(Ag)络合,为海洋哺乳动物体内Hg-NPs及其化学形态提供了直接证据[74]。
4.3.2 金属蛋白鉴定技术
蛋白质是一条或者多条肽链以特殊方式形成的生物大分子,大多数蛋白质以特定的三维结构存在。蛋白质鉴定主要在于识别蛋白质的一级结构,包括蛋白质肽链氨基酸的排列、肽段分子量以及二硫键数目和位置,是生物研究的有力工具。液相色谱-串联质谱(LC-MS/MS)由于其高灵敏度和特异性通常成为鉴定和定量分析复杂生物样品中蛋白质的首选方法。首先,它是一种高通量方法,能够同时定量数千种蛋白质[75-77]。其次,LC-MS/MS可以检测和量化天然蛋白并对修饰点进行分析,并通过蛋白相互作用(PPI)网络识别蛋白质参与的生物过程和相关途径[78],为研究蛋白质在细菌介导重金属转化过程中所扮演的角色提供有力支撑。
5 总结与展望
细菌在重金属环境中,会发展出抵御重金属毒性作用的复杂防御机制。本综述立足于金属组学相关方法,为细菌介导重金属转化过程这一科学问题的研究提供了新思路。在未来研究中,首先可以从细菌生物信息学数据入手,通过序列比对确定关键基因,并将关键基因进行敲除与转导,在体内暴露与体外模拟的过程中,通过对颗粒态和蛋白质结合态金属的分离检测与表征鉴定,研究细菌介导重金属转化的形态,为重金属形态转化过程的机制研究提供理论及技术基础。
但目前仍有一些问题需要进一步研究,例如,重金属与细菌最初发生相互作用(氧化还原、矿化)的初始位点尚不清楚,同时缺乏一定的技术方法去满足重金属和细菌相互作用的原位观测。另一方面,细菌介导重金属发生转化后的最终形态还不明确,更深层次的机制还需要一些新技术的开发与优化,例如蛋白质结构的鉴定等。