基于斑马鱼模型的补骨脂不同炮制品水提物急性毒性及肝毒性差异比较
赵竟成,李治建, ,霍仕霞, ,祖力皮卡尔·吾斯曼,钟雅韵,张数数,高姝燕,麦丽克姆·麦图如孜,张 云,
1.新疆医科大学药学院,新疆 乌鲁木齐 830011
2.新疆维吾尔自治区维吾尔医医院,新疆 乌鲁木齐 830049
3.齐鲁工业大学(山东省科学院),山东省科学院生物研究所,山东 济南 250103
4.山东省人类疾病斑马鱼模型与药物筛选工程技术研究中心,山东 济南 250103
补骨脂是豆科植物补骨脂PsoraleacorylifoliaL.的干燥成熟果实,在我国被广泛用作补益中药,《中国药典》2020 年版中有63 种含补骨脂的成方制剂[1]。然而近年来,越来越多的研究报道了补骨脂的不良反应,尤其是肝损害[2-5]。国家药品监督管理局先后通报了补骨脂及部分制剂致肝损伤的风险。古代本草认为制补骨脂有毒,通过炮制可降低其毒性。历代医籍和本草记载了多种补骨脂炮制方法[6]。补骨脂的炮制方法始载于《雷公炮灸论》:“凡使,性本大燥,毒,用酒浸一宿后,漉出,却用东流水浸三日夜,却,蒸,从巳至申,出,日干用”,宋代《证类本草》记载:“补骨脂一斤,酒浸一宿,放干,却用乌油麻一斤和炒,令麻子声绝,即播去,只取补骨脂,为末”[7]。又如宋代《圣济总录》记载:“炒令黄焦”[8]。另从古至今记载有药汁制、童便制、焙制等炮制方法[9],《寿世保元》并参考《中国药典》盐炙法,维吾尔医也常用盐炙法炮制补骨脂[10]。不同炮制法对补骨脂减毒效果的影响尚缺少系统的比较和研究[11]。斑马鱼近年来已成为用于药物活性筛选和安全性评价的新兴模式动物[12]。斑马鱼繁殖速度快、产卵数量高,胚胎和个体较小,通体透明且发育迅速,通常从受试物在斑马鱼上进行暴露到完成评价实验仅需3 d 左右,可开展实验室条件下短周期低成本的多样本快速评价。转基因荧光标记斑马鱼可在对应激发光下显现标记位置,如本研究使用的肝脏细胞绿色荧光标记转基因斑马鱼 Tg(lfabp: EGFP)在激发光下可通过观察记录其清晰的荧光肝脏形态,定量分析斑马鱼肝脏荧光面积、荧光强度和荧光3D 成像体积,为器官形态观察与指标测量提供方便。同时基因测序表明斑马鱼与人类基因同源性高达87%,斑马鱼肝脏和机体免疫炎症细胞对外源性药物的反应与人类高度相似。斑马鱼属于非哺乳类脊椎动物,在实验动物伦理方面的限制小,符合实验动物福利保护的国际“3R”原则。
为此本研究选取历代医籍记载的炮制方法,利用斑马鱼为模型,系统比较不同炮制方法对补骨脂减毒效果的影响,为优选补骨脂炮制方法提供参考,为补骨脂安全的开发利用提供实验依据。
1 材料
1.1 仪器
斑马鱼养殖系统(北京爱生科技有限公司);XW-80A 型混合仪(上海沪西分析器厂);HPG280BX 型光照培养箱(哈尔滨东联电子技术开发有限公司);Agilent 1290 UPLC 仪(美国安捷伦有限公司);API 4000 三重四级杆质谱(美国SCIEX公司);FSX16 型体视荧光显微镜(日本Olympus 公司);RM2245 型切片机(德国Leica 公司);KDBMII 型生物组织自动包埋机、KD-TS3D 型生物组织自动脱水机(浙江科迪仪器设备有限公司);KZPG-1A 型摊片烤片机(天津天利航空机电有限公司);PCRSCIENTZ-II D 型超声破碎机(浙江新芝生物科技股份有限公司);Allegra X-30R Centrifuge型离心机(美国Beckman Coulter 公司);CFX96 Touch C1000 Thermal Cycler 型实时荧光定量PCR仪(美国Bio-Rad 公司);NANODROP ONEC 超微量紫外可见分光光度计(美国 Thermo Fisher Scientific 公司)。
1.2 药材
补骨脂购自新奇康(新疆)药业股份有限公司,由新疆维吾尔自治区维吾尔医医院霍仕霞研究员鉴定为豆科植物补骨脂P.corylifoliaL.的干燥成熟果实。
1.3 药品与试剂
补骨脂素(批号10376,质量分数99.8%)、异补骨脂素(批号14592,质量分数99.6%)购自诗丹德(上海)标准技术服务有限公司;乙腈(批号I1133829105,质谱纯)、甲醇(批号I1139035113,质谱纯)购自美国 Merck 公司;甲酸(批号B2307725,质谱纯)购自上海阿拉丁生化科技股份有限公司;三卡因(批号A5040)、拍照用鱼体固定液羧甲基纤维素钠( sodium carboxy methyl cellulose,CMC-Na,批号419281)购自美国Sigma-Aldrich 公司;多聚甲醛(批号CR2209049)购自塞维尔(武汉)生物科技有限公司;PBS 漂洗缓冲液(批号SADKZ)、组织细胞RNA 快速提取试剂盒(批号DMQTQ)购自思科捷(山东)生物技术有限公司;99%生物技术级聚山梨酯 20(批号C13720975)购自麦克林(上海)生化科技有限公司;NovoStart SYBR qPCR SuperMix Plus ( 批号05256502)购自近岸(上海)蛋白质科技有限公司;HiScript III RT DuperMix for qPCR(批号R323-01)购自诺唯赞(南京)生物科技有限公司。
1.4 动物
AB 野生型斑马鱼、Tg(lfabp: EGFP)型肝脏细胞绿色荧光标记转基因斑马鱼和 Tg(lysc:DsRed2)型中性粒细胞红色荧光标记转基因斑马鱼品系为山东省科学院生物研究所斑马鱼药物筛选平台提供。
2 方法
2.1 斑马鱼的养殖与繁育
雌雄斑马鱼隔离喂养,交替照明14 h/黑暗10 h,每日按时投喂刚孵化的丰年虾幼体和人工饵料。采集受精卵时取性成熟的健康斑马鱼按雌雄1∶1 或1∶2的比例放入带隔板的缸中,次日给予照明(8: 00 时)同时去除隔板,9: 00~11: 00 时收获受精卵。对受精卵进行消毒和洗涤后移入斑马鱼胚胎培养用水中,28 ℃下控光培养。
2.2 补骨脂不同炮制品水提物制备、含量测定与斑马鱼给药溶液的制备
2.2.1 补骨脂不同炮制品水提物制备 炮制的方法参照各典籍,每次实验严格控制操作的温度和时间。本研究使用的是补骨脂不同炮制品的水提物。水提步骤为粉碎后经10 倍量纯化水煮沸提取3 次,3 次提取液混合后蒸发、回流、烘干。补骨脂干燥果实水提得补骨脂生品,记录出膏率;依据《雷公炮炙论》法炮制得补骨脂雷公法制品[13],水提后记录出膏率;据《太平圣惠方》法炮制得补骨脂清炒法制品[13],水提后记录出膏率;依据《洪氏集验方》法[13]炮制得补骨脂酒炙法制品,水提后记录出膏率;依据《寿世保元》法和《中国药典》2020 年版炮制得补骨脂盐炙法制品[14-15],水提后记录出膏率。水提生品出膏率26.22%,雷公法出膏率11.75%,清炒法出膏率22.24%,酒炙法出膏率21.32%,盐炙法出膏率23.75%。
2.2.2 补骨脂不同炮制品水提物含量测定
(1)对照品储备液的制备:取对照品补骨脂素和异补骨脂素各5 mg,精密称定,分别置5 mL 量瓶中,加甲醇适量,超声(功率250 W、频率40 kHz)使溶解,加甲醇至刻度,摇匀,即得质量浓度为5 mg/mL 的对照品储备液。
(2)线性溶液的制备:分别精密移取对照品储备液适量,置于不同规格量瓶中,加甲醇稀释至刻度,配制成一系列浓度的线性溶液,摇匀,即得。
(3)样品制备:取补骨脂生品、补骨脂清炒法制品、补骨脂酒炙法制品、补骨脂盐炙法制品、补骨脂雷公法制品25 mg,精密称定,置25 mL 量瓶中,加50%甲醇适量,超声(功率250 W、频率40 kHz)处理30 min,放冷,加50%甲醇至刻度,摇匀,精密移取1 mL,置5 mL 量瓶中,加50%甲醇至刻度,摇匀,取2 mL,12 000 r/min 离心5 min,取上清液,即得。
(4)色谱条件:Agilent Poroshell SB-C18色谱柱(100 mm×2.1 mm,1.9 µm);柱温30 ℃;体积流量0.3 mL/min;进样量2 µL;检测波长190~400 nm;流动相为0.1%甲酸乙腈溶液(A)-0.1%甲酸水溶液(B),梯度洗脱:0~2 min,10%~15% A;2~5 min,15%~20% A;5~7 min,20%~40% A;7~10 min,40% A;10~15 min,40%~50% A;15~17 min,50%~70% A;17~19 min,70%~90% A;19~22 min,90% A。
(5)质谱条件:电喷雾离子源(ESI);三重四级杆液质联用仪ESI 正、负离子检测模式;离子源温度550 ℃;喷雾气压力344.75 kPa;辅助加热气压力275.8 kPa;气帘气压力137.9 kPa;离子化电压5 500 V/−4 500V;各化合物质谱多反应监测(multiple reaction monitoring,MRM)参数见表1。

表1 MRM 参数Table 1 MRM parameters
2.2.3 斑马鱼给药溶液的制备 精密称取补骨脂生品、补骨脂雷公法制品、补骨脂清炒法制品、补骨脂酒炙法制品和补骨脂盐炙法制品,分别置于1.5 mL EP 管中,以1 mL 纯净水溶解配制得到各炮制品相当生药质量浓度200 mg/mL 的母液,后各取100 μL 母液于另一1.5 mL EP 管中,加900 μL 斑马鱼胚胎培养用水稀释至相当生药质量浓度 20 mg/mL 的分装药液用于后续实验给药,125、250、500 μg/mL 生药质量浓度给药体系分别为取用各炮制品分装溶液12.5、25、50 μL 于每孔总养鱼水2 mL 的24 孔板中配制所得。
斑马鱼胚胎培养水为1 L 纯净水中加入0.633 g KCl、2.452 g CaCl2、14.658 g NaCl、4.06 g MgSO4·7H2O。麻醉剂为纯净水配制的0.16 mg/mL三卡因溶液。
2.3 斑马鱼急性毒性分析
AB 野生型斑马鱼卵受精发育72 h 后(hours post-fertilization,hpf),在体视显微镜下挑选正常的斑马鱼胚胎,移入24 孔板中,每孔15 条。以出膏率换算同等生药量设定各炮制品组给药质量浓度(125、250、500、600、700、800、1 000 μg/mL),除空白对照组外胚胎培养用水中给药补骨脂不同炮制品处理72 h。每次每组3 个重复孔。每孔用胚胎培养用水加至总体积为2 mL。然后加盖,置于光照培养箱(28 ℃)让胚胎继续发育。连续3 d 记录各组死亡情况,药物处理72 h 后,取10~15 条于适量三卡因中麻醉,在体视显微镜下固定于甲基纤维素溶液中,使斑马鱼对眼侧卧于载玻片上,观察斑马鱼白光下全身情况并拍照,参考斑马鱼畸形评分标准[16]并运用软件统计各组斑马鱼全身毒性情况。
2.4 斑马鱼肝脏形态分析
利用72 hpf Tg(lfabp: EGFP)型肝脏细胞绿色荧光标记转基因斑马鱼,同“2.3”项下方法给药造模72 h 后,取10~15 条于适量三卡因中麻醉,在体视显微镜下固定于甲基纤维素溶液中,使斑马鱼对眼侧卧于载玻片上,观察斑马鱼在激发光线下荧光肝脏情况并拍照,统计补骨脂不同炮制品对荧光肝脏面积、荧光强度影响,并进行高内涵成像分析肝脏3D 形态差异。
2.5 斑马鱼肝脏组织病理切片分析
利用72 hpf AB 野生型斑马鱼,同“2.3”项下方法给药造模72 h 后,取5~10 条于适量三卡因中麻醉,再转入4%多聚甲醛对斑马鱼进行固定96 h后用梯度乙醇、醇苯、二甲苯脱水,在包埋机中以石蜡包埋后4 μm 切片,脱蜡至水,纯净水冲洗后进行苏木素-伊红(HE)染色,洗净切片放入梯度乙醇;二甲苯中脱水至透明,晾干,用中性树胶封片,于显微镜下观察并拍照。
2.6 斑马鱼炎症检测
2.6.1 斑马鱼肝脏区域炎症统计 利用72 hpf Tg(lysc: DsRed2)型中性粒细胞红色荧光标记转基因斑马鱼,同“2.3”项下方法给药造模72 h 后,随机取15~20 条于适量三卡因中麻醉,在体视显微镜下固定于甲基纤维素溶液中,使斑马鱼对眼侧卧于载玻片上,观察斑马鱼白光下和激发光线下肝脏区域红色荧光中性粒细胞情况并拍照,统计补骨脂不同炮制品对肝脏区域荧光中性粒细胞计数影响。
2.6.2 斑马鱼炎症相关因子基因表达检测 利用72 hpf AB 野生型斑马鱼,同“2.3”项下方法给药造模72 h 后,将各组斑马鱼取20 条,转移至1.5 mL无酶灭菌EP 管中,纯净水漂洗2 次后去除水分,按照试剂盒说明书提取总RNA 并合成cDNA,进行qRT-PCR 分析。引物序列见表2。

表2 引物序列Table 2 Primer sequences
2.7 统计学分析
3 结果
3.1 补骨脂不同炮制品水提物含量测定
使用UPLC-QqQ/MS 在MRM 模式下,测定补骨脂不同炮制品提取物中补骨脂素和异补骨脂素的含量(色谱图见图1),采用标准曲线法,补骨脂素在8.38~3 350.79 ng/mL 配制5 个稀释质量浓度,补骨脂素在16.58~3 315.68 ng/mL 配制5 个稀释质量浓度。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y),用最小二乘法进行线性回归分析,绘制线性方程,回归方程及线性范围结果见表3,含量测定结果见表4。在相对生药量500 μg/mL 的补骨脂生品、补骨脂雷公法制品、补骨脂清炒法制品、补骨脂酒炙法制品和补骨脂盐炙法制品溶液中,补骨脂素浓度分别为5.25、4.42、4.29、4.57、4.66 μmol/L,异补骨脂素浓度分别为4.19、2.01、3.37、3.55、3.69 μmol/L。

图1 对照品与炮制品的总离子流色谱图Fig.1 Total ion chromatogram of reference substance and processed product

表3 回归方程及线性范围Table 3 Regression equation and linear range

表4 5 批样品的含量测定Table 4 Content determination of five batches of samples
3.2 补骨脂不同炮制品水提物对斑马鱼急性毒性差异
如图2 所示,空白对照组无死亡;补骨脂生品的半数致死浓度(median lethal concentration,LC50)为718.0 μg/mL,最小致死浓度(minimum lethal concentration,LC1)为425.1 μg/mL;补骨脂酒炙法制品的LC50为730.1 μg/mL,LC1为520.8 μg/mL,补骨脂盐炙法制品的LC50为731.0 μg/mL,LC1为563.5 μg/mL;补骨脂清炒法制品和补骨脂雷公法制品的LC50为890.4 μg/mL,LC1为723.0 μg/mL。补骨脂不同炮制品水提物的LC50和LC1由大到小排序为补骨脂雷公法制品=补骨脂清炒法制品>补骨脂盐炙法制品>补骨脂酒炙法制品>补骨脂生品。
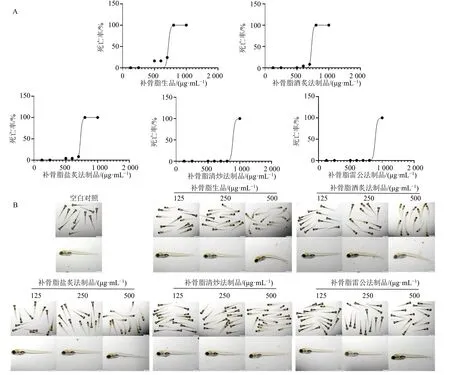
图2 补骨脂不同炮制品水提物对斑马鱼急性毒性Fig.2 Acute toxicity of water extracts from different processed products of Psoraleae Fructus to zebrafish
高质量浓度下补骨脂生品、补骨脂酒炙法制品和补骨脂盐炙法制品的水提物导致了斑马鱼明显的脊柱弯曲和鱼鳔丢失。
如图3-A 所示,补骨脂生品对斑马鱼有明显的致畸毒性,在高质量浓度下斑马鱼卵黄囊吸收显著迟缓且肝脏和卵黄囊区域明显发黑、脊柱明显弯曲、鱼鳔完全缺失、出现明显心包水肿;补骨脂盐炙法制品高质量浓度组和补骨脂酒炙法制品高质量浓度组有显著的致畸毒性,脊柱出现明显弯曲,卵黄囊吸收明显减缓且肝脏和卵黄囊区域轻微发黑,鱼鳔几乎缺失,同时盐炙法制品高质量浓度组还伴有轻微心包水肿;清炒法制品高质量浓度组有较明显的致畸毒性,卵黄囊吸收较明显减缓,出现轻微脊柱弯曲,伴有鱼鳔减小和轻微心包水肿;雷公法制品高质量浓度对全身无明显毒性。补骨脂不同炮制品水提物鱼鳔缺失毒性由强到弱排序为补骨脂生品>补骨脂酒炙法制品>补骨脂盐炙法制品>补骨脂清炒法制品>补骨脂雷公法制品。补骨脂不同炮制品水提物心包水肿毒性由强到弱排序为补骨脂生品>补骨脂酒炙法制品>补骨脂盐炙法制品>补骨脂清炒法制品>补骨脂雷公法制品。

图3 补骨脂不同炮制品水提物(500 μg·mL−1)对斑马鱼致畸毒性Fig.3 Teratogenic toxicity of water extracts from different processed products of Psoraleae Fructus (500 μg·mL−1) to zebrafish
如图3-B 所示,与空白对照组的脊柱弯曲角度相比,补骨脂生品、清炒法制品、酒炙法制品和盐炙法制品对斑马鱼有显著的脊椎弯曲毒性(P<0.05、0.001),补骨脂雷公法制品脊椎无显著性差异。与补骨脂生品组比较,雷公法、清炒法、酒炙法和盐炙法均显著降低了补骨脂对斑马鱼的脊柱弯曲毒性(P<0.05、0.001),补骨脂补骨脂不同炮制品水提物脊柱弯曲毒性由强到弱排序为补骨脂生品>补骨脂酒炙法制品=补骨脂盐炙法制品>补骨脂清炒法制品>补骨脂雷公法制品。
如图3-C 所示,与空白对照组的卵黄囊面积相比,补骨脂生品、清炒法制品、酒炙法制品和盐炙法制品对斑马鱼有显著的卵黄囊吸收减缓毒性(P<0.01、0.001),补骨脂雷公法制品卵黄囊面积无显著性差异。相比于补骨脂生品,雷公法、清炒法、酒炙法和盐炙法均显著降低了补骨脂对斑马鱼的卵黄囊吸收减缓毒性(P<0.05、0.01、0.001),补骨脂不同炮制品水提物卵黄囊吸收减缓毒性由强到弱排序为补骨脂生品>补骨脂酒炙法制品=补骨脂盐炙法制品>补骨脂清炒法制品>补骨脂雷公法制品。
如图3-D 所示,与空白对照组的全身畸形情况相比,补骨脂生品、酒炙法制品、盐炙法制品和清炒法制品对斑马鱼有显著的致畸毒性(P<0.001),补骨脂雷公法制品整体体态无显著差异。相比于补骨脂生品,雷公法和清炒法显著降低了补骨脂对斑马鱼的致畸毒性(P<0.001),酒炙法和盐炙法对补骨脂致畸毒性的影响无显著性差异,补骨脂不同炮制品水提物畸形评分由大到小排序为补骨脂生品>补骨脂酒炙法制品=补骨脂盐炙法制品>补骨脂清炒法制品>补骨脂雷公法制品。
3.3 补骨脂不同炮制品水提物对斑马鱼肝脏形态影响差异
如图4-A 所示,与空白对照组比较,补骨脂生品、酒炙法制品和盐炙法制品高浓度组斑马鱼肝脏形态有明显缺失而清炒法和雷公法高浓度组对斑马鱼肝脏形态无明显改变。

图4 补骨脂不同炮制品水提物(500 μg·mL−1)对斑马鱼肝脏形态的影响 (2D)Fig.4 Effect of water extracts from different processed products of Psoraleae Fructus (500 μg·mL−1) on liver morphology of zebrafish (2D)
如图4-B 所示,对斑马鱼肝脏荧光面积影响最大的炮制品是补骨脂盐炙法制品,其显著降低了斑马鱼肝脏荧光面积大小(P<0.001),甚至影响程度大于补骨脂生品组,这表明发生了强烈肝损伤;补骨脂清炒法制品对肝脏荧光面积有影响趋势,肝脏荧光面积影响排序为补骨脂盐炙法制品>补骨脂生品>清炒法>补骨脂酒炙法制品=补骨脂雷公法制品。
如图4-C 所示,对斑马鱼肝脏荧光强度影响较大的炮制品是补骨脂清炒法制品,其明显降低了肝脏的荧光强度(P<0.05),其次为补骨脂生品和补骨脂盐炙法制品(P<0.05),这表明肝细胞密度明显减小,肝脏荧光强度影响排序为补骨脂清炒法制品>补骨脂生品>补骨脂盐炙法制品>补骨脂酒炙法制品=补骨脂雷公法制品。
如图5-A 所示,用高内涵成像系统捕获空白对照组和补骨脂不同炮制品高质量浓度(500 μg/mL)组3D 肝脏形态。与空白对照组比较,在补骨脂生品、补骨脂酒炙法制品和补骨脂盐炙法制品影响下斑马鱼的肝叶出现缺失情况。

图5 补骨脂不同炮制品水提物(500 μg·mL−1)对斑马鱼肝脏形态的影响 (3D)Fig.5 Effect of water extracts from different processed products of Psoraleae Fructus (500 μg·mL−1) on liver morphology of zebrafish (3D)
如图5-B 所示,与空白对照组比较,补骨脂生品、酒炙法制品、盐炙法制品、清炒法和雷公法显著减小了斑马鱼肝脏荧光体积(P<0.05、0.001)。相比于补骨脂生品组,补骨脂盐炙法、清炒法和雷公法制品组肝脏荧光体积有明显的回升(P<0.05、0.001)。肝脏荧光体积影响排序为补骨脂生品>补骨脂酒炙法制品>补骨脂盐炙法制品>补骨脂清炒法制品>补骨脂雷公法制品。
3.4 补骨脂不同炮制品水提物对斑马鱼肝脏组织病理切片的影响
如图6 所示,与空白对照组比较,补骨脂雷公法制品对肝脏病理切片影响无显著差异,而在补骨脂生品、补骨脂盐炙法制品、补骨脂清炒法制品和补骨脂酒炙法制品的影响下斑马鱼肝脏细胞间出现明显空泡,表明肝脏结构存在严重缺陷,且肝脏细胞边界不清晰,细胞结构受损。肝脏组织病理结构影响排序为补骨脂生品>补骨脂盐炙法制品>补骨脂清炒法制品>补骨脂酒炙法制品>补骨脂雷公法制品。
3.5 补骨脂不同炮制品对斑马鱼机体炎症的影响
3.5.1 补骨脂不同炮制品对斑马鱼肝脏区域炎症的影响 如图7-A 所示,与空白对照组比较,补骨脂生品、盐炙法制品、酒炙法制品和清炒法制品导致了斑马鱼肝脏区域中性粒细胞的大量聚集,补骨脂雷公法制品对斑马鱼肝脏区域的中性粒细胞有轻微聚集作用。如图7-B 所示,与空白对照组比较,补骨脂生品、盐炙法制品、酒炙法制品、清炒法制品和雷公法制品显著增加了斑马鱼肝脏区域中性粒细胞的数量(P<0.05、0.001);相比补骨脂生品组,补骨脂盐炙法制品明显增加肝脏区域中性粒细胞数量(P<0.05),补骨脂雷公法制品显著减少了斑马鱼肝脏区域中性粒细胞的数量(P<0.001)。肝脏区域中性粒细胞数量由高到底排序为补骨脂盐炙法制品>补骨脂生品>补骨脂酒炙法制品>补骨脂清炒法制品>补骨脂雷公法制品。
3.5.2 补骨脂不同炮制品水提物对斑马鱼炎症相关因子mRNA 表达的影响 如图8 所示,与空白对照组比较,补骨脂生品显著提高了斑马鱼体内炎症相关基因IL-1β、NLRP3、TNF-α、NF-κBmRNA 表达水平(P<0.05、0.01、0.001),显著降低了斑马鱼体内抗炎相关基因IL-2mRNA 表达水平(P<0.05)。与补骨脂生品组比较,补骨脂雷公法制品显著逆转了TNF-αmRNA 改变并恢复正常水平(P<0.001),同时对IL-1β、NLRP3、NF-κBmRNA 表达有逆转趋势。清炒法、酒炙法及盐炙法相比空白对照组显著提升了IL-1βmRNA 水平(P<0.01、0.001),且相对补骨脂生品进一步提高了NLRP3和NF-κBmRNA 水平,但清炒法和酒炙法明显逆转了补骨脂生品对IL-2mRNA 水平的下降(P<0.05),且只有清炒法制品降低了IL-10mRNA 水平(P<0.05)。
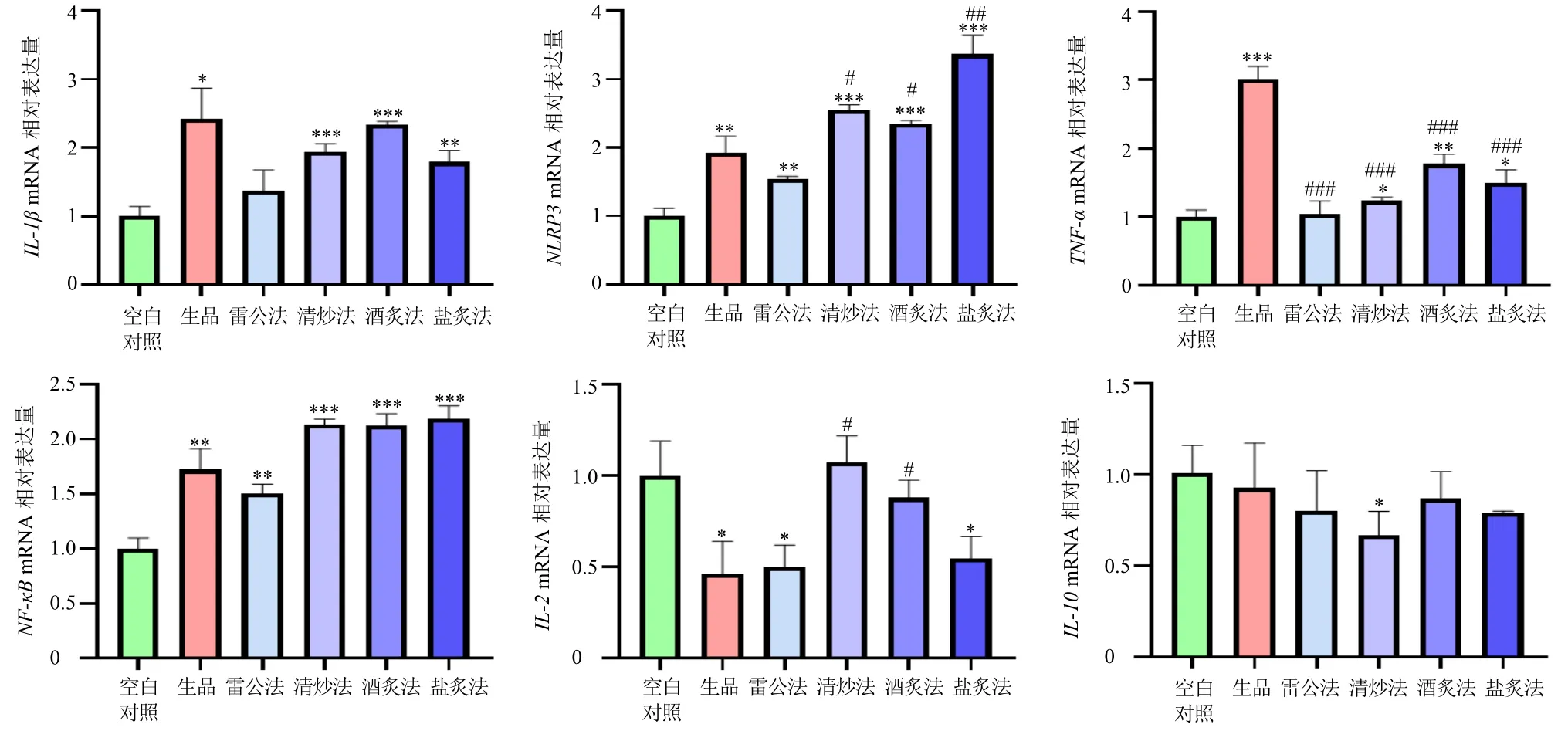
图8 补骨脂不同炮制品水提物(500 μg·mL−1)对斑马鱼炎症相关因子mRNA 表达的影响 (±s , n = 3)Fig.8 Effects of water extracts from different processed products of Psoraleae Fructus (500 μg·mL−1) on mRNA expressions of inflammation-related factors of zebrafish (±s , n = 3)
4 讨论
古籍中记载着丰富且复杂的补骨脂“炮制减毒”[17]方法,如酒炙法、雷公法、清炒法、盐炙法等,但不同炮制法的减毒效果及其科学内涵尚未进行系统研究。本研究根据历代本草记载的炮制方法,对比补骨脂不同炮制方法的减毒效果差异,为优选减毒炮制提供参考。
本研究前期通过HPLC 明确各补骨脂炮制品的主要成分补骨脂素和异补骨脂素含量,符合《中国药典》2020 年版补骨脂含补骨脂素和异补骨脂素的总量不得少于0.70%的规定,并以出膏率换算同等炮制前生药量500 μg/mL,同等生药量下,补骨脂生品的补骨脂素和异补骨脂素含量最高,雷公法制品的异补骨脂素含量最低,清炒法制品的补骨脂素含量最低。
本研究通过统计给药后斑马鱼脊椎弯曲程度、卵黄囊面积、鱼鳔缺失情况、心包水肿情况[18]以获得畸形评分[19]评价急性毒性强弱,发现基于斑马鱼模型补骨脂不同的炮制品水提物急性毒性存在差异,补骨脂生品急性毒性最强,与补骨脂不同炮制品相比同等生药量给药下补骨脂生品更易导致斑马鱼出现急性中毒死亡与严重的全身器官畸形,而不同炮制法可减轻急性毒性强度,其中雷公法的急性毒性减毒效果最佳。
本研究通过统计给药后转基因肝脏细胞绿色荧光标记斑马鱼肝脏荧光的强度、面积、体积[20],肝脏病理切片情况和转基因中性粒细胞红色荧光标记斑马鱼肝脏荧光中性粒细胞数量[21-22]来评价补骨脂不同炮制品的肝毒性强度,发现补骨脂不同的炮制品水提物肝脏毒性存在差异,补骨脂雷公法制品肝脏形态毒性、肝脏病理结构毒性、肝脏区域促炎毒性减毒效果均最为优异[23-24],这可能与雷公法导致补骨脂苷、异补骨脂苷、补骨脂素、异补骨脂素、补骨脂酚的含量明显减少和(异)补骨脂苷转化为活性成分(异)补骨脂素有关[25-26]。而相较于补骨脂生品,补骨脂盐炙法制品则进一步减弱了斑马鱼的肝脏荧光面积,加剧了肝细胞间空泡化并在补骨脂生品的肝脏促炎毒性基础上加重了肝脏区域中性粒细胞的积累,这与其他学者所得“与补骨脂生品相比补骨脂盐炙法制品肝毒性更强且补骨脂生品和盐炙法制品导致炎症升高”的实验结果[26]一致,这可能与盐炙法使补骨脂素、补骨脂二氢黄酮、补骨脂异黄酮、异补骨脂查耳酮、补骨脂查耳酮含量增加有关[15,27-29]。补骨脂清炒法制品则显著降低了斑马鱼的肝脏荧光强度,这可能与清炒法导致补骨脂苷、异补骨脂苷的总含量提高有关[30]。
炎症在药物性肝损伤等肝脏疾病发生发展中发挥关键作用[31]。IL-1β 是一种重要的促炎细胞因子,除补骨脂雷公法制品外,各炮制品组IL-1βmRNA表达水平均明显升高,提示补骨脂生品、补骨脂盐炙法制品、补骨脂酒炙法制品和补骨脂清炒法制品导致斑马鱼机体发生炎症反应。NLRP3 炎症小体是一种胞质多蛋白复合物,其异常激活与各种炎症性疾病的发病机制有关[32],除补骨脂雷公法制品外,各炮制品组NLRP3mRNA 表达水平均显著升高,补骨脂盐炙法制品组与补骨脂生品组斑马鱼相比炎症水平更高。TNF-α 是一种在炎症反应中起关键作用的细胞因子[33],补骨脂生品组显著上调了TNF-α的mRNA 表达水平,而不同炮制品显著逆转了炎症的发生,其中雷公法制品与空白对照组无显著差别。NF-κB 是炎症介质的转录激活剂[34-35],各补骨脂炮制品均显著上调了NF-κB的mRNA 表达水平,与生品相比,雷公法制品逆转了炎症水平的上升,而盐炙法、酒炙法、清炒法制品则加剧了炎症水平的上升。IL-2 是一种细胞因子,主要参与CD4+T 辅助亚群和CD4+T 调节细胞的分化和存活以及细胞毒性效应淋巴细胞的活化[36],补骨脂生品、雷公法制品、盐炙法制品组IL-2的mRNA 表达水平明显下降,提示免疫能力下降。IL-10 是一种抗炎细胞因子,在大多数免疫过程中都具有有效的抗炎和调节活性[37],提示只有清炒法明显下调了抗炎能力。不同炮制品给药组斑马鱼幼体内炎症相关因子IL-1β、NLRP3、TNF-α、NF-κBmRNA 水平与肝脏区域中性粒细胞数量结果趋势相符,提示基于斑马鱼模型补骨脂生品可能通过引起肝脏部位炎症反应导致肝损伤[38],而盐炙法可加重炎症的发生,雷公法则可减轻炎症的发生。
综上,补骨脂水提物对斑马鱼的急性毒性可通过炮制而减弱,而其肝毒性通过不同炮制除减毒外也存在增毒的情况。其中雷公法炮制对急性毒性和肝毒性的减毒效果最佳。本研究为补骨脂炮制减毒提供斑马鱼模型实验依据,表明采用合理的炮制方法可降低补骨脂急性毒性和肝脏毒性,推测补骨脂通过炮制对肝毒性的减毒机制与炎症有关。但仍需通过进一步研究揭示补骨脂炮制减毒的物质基础与作用机制,为补骨脂炮制方法的选择提供理论依据,从而达到降低补骨脂用药过程中的不良反应提升其药用价值的目的。
利益冲突所有作者均声明不存在利益冲突

