白背枫的化学成分研究
肖 碟,许浩楠,王浩鑫,陈 林,谢红茜,丁祖霄,左爱学,江志勇*
1.云南中医药大学 云南省高校民族药现代研究重点实验室 云南 昆明 650500
2.昆明医科大学药学院 云南 昆明 650500
白背枫BuddlejaasiaticaLour.为马钱科醉鱼草属药用植物[1],其根及茎叶具有抗菌[2]、降压、降糖、抗氧化及神经保护作用[3]。文献报道显示该属植物的化学成分包括苯丙素类[3]、黄酮[4]、三萜皂苷[5-6]及环烯醚萜苷类[7]等,目前关于白背枫的化学成分报道较少[2,8],为了从中寻找新的降糖活性成分,本实验对其90%甲醇提取物进行了化学成分研究,从二氯甲烷的萃取部分分离得到9 个化合物(图1),经波谱学分析,结合文献比较,分别鉴定为(S)-1,4-di(benzo[d][1,3]dioxol-5-yl)-3-(hydroxymethyl)butan-2-one(1)、meridinol(2)、3,3'-bis(3,4-dihydro-4-hydroxy-6-methoxy-2H-1-benzopyran,3)、protocatechualdehyde(4)、丁香醛(syringaldehyde,5)、3,4-二甲氧基桂皮酸(3,4-dimethoxycinnamic acid,6)、4-甲氧基桂皮酸(4-methoxycinnamic acid,7)、异东莨菪内酯(isoscopoletin,8)、松柏醛(coniferaldehyde,9)。其中化合物1 为1 个结构较新颖的降木脂素,命名为白背枫酮;除化合物6 外,其余化合物均为首次从该植物中分离得到。并考察了化合物对α-葡萄糖苷酶的抑制活性。

图1 化合物1~9 的结构Fig.1 Structures of compounds 1—9
1 仪器与材料
Autopol V Plus 型比旋光测定分析仪(美国Rudolph 公司);Agilent 6030 Q-TOF 型质谱仪(美国Agilent 公司);Bruker AM-600 型核磁共振仪(瑞士Bruker 公司);UV5Bio 紫外可见分光光度计(瑞士Mettler Toledo 公司);柱色谱硅胶(200~300 目)、薄层色谱硅胶GF254(青岛美高化工有限公司);MCI(日本三菱化工),Sephadex LH-20(Pharmacia 公司)。HPLC 为Aglilent 1260 半制备液相色谱仪(美国安捷伦科技公司)。Shimadzu shim-pack GIS 色谱柱(日本岛津公司);C18柱色谱硅胶(德国默克公司);高效液相色谱仪使用色谱纯甲醇(德国默克公司)和娃哈哈纯净水,其余试剂为工业纯二次重蒸试剂。α-葡萄糖苷酶(上海宝曼生物科技有限公司);阿卡波糖(Acarbose,质量分数为99%,Sigma公司)
样品干燥白背枫的茎叶于2020 年9 月采自丽江,经中国科学院西双版纳热带植物园周仕顺高级工程师鉴定为白背枫B.asiaticaLour.。标本(YUTCM-2020092)保存于云南省高校民族药现代研究重点实验室。
2 提取与分离
干燥白背枫的茎叶(9.5 kg)粉碎后,用8 倍质量的90%甲醇-水(90∶10)回流提取3 次,每次2 h,合并提取液浓缩得浸膏1.5 kg。将浸膏混悬于适量的水中,依次用石油醚、二氯甲烷、醋酸乙酯萃取,得到石油醚浸膏165 g、二氯甲烷浸膏117 g、醋酸乙酯浸膏79 g。石油醚部分浸膏(165 g)经硅胶柱色谱分离,二氯甲烷-甲醇(100∶0、98∶2、95∶5、90∶10)梯度洗脱,经过TLC 检测合并相同组分,得到5 个组分Fr.1~5。
取Fr.2(15 g),以MCI 柱色谱脱色,甲醇-水(50∶50→100∶0)梯度洗脱,得到4 个流分(Fr.2.1~2.4),其中Fr.2.1(3 g)石油醚-醋酸乙酯(98∶2→70∶30)为洗脱剂进行梯度洗脱分离,后采用半制备HPLC 分离纯化得到化合物2(59 mg)、4(4 mg)。Fr.2.2(5 g)经过反相C18柱色谱,以甲醇-水(60∶40→100∶0)梯度洗脱,后经过HPLC(流动相:甲醇-水80∶20)分离,再经过Sephadex LH-20甲醇-二氯甲烷(1∶1),得到化合物1(10 mg)、3(8 mg)和6(30 mg)。Fr.2.3(4 g)以石油醚-丙酮(90∶10→60∶40)为洗脱剂进行梯度洗脱分离后再进一步用经半制备HPLC(流动相:甲醇-水76∶24)纯化得到化合物5(tR=14.5 min,8 mg)、7(tR=18.5 min,11 mg)、8(tR=23.9 min,2 mg)。Fr.2.4(1 g)经过反相C18柱色谱,以甲醇-水(70∶30→100∶0)梯度洗脱,再经过半制备HPLC 分离(流动相:甲醇-水68∶32)纯化得到化合物9(tR=17.6 min,5 mg)。
3 结构鉴定
化合物1:白色无定型粉末。[α]20.1D−19.5º (c0.04,MeOH)。其HRESIMS (−) 在m/z341.102 4 [M-H]−(计算值341.102 5,C19H17O6)处给出去氢离子峰,提示其分子式为C19H18O6,不饱和度为11。化合物1 的红外(IR)光谱显示分子中存在羟基(3 506 cm−1)、羰基(1 692 cm−1)和芳环(1 607、1 496、1 443 cm−1)等官能团。1H-NMR (600 MHz, CDCl3)(表1)中,在δH6.50 (1H, dd,J= 8.0, 1.9 Hz), 6.51(1H, d,J= 1.8 Hz), 6.71 (1H, d,J= 8.0 Hz) 和δH6.55 (1H, dd,J= 7.9, 1.6 Hz), 6.57 (1H, d,J= 1.6 Hz), 6.71 (1H, d,J= 8.0 Hz) 处给出2 组芳环质子信号,揭示结构中存在2 个1,3,4-三取代的苯环片。表1 中给出19 个碳原子信号,包括1 个酮羰基、2个芳环(12 个芳基碳原子)、5 个亚甲基和1 个次甲基。其中δC101.2 和101.1 处给出的2 个二氧亚甲基碳原子信号与氢谱中给出的二氧亚甲基质子信段,此外还在δH5.934 和5.929 处观察到2 个二氧亚甲基质子信号。其13C-NMR (150 MHz, CDCl3) 谱信号相符,进一步证实了分子中存在2 个二氧亚甲基官能团。仔细对比化合物1 和本研究分离得到的已知木脂素类化合物meridinol(2)[9-10]图谱显示,2 个化合物的芳环上的波谱数据极为相似,提示两者有相同的芳环连接取代。不同之处在于化合物1 的低场部分多出1 个酮羰基碳原子信号,同时少了1 个酯羰基,此外分子中的总碳原子也较meridinol 少了1个,提示化合物1 可能为1 个降木脂素类化合物。

表1 化合物1 的1H-和13C-NMR 数据 (600/150 MHz,CDCl3)Table 1 1H- and 13C-NMR data of compound 1 (600/150 MHz, CDCl3)
为了明确化合物1 的结构,测试了其2D 相关图谱。如图2 所示,化合物1 的HMBC 谱中,δH5.934处的二氧亚甲基的质子信号分别与A 环中的C-3(δC147.9) 和C-4 (δC146.8) 相关,而δH5.929 处的二氧亚甲基的质子信号与B 环的C-3'(δC147.8) 和C-4'(δC146.3) 相关,表明化合物1 中存在与meridinol 相同连接的2 个二氧亚甲基。其HMBC谱中还给出H2-7 (δH3.54, d,J= 15.7 Hz;3.49, d,J=15.7 Hz) 与羰基 (δC211.8) 和C-1 (δC126.9), C-2(δC110.0) 及C-6 (δC122.9) 相关,提示C-7 与芳环A 和羰基相连。此外还观察到H2-7'(δH2.80, dd,J=13.7, 8.2 Hz;2.68, dd,J= 13.7, 7.0 Hz) 分别与C-1'(δC132.4), C-2'(δC109.3), C-6'(δC122.0) 的远程相关,提示C-7'与芳环B 相连。同时,在1H-1H COSY(图2)中清晰地给出H2-7'/H-8', H-8'/H-9'的相关,推测分子中存在C-7'/8'/9'片段。根据HMBC(图2)远程相关谱中H2-7'、H-8'、H-9'与羰基 (δC211.8) 相关,以及H-8'与C-7 相关,揭示分子中的羰基与C-8'相连;通过上述相关波谱分析,最终将化合物1 的结构鉴定为如图1 所示,为1 个新的降木脂素。
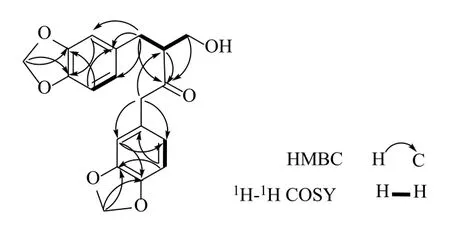
图2 化合物1 的关键HMBC 和COSY 相关Fig.2 Key HMBC and COSY correlations of compound 1
化合物1 中仅存在1 个手性碳C-8',因此其实验旋光值可以作为确定其绝对构型的理想方法。遗憾的是,目前未见与化合物1 手性碳连接相近的化合物文献报道,故无法借助文献确定化合物1 的绝对构型。为了进一步明确化合物1 中C-8'的绝对构型,通过计算化学的方法计算了该化合物的旋光,结果显示,当C-8'的绝对构型为S时,其旋光值为负值 (−5.16º),而其实验旋光值为负值 (−19.5º),表明化合物1 中C-8'为S。
综合以上分析,最终将化合物1 的结构鉴定为如图1 所示,命名为白背枫酮 [(−)asiaticaone,1]。
化合物2:白色无定型粉末。ESI-MSm/z: 371[M+H]+。1H-NMR (600 MHz, CDCl3)δ: 6.75 (1H, d,J= 8.0 Hz, H-5), 6.74 (1H, d,J= 8.0 Hz, H-5′), 6.68(1H, d,J= 1.5 Hz, H-2′), 6.61 (1H, dd,J= 1.6, 7.9 Hz, H-6′), 6.60 (1H, d,J= 1.4 Hz, H-2), 6.58 (1H, dd,J= 1.4, 7.9 Hz, H-6), 3.98~4.04 (2H, m, H-9), 3.05(2H, d,J= 13.8 Hz, H-7′a), 2.92 (2H, d,J= 13.8 Hz,H-7′b), 2.87 (1H, m, H-8), 2.48~2.52 (2H, m, H-7);13C-NMR (150 MHz, CDCl3)δ: 132.3 (C-1), 108.5(C-2), 148.0 (C-3), 147.1 (C-4), 109.3 (C-5), 121.9 (C-6),31.8 (C-7), 44.1 (C-8), 70.1 (C-9), 101.2 (OCH2O),127.9 (C-1′), 108.6 (C-2′), 148.0 (C-3′), 146.4 (C-4′),110.5 (C-5′), 123.5 (C-6′), 42.3 (C-7′), 76.4 (C-8′), 178.5(C-9′), 101.1 (OCH2O)。上述波谱数据与文献报道一致[9-10],故鉴定为化合物2 为meridinol。
化合物3:白色无定型粉末。ESI-MSm/z: 357[M-H]−。1H-NMR (600 MHz, CDCl3)δ: 6.90 (2H, d,J= 2.1 Hz, H-5, 5′), 6.89 (2H, d,J= 8.1 Hz, H-8, 8′),6.82 (2H, dd,J= 2.1, 8.1 Hz, H-7, 7′), 4.74 (2H, d,J=4.3 Hz, H-4, 4′), 4.25 (2H, dd,J= 6.9, 9.1 Hz, H-2a,2′a), 3.90 (6H, s, -OCH3), 3.88 (2H, dd,J= 3.7, 9.2 Hz, H-2e, 2′e ), 3.10 (2H, m, H-3, 3′);13C-NMR (150 MHz, CDCl3)δ: 71.8 (C-2, 2′), 54.3 (C-3, 3′), 86.0(C-4, 4′), 114.4 (C-5, 5′), 146.8 (C-6, 6′), 119.1 (C-7,7′), 108.7 (C-8, 8′), 145.4 (C-9, 9′), 133.0 (C-10, 10′),56.1 (OCH3)。上述波谱数据与文献报道一致[11],故鉴定为化合物3 为3,3'-bis(3,4-dihydro-4-hydroxy-6-methoxy-2H-1-benzopyran)。
化合物4:淡黄色无定型粉末。ESI-MSm/z: 137[M-H]−。1H-NMR (600 MHz, CD3OD)δ: 9.69 (1H,s, -CHO), 7.31 (1H, d,J= 2.4 Hz, H-2), 7.30 (1H, dd,J= 2.4, 8.3 Hz, H-6), 6.90 (1H, d,J= 7.9 Hz, H-5);13C-NMR (150 MHz, CD3OD)δ: 130.8 (C-1), 115.4(C-2), 147.2 (C-3), 153.8 (C-4), 116.3(C-5), 126.4 (C-6),193.1 (C-7)。上述波谱数据与文献报道一致[12],故鉴定为化合物4 为protocatechualdehyde。
化合物5:黄色无定型粉末。ESI-MSm/z: 205[M+Na]+。1H-NMR (600 MHz, CDCl3)δ: 9.80 (1H,s, -CHO), 7.13 (2H, s, H-2, 6), 3.94 (6H, s, -OCH3);13C-NMR (150 MHz, CDCl3)δ: 190.9 (CHO), 128.5(C-1), 106.8 (C-2, 6), 147.5 (C-3, 5), 141.0 (C-4), 56.6(3,5-OCH3)。上述光谱数据与文献报道一致[13],故鉴定为化合物5 为丁香醛。
化合物6:白色无定型粉末。ESI-MSm/z: 231[M+Na]+。1H-NMR (600 MHz, C5D5N)δ: 8.11 (1H,d,J= 16.0 Hz, H-7), 7.34 (1H, d,J= 1.8 Hz, H-2),7.27 (1H, dd,J= 1.8, 8.4 Hz, H-6), 6.94 (1H, d,J=8.4 Hz, H-5), 6.92 (1H, d,J= 16.0 Hz , H-8), 3.80,3.76, (各3H, s, CH3O×2);13C-NMR (150 MHz,C5D5N)δ: 128.7 (C-1), 111.4 (C-2), 150.6 (C-3),152.2 (C-4), 112.5 (C-5), 123.2 (C-6), 118.7 (C-7),144.9 (C-8), 169.9 (COOH)。上述波谱数据与文献报道一致[14],故鉴定为化合物6 为3,4-二甲氧基桂皮酸。
化合物7:无色针状晶体(甲醇)。ESI-MSm/z:201 [M+Na]+。1H-NMR (600 MHz, CD3OD)δ: 7.62(1H, d,J= 15.9 Hz, H-7), 7.54 (2H, d,J= 8.7 Hz,H-2, 6), 6.95 (2H, d,J= 8.8 Hz, H-3, 5), 6.33 (1H, d,J= 15.9 Hz, H-8), 3.83 (3H, s, 4-OCH3);13C-NMR(150 MHz, CD3OD)δ: 128.6 (C-1), 130.9 (C-2,6),115.4 (C-3,5), 163.1 (C-4), 146.3 (C-7), 116.6 (C-8),170.8 (C-9), 55.8 (CH3O)。上述波谱数据与文献报道一致[15],故鉴定为化合物7 为4-甲氧基桂皮酸。
化合物8:黄色针晶(甲醇)。ESI-MSm/z: 215[M+Na]+。1H-NMR (600 MHz, CD3OD)δ: 7.82 (1H,d,J= 9.4 Hz, H-4), 6.98 (1H, s, H-5), 6.97 (1H, s,H-8), 6.24 (1H, d,J= 9.4 Hz, H-3), 3.95 (3H, s,-OCH3);13C-NMR (150 MHz, CD3OD)δ: 164.0(C-2), 113.5 (C-3), 145.9 (C-4), 110.6 (C-5), 153.5(C-6), 145.3 (C-7), 112.9 (C-8), 150.3 (C-9), 113.4(C-10), 56.9 (OCH3)。上述波谱数据与文献报道一致[16],故鉴定化合物8 为异东莨菪内酯。
化合物9:淡黄色油状物。ESI-MSm/z: 179.07[M+H]+。1H-NMR (600 MHz, CDCl3)δ: 9.65 (1H, d,J= 7.7 Hz, H-9), 7.40 (1H, d,J= 15.7 Hz, H-7), 7.12(1H, dd,J= 1.5, 8.1 Hz, H-5), 7.07 (1H, d,J= 1.5 Hz,H-3), 6.96 (1H, d,J= 8.2 Hz, H-6), 6.59 (1H, dd,J=7.8, 15.8 Hz, H-8), 5.95 (1H, s, -OH), 3.95 (3H, s,-OCH3);13C-NMR (150 MHz, CDCl3)δ: 149.1 (C-1),147.1 (C-2), 109.6 (C-3), 126.8 (C-4), 124.2(C-5),115.1 (C-6), 153.3 (C-7), 126.6 (C-8), 193.8 (C-9)。上述光谱数据与文献报道一致[17],故鉴定为化合物9为松柏醛。
4 α⁃葡萄糖苷酶抑制活性
采用本研究组前期报道[18]的分光光度法,以阿卡波糖为阳性对照,对本实验中分离得到5 mg 以上的化合物1、3、5~7、9 进行了α-葡萄糖苷酶抑制活性的筛选。结果显示,化合物3 对α-葡萄糖苷酶有一定的抑制作用,IC50为41.3 μmol/L,其余化合物均未显示出对α-葡萄糖苷酶的抑制作用。
利益冲突所有作者均声明不存在利益冲突

