铁轴草化学成分及其对HT-22 细胞铁死亡抑制活性研究
王 欢 ,刘翰飞 ,舒晓蝶 ,李金玉 ,娄华勇 *,潘卫东
1.贵州医科大学 省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014
2.贵州省天然产物研究中心,贵州 贵阳 550014
3.贵州医科大学药学院,贵州 贵阳 550025
唇形科药用植物资源丰富,是现代药理学以及植物化学重点研究对象之一。其中香科科属TeucriumLinn.铁轴草TeucriumquadrifariumBuch.-Ham.植物具有祛风解暑、利湿消肿、凉血解毒之功效;民间用全草治劳伤水肿、风湿痛、中暑不出汗、感冒咳嗽,根治肚胀、泻痢,叶用于止血、治刀枪伤、蜂蛰肿痛[1-3]。近年来对铁轴草化学成分的研究相对较少,仅报道了几个萜类[4-5]和黄酮类[6-7]化合物,其中分离鉴定的单体化合物药理活性主要一些常见的筛选模型,如杀虫拒食活性[8]、抗菌[9]、抗炎[10]、抗肿瘤[11]等。铁死亡(ferroptosis)是一种铁依赖性的、以脂质过氧化为主要特征的新型程序性细胞死亡形式,机体正常细胞发生铁死亡则会引起诸多疾病,特别是神经系统疾病如阿尔茨海默症、帕金森病、脑卒中等[12]。结合铁轴草的解暑和解毒功效,推测其对于神经系统疾病可能也有一定的治疗作用。因此本研究采用硅胶柱色谱、薄层色谱、C18反相柱色谱及半制备高效液相色谱等分离手段对铁轴草乙醇提取物的石油醚部位进行系统分离纯化,并利用现代波谱方法与文献对比等方式对分离得到的单体化合物进行结构鉴定,共鉴定16 个化合物,分别为 (4R,5S,7R)-木萝烷-1(6),10(14)-二烯-4,5-二醇 [(4R,5S,7R)-muurol-1(6),10(14)-diene-4,5-diol,1]、对甲磺酰甲基苯酚(p-methylsulfonylmethyl-phenol,2)、合欢金素(acacetin,3)、6,4′-二甲氧基-野黄芩苷( 6,4′-dimethoxyl-scutellarin,4 )、香叶木素( diosmetin,5 )、去甲氧基矢车菊黄酮素(demethoxycentaureidin,6)、5-羟基-3,3′,4′,5′,7-五甲氧基黄酮(combretol,7)、蓟黄素(cirsimaritin,8)、吲哚-3-甲酸乙酯(ethyl indole-3-carboxylate,9)、13-酮-9,11-十八碳二烯酸 [(9Z,11E)-13-oxo-9,11-ocatadecadienoic acid,10]、9-酮-10,12-十八碳二烯酸 [(E,E)-9-oxooctadeca-10,12-dienoic acid,11]、α-托可醌(α-tocopherolquinone,12)、N-苯甲酰-L-苯丙氨酰-N-苯甲酰-L-苯丙氨酸酯(N-benzoyl-Lphenylalaninyl-N-benzoyl-L-phenylalaninate,13)、金色酰胺醇酯(aurantiamide acetate,14)、2″,3″-乙酰马蒂罗苷(2″,3″-O-acetylmartynoside,15)、香草醛(vanillic,16)。其中,化合物1 是新的杜松烷型倍半萜类化合物,命名为铁轴草素A;化合物2、4、6、7、9~16 为首次从香科科属植物中分离得到。采用MTT 法对分离得到的大部分化合物进行了体外抑制细胞铁死亡活性,其中化合物7、9 对铁死亡诱导剂RSL3 诱导的HT-22 细胞损伤有不同程度的抑制作用,EC50分别为(1.46±0.49)μmol/L 和(3.31±1.66)μmol/L。
1 仪器与材料
INOVA-600 MHz 核磁共振仪(美国Varian 公司);Agilent 1100 高效液相色谱仪(美国安捷伦公司);半制备高效液相色谱仪(江苏汉邦科技有限公司);YMC C18半制备色谱柱(250 mm×10 mm,5 μm);Waters XBridge BEH Amide OBD 半制备色谱柱(250 mm×10 mm,5 μm,美国Waters 公司);Hei-VAP Digital G3 旋转蒸发仪(德国Heidolph 公司);ZF−7N 型智能暗箱式三用紫外分析仪(上海嘉鹏科技有限公司);ME204E/02 型电子分析天平(瑞士Mettler Toledo 公司);DLSB-5/20 型低温冷却液循环泵(郑州长城科工贸有限公司);Sephadex LH-20 凝胶(瑞典Amersham 公司);RP-18、MCI反相填料(德国默克公司);硅胶(60~80、100~200、300~400 目,青岛海洋化工厂);薄层硅胶板(烟台江友硅胶发展有限公司);色谱甲醇、氘代甲醇 [萨恩化学技术(上海)有限公司];其他试剂均为分析纯,水为超纯水。
小鼠海马神经元细胞系HT-22 细胞(武汉普诺赛生命科技有限公司);铁死亡诱导剂RSL3(北京索莱宝科技有限公司);二氧化碳细胞培养恒温箱(上海力申科学仪器有限公司);超净工作台(浙江孚夏医疗科技有限公司);倒置显微镜(舜宇光学科技有限公司);酶标仪(赛默飞世尔科技,美国);恒温水浴锅(深圳市鼎鑫宜实验设备有限公司);细胞培养皿(无锡耐思生命科技股份有限公司);DMEM 高糖培养基(gibco);青链霉素混合液(北京索莱宝科技有限公司);胰蛋白酶(北京索莱宝科技有限公司);噻唑蓝(北京索莱宝科技有限公司);PBS 缓冲液(武汉赛维尔生物科技有限公司)。
铁轴草于2021年8月采集于贵州省平塘县者密镇红旗村,经贵州省药用植物园侯小琪副教授鉴定为铁轴草T.quadrifariumBuch.-Ham.全草,样品(凭证标本号TZC20210806)保存在贵州省天然产物研究中心。
2 方法
2.1 提取与分离
干燥的铁轴草全草20.0 kg,粉碎,用95%乙醇回流提取3 次,每次2 h,得到的提取液减压浓缩至无醇味,回收溶剂得到粗提物浸膏,浸膏用热水分散,依次用石油醚、醋酸乙酯萃取,减压回收溶剂得石油醚萃取部位(1 047.4 g)和醋酸乙酯萃取部位(819.9 g)。
石油醚部位经硅胶柱色谱分离,以石油醚:醋酸乙酯(100∶0~0∶100)梯度洗脱,薄层色谱检测合并得到7 个流分(Fr.A~G)。Fr.D 经MCI 反相柱色谱分离,以甲醇-水(60%~95%)梯度洗脱,薄层色谱检测合并得到8 个流分(Fr.D1~8)。Fr.D1经硅胶柱色谱和半制备HPLC(32%甲醇)纯化得到化合物2(23.1 mg,tR=19.6 min)和3(35.0 mg,tR=15.6 min)。Fr.D5 经硅胶柱色谱,石油醚-醋酸乙酯(10∶1~0∶10)与二氯甲烷-甲醇(30∶1~1∶1)梯度洗脱分为10 个流分(Fr.D5.1~D5.10),Fr.D5.4 析出黄色针状晶体为化合物4(32.2 mg);Fr.D5.7 经反复硅胶、凝胶Sephadex LH-20 柱色谱后,再经半制备HPLC 纯化(57%甲醇)得到化合物9(6.2 mg,tR=24.8 min)、10(15.6 mg,tR=42.5 min)和11(9.5 mg,tR=48.6 min)。Fr.D6 经反复经硅胶、Sephadex LH-20 分离,再经半制备HPLC 纯化(76%甲醇)得到化合物7(3.7 mg,tR=39.5 min)、13(4.9 mg,tR=32.5 min)和14(4.4 mg,tR=12.5 min)。Fr.D7 经硅胶柱色谱,石油醚-醋酸乙酯(100∶0~0∶100)梯度洗脱分为5 个流分(Fr.D7.1~D7.5),Fr.D7.3 进一步经硅胶柱色谱、半制备HPLC 纯化(99%乙腈)得到化合物12(1.9 mg,tR=49.0 min)。Fr.E 经反相C18柱色谱分离,甲醇-水(30%~95%)梯度洗脱得到8 个流分(Fr.E1~E8)。Fr.E2 经硅胶柱色谱,二氯甲烷-甲醇(100∶0~0∶100)梯度洗脱得到6 个流分(Fr.E2.1~E2.6);Fr.E2.4 经凝胶Sephadex LH-20 洗脱后析出黄色粉末状固体,得到化合物5(25.6 mg)。Fr.E2.2经硅胶柱色谱、半制备HPLC(75%甲醇)得到化合物1(2.5 mg,tR=32.5 min)。Fr.E2.3 经半制备HPLC 纯化得到化合物15(49.2 mg,tR=50.0 min)和16(1.3 mg,tR=32.5 min)。Fr.E2.5 经Sephadex LH-2 柱色谱与半制备HPLC(65%甲醇)得到化合物6(1.5 mg,tR=25.5 min)。Fr.E2.6 经硅胶柱色谱与凝胶柱色谱得到化合物8(2.0 mg)。
2.2 化合物1 的化学计算
化合物1 经Spartan 软件进行构象搜索后,最优构象用gaussian 16 的b3lyp/6-31(d)基组进行构象优化,确定无虚频后,得到的构象用gaussian16的b3lyp/6-31+(d,p)基组进行电子圆二色谱(electronic circular dichroism,ECD)计算,得到的数据经SpecDis 软件生成图像文件,再与化合物1测试的CD 谱进行对比确定化合物的绝对构型。
2.3 HT-22 细胞铁死亡抑制活性测试
用 DMEM 高糖培养基 [含 10%胎牛血清(FBS),含青霉素链霉素双抗、谷丙酰胺各1%] 培养HT-22 细胞。将细胞置于37 ℃、5% CO2细胞培养箱中进行传代培养,取对数生长期细胞用于实验。将RSL3 溶于DMSO,配制为5 mmol/L 母液,使用时工作浓度为1 μmol/L,实验分为含完全培养基的对照组、模型(RSL3)组、RSL3+药物组、RSL3+阳性药组 [铁死亡抑制剂ferrostatin-1(Fer-1)作为阳性药],每组3 个平行。将细胞以3×103个/孔接种于96 孔板,每孔90 μL 完全培养基,置于培养箱中培养24 h 后给药,药物和RSL3 按照浓度各加入10 μL 于96 孔板中,48 h 后加MTT,4 h 后吸取上清液,加DMSO,在490 nm 波长下测定吸光度(A)值。
2.4 统计分析
采用统计软件GraphPad Prims 8.0 进行数据分析,实验结果表示为±s,使用单因素方差分析和t检验评估数据的重要性。P<0.05 表示差异有统计学意义。
3 结果
3.1 结构鉴定
化合物1:白色无定形粉末(甲醇)。[α]25D−331.372 (c1.025, MeOH);;HR-ESI-MSm/z: 259.166 9 [M+Na]+(计算值259.165 7,C15H24O2Na),分子式为C15H24O2,不饱和度为4。化合物1 的1H-NMR(表1)中显示出3 个甲基氢信号 [δH0.76 (3H, d,J= 6.6 Hz), 0.98(3H, d,J= 7.2 Hz), 1.25 (3H, s)] 和2 个单峰烯氢信号δH4.95 (1H, s),δH4.80 (1H, s)。结合13C-NMR(表1)和HMQC 谱图数据分析,显示该化合物有15 个碳信号,分别为3 个甲基碳、5 个亚甲基碳、3 个次甲基碳和4 个季碳。通过13C-NMR 数据与文献报道[13]对比发现化合物1 与 (4R,5R)-木萝烷-1(6),10(14)-二烯-4,5-二醇较为相似,两者明显的差别为化合物1 的C-5 与已知化合物的C-5 化学位移相差δ4.1,其余位置相差在δ1.0 左右,初步推测是由于C-5为的差向异构引起,故推测化合物1 也是1 个杜松烷型倍半萜类化合物,且是已知化合物的差向异构体。
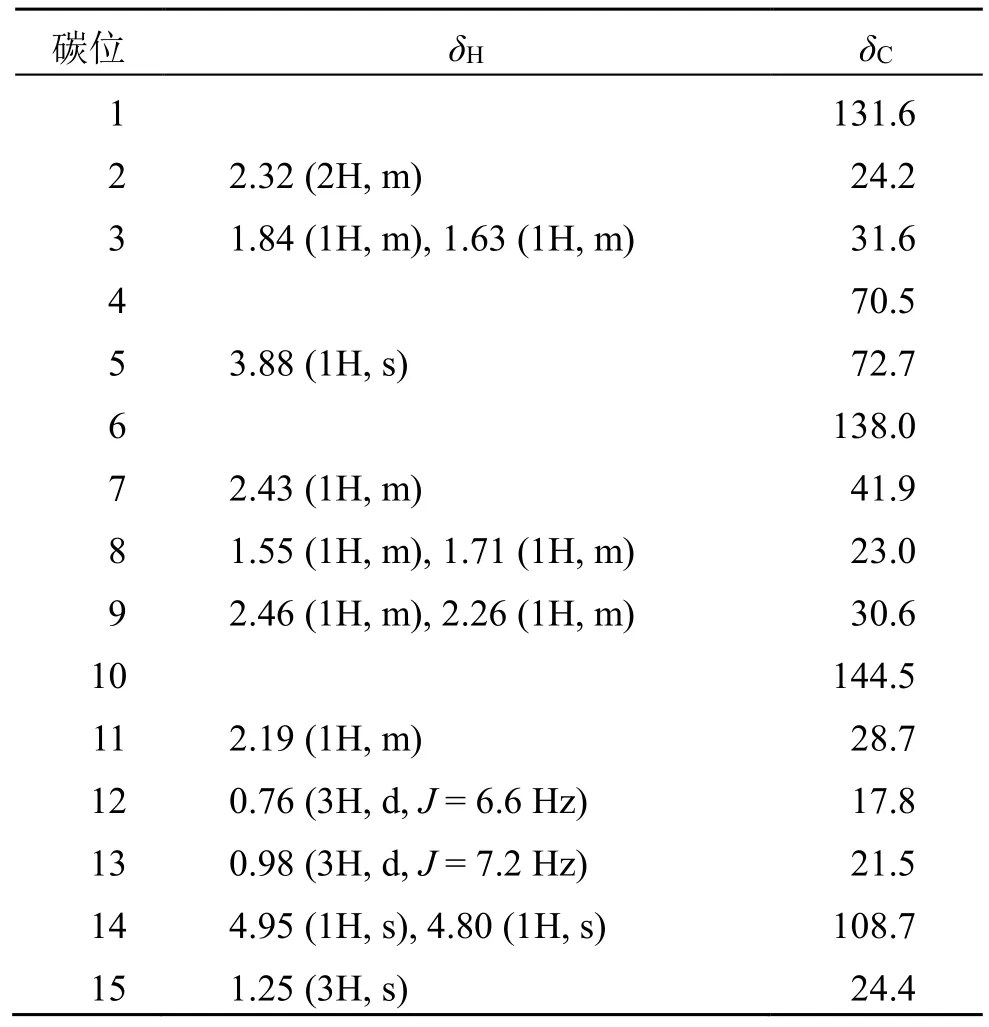
表1 化合物1 的1H-NMR (600 MHz, CDCl3) 和13C-NMR(150 MHz, CDCl3) 数据Table 1 1H NMR (600 MHz, CDCl3) and 13C NMR (150 MHz, CDCl3) data for compound 1
进一步通过HMBC 谱(图1),可以发现存在H-2 (δH2.32) 与C-1、C-6 相关,H-8 (δH1.71, 1.55)与C-6、C-10 相关,H-7 (δH2.43) 与C-5、C-6 相关,H-14 (δH4.80, 4.95) 与C-1、C-9 相关,以及Me-15(δH1.25)与 C-3、C-4、C-5 相关,加之存在的Me-13/H-11/H-7/H-8/H-9 的1H-1H COSY 相关信号(图1),进一步确定化合物1 的平面结构与 (4R,5R)-木萝烷-1(6),10(14)-二烯-4,5-二醇一致。化合物1 相对构型通过NOESY 谱解析,在NOESY 谱(图1)中存在Me-15/H-5 以及H-5/H-7 相关信号,表明Me-15、H-5、H-7 在同一朝向。进一步通过计算ECD的方法,通过比对化合物1 的实验ECD 与计算ECD图谱(图2),最终确定了化合物1 的绝对构型为(4R,5S,7R)。因此化合物1 的结构鉴定为 (4R,5S,7R)-木萝烷-1(6),10(14)-二烯-4,5-二醇,为1 个新化合物,命名为铁轴草素A。
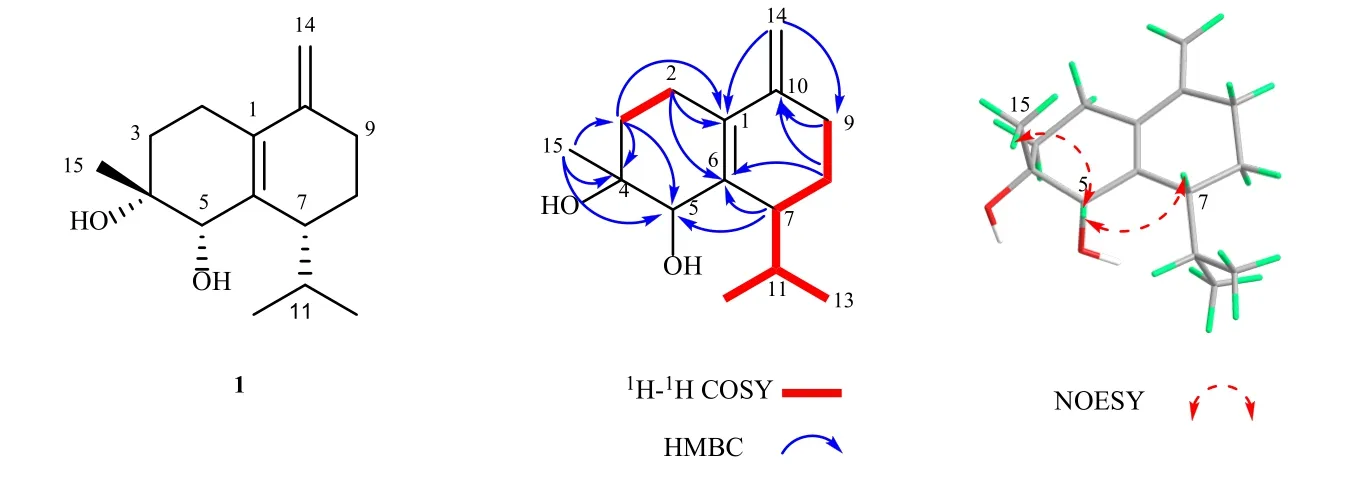
图1 化合物1 的关键1H-1H COSY、HMBC 和NOESY 相关信息Fig.1 Key 1H-1H COSY, HMBC and NOESY correlations of compound 1

图2 化合物1 的测试和计算ECD 谱Fig.2 Experimental and calculated ECD spectra of compound 1
化合物2:白色粉末;ESI-MSm/z: 209.0 [M+Na]+;1H-NMR (600 MHz, CD3OD)δ: 7.26 (2H, d,J=8.4 Hz, H-3, 5), 6.82 (2H, d,J= 8.4 Hz, H-2, 6), 4.30(2H, s, H-1′), 2.82 (3H, s, H-2′);13C-NMR (150 MHz,CD3OD)δ: 159.5 (C-1), 133.3 (C-2, 6), 120.5 (C-4),116.6 (C-3, 5), 60.8 (C-2′), 39.2 (C-1′)。以上数据与文献报道基本一致[14],故鉴定化合物2 为对甲磺酰甲基苯酚。
化合物3:黄色粉末;ESI-MSm/z: 283.1 [MH]−。1H-NMR (600 MHz, DMSO-d6)δ: 12.90 (1H, s,5-OH), 7.98 (2H, d,J= 9.0 Hz, H-2′, 6′), 7.07 (2H, d,J= 9.0 Hz, H-3′, 5′), 6.80 (1H, s, H-3), 6.46 (1H, d,J= 2.4 Hz, H-8), 6.18 (1H, d,J= 2.4 Hz, H-6), 3.83(3H, s, 4′-OCH3);13C NMR (150 MHz, DMSO-d6)δ:181.8 (C-4), 164.7 (C-7),163.3 (C-2), 162.3 (C-4′),161.5 (C-9), 157.4 (C-5), 128.3 (C-2′, 6′), 122.9(C-1′), 114.6 (C-3′, 5′), 103.7 (C-10), 103.5 (C-3),99.1 (C-6), 94.1 (C-8), 55.6 (4′-OCH3)。以上数据与文献报道基本一致[15],故鉴定化合物3 为合欢金素。
化合物4:黄色针状晶体(甲醇),mp 223~224 ℃;ESI-MSm/z: 315.1 [M+H]+;1H-NMR (600 MHz, DMSO-d6)δ: 13.02 (1H, s, 5-OH), 10.74 (1H, s,7-OH), 8.01 (2H, d,J= 9.0 Hz, H-2′, 6′), 7.09 (2H, d,J= 9.0 Hz, H-3′, 5′), 6.85 (1H, s, H-3), 6.60 (1H, s,H-8), 3.85 (3H, s, 4′-OMe), 3.75 (3H, s, 6-OMe);13CNMR (150 MHz, DMSO-d6)δ: 182.2 (C-4), 163.4(C-2), 162.3 (C-4′), 157.4 (C-9), 152.8 (C-7), 152.5(C-5), 131.4 (C-6), 128.3 (C-2′, 6′), 122.9 (C-1′),114.6 (C-3′, 5′), 104.2 (C-10), 103.1 (C-3), 94.3 (C-8),60.0 (6-OMe), 55.6 (4′-OMe)。以上数据与文献报道基本一致[16],故鉴定化合物4 为6,4′-二甲氧基-野黄芩苷。
化合物5:淡黄色粉末;ESI-MSm/z: 301.1 [M+H]+;1H-NMR (600 MHz, DMSO-d6)δ: 12.93 (1H, s,5-OH), 10.83 (1H, s, 7-OH), 9.45 (1H, s, 3′-OH), 7.53(1H, dd,J= 8.4, 2.4 Hz, H-6′), 7.42 (1H, d,J= 2.4 Hz, H-2′), 7.07 (1H, d,J= 8.4 Hz, H-5′), 6.74 (1H, s,H-3), 6.46 (1H, d,J= 2.4 Hz, H-8), 6.19 (1H, d,J=1.8 Hz, H-6), 3.86 (3H, s, 4′-OCH3);13C-NMR (150 MHz, DMSO-d6)δ: 181.7 (C-4), 164.2 (C-7), 163.5(C-2), 161.5 (C-9), 157.3 (C-5), 151.1 (C-4′), 146.8(C-3′), 123.0 (C-6′), 118.7 (C-1′), 113.0 (C-2′), 112.1(C-5′), 103.8 (C-3), 103.5 (C-10), 98.9 (C-6), 93.9(C-8), 55.8 (4′-OCH3)。以上数据与文献报道基本一致[15],故鉴定化合物5 为香叶木素。
化合物6:黄色粉末;ESI-MSm/z: 331.1 [M+H]+;1H-NMR (600 MHz, DMSO-d6)δ: 12.93 (1H, s,5-OH), 9.97 (1H, s, 7-OH ), 9.36 (1H, s, 3′-OH), 7.43(2H, m, H-2′, 6′), 6.90 (1H, d,J= 9.0 Hz, H-5′), 6.83(1H, s, H-3), 6.70 (1H, s, H-8), 3.91 (3H, s, 6-OCH3),3.73 (3H, s, 4′-OCH3);13C NMR (150 MHz,DMSO-d6)δ: 182.1 (C-4), 164.2 (C-2), 158.6 (C-9),152.6 (C-5), 152.1 (C-7), 149.8 (C-4′), 145.8 (C-3′),131.9 (C-6), 121.5 (C-1′), 119.1 (C-6′), 115.9 (C-5′),113.5 (C-2′), 105.1 (C-10),102.7 (C-3), 91.4 (C-8),60.0 (6-OCH3), 56.4 (4′-OCH3)。以上数据与文献报道基本一致[17],故鉴定化合物6 为去甲氧基矢车菊黄酮素。
化合物7:黄色粉末;ESI-MSm/z: 411.1 [M+Na]+;1H-NMR (600 MHz, CDCl3)δ: 12.58 (1H, s,5-OH), 7.37 (2H, s, H-2′, 6′), 6.45 (1H, d,J= 2.4 Hz,H-8), 6.37 (1H, d,J= 1.8 Hz, H-6), 3.95 (9H, s,3′,4′,5′-OCH3), 3.89 (3H, s, 7-OCH3), 3.87 (3H, s,3-OCH3);13C-NMR (150 MHz, CDCl3)δ: 178.9(C-4), 165.7 (C-7), 162.2 (C-5), 156.9 (C-9), 155.8(C-2), 153.3 (C-3′, 5′), 140.7 (C-4′), 139.6 (C-3),125.6 (C-1′), 106.2 (C-10, 2′, 6′), 98.1 (C-6), 92.4(C-8), 61.2 (4′-OCH3), 60.5 (3-OCH3), 56.5(3′,5′-OCH3), 56.0 (7-OCH3)。以上数据与文献报道基本一致[18],故鉴定化合物7 为5-羟基-3,3′,4′,5′,7-五甲氧基黄酮。
化合物8:黄色粉末;ESI-MSm/z: 337.1 [M+Na]+;1H-NMR (600 MHz, DMSO-d6)δ: 12.93 (1H, s,5-OH), 10.40 (1H, s, 4′-OH), 7.97 (1H, d,J= 9.0 Hz,H-2′, 6′), 6.94 (2H, d,J= 2.4 Hz, H-3′, 5′), 6.92 (1H,s, H-8), 6.86 (1H, s, H-3), 3.92 (3H, s, 7-OCH3), 3.73(3H, s, 6-OCH3);13C-NMR (150 MHz, DMSO-d6)δ:182.3 (C-4), 164.1 (C-2), 161.4 (C-4′), 158.6 (C-7),152.7 (C-9), 152.1 (C-5), 131.9 (C-6), 128.6 (C-2′, 6′),121.1 (C-1′), 116.0 (C-3′, 5′), 105.1 (C-10), 102.7(C-3), 91.6 (C-8), 60.1 (6-OCH3), 56.5 (7-OCH3)。以上数据与文献报道基本一致[19],故鉴定化合物8 为蓟黄素。
化合物9:黄色油状物;ESI-MSm/z: 190.1 [M+H]+;1H-NMR (600 MHz, CDCl3)δ: 8.73 (1H, s, NH),8.25~8.14 (1H, m, H-2), 7.93 (1H, d,J= 2.4 Hz,H-4), 7.44~7.37 (1H, m, H-7), 7.31~7.22 (2H, m,H-5, 6), 4.40 (2H, q,J= 7.2 Hz, H-9), 1.43 (3H, t,J=7.2 Hz, H-10);13C-NMR (150 MHz, CDCl3)δ: 165.5(C-8), 136.2 (C-7a), 131.1 (C-2), 125.9 (C-3a), 123.3(C-6), 122.1 (C-5), 121.7 (C-4), 111.6 (C-7), 109.3(C-3), 60.0 (C-9), 14.7 (C-10)。以上数据与文献报道基本一致[20],故鉴定化合物9 为吲哚-3-甲酸乙酯。
化合物10:黄色油状物;ESI-MSm/z: 293.2[M-H]−;1H-NMR (600 MHz, CDCl3)δ: 7.48 (1H,dd,J= 15.6, 12.0 Hz, H-11), 6.15 (1H, d,J= 15.0 Hz,H-12), 6.10 (1H, t,J= 10.8 Hz, H-10), 5.90 (1H, dt,J= 10.8, 7.8 Hz, H-9), 2.53 (2H, t,J= 7.2 Hz, H-14),2.33 (2H, t,J= 7.2 Hz, H-2), 2.29 (2H, m, H-8) 1.61(2H, m, H-17), 1.41 (2H, m, H-3), 1.32 (12H, brs,H-4~7, 15~16), 0.88 (3H, t,J= 7.2 Hz, H-18);13C-NMR (150 MHz, CDCl3)δ: 201.4 (C-13), 179.9(C-1), 142.9 (C-9), 137.3 (C-11), 129.4 (C-12), 127.0(C-10), 41.1 (C-14), 34.1 (C-2), 31.5 (C-16), 29.2(C-5, 7), 29.1 (C-8), 29.0 (C-6), 28.5 (C-4), 24.7(C-3), 24.4 (C-15), 22.6 (C-17), 14.1 (C-18)。以上数据与文献报道基本一致[21],故鉴定化合物10 为13-酮-9,11-十八碳二烯酸。
化合物11:黄色油状物;ESI-MSm/z: 295.2[M+H]+,1H NMR (600 MHz, CDCl3)δ: 7.19~7.09(1H, m, H-11), 6.21~6.15 (2H, m, H-12, 13), 6.07(1H, d,J= 15.6 Hz, H-10), 2.53 (2H, t,J= 7.2 Hz,H-10), 2.34 (2H, t,J= 7.2 Hz, H-2), 2.21~2.14 (2H,m, H-14), 1.69~1.56 (4H, m, H-3, 7), 1.45~1.40(2H, m, H-15), 1.36~1.29 (10H, m, H-4~6, 16, 17),0.89 (3H, t,J= 7.2 Hz, H-18);13C-NMR (150 MHz,CDCl3)δ: 201.3 (C-9), 179.2 (C-1), 150.0 (C-13),143.2 (C-11), 129.0 (C-12), 128.0 (C-10), 40.6 (C-8),34.0 (C-2), 33.3 (C-14), 31.5 (C-16), 29.2 (C-5, 6), 29.0(C-4), 28.5 (C-15), 24.8 (C-3), 24.5 (C-7), 22.6 (C-17),14.1 (C-18)。以上数据与文献报道基本一致[22],故鉴定化合物11 为9-酮-10,12-十八碳二烯酸。
化合物12:黄色油状物;ESI-MSm/z: 445.7[M-H]−;1H-NMR (600 MHz, CDCl3)δ: 2.52 (2H,m, H-1′), 2.01 (3H, s, CH3-5), 1.98 (6H, s, CH3-2, 3),1.21 (3H, s, CH3-3′), 0.84 (3H, d,J= 3.0 Hz,CH3-11′), 0.83 (6H, s, 2×CH3-15′), 0.82 (3H, d,J=6.6 Hz, CH3-7′);13C-NMR (150 MHz, CDCl3)δ:187.8 (C-4), 187.3 (C-1), 144.6 (C-6), 140.6 (C-5),140.5 (C-3), 140.3 (C-2), 72.7 (C-3′), 42.4 (C-4′), 40.3(C-2′), 39.5 (C-14′), 37.7 (C-6′), 37.5 (C-10′, 8′), 37.4(C-12′), 32.9 (C-7′, 11′), 28.1 (C-15′), 26.7 (3′-CH3),24.9 (C-13′), 24.6 (C-9′), 22.8 (15′-CH3), 22.7(15′-CH3), 21.5 (C-1′), 21.4 (C-5′), 19.9 (11′-CH3),19.8 (7′-CH3), 12.5 (5-CH3), 12.4 (2-CH3), 12.1(3-CH3)。以上数据与文献报道基本一致[23],故鉴定化合物12 为α-托可醌。
化合物13:白色粉末;ESI-MSm/z: 507.2 [M+H]+;1H-NMR (600 MHz, CDCl3)δ: 7.69 (2H, d,J=8.4 Hz, H-12′, 16′), 7.65 (2H, d,J= 7.2 Hz, H-12, 16),7.50 (1H, t,J= 7.2 Hz, H-14), 7.43 (1H, t,J= 7.2 Hz,H-14′), 7.39 (2H, t,J= 7.8 Hz, H-13, 15), 7.34~7.23(12H, m, H-5~9, 5′~9′, 13′, 15′), 6.66 (1H, d,J= 9.0 Hz,N-Hb), 6.57 (1H, d,J= 6.6 Hz,N-Ha), 4.92 (1H,q,J= 6.6 Hz, H-2′), 4.62 (1H, m, H-2), 4.54 (1H, dd,J= 11.4, 3.6 Hz, H-1b), 4.04 (1H, dd,J= 11.4, 4.8 Hz,H-1a), 3.29 (1H, dd,J= 14.4, 6.6 Hz, H-3′b), 3.21(1H, dd,J= 13.8, 7.2 Hz, H-3′a), 3.00 (1H, dd,J=13.8, 6.6 Hz, H-3b), 2.89 (1H, dd,J= 13.8, 8.4 Hz,H-3a);13C-NMR (150 MHz, CDCl3)δ: 172.1 (C-1′),167.6 (C-10), 167.3 (C-10′), 137.3 (C-4), 135.9 (C-4′),134.4 (C-11′), 133.5 (C-11), 132.2 (C-14), 131.5(C-14′), 129.5 (C-5, 9), 129.3 (C-5′, 9′), 129.0 (C-13,15), 128.8 (C-6, 8), 128.8 (C-6′, 8′), 128.6 (C-13′, 15′),127.5 (C-7′), 127.3 (C-12′, 16′), 127.2 (C-12, 16),127.0 (C-7), 65.6 (C-1), 54.6 (C-2′), 50.4 (C-2), 37.7(C-3′), 37.4 (C-3)。以上数据与文献报道基本一致[24],故鉴定化合物13 为N-苯甲酰-L-苯丙氨酰-N-苯甲酰-L-苯丙氨酸酯。
化合物14:蓝紫色粉末;ESI-MSm/z: 430.1[M+H]+;1H-NMR (600 MHz, CDCl3)δ: 7.71 (1H, d,J= 6.6 Hz, H-3′, 7′), 7.52 (1H, m, H-5′), 7.44 (2H, t,J= 7.8 Hz, H-4′, 6′), 7.25 (5H, m, H-5, 9), 7.15 (2H,m, H-5′′, 7′′), 7.07 (2H, m, H-4′′, 8′′), 6.77 (1H, d,J=7.8 Hz, H-βNH), 6.01 (1H, d,J= 9.0 Hz, H-αNH),4.77 (1H, dd,J= 8.1, 6.0 Hz, H-2), 4.34 (1H, m,H-1′′), 3.93 (1H, dd,J= 11.4, 4.8 Hz, H-9′′), 3.82 (1H,dd,J= 11.4, 4.2 Hz, H-9′′), 3.22 (1H, dd,J= 13.8, 6.0 Hz, H-3), 3.06 (1H, dd,J= 13.8, 8.4 Hz, H-3), 2.74(1H, m, H-2′′), 2.02 (3H, s, -COCH3);13C-NMR (150 MHz, CDCl3)δ: 170.9 (-COCH3), 170.4 (C-1), 167.2(C-1′), 136.8 (C-4), 136.7 (C-3′′), 133.8 (C-2′), 132.1(C-5′), 129.4 (C-6, 8), 129.3 (C-5′′, 7′′), 128.9 (C-4′′,8′′), 128.8 (C-5, 9), 128.7 (C-3′, 7′), 127.3 (C-7), 127.2(C-4′, 6′), 126.9 (C-6′′), 64.7 (C-9′′), 55.1 (C-2), 49.5(C-1′′), 38.6 (C-3), 37.6 (C-2′′), 21.0 (-COCH3)。以上数据与文献报道基本一致[25],故鉴定化合物14 为金色酰胺醇酯。
化合物15:浅黄色油状物;ESI-MSm/z: 759.3[M+Na]+;1H-NMR (600 MHz, CD3OD)δ: 7.67 (1H,d,J= 16.2 Hz, H-7′′′), 7.19 (1H, d,J= 1.8 Hz, H-2′′′),7.08 (1H, dd,J= 8.4, 1.8 Hz, H-6′′′), 6.81 (1H, d,J=3.6 Hz, H-5′′′), 6.79 (1H, d,J= 3.6 Hz, H-5), 6.72(1H, d,J= 2.4 Hz, H-2), 6.67 (1H, dd,J= 8.4, 2.4 Hz,H-6), 6.38 (1H, d,J= 16.2 Hz, H-8′′′), 5.34 (1H, dd,J= 3.6, 1.8 Hz, H-2′′), 5.18 (1H, d,J= 1.8 Hz, H-1′′),4.95 (2H, m, H-4′, 3′′), 4.35 (1H, d,J= 7.8 Hz, H-1′),4.05 (1H, m, H-8a), 3.86 (3H, d,J= 1.2 Hz, 4-OCH3),3.83 (1H, t,J= 9.0 Hz, H-3′), 3.79 (3H, d,J= 1.8 Hz,3′′′-OCH3), 3.71 (1H, m, H-8b), 3.63 (1H, m, H-5′′),3.54 (2H, H-6′, 4′′), 3.43 (2H, m, H-2′, 5′), 2.79 (2H,m, H-7), 2.04 (3H, s, 2′′-OAc), 1.95 (3H, s, 3′′-OAc),1.13 (1H, dd,J= 6.0, 1.2 Hz, H-6′′);13C-NMR (150 MHz, CD3OD)δ: 172.2 (2′′-OAc), 171.7 (3′′-OAc),168.2 (C-9‴), 150.8 (C-4′′′), 149.3 (C-3′′′), 148.0(C-7′′′), 147.5 (C-3), 147.3 (C-4), 132.8 (C-1), 127.6(C-1′′), 124.3 (C-6′′), 121.2 (C-6), 117.0 (C-2), 116.5(C-5′′), 114.9 (C-8′′), 112.8 (C-5), 111.8 (C-2′′), 104.1(C-1′), 100.3 (C-1′), 82.0 (C-3′), 75.9 (C-2′), 75.9 (C-5′),73.1 (C-4′), 72.1 (C-8), 71.3 (C-2′), 71.1 (C-3′′), 70.5(C-5′′), 70.4 (C-4′), 62.3 (C-6′), 56.4 (4-OCH3), 56.4(3′′-OCH3), 36.5 (C-7), 20.9 (2′-OAc), 20.7 (3′′-OAc),18.4 (C-6′′)。以上数据与文献报道基本一致[26],故鉴定化合物15 为2″,3″-乙酰马蒂罗苷。
化合物16:白色粉末;ESI-MSm/z: 175.0 [M+Na]+;1H-NMR (600 MHz, DMSO-d6)δ: 9.93 (1H, s,7-CHO), 7.58 (1H, dd,J= 8.4, 1.8 Hz, H-6), 7.54 (1H,d,J= 1.8 Hz, H-2), 7.13 (1H, d,J= 7.8 Hz, H-5), 4.00(3H, s, 3-OCH3);13C-NMR (150 MHz, DMSO-d6)δ:191.1 (C-7), 153.2 (C-4), 148.2 (C-3), 128.7 (C-1),126.2 (C-6), 115.4 (C-5), 110.7 (C-2), 55.6 (C-8)。以上数据与文献报道基本一致[27],故鉴定化合物16为香草醛。
3.2 化合物对RSL3 诱导的HT-22 细胞活力测定
由图3 可知,与模型组相比,化合物7 和9 在50 μmol/L 浓度下能不同程度增强RSL3 损伤的HT-22 细胞活力,而其余化合物未表现出明显的保护活性。进一步测试获得化合物7 和9 的EC50值分别为(1.46±0.49)、(3.31±1.66)μmol/L,Fer-1 EC50为0.084 4 μmol/L。上述结果表明化合物7 和9 有较好抑制HT-22 细胞铁死亡的潜力。

图3 化合物对RSL3 诱导的HT-22 细胞损伤后的影响(x ± s, n = 3)Fig.3 Effects of compounds on HT-22 cells induced by RSL3 (x ± s, n = 3)
4 讨论
贵州特色喀斯特地貌和气候特征孕育了丰富的中药和民族药用植物资源,铁轴草的化学成分至今研究较少,本研究对贵州产地铁轴草乙醇提取物的石油醚部位进行系统分离纯化,从中鉴定了16 个单体化合物,除化合物3 外,所有化合物均首次从铁轴草中分离获得,其中13 个化合物首次从香科科属中分离获得。研究结果显示铁轴草化学成分主要为黄酮类、脂肪酸类、肽类、酚类化合物,进一步显示了铁轴草次生代谢产物的结构类型多样性。此外,该研究也对铁轴草中分离鉴定的单体化合物进行了HT-22 细胞铁死亡抑制活性研究,并发现其中2 个单体化合物对RSL3 诱导的小鼠海马神经元细胞系HT-22 细胞铁死亡有较好的抑制作用。文献报道[28-29]从唇形科筋骨草属植物中分离的二萜具有抑制铁死亡活性,本研究对唇形科香科科属植物铁轴草中的化学成分进行抑制铁死亡活性研究,发现铁轴草中的多甲氧基黄酮与吲哚类化合物同样具有抑制铁死亡活性,该研究不仅丰富了铁死亡抑制剂种类,也提示该植物或者香科科属植物可能在神经细胞保护方面具有潜在的药用价值,为今后开展铁轴草民间药用植物或香科科属其他药用植物的深入开发利用提供一定的理论依据。
利益冲突所有作者均声明不存在利益冲突

