紫苏叶HPLC 指纹图谱建立及其抗流感病毒活性谱效关系研究
刘振杰,丘海芯,甘金月,奉建芳,唐红珍,谭小青,杨海玲,
1.广西优势中成药与民族药开发工程技术研究中心,广西中医药大学,广西 南宁 530299
2.广西中药质量标准研究重点实验室,广西壮族自治区中医药研究院,广西 南宁 530022
3.安徽医学高等专科学校,安徽 合肥 230601
紫苏Perillafrutescens(L.) Britt.为唇形科一年生草本植物,收载于《中国药典》[1]、《名医别录》[2]等,别名桂荏、白苏、赤苏、红苏、黑苏、白紫苏、青苏、苏麻、水升麻等,分布于中国、不丹、印度、印度尼西亚、日本、朝鲜,在中国各地广泛栽培[3]。紫苏可供药用和香料用。其不同入药部位紫苏叶、紫苏梗、紫苏子均被《中国药典》收载,其中紫苏叶有解表散寒、行气和胃的作用,紫苏梗有理气宽中、止痛、安胎等作用,紫苏子有降气化痰、止咳平喘、润肠通便等作用[1]。现代研究表明,紫苏叶中含有挥发油、黄酮、酚酸类等化学成分[4-8]。药理研究表明,紫苏叶具有抗炎[9-10]、抗氧化[11-13]、抗抑郁[14-15]、抗病毒[16-17]等效果。
流感病毒神经氨酸酶(neuraminidase,NA)是流感病毒复制、感染和致病的关键酶,通过抑制NA的活性,可以有效地缓解流感症状,降低病毒复制和传播风险,因此,NA 活性荧光检测法成为抗流感病毒药物筛选的重要方法[18]。查阅文献未见紫苏叶化学模式识别和抗流感病毒活性生物效价的报道。基于此,本实验将建立不同产地紫苏叶指纹图谱,并采用超高效液相色谱-三重四级杆飞行时间质谱联用(UPLC-Q-TOF-MS/MS)对紫苏叶化学成分进行表征,鉴定化学成分,应用聚类分析与主成分分析(principal component analysis,PCA)对不同产地紫苏叶药材进行比较分析;通过测定紫苏叶抗病毒活性生物效价,并利用灰色关联度分析其特征峰与抗病毒活性的关系,为开发利用紫苏药材资源提供科学依据。
1 仪器与材料
1.1 仪器
Sciex X500R Q-TOF 型液质联用仪,配有ESI源和Sciex OS 数据处理软件,美国Sciex 公司;1525-2707-2489-2424 型超高效液相色谱仪,美国沃特世公司;KQ5200E 型超声波清洗器,昆山市超声仪器有限公司;Synergy H1 型多功能检测仪,美国Biotek 公司;XS205 型十万之一电子天平,瑞士梅特勒-托利多公司。
1.2 材料
1.2.1 试剂 甲醇(批号0212211202)、乙腈(批号0114220902),色谱级,赛默飞世尔科技(中国)有限公司;磷酸(色谱级,批号20210715),天津市科密欧化学试剂有限公司;对照品咖啡酸(批号CFS202201)、阿魏酸(批号CFS202202)、迷迭香酸(批号CFS202202)、木犀草素(批号CFS202201),经HPLC 测定质量分数均≥98%,均购于武汉中标科技有限公司;对照品芹菜素-7-O-二葡萄糖醛酸苷(批号PS013316)、野黄芩苷(批号PS020995),经HPLC 测定质量分数均≥98%,均购于成都普思生物科技有限公司;水为屈臣氏饮用水。抗NA 效价试剂盒,批号200713,含3.0 mg/mL 的帕拉米韦阳性对照品溶液(100 mL),上海碧云天生物技术有限公司。
1.2.2 药材 紫苏是唇形科紫苏属1 年生草本植物,样品经广西中医药大学唐红珍教授鉴定为唇形科草本植物紫苏P.frutescens(L.) Britt.的干燥叶。15 批紫苏叶样品,编号分别为S1~S15,结果见表1。

表1 紫苏叶药材产地信息Table 1 Origin information of Perillae Folium
2 方法与结果
2.1 溶液的制备
2.1.1 供试品溶液的制备 取紫苏叶粉末0.5 g,精密称定。置具塞三角瓶中,加入70%甲醇25 mL,超声20 min(40 kHz、200 W),用微孔滤膜(0.45 μm)滤过,取续滤液,即得供试品溶液。
2.1.2 混合对照品溶液的制备 取各对照品,精密称定,加甲醇定容至10 mL 量瓶中,制成质量浓度分别为咖啡酸1.10 mg/mL、阿魏酸1.00 mg/mL、芹菜素-7-O-二葡萄糖醛酸苷0.68 mg/mL、野黄芩苷0.58 mg/mL、迷迭香酸0.15 mg/mL、木犀草素0.10 mg/mL的单一对照品溶液,分别精密量取配好的单一对照品溶液,其中咖啡酸、阿魏酸各1 mL、芹菜素-7-O-二葡萄糖醛酸苷、野黄芩苷、迷迭香酸、木犀草素各2 mL,混合,定容至10 mL 量瓶中,得到含咖啡酸0.11 mg/mL、阿魏酸0.10 mg/mL、芹菜素-7-O-二葡萄糖醛酸苷0.14 mg/mL、野黄芩苷0.12 mg/mL、迷迭香酸0.03 mg/mL、木犀草素0.02 mg/mL 的混合对照品溶液。
2.2 UPLC-Q-TOF-MS/MS 定性分析
2.2.1 色谱条件 色谱柱为Kinetex C18柱(100 mm×2.1 mm,1.7 μm);体积流量0.4 mL/min;流动相为乙腈-水,梯度洗脱:0~30 min,5%~95%乙腈;进样量3 μL;柱温40.0 ℃。
2.2.2 质谱条件 电喷雾电离源(ESI),扫描范围m/z100~2 000;碰撞能量35 eV;离子源温度为600 ℃;喷雾电压5 500 V。通过一级质谱信息确定精确相对分子质量,二级质谱获得裂解信息,搜索天然产物高分辨质谱数据库(natural procducts HR MSMS 2.0)、查阅文献以及对照品比对确定化合物的结构式信息。
2.2.3 化合物质谱分析 采用UPLC-Q-TOF-MS/MS仪对紫苏叶进行分析,选择正、负离子模式,分别对紫苏叶的供试品溶液进行扫描,得到总离子流图,结果见图1。通过SCIX OS 数据处理系统查找质谱响应较高的成分的精确相对分子质量,通过天然产物高分辨质谱数据库(natural procducts HR MSMS 2.0)和TCM MS/MS Library 数据库检索、结合一级分子离子峰和二级质谱碎片信息推测和相关查阅文献,对部分成分的结果作进一步验证,总共鉴定出47 个化学成分[19-23],质谱信息见表2。通过UPLCQ-TOF-MS/MS 技术对紫苏叶的化学成分进行了初步鉴定,为反映紫苏叶内在整体化学成分情况,实验将结合指纹图谱和化学识别模式对紫苏叶进一步研究,以期了解其药效物质基础。
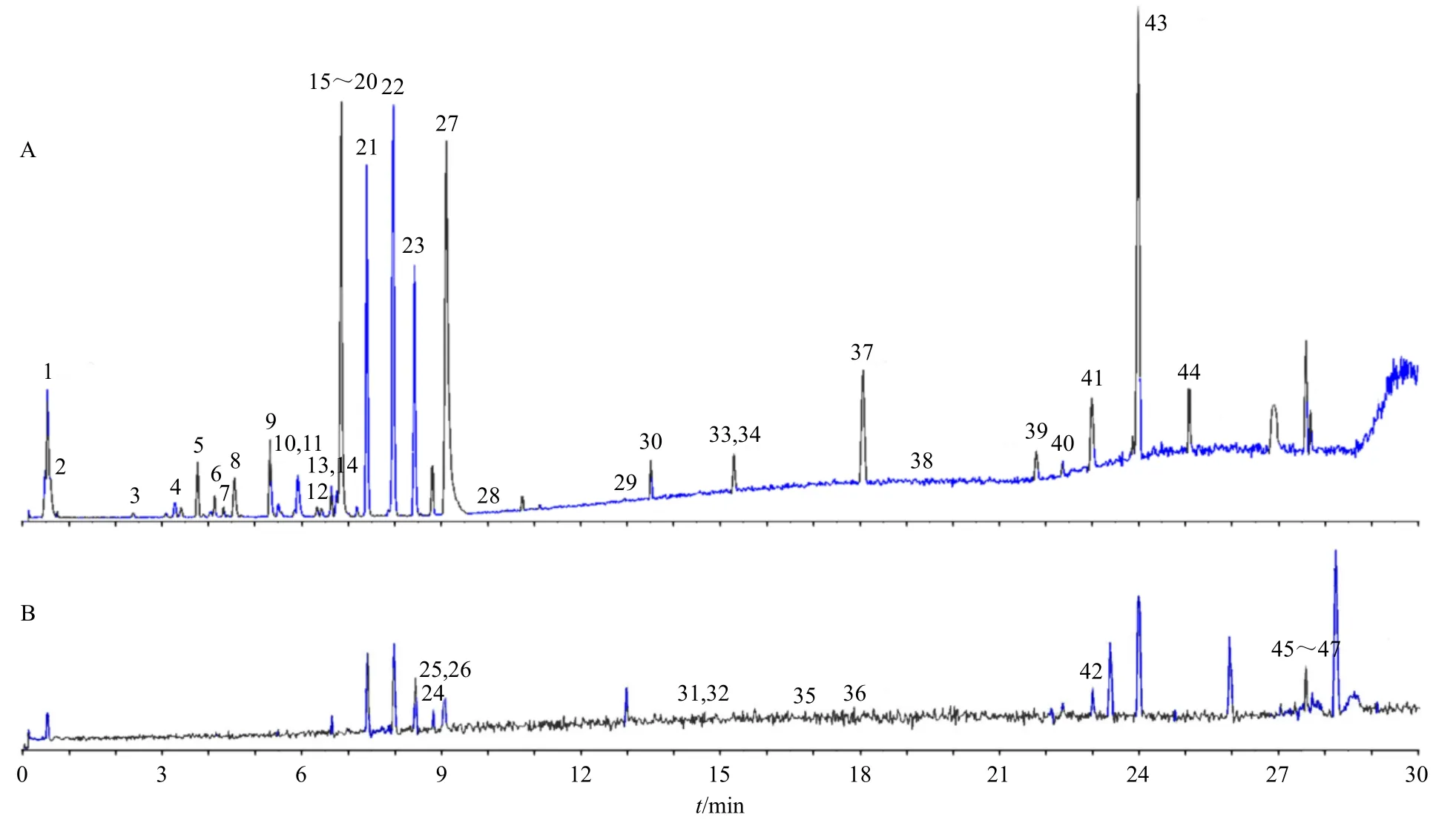
图1 紫苏叶的负离子 (A)、正离子 (B) 模式总离子流图Fig.1 Negative (A) and positive (B) total ion flow chart of Perillae Folium

表2 紫苏叶中化学成分的UPLC-Q-TOF-MS/MS 鉴定结果Table 2 Identification of chemical components in Perillae Folium by UPLC-Q-TOF-MS/MS
2.3 紫苏叶指纹图谱的建立及相似度评价
2.3.1 色谱条件 色谱柱为Supersil ODS2 C18柱(250 mm×4.6 mm,5 μm);体积流量1 mL/min;柱温25 ℃;检测波长330 nm;进样量10 μL;流动相为0.1%磷酸水溶液-甲醇,梯度洗脱:0~20 min,25%~40%甲醇;20~80 min,40%~80%甲醇;80~81 min,80%~25%甲醇;81~85 min,25%甲醇。
2.3.2 参照峰的选择 在特征图谱中,迷迭香酸含量较高,并且较稳定,故选择迷迭香酸的色谱峰(18号峰)作为参照峰,计算各共有峰的相对保留时间和相对峰面积。
2.3.3 精密度试验 取S4 的紫苏叶供试品溶液,按“2.3.1”项下色谱条件,连续测定6 次,记录谱图,结果各共有峰的相对保留时间和相对峰面积的RSD 均小于3%,表明仪器精密度良好。
2.3.4 重复性试验 取S4 的紫苏叶样品,共6 份,按“2.1.1”项下条件制备,按“2.3.1”项下色谱条件进行测定,结果各共有峰的相对保留时间和相对峰面积的RSD 均小于3%,表明方法重复性良好。
2.3.5 稳定性试验 取S4 的紫苏叶供试品溶液,按“2.3.1”项下色谱条件,置于室温下,于0、2、4、8、12、24 h 进样,结果各共有峰的相对保留时间和相对峰面积的RSD 均小于3%,表明供试品溶液在24 h 内稳定性良好。
2.3.6 指纹图谱建立及相似度评价 取15 批的紫苏叶药材粉末,按“2.1.1”项下方法,分别制备紫苏叶的试品溶液,按“2.3.1”项下色谱条件,进样测定,得到15 批紫苏叶的色谱图。将数据导入中药色谱指纹图谱相似度评价系统(2004 年版)软件,样品(S4)图谱作为参照图谱,利用多点校正法生成指纹图谱和对照指纹图谱。15 批紫苏叶样品的指纹图谱见图2,并进行相似度评价,S1~S15 的相似度结果在0.9~1.0。15 批紫苏叶样品共标定19 个共有峰,通过比较各峰保留时间和吸收光谱,对各峰进行指认(图3),紫苏叶样品HPLC 指纹图谱的咖啡酸(峰6)、阿魏酸(峰12)、芹菜素-7-O-二葡萄糖醛酸苷(峰15)、野黄芩苷(峰16)、迷迭香酸(峰18)、木犀草素(峰19)得到了指认。结合UPLCQ-TOF-MS/MS 法鉴定出紫苏叶的47 个化合物(表2),其中6 种成分能在指纹图谱上明确指认,实验将进一步采用化学识别模式对指纹图谱中共有峰在样品中的差异进行分析。
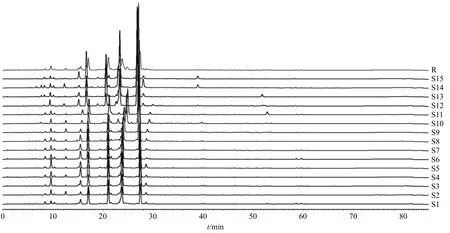
图2 15 批紫苏叶样品HPLC 指纹图谱及其对照指纹图谱 (R)Fig.2 HPLC fingerprints of 15 batches of Perillae Folium samples and its reference fingerprint (R)

图3 混合对照品 (A) 和紫苏叶样品 (B) 的HPLC 图Fig.3 HPLC of mixed reference substances (A) and Perillae Folium sample (B)
2.4 化学模式识别分析
中药指纹图谱可全面系统地反映物质基准的化学信息,同时采用化学识别模式对指纹图谱中共有峰在样品中的差异进行分析,可将共有峰对各批次样品间指纹图谱差异的贡献度量化。
2.4.1 聚类分析 将15 批紫苏叶样品的共有峰的峰面积进行数据标准化,然后导入SPSS 22.0 软件进行系统聚类,采用Ward 法,平方Euclidean 距离聚类,结果见图4。当分类距离为5 时,15 批紫苏叶样品可分为2 类,第I 类S1~S9、S15,第II 类S10~S14。
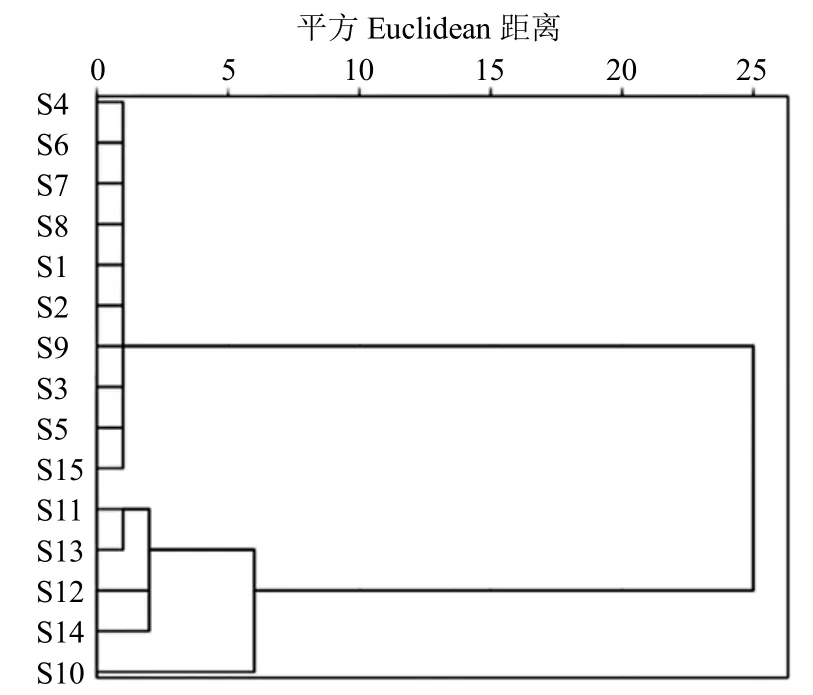
图4 15 批紫苏叶聚类分析树状图Fig.4 Dendrogram of cluster analysis of 15 baches of Perillae Folium
2.4.2 PCA 为评价所有样品的差异,运用SIMCA 14.1 分析软件对其进行PCA,结果见图5,由PCA图可以看出,S1~S9 聚为一类;S10~S15 为一类;结果与聚类分析的结果基本一致,样品之间的离散程度较大,表明样品差异性较大。

图5 紫苏叶PCA 图Fig.5 PCA of Perillae Folium
2.4.3 偏最小二乘法-判别分析(partial least squaresdiscriminant analysis,PLS-DA) 将19 个共有峰峰面积的标准化处理数据导入SIMCA 14.1 软件,得到PLS-DA 载荷散点图和变量重要性投影值图[24],如图6 所示。结果发现其关键参数R2X、R2Y、Q2的值分别为0.255、0.816、0.670,基本大于0.5,说明该模型具有良好的拟合能力及预测能力。PLS-DA载荷散点图(图6-A)上每1 个点代表1 个变量,距离原点越远,表明对样本的区分能力越强。为进一步筛选出对上述样本分类贡献较大的成分,结合VIP 图可更直观地看出,各色谱峰的影响程度,VIP值>1.0 为有意义变量。结果共找到5 个有意义变量,依次为峰15(芹菜素-7-O-二葡萄糖醛酸苷)、18(迷迭香酸)、17、14、2,结果见图6-B。说明这5 种成分可能是将15 批紫苏叶分为2 类的差异性质量标志物(quality markers,Q-Marker)。

图6 紫苏叶PLS-DA 载荷散点图 (A) 和VIP 值 (B)Fig.6 PLS-DA loading scatter plot (A) and VIP value (B)of Perillae Folium
2.5 紫苏叶抗病毒活性研究
2.5.1 抗病毒样品制备 取紫苏叶(粉碎,过筛)5 g,精密称定,于250 mL 具塞锥形瓶中,加入70%甲醇250 mL,超声20 min(40 kHz、200 W),放冷,滤过,浓缩得浸膏,待用。
分别称取紫苏叶浸膏样品0.5 g,精密称定,用纯水溶解,定容至10 mL 量瓶中,用0.22 μm 微孔滤膜滤过。将供试品及参比液(试剂盒自带,帕拉米韦3.0 mg/mL,共100 mL)用水依次对倍稀释包括原液共5 个质量浓度的样品溶液。
2.5.2 对照品溶液的制备 取4 个对照品溶液,精密称定,加甲醇定容至10 mL 量瓶中,分别得到咖啡酸为2.008 mg/mL、阿魏酸2.001 mg/mL、迷迭香酸2.008 mg/mL、木犀草素2.001 mg/mL 的对照品溶液。
2.5.3 抗流感病毒NA 活性反应条件与加样 参考已广泛应用的NA 活性测定方法[25-26],为了方便观察对比,反应在96 孔板中进行。在测定紫苏叶提取物抗流感病毒NA 活性实验中,实验设置为5 组,分别为对照组、NA 组、阳性药帕拉米韦组(3 mg/mL)、样品组以及本底组。其中,对照组加入90 μL 缓冲液+10 μL 底物4-甲基伞形花酰-α-D-N-乙酰 神 经 氨 酸 ( 4-methylumbelliferyl-α-D-Nacetylneuraminic acid,MUNANA);NA 组加入10 μL NA+80 μL 缓冲液+10 μL 底物;帕拉米韦组加入10 μL 帕拉米韦溶液+70 μL 缓冲液+10 μL NA+10 μL 底物;样品组加入10 μL 样品溶液+70 μL 缓冲液+10 μL NA+10 μL 底物;本底组加入10 μL 纯水+70 μL 缓冲液+10 μL NA+10 μL 底物;按以上方法加入96 孔板后,37 ℃下反应1 h,加入终止液200 μL 终止反应。设定参数:激发波长355 nm,检测波长460 nm,使用酶标仪测定荧光强度,每组3孔重复实验。
2.5.4 数据处理与效价计算 生物效价为根据质反应平行线法计算得到的样品的效价。由效价测定原理编制的计算机软件完成生物效价计算,该软件《中药效价计算器》2.0 版为中国人民解放军总医院第五医学中心肖小河团队开发和应用。
反应抑制率=1-(样品组或阳性药组荧光值-本底组荧光值)/(NA 组荧光值-对照组荧光值)
样品组为紫苏叶样品、缓冲液、NA 和底物的混合溶液,阳性药组为帕拉米韦、缓冲液、NA 和底物的混合溶液,本底组为纯水、缓冲液、NA 和底物的混合溶液,NA 组为NA、缓冲液和底物的混合溶液,对照组为缓冲液和底物的混合溶液
2.5.5 抗流感病毒NA 活性的测定 按照上述测定方法分别对不同质量浓度(5.000、2.500、1.250、0.625、0.312 5 mg/mL)的紫苏叶样品溶液进行测定,计算抑制率,结果见表3。不同批次的紫苏叶对NA的抑制活性存在差异。

表3 15 批紫苏叶抗流感病毒NA 活性的抑制率测定Table 3 Reaction inhibition rate against 15 batches of Perillae Folium
2.5.6 生物效价测定 将15 批紫苏叶样品的抗流感病毒NA 活性结果输入生物效价软件计算其抗NA 效价。结果见图7。S1~S15 的生物效价分别为6.21、5.58、4.19、8.19、6.09、5.82、6.10、5.36、5.54、10.86、4.74、5.78、3.78、7.98、5.65 U/mg。变异系数(coefficient of variance,CV)为标准差与均值的比率,公式表示为CV=σ/|μ|,不同产地的紫苏叶样品的生物效价的CV 为28.70%,说明样品之间存在较大差异,其效价为江西赣州的S10 号样品效价最高,为10.86 U/mg,湖北神农架S13 号样品效价最低,为3.78 U/mg。广西玉林、广西桂平和广西南宁样品同产于广西,其效价为分别是5.58、5.54、5.64 U/mg,说明同一产地的紫苏叶效价差异较小。

图7 15 批紫苏叶样品的抗流感病毒NA 效价Fig.7 Biological value of 15 baches of Perillae Folium against NA
2.6 紫苏叶HPLC 图谱与抗病毒活性的灰色关联分析(gray correlation analysis,GCA)
2.6.1 原始数据的无量纲化处理 原始数据的变换采用初值化变换法,将15 批紫苏叶样品的抗病毒活性的生物效价指标作为母序列,记为{X0(t)},紫苏叶样品不同批次的共有峰面积作为子序列,记为{Xi(t)}[27-28]。
2.6.2 绝对差序列及关联系数的计算 在t=k时(k为峰号),母序列记为{X0(t)},子序列记为{Xi(t)},母序列与子序列的绝对差序列Δ0i(k)=|X0(k)-Xi(k)|(1≤i≤m)。计算在t=k时母序列与子序列的关联系数η(k)。
Y0(k)为紫苏叶不同批次抗病毒活性的生物效价;Yi(k)为不同批次紫苏叶特征峰面积归一化数值;k为峰号;ρ为分辨系数,ρ∈(0,1),本实验中ρ取0.5;|Y0(k)-Yi(k)|为母序列与子序列的绝对差值;minmin|Y0(k)-Yi(k)|绝对差值的最小值;maxmax|Y0(k)-Yi(k)|为绝对值的最大值
2.6.3 关联度(r)的计算 根据“2.6.1”项和“2.6.2”项计算,峰1~19 的η值依次为0.90、0.96、0.92、0.95、0.95、0.97、0.94、0.96、0.96、0.92、0.93、0.96、0.94、0.86、0.95、0.90、0.92、0.82、0.97。由以上数据可知,紫苏叶对抗病毒作用药效贡献由大到小为6、19>2、8、9、12>4、5、15>7、13>11>3、10、17>1、16>14>18(特征峰编号),并采用对照品对6、12、15、16、18、19 号峰进行指认,依次为咖啡酸、阿魏酸、芹菜素-7-O-二葡萄糖醛酸苷、野黄芩苷、迷迭香酸、木犀草素。
3 讨论
本实验考察了波长、流动相组成、洗脱梯度等条件。本实验考察了230、320、330、350 nm 波长,综合考虑其出峰数量、响应值、峰形等因素,为了使指纹图谱信息丰富,避免影响峰值响应和检测结果稳定性,保证多成分在最大吸收波长下的最佳吸收而互不干扰,最终确定扫描波长为330 nm。流动相分别考察了甲醇-水、甲醇-0.1%磷酸水溶液、乙腈-0.1%磷酸水溶液,发现使用甲醇-0.1%磷酸水溶液洗脱有较好的色谱峰峰形,分离度良好,响应值高,综合考虑选用甲醇-0.1%磷酸水溶液作为流动相。实验还考察了不同洗脱梯度条件下样品的分离能力,发现0~20 min,25%~40%甲醇;20~80 min,40%~80%甲醇;80~81 min,80%~25%甲醇;81~85 min,25%甲醇梯度条件下,各成分分离度良好,峰型良好,故选择此梯度洗脱。
15 批紫苏叶样品的指纹图谱具有较高的相似度(0.9~1.0),说明不同产地的紫苏叶在宏观上具有相似的化学表征,指纹图谱相似度评价不能区分不同产地的紫苏叶药材的差异。实验将进一步采用化学识别模式对指纹图谱中共有峰在样品中的差异进行分析,通过聚类分析可将15 批紫苏叶分为2 类(第I 类S1~S9、S15,第II 类S10~S14);PCA 与聚类分析结果基本一致(S1~S9 聚为一类;S10~S15 为一类),这是由峰15(芹菜素-7-O-二葡萄糖醛酸苷)、峰18(迷迭香酸)等5 个主要的有意义变量导致,而峰15 和峰18 是紫苏叶指纹图谱的所有色谱峰中峰面积最大的,其在不同产地紫苏叶中的差异性也较大,使紫苏叶被PCA 和聚类分析分成2 大类或聚为2 大类。
因此,从结果分析来看,峰15(芹菜素-7-O-二葡萄糖醛酸苷)、18(迷迭香酸)具有一定的特征性,可以作为不同产地紫苏叶的标志性差异性成分。另外,《中国药典》2020 年版规定紫苏子和紫苏梗的都是以迷迭香酸作为含量测定的指标性成分,但是,由于不同产地的紫苏的迷迭香酸含量差异较大,导致部分药材有可能会达不到其质量标准。此外,咖啡酸、阿魏酸、木犀草素等是否可以作为紫苏叶指标性成分有待考察,因此,还需要通过谱效关系来进一步确认。
由于中药化学表征不能关联其临床功效,往往需要通过药效学方法来对其质量进行评价,而药效学实验也存在实验步骤复杂、耗费大、难以定量等缺点,而通过选择直接关联功效的生物效价分析方法能很好弥补化学评价方法的不足,为中药的整体质量评价提供新的研究思路,生物效价检测也称为中药质量生物评价,生物效价可以较好地反映中药产品的整体活性,并关联中药功效,适用于化学物质基础不明确、常规理化方法难以评价其质量或不能反映其临床生物活性的中药及其制剂[29]。目前、由肖小河等团队开发了板蓝根、金银花、黄连、丹参、大黄、水蛭、附子、牛黄、地黄、荆芥、五味子等数十个中药品种的生物效价检测方法,但是紫苏叶的生物效价检测方法仍然有待完善[30]。
近年来研究表明,唇形科植物挥发油具有抗病毒活性,紫苏叶都具有一定的体外抗流感活性,因此,课题组基于流感病毒NA,应用中药质量生物评价的方法,首次构建了紫苏叶药材的抗病毒活性的生物效价测定方法,并测定不同产地批次的紫苏叶的抗流感病毒NA 活性的生物效价。15 批不同产地的紫苏叶样品均具有抗流感病毒活性,其生物效价为3.78~10.86 U/mg,不同批次间的效价的最大差值有将近3 倍,说明生物效价测定能很好地反应出不同产地紫苏叶的抗流感病毒NA 活性差异。此外,本实验采用底物荧光检测法来检测NA 体外活性,并按照生物效价检测的要求设计试验条件,建立的基于流感病毒NA 活性检测的紫苏叶质量生物效价检测方法具有稳定,可靠,快速、关联临床功效的特点,为紫苏叶的质量评价提供了参考依据,也可为其他中药的质量生物效价检测方法构建提供参考。
最后,本研究通过UPLC-Q-TOF-MS/MS 技术对紫苏叶的化学成分进行鉴定,得到47 个化学成分;液质联用分析对指纹图谱的定性分析提供了对照品的筛选范围,从而可以做到有的放矢,避免进行大海捞针式地匹配。
此外,这些成分中的咖啡酸、柠檬酸、木犀草苷、木犀草素等成分据文献报道可能具有抗病毒活性,这也为紫苏叶的抗病毒活性的药效物质筛选提供了方向。另外,本研究建立了紫苏叶HPLC 指纹图谱,标定了19 个色谱峰且通过对照品指认出6 个化学成分,分别是咖啡酸(峰6)、阿魏酸(峰12)、芹菜素-7-O-二葡萄糖醛酸苷(峰15)、野黄芩苷(峰16)、迷迭香酸(峰18)、木犀草素(峰19);通过研究紫苏叶对抗流感病毒NA 的方法,研究其抗病毒活性,采用GCA 方法研究了共有色谱峰与抗病毒活性之间的关系,发现各共有色谱峰与紫苏叶抗病毒活性均有不同程度的关联度(0.82~0.97),其中咖啡酸、阿魏酸、木犀草素的抗病毒药效关联度较强。
总之,本研究基于化学模式识别模式的指纹图谱技术,结合构建的紫苏叶的生物效价检测方法,综合评价了不同产地来源的紫苏药材的质量,将为紫苏叶的进一步开发利用提供依据。
利益冲突所有作者均声明不存在利益冲突

