曼地亚红豆杉NPR1 基因家族鉴定及表达模式分析
杜雨晴,袁菊红,王 旭,张恺恺,陈段芬,邱德有,杨艳芳*
1.中国林业科学研究院林业研究所,林木遗传育种国家重点实验室,国家林业局林木培育重点实验室,北京 100091
2.江西财经大学艺术学院 风景园林与植物资源研究所,江西 南昌 330032
3.河北农业大学园艺学院,河北 保定 071001
红豆杉Taxuswallichianavar.chinensis(Pilger)Florin 又称为紫杉、赤柏松,由于其能够提取天然抗癌药物紫杉醇而闻名于世。紫杉醇是高效的抗癌药物之一,它对多种癌症,如卵巢癌、乳腺癌、宫颈癌等的治疗有着明显的积极作用[1],同时也逐渐涉及到对胃癌、食道癌等癌症的治疗[2-3]。紫杉醇虽然广受欢迎,但是其在红豆杉中含量极低,且红豆杉生长极为缓慢,因此造成红豆杉野生资源遭受严重破坏。
水杨酸是植物抗病反应调控中的主要参与者,同时也响应植物参与的其它非生物胁迫。病程相关基因非表达子 1(non-expressor of pathogenesisrelated genes 1,NPR1)作为植物激素水杨酸信号通路调控的重要组成部分,在水杨酸参与的植物系统获得抗性(systemic acquired resistance,SAR)反应中起着重要的传递作用[4]。同时,它也可以通过作用于某些转录因子来诱导抗性基因的表达,从而激活植物的免疫系统,提高植物的抗性[5-6]。此外,有研究也证实NPR1 参与介导茉莉酸、乙烯、脱落酸等其他植物激素信号通路的交互作用[7-8]。
目前,NPR1 作为水杨酸信号通路重要调控因子已得到广泛研究,其作用机制已部分阐明。水杨酸通过改变细胞氧化还原势使得多聚体NPR1 蛋白解聚为单聚体进入细胞核[9-10],NPR1 在核内与其它转录因子互作,激活或增强防御基因的表达,从而启动多种防御反应[6,11]。同时,NPR1 蛋白可以通过磷酸化、泛素化等修饰展现出不同的稳定性与功能[12]。Liu 等[13]在拟南芥的基因组中发现了5个NPR1的同源基因,并且将它们分别命名为NPR2、NPR3、NPR4、NPR5和NPR6,之后Fu 等[14]发现AtNPR3/4 能够直接结合水杨酸发挥负调控作用,而Ding 等[15]则发现AtNPR1、AtNPR3/4 都可以直接与水杨酸相互作用,平行行使激活抗病基因的功能,协同激活免疫反应。随着NPR1及其同源基因和水杨酸相互调控机制逐步被揭示,NPR1 在调控水杨酸信号转导过程中的重要性逐渐被人们认识。
研究发现,除了茉莉酸甲酯(methyl jasmonate,MeJA)以外,水杨酸也会影响红豆杉中紫杉醇的生物合成,从而影响紫杉醇的含量[16]。然而,相关分子机制研究较为少见。本研究通过对曼地亚红豆杉Taxus×mediaRehder 的NPR1基因家族进行生物信息学以及表达模式分析,为进一步研究水杨酸调控红豆杉紫杉醇合成的分子机制提供理论依据,并为后续利用细胞工程和基因工程提高紫杉醇终产量奠定理论基础。
1 材料
曼地亚红豆杉3~5 年生小苗种植于中国林业科学研究院科研温室内,并经中国林业科学研究院林业研究所杨艳芳研究员鉴定确认为曼地亚红豆杉Taxus×mediaRehder。曼地亚红豆杉愈伤组织保存于中国林业科学院研究院林木遗传育种国家重点实验室,利用B5 培养基进行培养,28 d 继代1 次,培养条件为25 ℃,暗培养。转录组测序在安诺优达基因科技(北京)有限公司进行。
2 方法
2.1 TmNPR1 家族成员鉴定及筛选
从TAIR(https://www.arabidopsis.org/)数据库中获取拟南芥AtNPR1(AT1G64280.1)蛋白序列。将拟南芥AtNPR1 序列作为query,与课题组前期测序获得的曼地亚红豆杉全长转录组数据进行Tblastn 比对,E值<1×10−10,获得TmNPR1候选基因核苷酸序列。将所得到的核苷酸序列通过在线网 站 ORF Finder ( https://www.ncbi.nlm.nih.gov/orffinder/)来搜寻序列对应的完整开放阅读框(open reading frame,ORF),再通过CD-HIT 软件对NPR1候选基因的ORF 序列进行去冗余处理,调整cut-off 参数为0.90,最终获得TmNPR1s基因核苷酸序列。
2.2 TmNPR1 家族系统进化关系分析
利用DNAMAN 将所获得的TmNPR1s 氨基酸序列、拟南芥NPR1 氨基酸序列与中国红豆杉NPR1氨基酸序列[17]进行保守结构域的同源性比对。使用MEGA X 软件采用临接法(neighbor-joining,NJ)对所获得的 TmNPR1s 蛋白序列和其他植物的NPR1 蛋白序列(下载自Genbank 数据库与TAIR数据库)进行进化树的构建,bootstrap 为1 000 次重复,其他参数为默认值。利用iTOL(https://itol.embl.de/)在线网站对进化树进行美化。
2.3 TmNPR1 家族蛋白理化性质分析
使用 ExPaSy-ProtParam tool ( https://web.expasy.org/protparam/)网站对所获得的NPR1 蛋白序列的氨基酸数量(number of amino acids)、相对分子质量(molecular weight)、等电点(pI)、不稳定系数(instability index)、脂肪系数(aliphatic index)和总平均亲水性(grand average of hydropathicity,GRAVY)等理化性质进行分析。
2.4 TmNPR1 家族保守结构域与保守基序分析
利用NCBI 网站上的在线工具Batch CD-Search(https://www.ncbi.nlm.nih.gov/Structure/ cdd/wrpsb.cgi)对TmNPR1s基因的ORFs 进行保守结构域预测分析,随后将预测结果通过DNAMAN 和TBtoolsv1.108 软件进行可视化处理[18]。利用 MEME 在线网站( https://meme-suite.org/meme/tools/meme ) 对TmNPR1s 家族蛋白进行保守基序(Motif)分析[19],最大motif 检索数为10,其余为默认参数,将结果通过TBtoolsv1.108 软件进行可视化处理[17]。
2.5 TmNPR1s 基因表达模式分析
从NCBI 网站SRA 数据库中下载云南红豆杉不同组织(根、茎、叶)的转录组数据(SRP127697)、低温处理(0℃处理2~3 年生中国红豆杉幼苗12 h)后红豆杉的转录组数据(SRP096539)和MeJA处理(红豆杉愈伤组织分别经过MeJA 处理0、0.5、3、24 h)后的曼地亚红豆杉转录组数据(SRP133888),以及本课题组前期测得的冠菌素(coronatine,COR)处理(在曼地亚红豆杉的B5培养基中加入1 μmol/L COR,分别于0 h、4 h、12 h、48 h、4 d 和14 d 时收集愈伤组织)后的转录组数据[20]。
利用所获得的TmNPR1s序列分别与以上转录组数据进行Blastn 同源比对,一致性最高同源序列的FPKM 值即为不同处理下TmNPR1s的表达量,并利用GraphPad Prism 8 软件作图,进行基因差异表达分析。
3 结果与分析
3.1 TmNPR1 家族成员鉴定及其编码蛋白理化性质分析
本研究从曼地亚红豆杉全长转录组中鉴定出3个NPR1基因,通过Batch CD-Search 在线工具预测分析发现3 条NPR1 的蛋白序列均含有BTB_POZ结构域与AnK 保守域(图1),是典型的NPR1 家族蛋白。将鉴定到的3 条基因序列分别命名为TmNPR1~TmNPR3,以便后续分析。

图1 TmNPR1s 蛋白保守结构域预测Fig.1 Prediction of conserved domains of TmNPR1s proteins
对获得的3 个TmNPR1基因编码蛋白进行理化性质分析,如表1 所示,发现3 个NPR1 蛋白分别含有600、519 和658 个氨基酸残基;相对分子质量在65 020~75 170;3 个蛋白的等电点分别为5.86、5.56 和5.34,全部小于7,说明该家族蛋白全部偏酸性;不稳定系数为42.43~51.79,表明3 个蛋白均不稳定;脂肪系数80.56~93.72,都在80 以上,说明都为脂溶性蛋白;总平均亲水性分别为−0.201、−0.235 和−0.498,均为负值,表明3 个蛋白都为亲水蛋白。

表1 TmNPR1 家族成员理化性质分析Table 1 Physicochemical property analysis of TmNPR1 family members
3.2 TmNPR1 家族系统进化及多序列比对分析
本研究对包括3 个TmNPR1 蛋白在内的共32个NPR1 蛋白进行系统进化树构建。结果如图2 所示,这些NPR1 家族蛋白共分为3 个亚家族,分别为Clade Ⅰ(AtNPR1/2 subfamily)、Clade Ⅱ(AtNPR3/4 subfamily)和Clade Ⅲ(AtNPR5/6 subfamily)。在3个TmNPR1蛋白中,TmNPR1、TmNPR2聚在Clade II 亚家族,TmNPR3 聚在Clade III 亚家族。在拟南芥中,AtNPR5/6 被证明并没有参与免疫反应,但能够调控叶片与花的发育[21],TmNPR3 与AtNPR5/6聚类在一起,说明TmNPR3 可能对红豆杉植株生长形态起到调控作用。而TmNPR1/2 则与Clade II 类AtNPR3/4 蛋白亲缘关系较近,表明TmNPR1/2 可能具有与AtNPR3/4 蛋白相似的功能。
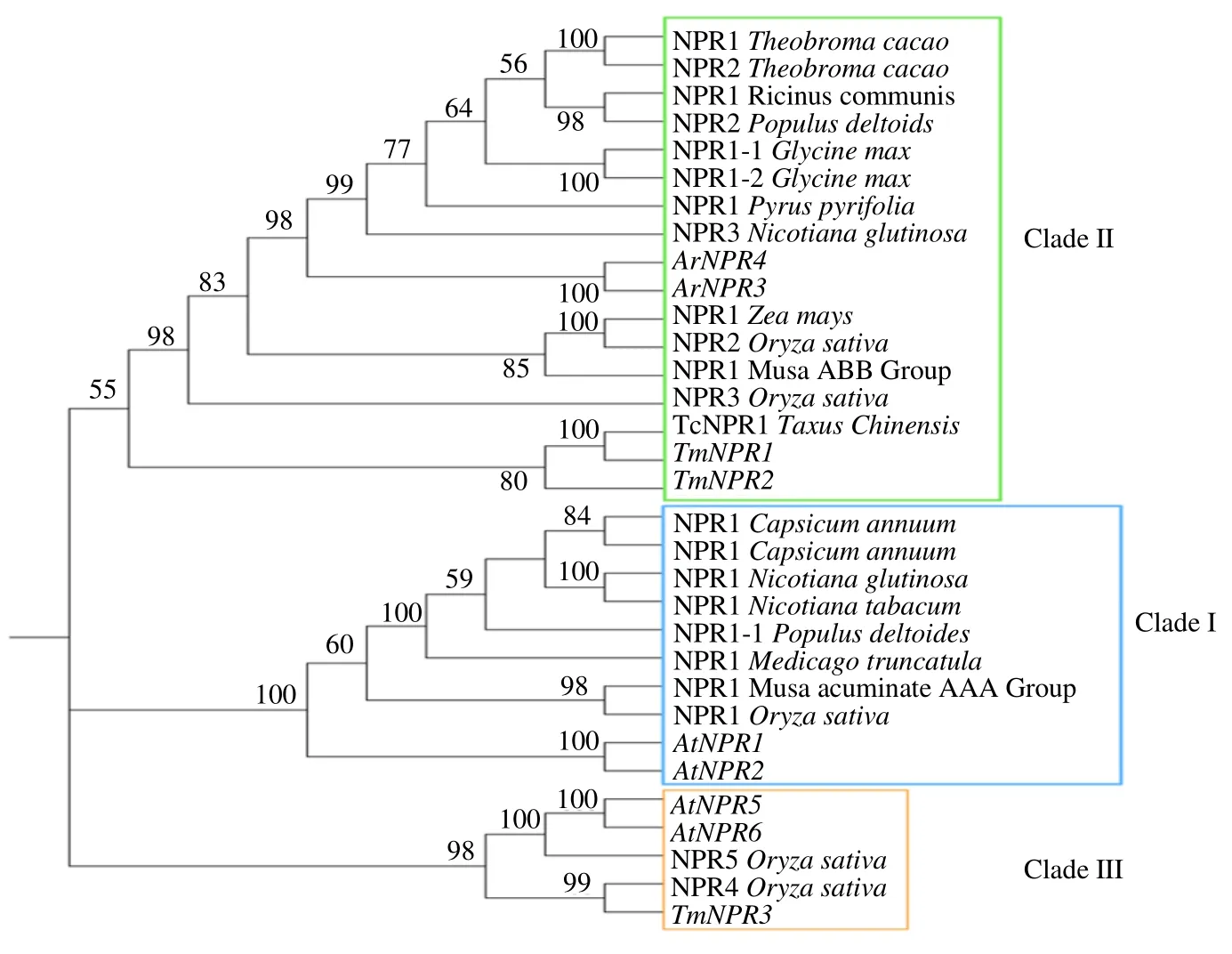
图2 不同植物NPR1 蛋白进化树分析Fig.2 Phylogenetic analysis of NPR1 proteins from different plant species
进一步对3 个TmNPR1 蛋白(TmNPR1-3)序列以及 6 个拟南芥 NPR1 蛋白序列(AtNPR1-6)、1 个中国红豆杉 NPR1 蛋白[17](TcNPR1)进行多序列对比分析,结果如图3 所示,所有序列均包含BTB_POZ 结构域和锚蛋白重复结构域AnK,这2 个结构域在红豆杉和拟南芥中较为保守,但TmNPR3 的BTB_POZ 结构域和AnK 保守域位置与其他序列相比有较大差异(图1);除AtNPR5/6 和TmNPR3 外,其余NPR1蛋白序列均包含NPR_like_C 区域。此外,在寡聚物-单体相互转变过程中发挥重要作用的3 个半胱氨酸残基(Cys82、Cys155 和 Cys216)在除TmNPR3 外的9 个NPR1 蛋白中完全保守。同时,TmNPR1、TcNPR1 和AtNPR3/4 还具有EAR 基序(VDLNETP),该基序在转录抑制方面发挥着重要的作用。

图3 曼地亚红豆杉及拟南芥NPR1 蛋白多序列比对Fig.3 Multiple sequence alignment of NPR1 proteins of Taxus × media and Arabipdosis thaliana
3.3 TmNPR1 家族蛋白保守基序分析
利用MEME 在线网站对3 个TmNPR1 蛋白以及拟南芥、中国红豆杉的NPR1 蛋白进行保守基序分析,结果如图4 所示。所有NPR1 蛋白均含有motif1、3、5,但TmNPR3 只含有这3 种motif,而且motif1、3 在TmNPR3 蛋白上的位置也与其他NPR1 蛋白存在较大差异。此外,除AtNPR5、6 与TmNPR3 外,剩余7 个NPR1 蛋白均含有motif1~10,AtNPR5、6 缺少motif6、7、9、10。同时,从图4 中还发现TmNPR1 与TcNPR1、AtNPR1与TmNPR2 具有极高的相似性,除去motif3、7、9在位置上有所偏移,其余motif 类型、数量以及位置几乎没有差别,TmNPR2 与TmNPR1、TcNPR1相比,也只是motif 位置有所不同,可见,在不同物种中NPR1 蛋白具有较高的保守性,但也存在motif 类型、数量以及位置等差异。

图4 红豆杉及拟南芥NPR1 蛋白保守基序分析Fig.4 Conservative motif analysis of NPR1 proteins of T.wallichiana var.chinensis and A.thaliana
3.4 TmNPR1s 基因不同组织表达模式分析
为进一步探讨3 个TmNPR1基因的表达特性,本研究同时利用转录组数据对红豆杉3 个组织(根、茎、叶)中TmNPR1~TmNPR3的表达模式进行分析。结果发现3 个基因具有组织表达特异性(图5)。在根中,TmNPR1的表达量最高;在茎中,TmNPR1表达量略高于其他2 个基因,但是明显低于该基因在根和叶中表达量;在针叶中,TmNPR1和TmNPR2表达量最高且两者非常相近,TmNPR3在针叶中表达量虽不及前2 个基因,但是比其在根和茎中的表达量相对较高。

图5 TmNPR1s 基因在曼地亚红豆杉不同组织的表达模式Fig.5 Expression pattern of TmNPR1s genes in different tissues of Taxus × media
3.5 TmNPR1s 基因在低温胁迫表达分析
本研究对低温处理下红豆杉植株中TmNPR1-3的表达水平也进行了检测。结果如图6 所示,3 个基因在正常温度下表达水平较为接近,但是在低温诱导(LT)后,TmNPR1基因的表达与对照(NT)相比显著提升,而TmNPR2和TmNPR3基因在低温处理后的表达发生了降低,且远低于TmNPR1的表达水平。
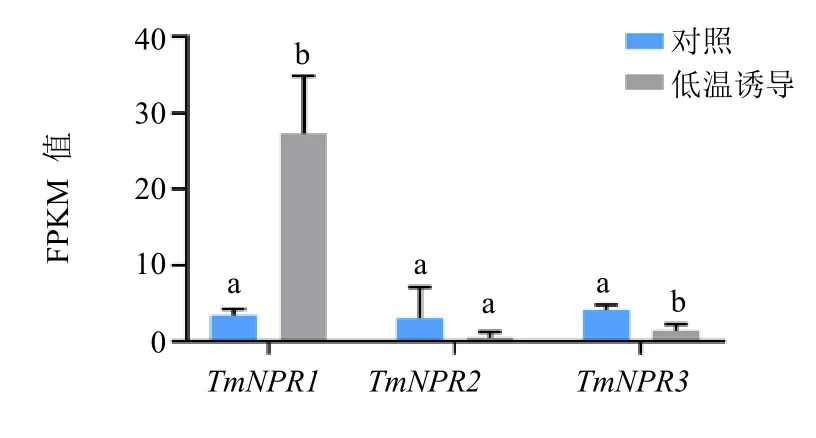
图6 TmNPR1s 基因冷胁迫下的表达模式Fig.6 Expression pattern of TmNPR1s genes under cold stress
3.6 TmNPR1s 基因在COR 和MeJA 处理下表达分析
如图7 所示,经过COR 处理后,TmNPR1表达量明显高于TmNPR2和TmNPR3,并且呈现随着处理时间的增加而升高进而再降低的趋势,在处理4 h 时达到最大值,在处理4 d 时表达量达到最低值,处理14 d 时表达量基本同对照持平。TmNPR2和TmNPR32 个基因在COR 处理后表达量变化幅度较小,这表明TmNPR1对COR 的处理响应更为积极。
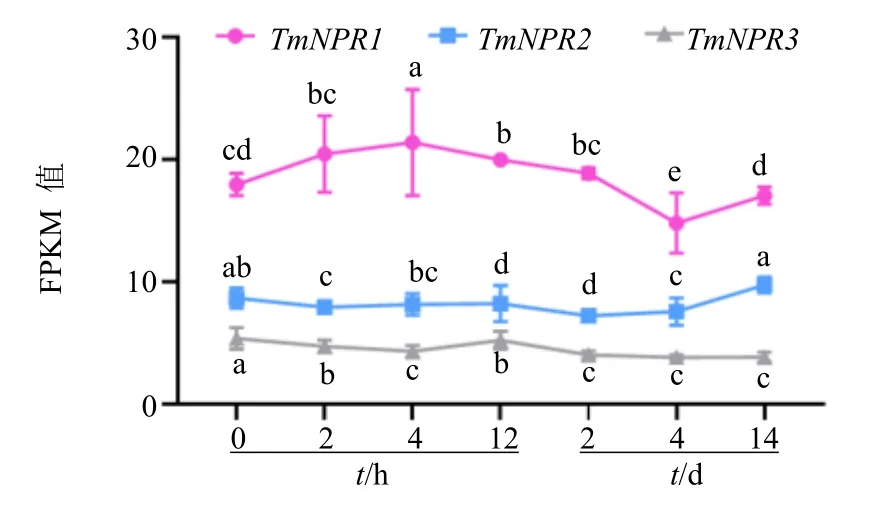
图7 TmNPR1s 基因在COR 处理下的表达模式Fig.7 Expression pattern of TmNPR1s genes under COR processing
本研究还对MeJA 处理下曼地亚红豆杉细胞系中TmNPR1s基因的表达水平进行了分析。结果如图8 所示,整体来看与COR 处理下结果相似,三者中,TmNPR1基因表达水平最高,TmNPR2和TmNPR3表达量较低,且2 个基因在处理后各个时间点表达量并没有显著变化。与COR 处理不同的是,在MeJA 处理后,TmNPR1基因在处理0~24 h呈现逐渐升高趋势,并在24 h 表达量最高。

图8 TmNPR1s 基因在MeJA 处理下的表达模式Fig.8 Expression pattern of TmNPR1s genes under MeJA processing
4 讨论
水杨酸是植物抗病反应中激活植物防御保护机制的信号分子[22],而NPR1 是水杨酸信号通路的重要调控因子,在植物中常常以家族形式存在,该基因家族在植物的抗病以及逆境胁迫响应等方面起着重要作用。本研究从曼地亚红豆杉全长转录组中筛选出3 个与拟南芥AtNPR1 同源性较高的NPR1基因,并发现其有2 个进化分枝,TmNPR1/2 与AtNPR3/4 聚为一类,TmNPR3 与AtNPR5/6 为一类,该实验结果和鳄梨Perseaamericana的研究结果类似[23],可以看出该家族基因在植物的进化种具有高度保守性。
拟南芥中NPR1 家族成员,结构十分相似,但是功能却相差甚远。尽管 AtNPR1 和AtNPR3/AtNPR4 都是水杨酸受体,但是它们在水杨酸诱导的防御基因表达的转录调控中起相反的作用。SA 通过抑制AtNPR4 的转录抑制活性和促进AtNPR1 的转录激活活性,从而激活关键免疫调节因子的表达[15]。本研究通过结构域分析,发现3 个TmNPR1 蛋白的N 端均含有BTB_POZ 结构域和AnK 保守域,但是 TmNPR3 的 C 端缺少NPR1_Like_C 结构域。Motif 分析结果也看出TmNPR3 与TmNPR1 和TmNPR2 结构上存在显著差异。此外,motif 分析结果显示,TmNPR1 和TmNPR2 与拟南芥的AtNPR1-3 不论从motif 数目还是位置上都一致,但进化树分析结果显示TmNPR1/2 与AtNPR3 聚在一起。Ding 等[15]发现AtNPR3 和 AtNPR4 蛋白含有 EAR 基序(VDLNETP),该基序在转录抑制方面发挥着重要的作用。多序列比对结果可以看出,TmNPR1/2 也具有EAR 基序。由此推测TmNPR1/2 更有可能与AtNPR3 的功能相似。上述结果也表明TmNPR1 家族既存在较高的保守性,同时,不同成员之间也很有可能存在功能特异性。
NPR1 家族成员还参与器官发育进程,研究发现拟南芥中的AtNPR5和AtNPR6基因,具有调控叶片及花器官生长发育的功能[21,24]。在本研究组织表达量分析中,TmNPR1家族基因成员TmNPR1/2在针叶和/或根中高表达,TmNPR3在针叶中相对表达量较高。该结果与棉花、小麦NPR1基因表达结果相似,具有典型的组织表达特异性[25-26]。此外,进化树分析结果显示TmNPR3 与AtNPR5/6 聚在一起,因此,TmNPR3极可能在曼地亚红豆杉中调控针叶的形成,同时TmNPR1/2也可能参与了根和针叶器官的发育。
NPR1 家族除了具有抗病以及影响器官发育的功能,还被证实与植物非生物胁迫相关。如在低温胁迫下,AtNPR1 与热休克转录因子1(recombinant heat shock transcription factor 1,HSFAI)相互作用,提高拟南芥的抗寒性[27]。在高粱中,SbNPR1基因在PEG6000 和NaCl 处理0.5 h 时表达达到高峰[28],可见其可能也与干旱和高盐胁迫有关。因此,本研究利用转录组数据对曼地亚红豆杉NPR1基因家族的表达模式进行分析,冷胁迫、COR 以及MeJA 处理的结果均显示TmNPR1表达量最高,TmNPR2在COR 处理14 d 表达量较高。可见,三者中,TmNPR1响应激素信号以及低温诱导,而TmNPR3极有可能不参与低温胁迫。此外,本研究中来自曼地亚红豆杉的TmNPR1 与前人报道的中国红豆杉的TcNPR1序列一致性达到88%,进化树分析也聚类在一起,推测两者为不同种红豆杉中的直系同源基因。研究发现TcNPR1强烈响应干旱和高盐逆境胁迫[17],本研究中TmNPR1也能响应低温胁迫,这表明红豆杉TmNPR1基因能响应多种非生物胁迫。
本研究从曼地亚红豆杉转录组中鉴定出3 个NPR1基因成员,发现TmNPR1家族基因编码的3个蛋白在N 端均具有典型的BTB_POZ 结构域和AnK 保守域,TmNPR1 家族有很大可能与其他植物的NPR1 蛋白功能相似。蛋白功能结构域分析结果预示着TmNPR1 家族成员之间可能存在功能的特异性。表达模式分析显示,3 个TmNPR1基因在红豆杉不同组织中和不同处理下的表达量各不相同,TmNPR1基因可能在红豆杉体内响应多种非生物胁迫,TmNPR3基因则极可能参与红豆杉针叶的形成。该研究为进一步探索红豆杉NPR1基因功能提供理论支撑,并为后续深入挖掘水杨酸调控红豆杉紫杉醇合成的分子机制提供理论依据。
利益冲突所有作者均声明不存在利益冲突

