地黄花叶病毒河南分离物的CP基因克隆及序列分析
冯陈尉, 李正刚, 郭 枭, 庄新建, 丁诗文, 董卓倬, 贺 振, 王铁霖, 张 坤*
(1. 扬州大学植物保护学院, 江苏扬州 225009; 2. 广东省农业科学院植物保护研究所, 广州 510640; 3. 广东省植物保护新技术重点实验室, 广州 510640; 4. 中国中医科学院中药资源中心, 北京 100700)
地黄(RehmanniaglutinosaLibosch.)又名地髓、生地等,因其地下块根呈黄白色而得名,为玄参科(Scrophulariaceae)地黄属(Rehmannia)多年生草本植物,最早记载于《神农本草经》中,被列为上品中药[1]。在田间生产中,连作和依靠块茎进行营养繁殖是导致地黄质量和产量下降的主要原因[2], 地黄花叶病、轮纹病等是地黄生长过程中的主要病害[3]。
我国最早在河南省报道了地黄花叶病毒 (rehmannia mosaic virus, ReMV)[4], 其为烟草花叶病毒属(Tobamovirus)成员[5], 是地黄生长过程中较易携带和传播的一种植物病毒,侵染后会引起地黄产量及质量降低[6]。目前在我国北京、山西、河南以及国外日本、韩国等地均有ReMV的报道[7]。侯红琴等[6]于2007年发现ReMV的粒子形态为杆状,经过机械摩擦能侵染茄科、十字花科等10多种植物,表现出枯萎及花叶等症状,且体外存活期长。雷彩燕[8]研究表明地黄花叶病毒基因组由6 395个核苷酸组成,含4个开放阅读框架(open reading frame, ORF), 分别编码126、183、30和17.5 ku蛋白质; 基因组5′末端和3′末端分别有71和204 nt的非编码区,其中外壳蛋白(coat protein,CP)基因起始于5 712 nt处,终止于6 191 nt处。本研究对河南焦作温县地黄种植园中疑似地黄花叶病毒病样品进行鉴定与分析,利用RT-PCR方法成功克隆出ReMV河南分离物的CP基因核苷酸序列,测序后与NCBI数据库中已有的核苷酸序列进行比对,分析该地区地黄花叶病毒基因的变异与进化情况,为地黄花叶病毒的鉴定、防治及致病机制的研究提供参考。
1 材料与方法
1.1 供试材料及主要试剂、仪器
1) 样品: 2019年夏,从河南省焦作市温县某中草药园内的地黄种植区内,采集具有叶片黄化、花叶、褪绿和坏死枯斑等典型病毒侵染症状的地黄样品22份,用干燥剂和液氮处理后于-80 ℃冰箱保存。
2) 试剂: RTase M-MLV、5×M-MLV Buffer、dNTP Mixture、Recombinat RNase Inhibitor [宝生物工程(大连)公司], ReMV的ELISA检测试剂盒(上海哈灵生物科技公司), DNA Marker、FastPure Gel DNA Extraction Mini Kit试剂盒、2×TaqMaster Mix、RNA-easyTMIsolation Reagent试剂盒、FastPure Gel DNA胶回收试剂盒等(南京诺唯赞生物科技公司), pMD19-T载体[擎科生物科技(南京)公司]。
3) 仪器: T100 Thermal Cycler PCR仪、凝胶成像系统[Bio-Rad(美国)公司], EPS 600凝胶电泳仪[天能科技(上海))公司], D3024R台式高速微量冷冻离心机[塞洛捷克科技(美国)公司], Research plus手动移液枪[艾本德科技 (德国) 公司], 无酶PCR管、离心管、枪头等[爱思进 (美国) 公司]。
1.2 试验方法
根据GenBank中发布的不同地区ReMV分离物的CP基因核苷酸序列,使用BioEdit、SnapGene软件设计引物,引物序列为CPReMV-F (5′-ATGTCTTATACAATTGCAACTCCAT-3′)和CPReMV-R (5′-TCAAGTTGCGGGACCAGAAG-3′)。引物由南京擎科生物科技公司合成。
1) 总RNA提取: 按文献[9]的方法进行,略加改进。取0.2 g疑似带毒地黄样品,液氮冷却后转入液氮预冷的1.5 mL离心管中,磨成粉末; 加入RNA提取液和RNA缓冲液各600 μL, 剧烈混匀,静置5 min, 涡旋振荡, 4 ℃下12 000 r·min-1离心20 min; 吸取上清,加入等量RNA提取液,混匀后于冰上静置, 4 ℃下12 000 r·min-1离心20 min; 吸取上清,加入等体积异丙醇, -20 ℃沉淀1 h, 4 ℃离心10 min; 弃去上清,加入70%乙醇1 mL, 4 ℃离心5 min; 弃去上清,加入100%乙醇1 mL, 4 ℃离心5 min; 真空抽干,溶于30 μL DEPC-H2O中备用。
2) 反转录: 取5 μL总RNA为模板,利用RTase M-MLV、5×M-MLV Buffer、dNTP Mixture、Recombinat RNase Inhibitor反转录试剂,合成cDNA.
3) PCR扩增: 以cDNA为模板,使用Phanta高保真酶进行PCR扩增,获得ReMVCP基因序列。50 μL PCR反应体系中, cDNA 1 μL, 正反引物各2 μL, Phanta Max Super-Fidelity 1 μL, dNTP Mix 1 μL, 2×Phanta Max Buffer 25 μL, ddH2O 18 μL。程序设置: 95 ℃预变性3 min; 95 ℃变性15 s, 53 ℃ 退火30 s, 72 ℃延伸1 min, 共28个循环; 72 ℃再延伸5 min, 25 ℃冷却1 min。
PCR产物经1%琼脂糖电泳检测后,使用FastPure Gel DNA Extraction Mini Kit试剂盒纯化回收,克隆至pMD19-T载体中,转化大肠杆菌DH5α菌株,随机挑选6个阳性单克隆送至上海生工生物工程公司测序,测序结果使用BioEdit、SnapGene、MEGA、DNAMAN等软件进行序列比对与分析,从NCBI中的BankIt (https://www.ncbi.nlm.nih.gov/WebSub/index.cgi)提交序列。所得序列使用NCBI中的BLAST程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)搜索相似性序列并下载所有已发布的地黄花叶病毒CP基因序列,使用BioEdit的ClustalW Multiple alignment功能进行所有CP基因核苷酸的序列比对,比对结果导入MEGA软件,利用Neighbor-Joining法构建系统进化树 (设置Boostrap为1 000)[10]。
2 结果与分析
2.1 地黄花叶病毒病株症状
通过观察、比较发现,健康地黄叶片翠绿,植株挺拔,整体长势好 (图1.A)。部分疑似感病的地黄植株长势与健康植株相对较弱,植株偏矮小; 叶缘变色,叶片有轻微黄化、褪绿和花叶症状; 下部叶片还伴有坏死斑出现,并有向上位叶发展的趋势; 新生叶片则无明显症状,仅在叶缘有零星花叶症状 (图1.A)。初步推断上述症状可能是病毒侵染所致。

图1 地黄疑似受病毒侵染后症状及分子鉴定图*Fig.1 Symptoms and molecular identification of R.glutinosa after suspected virus infection* A. 健康地黄与疑似感病地黄; B. CPReMVRT-PCR检测结果; C. CPReMV序列与GenBank登陆号。* A. healthy and suspected diseased R.glutinosa; B. detection of rehmannia mosaic virus in R.glutinosa samples by RT-PCR; C. the GenBank login number and sequence of CPReMV.
2.2 ReMV CP基因克隆
从NCBI数据库中下载所有已发布的不同地区ReMV分离物的CP基因核苷酸序列,通过SnapGene软件设计引物,进行RT-PCR检测。PCR扩增结果显示,本试验的4个地黄样品均检测出大小为480 bp的条带(图1.B), 与NCBI中公布的ReMVCP保守核苷酸序列大小一致。为获得更为准确的地黄花叶病毒河南分离物的CP基因序列,对PCR产物切胶回收并纯化,构建至pMD19-T载体中,转化入大肠杆菌DH5α, 随机挑选阳性单克隆测序。使用BioEdit处理测序结果,获得ReMV河南焦作分离物(建议命名为ReMV-JZ等)CP基因核苷酸序列。
2.3 ReMV CP基因序列比对分析
通过NCBI中的BankIt程序上传所得核苷酸序列,获得ReMV-JZCP的GenBank登录号为OM964874 (图1.C)。将所有已报道的9条ReMVCP基因与ReMV-JZCP基因核苷酸序列进行比对,发现ReMV-JZCP基因序列与来自美国的ReMV分离物的CP基因(登录号为MF348202.1)相似性最低为94.1%, 与来自韩国、日本以及我国山西、河南ReMV分离物的CP基因(登录号为MG418836.1、KU133476.1、JX575184.1、JQ285996.1、LC571586.1、EF375551.1、NC 009041.1)均达到97.9%。这说明ReMVCP序列较为保守,在遗传分化上地域差异不明显。
2.4 ReMV CP基因的系统发育进化树分析
ReMV河南焦作分离物的CP基因与我国河南郑州和山西分离物以及韩国分离物的亲缘关系较近,与日本分离物(登录号为AB6281881.1)和美国分离物(登录号为MF348202.1)亲缘关系较远(图2), 因此ReMV-JZ又与其他地区发现的分离物存在一定的遗传分化。
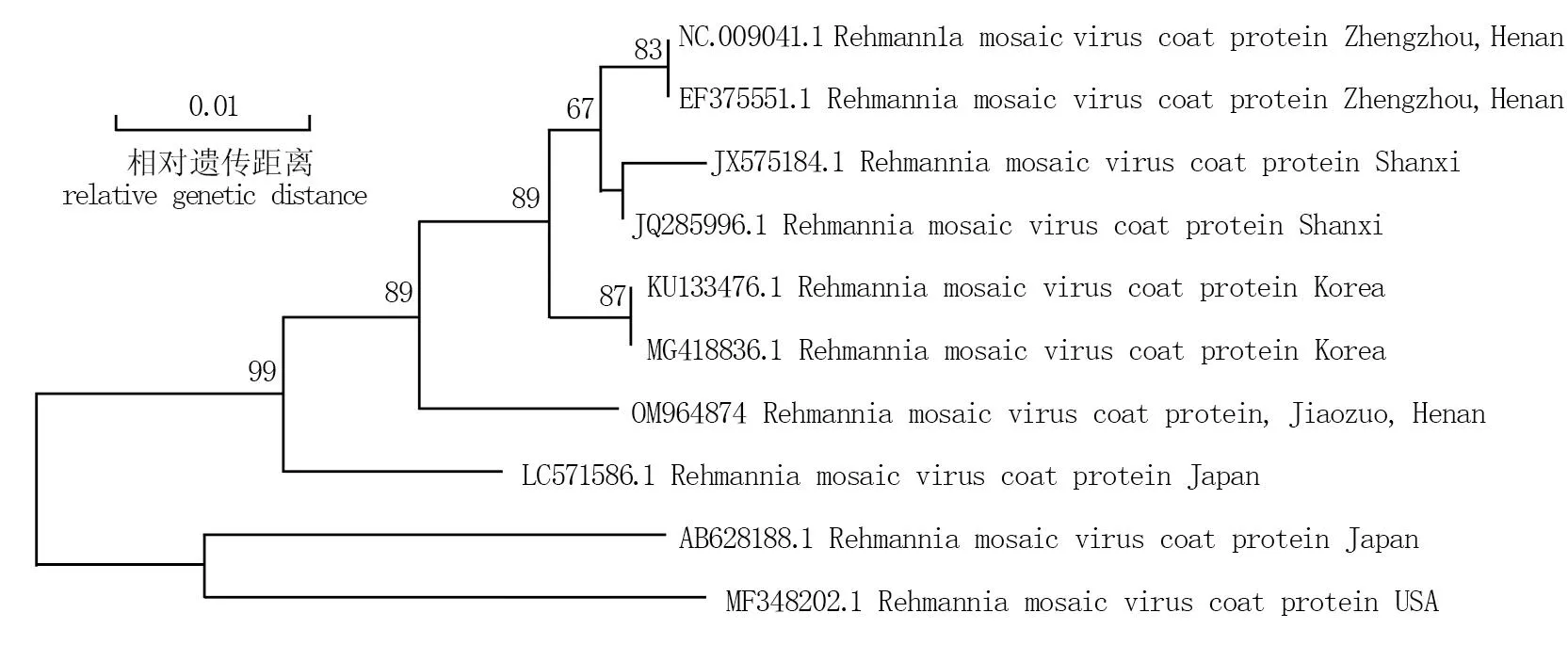
图2 基于CPReMV核苷酸序列构建的ReMV不同分离物的系统进化树*Fig.2 Phylogenetic tree of obtained CPReMV nucleotide sequences and other deposited sequences in NCBI* 图中节点处数字为重复1 000次所得到的自举百分率。* The number at the node shows the bootstrap percentage obtained by repeating 1 000 times in the figure.
2.5 ReMV CP的序列一致性分析
地黄花叶病毒河南焦作分离物(登录号为OM964874, 下同)与日本分离物(LC571586.1)、韩国分离物(MG418836.1、KU133476.1)、山西分离物(JQ285996.1、JX575184.1)、郑州分离物(NC_009041.1、EF37555.1)序列相似性较高,均在98%以上; 与美国分离物(MF348202.1)、日本分离物(AB628188.1)序列相似性仅为94%, 说明亲缘关系较远(图3)。该结果与系统发育进化树结果相一致。
3 讨论
地黄在世界多个国家均有种植,且随着地黄有效成分的不断开发利用,人们对地黄的需求量也日益增长。由于耕种制度与地理环境的不同,不同种植区内地黄遭受到多种不同病毒的影响。现阶段发现感染地黄的主要病毒类型有TMV、ToMV、ReMV、CMV、BBWV2、PVX、CIRV等[11-15]。
本研究于2019年夏从河南省焦作地区采集若干疑似受病毒侵染而呈现出花叶、枯萎等症状的地黄样品,利用RT-PCR检测确定了所采地黄样品被ReMV侵染,同时对河南温县地区ReMV的分子变异和遗传分化情况进行了调查研究,通过与国内河南郑州和山西地区,以及国外韩国、日本、美国报道的ReMV分离物CP基因进行序列比对及分析,结果表明不同地区间ReMV分离物的CP基因在亲缘关系上总体很接近,但随着地理距离的扩大也存在一定差异,这可能是不同地区的耕作制度、气候、环境等多种因素综合作用加速了病毒的进化与变异。本研究通过对ReMV的CP基因序列进行分析,为河南焦作地区ReMV的发生、分布、基因进化与变异分析及地黄病毒病防治,保障地黄产业安全生产提供了理论依据。
4 结论
结合前期高通量测序结果进行引物设计,通过RT-PCR技术成功克隆出地黄花叶病毒河南分离物的CP基因,结合NCBI中发布的地黄花叶病毒其他地区分离物的CP基因,构建了系统发育进化树,结果表明河南焦作分离物与山西、郑州及韩国分离物处于同一分支,其可能存在相同的传染源; 但与日本、美国分离物的亲缘关系较远,说明其又存在一定的遗传分化,这可能与其侵染了不同寄主有关,序列一致性分析与该结果相一致。该研究有助于加强对ReMV的防控,丰富了对ReMV基因组的研究,为后续针对ReMV的改造奠定了基础。

