儿童活动性狼疮性肾炎标准治疗早期和晚期应用贝利尤单抗对比观察
彭倩倩,杨焕丹,邱闪,陆倩
徐州医科大学附属徐州儿童医院肾内风湿免疫科,江苏徐州 221000
儿童系统性红斑狼疮(cSLE)是一种侵犯多脏器、多系统的慢性自身免疫性疾病,狼疮性肾炎(LN)是cSLE 最严重的并发症之一,与成人比受累程度更严重、病情进展更迅速,患儿预后更差[1-2]。经过积极的糖皮质激素(GC)、免疫抑制剂标准治疗,或者多靶点治疗,可改善LN 患儿预后,但仍有高达30%的患儿进展为终末期肾脏病[3]。维持期多出现病情反复,长期使用大剂量糖皮质激素及免疫抑制剂,会增加股骨头坏死风险、机会感染几率、不孕不育风险等[4]。近几年针对SLE 新型生物靶向药物的应运而生,极大改善预后。贝利尤单抗(BLM)是一种重组人IgG1λ 单克隆抗体,可与可溶性B 细胞活化因子(BAFF)结合,抑制B 细胞的存活和分化,促进自身反应性细胞凋亡,减少自身抗体数量,从而达到治疗SLE 的目的[5-6]。近年来,生物靶向治疗结合标准治疗,已经在成人LN 中取得一定的疗效,但BLM 在活动性LN 患儿中的应用,以及何时应用可取得更为有效的效果鲜有报道。本研究分别于标准治疗0.65(0.50~1.00)个月以及标准治疗6(6.00~7.25)个月后静滴BLM 治疗儿童活动性LN,比较两时间点静滴BLM 治疗的效果。
1 资料与方法
1.1 临床资料 选取2018 年5 月—2022 年12 月徐州市儿童医院收治的活动性LN 患儿22 例,男5例,女17 例;年龄7~16(11.83 ± 2.54)岁;肾脏病理类型:Ⅲ + Ⅴ型1 例、Ⅳ型11 例、Ⅳ + Ⅴ型6 例、Ⅴ型3 例、膜增生性肾小球肾炎1 例。儿童SLE 诊断标准:采用1997 年ACR 修订的SLE 诊断标准[7]或2019 年EULAR/ACR 对SLE 的分类标准[8]。儿童LN 的诊断标准:采用2016 年中华医学会儿科分会狼疮性肾炎诊治指南标准[9]。LN 完全缓解:尿蛋白/肌酐比值<0.2 mg/mg,或24 h 尿蛋白定量<150 mg,镜检尿红细胞不明显,肾功能正常或接近正常(肾小球滤过率达到正常值 ± 10%);部分缓解:尿蛋白降低>50%,非肾病范围,血肌酐( ± 25%)或改善,但未达正常水平。纳入标准:①6~18 岁符合儿童LN 的诊断标准;②肾脏病理类型为Ⅲ型及以上;③初始治疗的患儿及标准治疗6月后仍未缓解的患儿;④完成32 w 以上的随访。排除标准:①目前有活动性肝炎、结核、EB 病毒感染;②合并感染尚未控制;③肾功能异常正在接受血浆置换等肾脏替代治疗;④合并其他因素导致肾脏损害,如合并TMA;⑤对BLM 及其辅料中的任何成分过敏、不耐受或禁忌者;⑥疗效不可评估或疗效不详;⑦随访<32 w 患儿。22 例儿童活动性LN 患儿按照BLM 治疗时间不同分为早期组(12例)和晚期组(10 例)。两组一般资料无统计学差异,具有可比性。本研究通过医学伦理委员会批准(2023-05-07-H07),且患者知情同意。
1.2 BLM 静滴方法 两组均采用标准治疗,早期组于标准治疗0.65(0.50~1.00)个月后应用BLM治疗,晚期组于标准治疗6(6.00~7.25)个月后应用BLM 治疗。①硫酸羟氯喹、血管紧张素转换酶抑制剂应用及标准治疗方法:两组患者均予口服硫酸羟氯喹(4~5 mg/d,最大量0.4 g/d,晨起顿服)及血管紧张素转换酶抑制剂[0.25~0.3 mg/(kg·d),最大量10 mg/d,晨起顿服]和标准治疗[10]。标准治疗为诱导期和维持期治疗,根据不同病理类型选择不同的诱导方案,诱导期治疗疗程6 个月。a. Ⅲ型、Ⅳ型和非单纯Ⅴ型(Ⅲ + Ⅴ或Ⅳ + Ⅴ型):甲强龙冲击[20 mg/(kg·d),3 d,最大量1 g/d],冲击后GC 维持[1~2 mg/(kg·d),最大量60 mg/d,晨起顿服,10 d~2 周减5 mg],联合静脉环磷酰胺(CTX)冲击治疗[10 mg/(kg·d),2 d,每2 周1 次,累及量150~168 mg/kg]或吗替麦考酚酯分散片[MMF,20~30 mg/(kg·d),每12 小时口服,最大量2 g/d];b. 单纯Ⅴ型:醋酸泼尼松[1~2 mg/(kg·d),最大量60 mg/d,晨起顿服,10 d~2 周减5 mg]联合他克莫司胶囊[FK506,0.05~1 mg/(kg·d),每12小时口服1 次,最大量3 mg/d,血药浓度维持5~10 ng/mL]或MMF(剂量及次数同上)。诱导缓解后给予维持治疗,维持期治疗:GC(2.5~5 mg/d,晨起顿服)联合MMF[10~20 mg/(kg·d),最大量2 g,每12 小时口服],维持治疗最少3 a。诱导期早期组采用MMF 治疗7 例(58.3%)、CTX 冲击治疗5例(41.67%),晚期组采用MMF 治疗5 例(50%)、CTX 冲击治疗3 例(30%)、FK506 治疗2 例(20%)。②BLM 静滴方法:每次10 mg/kg,最大量600 mg,每2 周1 次连续3 次后每4 周1 次连续7次,共用10 次。
1.3 观察指标及观察方法 分别收集两组患儿BLM 靶向治疗0、4、8、12、24、32 w 的晨尿及24 h 尿液,分别取5 mL 进行离心操作(3 000 r/min),离心5 min 后,分别取上清液,采用免疫比浊法检测尿微量白蛋白,邻苯三酚红钼法检测24 h尿蛋白定量,检测设备选用美国贝克曼IMMAGE800 全自动免疫分析仪。收集两组患儿治疗0、4、8、12、24、32 w 的空腹外周静脉血2 mL,以3 000 r/min 速度离心,离心5 min 后,取血清,采用散射免疫法检测血清Alb、C3、C4、Cr、IgG[11-12]。另收集两组患儿治疗0、4、8、12、24、32 w 外周静脉血2 mL,采用流式细胞仪测算CD19+B 细胞计数[13]。记录观察两组患儿不同时间点SLE疾病活动度计数(SLEDAI)2000评分[无活动(0~4 分),轻度活动(5~9 分)、中度活动(10~14分)、重度活动(≥15分)[14]]及糖皮质激素用量。
1.4 统计学方法 采用SPSS26.0 统计软件。符合正态分布的计量资料以±s表示,比较采用t检验或多因素方差分析;计数资料比较Fisher's确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗不同时点尿微量白蛋白、24 h尿蛋白定量比较 治疗不同时点尿微量白蛋白、24 h 尿蛋白定量比较见表1。
表1 两组治疗不同时点尿微量白蛋白、24 h尿蛋白定量比较(± s)
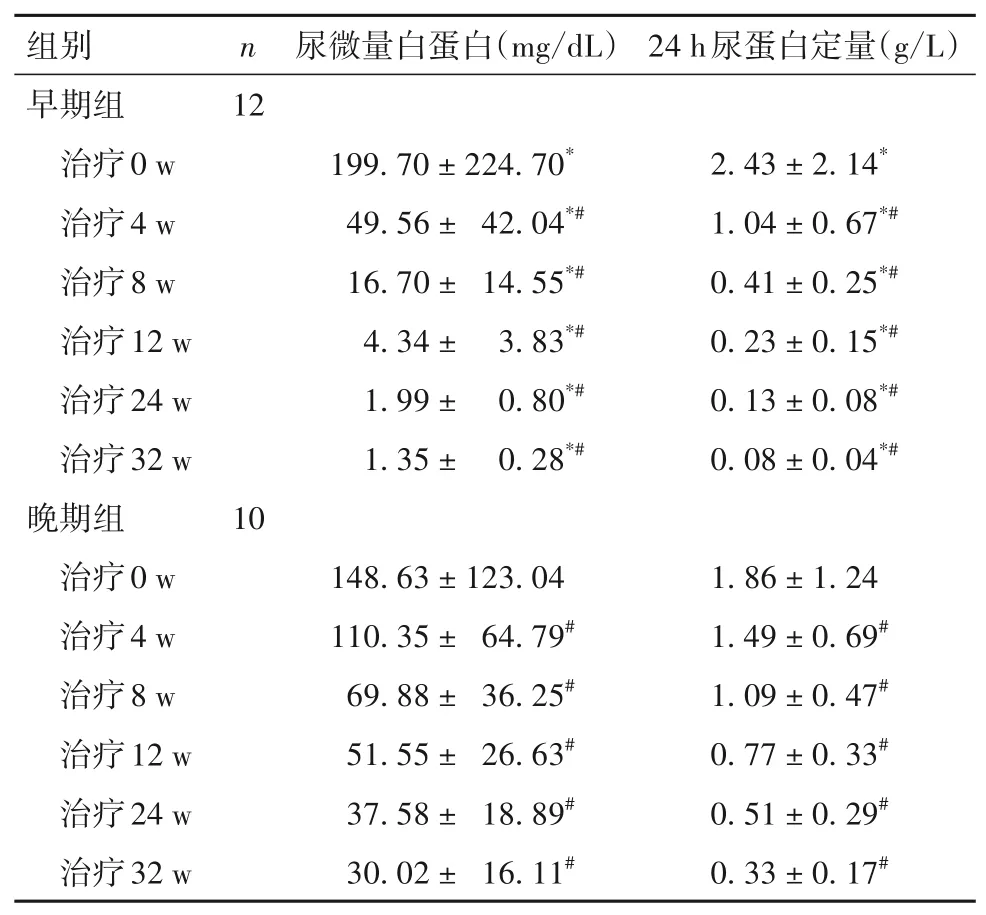
表1 两组治疗不同时点尿微量白蛋白、24 h尿蛋白定量比较(± s)
注:与晚期组比较,*P<0.05;与同组治疗0 w比较,#P<0.05。
?
2.2 两组治疗不同时点血清学指标、CD19+B 细胞计数、SLEDAI-2K 活动评分比较 治疗不同时点血清学指标、CD19+B 细胞计数、SLEDAI-2K 活动评分比较见表2。
表2 两组治疗不同时点血清学指标、CD19 + B细胞计数、SLEDAI-2K活动评分比较(± s)
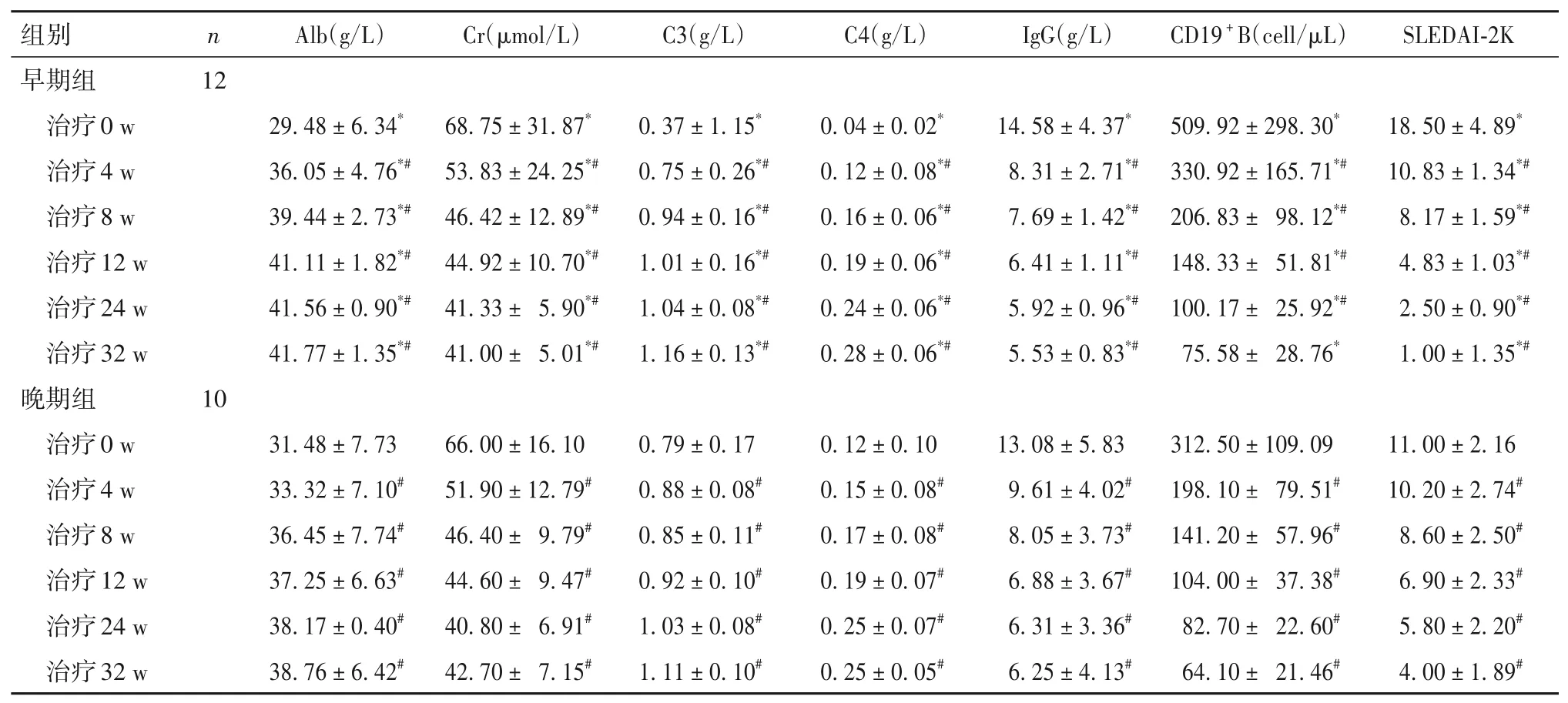
表2 两组治疗不同时点血清学指标、CD19 + B细胞计数、SLEDAI-2K活动评分比较(± s)
注:与晚期组比较,*P<0.05;与同组治疗0 w比较,#P<0.05。
?
2.3 两组GC 剂量比较 早期组治疗0 w 使用GC 1~2 mg/(kg·d) 12 例、0.5~1 mg/(kg·d) 0 例、0.25~0.5 mg/(kg·d) 0 例、7.5~5 mg/(d) 0 例、2.5~5 mg/(d) 0 例,治疗4 w 分别为12、0、0、0、0例,治疗8 w 分别为0、8、4、0、0 例,治疗12 w 分别为0、2、10、0、0例,治疗24 w分别为0、0、0、8、4例,治疗32 w 分别为0、0、0、0、12例;晚期组治疗0 w 使用GC 1~2 mg/(kg·d) 0 例、0.5~1 mg/(kg·d) 6 例、0.25~0.5 mg/(kg·d) 4例、7.5~5 mg/(kg·d) 0例、2.5~5 mg/(kg·d) 0 例,治疗4 w 分别为0、6、4、0、0例,治疗8 w 分别为0、5、5、0、0 例,治疗12 w 分别为0、4、6、0、0 例,治疗24 w 分别为0、0、3、7、0 例,治疗32 w 分别为0、0、0、0、10 例;同组治疗4、8、12、24、32 w 与治疗0 w 比较,两组间治疗0、4、24、32 w 比较,P均<0.05。
2.4 两组不良反应比较 两组患儿治疗期间均无过敏反应,肾功能均无恶化,均未继发机会感染。
3 讨论
SLE 是一种多系统受累的自身免疫病,cSLE病情更重,临床表现高度异质性、复杂多样,临床诊断及治疗相较于成人更为复杂,且容易出现最重要脏器损害,累及肾脏时成为LN,肾脏损伤的程度可影响SLE 的预后[15]。儿童LN 临床表现多样化,可从无症状性蛋白尿到急进性肾炎的各种临床表现。早期及时诊断及积极治疗可避免肾脏早期炎症反应进展为硬化性病变,减少肾脏不可逆的损伤。而活动期增殖性LN 作为儿童LN 中最常见且较严重的类型,虽然近几年糖皮质激素联合免疫抑制剂标准治疗可改善LN的预后[16],但现今临床诊疗中发现长期大剂量使用有较显著的药物毒性,如性腺损害、股骨坏死、代谢及继发感染等不良反应,同时儿童LN存在高度异质性,以肾脏病理类型为依据制定的标准治疗中患儿对药物临床反应存在差异性,复发率较高,导致SLE 患儿病死率增加[17-19],治疗上存在棘手。在儿童LN 治疗中更好的保护肾功能和减少标准治疗药物毒性的方法尚未得到满足。
随着对LN 发病机制的深入研究[20],B 细胞的刺激成熟在肾脏损伤中发挥重要作用,BLM特异性抑制BAFF 减少成熟B 细胞的生成,达到治疗LN 的目的。一项前瞻性随机对照研究(BLISS-LN)[21]证明,标准治疗基础上加用BLM联合治疗成人活动性LN,可减少尿蛋白及增加肾脏缓解率,可快速减少糖皮质激素剂量。因此,对于提高LN 患儿治疗效果及减少药物剂量的联合策略提供机会。目前大多数研究证实,BLM 在治疗LN 的有效性和安全性,但在儿童LN不同时间点应用鲜有报道。本研究显示,初始组治疗8 w 后尿微量白蛋白及24 h 尿蛋白定量降低至轻度蛋白尿;晚期组在治疗24 w 后24 h尿蛋白定量0.5 g 左右。与曾萍等[22]报道的BLM 在治疗中国儿童SLE 疗效分析中对于BLM在治疗LN 中比传统治疗有优势相一致。可能与LN 患儿早期肾脏病理炎症反应重,早期标准治疗联合BLM 积极治疗可快速控制炎症反应,缩短缓解时间,而病程长未达标患儿肾脏病理可能发生改变,出现肾小球硬化和或肾小管间质纤维化等慢性表现[23-24],但加用BLM 治疗后尿蛋白也有不同程度下降,增加肾脏缓解率[25]。本研究显示,LN 患儿诱导期早期加用BLM 积极治疗尿蛋白可尽快达标,而对于诱导治疗后未达标患儿加用BLM 强化治疗后可改善蛋白尿。但本研究中未达标患儿未重复肾活检,样本少,需进一步扩大样本探讨BLM 对不同肾脏病理类型的疗效。研究[26]证实,自身免疫功能紊乱,B细胞过度增生,产生大量抗体导致SLE 的发生,大量免疫复合物沉积肾脏激活补体导致LN 的发生,因此对于LN 治疗反应还需评估患儿的免疫功能及SLE 整体活动度。本研究同时观察BLM在治疗LN 的血清学指标,早期组治疗8 w 后血清Alb、C3、C4 及IgG 均在正常范围内,SLEDAI-2K 评分由重度活动[(18.50 ± 4.89)分]降至轻度活动[(8.17 ± 1.59)分],提示标准治疗联合BLM 早期治疗可明显改善患儿的血清学指标,在改善低蛋白血症、低补体状态、高免疫球蛋白血症及降低疾病活动度方面疗效显著。同时两组患儿在BLM 治疗12 w 后CD19+B 细胞计数明显下降,32 w 后IgG 有轻度下降,但期间患儿均无继发机会感染表现。可能BLM 降低自身免疫相关B 细胞,主要是早期发育阶段的B 淋巴细胞,尤其对幼稚B 细胞具有快速抑制作用,而对浆细胞影响不大[27]。GC 巨大的抗炎及免疫抑制作用使其在SLE 及LN 的治疗中始终处于一线药物的地位,然而其长期应用的不良反应已经超过疾病本身的损伤。本研究中早期组联合BLM 治疗24 w 后GC 顺利减量至≤7.5 mg/d,差异有统计学意义。提示早期标准治疗联合BLM 治疗可助减GC 早期达到最小剂量。晚期组中有6例GC 30 mg/d,4 例GC 15 mg/d,由于肾脏损害重,激素减量后病情反复,加用BLM 治疗后病情逐渐缓解的情况下获得了GC 逐渐减量至7.5 mg/d。提示对于标准治疗诱导期未达标尽快联合BLM 的强化治疗可助减GC 剂量。与文献[28-29]研究结果一致。
总之,LN 患儿标准治疗联合早期静滴BLM治疗疗效肯定,可明显减轻蛋白尿及改善免疫学指标,尽快达标,同时可明显减少GC 用量;晚期静滴BLM 治疗,虽不如早期应用效果,但有助于稳定患儿病情,延缓肾脏病变的进展。

