人OC细胞系细胞miR-211-5p表达、转染miR-211-5p模拟物后的增殖及迁移侵袭和EMT观察
杨立芬,何建清,尹立新
1 唐山市妇幼保健院妇产科,河北唐山 063000;2 唐山市南湖医院外科
卵巢癌(OC)是世界上最常见的妇科恶性肿瘤之一,早期患者经治疗预后相对较好,但由于早期诊断准确率较低,大多数患者明确诊断时已经处于晚期,因此病死率较高[1]。近年来,虽然在包括手术、放化疗在内的OC 治疗取得了巨大进展,但OC 患者的5年生存率仍不能令人满意[2]。因此,迫切需要探索OC 发病进展的分子机制,寻找潜在的治疗靶点,以提高晚期OC 患者的生存率。SKOV3、A2780、HO8910 细胞是人OC 细胞系,为目前较常见的应用于OC 实验研究的细胞株,其中SKOV3 是从一位OC患者的腹腔积液分离得到,广泛应用于OC 的细胞学功能研究。研究[3-4]显示,miRNA 的异常表达、分布与许多疾病的发病及进展密切相关,miRNA 的发现被认为给肿瘤治疗带来更好的前景。微小RNA-211-5p(miR-211-5p)是近年发现的与癌症相关的miRNA 家族成员之一,其在许多恶性肿瘤组织和细胞中表达降低,发挥抑癌基因作用[5]。但至今miR-211-5p在OC中的研究甚少,且机制尚不明确。2022年6—12 月,我们观察了人OC 细胞系细胞miR-211-5p 表达,以及转染miR-211-5p 模拟物(miR-211-5p mimics)后的增殖及迁移侵袭和上皮间质转化(EMT)。
1 材料与方法
1.1 细胞系及主要试剂 人OC 细胞系SKOV3、A2780、HO8910 细胞及人正常卵巢上皮IOSE80 细胞购自美国ATCC 公司。TRIzol 抽取试剂购自美国Invitrogen 公司;Prime ScriptTM逆转录试剂盒、SYBR Green Master Mix 试剂盒购自日本TAKARA 公司;Transwell 小室购自美国Corning 公司;基质胶购自美国BD 公司;所有PCR 引物、miR-211-5p mimics、miR-NC、壳多糖酶3 样蛋白1(CHI3L1)-wt、CHI3L1-mut购自上海吉玛制药公司;Lipofectamine 3000脂质体转染试剂购自美国Thermo 公司;双荧光素酶检测试剂盒购自美国Promega公司;CHI3L1、E-Cadherin、N-cadherin、Fibronectin、GAPDH 一抗及二抗IgG 购自美国Santa Cruz公司。
1.2 SKOV3、A2780、HO8910、IOSE80 细胞中miR-211-5p 检测 SKOV3、A2780、HO8910、IOSE80 细胞均在含10%胎牛血清(FBS)的DMEM/F12培养基中培养(37 ℃、95%湿度、5%CO2环境),待细胞融合度为70%~80%时,应用胰蛋白酶消化细胞,取传3 代的对数生长期细胞用于后续实验。采用qRT-PCR技术检测细胞miR-211-5p。用TRIzol 试剂提取SKOV3、A2780、HO8910、IOSE80 细胞总RNA,分光光度计检测RNA 质量和浓度复合要求,应用Prime-ScriptTM逆转录试剂盒将RNA 逆转录合成cDNA。以合成的cDNA 为模板,加入相关引物,应用SYBR Green Master Mix 试剂盒配置反应体系,进行扩增反应并检测。PCR 引物序列如下:miR-211-5p 上游序列:5'-CTCGAGTAACCGTATTGTTCGCGTCATGCCAGCA-3',下游序列:5'-GCGGCCGCCAGACCATGTGTCCCATTTG-3';U6 上游序列:5'-CTCGCTTCGGCAGCACA-3',下游序列:5'-AACGCTTCACGAATTTGCGT-3'。PCR 反应条件:95 ℃、30 s,95 ℃、5 s,60 ℃、30 s,一共进行40 个循环。U6 作为内参基因,以2-ΔΔCt法计算miR-211-5p 的表达水平。选择miR-211-5p 表达水平最低的OC 细胞系进行后续转染实验。
1.3 SKOV3 细胞分组、转染及转染效率检测 取对数生长期的SKOV3 细胞,接种于6 孔板,细胞密度为1×104个/孔,根据转染物的不同分为高表达组和对照组,高表达组SKOV3 细胞应用Lipofectamine 3000 脂质体转染试剂将miR-211-5p 模拟物miR-211-5p mimics转染至细胞中,对照组应用Lipofectamine 3000 脂质体转染试剂将阴性对照miRNC 转染至细胞中,转染后6 h 更换培养液,转染后24 h 收集细胞,qRT-PCR 法检测各组细胞中miR-211-5p 水平,确定miR-211-5p 模拟物转染效率。高表达组和对照组细胞中miR-211-5p 的表达水平分别为3.58 ± 0.29、1.01 ± 0.03,高表达组细胞中miR-211-5p 的表达水平明显高于对照组(P<0.05),证明miR-211-5p 模拟物转染效率较高,细胞符合后续实验要求。
1.4 转染miR-211-5p 模拟物的SKOV3 细胞增殖活性检测 采用CCK-8 实验。将SKOV3 细胞按照“1.3”所述方法分组及转染24 h 后,收集两组SKOV3 细胞,以5×103个/孔的细胞密度均匀接种于96 孔板,继续培养每隔24 h 向每孔加入10 μL 的CCK-8 溶液,继续孵育2 h 后,用酶标仪测定450 nm处的光密度(OD)值。细胞增殖活性以OD值表示。
1.5 转染miR-211-5p 模拟物的SKOV3 细胞迁移能力检测 采用细胞划痕实验。将SKOV3 细胞按照“1.3”所述方法分组及转染24 h 后,收集两组SKOV3 细胞,无血清培养基制备细胞悬液,各组取等量细胞接种至6 孔板,继续培养细胞至铺满整个细胞板孔面,用规格200 μL 的无菌移液枪头垂直于细胞板自上而下做“1”字形直线划痕,PBS 将因划掉的细胞冲洗干净,加入无血清细胞培养基同样条件下继续培养24 h,显微镜下观察并计算细胞移动距离百分比,细胞移动距离百分比=(0 h 划痕间距-24 h 划痕间距)/0 h 划痕间距×100%。细胞迁移能力以细胞划痕移动距离百分比表示。
1.6 转染miR-211-5p 模拟物的SKOV3 细胞侵袭能力检测 采用Transwell 侵袭实验。将SKOV3 细胞按照“1.3”所述方法分组及转染24 h 后,收集两组SKOV3 细胞,无血清细胞培养基重悬细胞,制备细胞密度为1×105个/mL的细胞悬液,将含20%胎牛血清的细胞培养基加入Transwell 下室,在预先包被Mgtrigel 基质胶的Transwell 上室中加入300 μL 两组细胞悬液,继续常规培养24 h后取出小室,去除小室膜上表面的未侵入细胞,4%甲醛固定小室膜下表面的侵入细胞,结晶紫溶液染色细胞,倒置高倍显微镜下观察并计数侵入细胞的数。细胞侵袭能力以侵入细胞数表示。
1.7 转染miR-211-5p 模拟物的SKOV3 细胞CHI3L1 及EMT 相关蛋白检测 采用Western blotting 法检测。将SKOV3 细胞按照“1.3”所述方法分组及转染24 h 后,收集两组SKOV3 细胞,RIPA 裂解细胞并提取细胞总蛋白,BCA 法检测蛋白浓度。蛋白样品行SDS-PAGE电泳(120 V,90 min),将蛋白质电转至PVDF 膜上(50 V,120 min),将膜放置于含5%脱脂奶粉的封闭液中封闭1 h,然后加入CHI3L1抗体(1︰1 000 稀释)、E-Cadherin 抗体(1︰2 000 稀释)、N-Cadherin 抗体(1︰2 000 稀释)、Fibronectin 抗体(1︰2 000 稀释)、GAPDH 抗体(1︰10 000 稀释),4 ℃孵育过夜,洗膜后加入二抗IgG,室温继续孵育1 h,ECL 发光、显影,拍照,Gel-Pro Analyzer 凝胶图像处理软件分析蛋白条带的灰度值。蛋白的表达水平以灰度值比值表示。
1.8 miR-211-5p与CHI3L1负向调控靶向匹配关系验证 采用双荧光素酶报告基因实验。将SKOV3细胞种于96 孔细胞板上,应用Lipofectamine 3000 脂质体转染试剂将miR-211-5p mimics 或miR-NC 与CHI3L1 野生型双荧光素酶报告载体CHI3L1-wt 或CHI3L1 突变型双荧光素酶报告载体CHI3L1-mut 共转染入SKOV3 细胞,转染后细胞分为miR-211-5p mimics + CHI3L1-wt 组、miR-NC + CHI3L1-wt 组、miR-211-5p mimics + CHI3L1-mut 组、miR-NC +CHI3L1-mut 组,转染24 h 后收集并裂解细胞,应用荧光素酶试剂盒检测各组细胞的荧光素酶活性。
1.9 统计学方法 采用SPSS22.0 统计软件。符合正态分布的计量资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 人OC细胞系及正常卵巢上皮细胞miR-211-5p相对表达量比较 SKOV3、A2780、HO8910、IOSE80细胞miR-211-5p 相对表达量分别为0.56 ± 0.11、0.68± 0.13、0.64 ± 0.09、1.04 ± 0.05,SKOV3、A2780、HO8910 细胞分别与IOSE80 细胞比较(P均<0.05)。人OC 细胞系中SKOV3 细胞miR-211-5p 表达水平最低,因此选择SKOV3 细胞进行后续实验研究。
2.2 两组不同时点细胞OD 值比较 不同时点细胞OD值比较见表1。
表1 两组不同时点细胞OD值比较(± s)
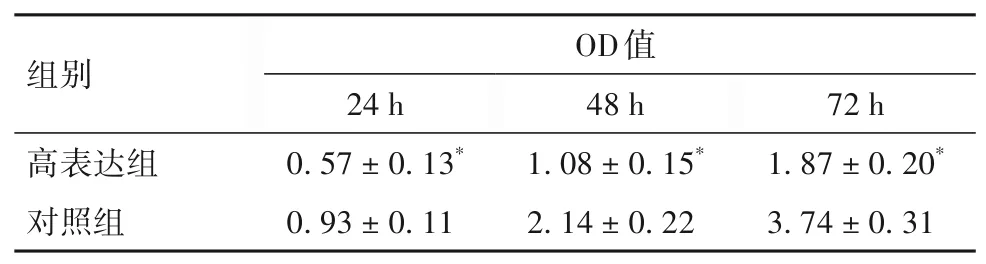
表1 两组不同时点细胞OD值比较(± s)
注:与对照组比较,*P<0.05。
?
2.3 两组细胞移动距离百分比比较 高表达组和对照组细胞移动距离百分比分别为52.4% ± 3.9%、83.6% ± 3.7%,两组比较,P<0.05。
2.4 两组侵入细胞数比较 高表达组和对照组侵入细胞数分别为(126 ± 21)个、(268 ± 39)个,两组比较,P<0.05。
2.5 两组EMT 相关蛋白灰度值比值比较 EMT 相关蛋白灰度值比值比较见表2。
表2 两组EMT相关蛋白灰度值比值比较(± s)

表2 两组EMT相关蛋白灰度值比值比较(± s)
注:与对照组比较,*P<0.05。
?
2.6 miR-211-5p对CHI3L1的靶向匹配关系验证结果 高表达组和对照组SKOV3 细胞中CHI3L1 蛋白表达水平分别为0.33 ± 0.08、0.68 ± 0.11,两组比较,P<0.05。miR-211-5p mimics + CHI3L1-wt 组、miR-NC + CHI3L1-wt组、miR-211-5p mimics + CHI3L1-mut组、miR-NC + CHI3L1-mut 组细胞相对荧光素酶活性分别为0.44 ± 0.08、0.98 ± 0.04、0.99 ± 0.03、1.02 ± 0.04,miR-211-5p mimics + CHI3L1-wt 组和miR-NC + CHI3L1-wt组比较,P<0.05。
3 讨论
OC是全球女性相关死亡的主要原因之一,常见于50 岁以上的女性,其发病率在妇科恶性肿瘤中排名第4,病死率在妇科癌症中排名第二,并且近年来其发病率有上升趋势,是目前世界范围内严重影响女性健康和生命的常见妇科恶性肿瘤。手术、化疗和放疗是目前OC 最常见的传统治疗方法,但由于OC早期缺乏特异性症状,很多患者确诊时已经处于晚期,目前的诊疗方法效果较差,患者预后不能令人满意。SKOV3、A2780、HO8910 细胞是目前较常应用于OC 实验研究的细胞株,其中SKOV3 是从一位OC 患者的腹腔积液分离得到,是良好转染宿主细胞,适合OC 的细胞学功能研究。OC 的发生和进展是一个复杂而渐进的过程,与基因突变和信号通路异常等多种因素有关。随着基础和临床研究的进展,人们对OC 的发展和进展机制有了更深入的了解,但近几十年来OC 患者的生存和预后并没有明显改善。因此,OC患者的治疗仍然是一个重大的临床挑战,尚需要在分子水平上对肿瘤发生和新疗法进行进一步研究。
miRNA 是一种长度为20~22 个核苷酸非编码单链RNA,在进化上具有高度保守性,能够调控下游靶基因的翻译或转录,可以调节细胞分化、凋亡和增殖等生命活动,参与机体的生理病理活动[6]。近年来越来越多的转录组学和基因组学研究证据表明,miRNA 的异常表达与OC 肿瘤发生之间存在相关性[7]。DIRIMTEKIN 等[8]报道,miR-34a 可能作为提高OC 早期诊断效率的潜在生物学标志物,并且过表达miR-34a 可能通过靶向FOXP1 来抑制OC 的发病及进展。miR-590-5p 被发现通过靶向hMSH2基因促进OC 对顺铂的耐药性[9]。miR-211-5p 是近期发现的肿瘤相关miRNA 家族重要成员之一,研究发现其在膀胱癌[10]、肾癌[11]、甲状腺癌[12]、肝细胞癌[13]等多种恶性肿瘤中均表达异常,可能参与肿瘤的发生进展。近年来研究[14-15]显示,miR-211-5p 在调控恶性肿瘤EMT 过程中发挥着重要作用。EMT过程是上皮细胞丧失上皮特性,获得间充质表型的过程,是肿瘤细胞获得生长及转移等肿瘤恶性表型的关键过程,为恶性肿瘤发生进展的重要环节[16]。并且近期研究发现,miR-211-5p 能够靶向调控CHI3L1 基因表达从而调节肿瘤细胞的生物学行为[17]。CHI3L1 是一种分泌型糖蛋白,位于人1 号染色体q32 的高度保守区域。近期研究[18-20]表明,CHI3L1在包括OC在内的众多肿瘤中表达异常高表达,并且其高表达与患者转移、化疗药物抵抗及不良预后有关。LIN 等[21]发现OC 患者CHI3L1 高表达与患者的不良结局和化疗耐药性相关,CHI3L1显著增强OC 细胞的干细胞特性。较多的既往研究及本课题组前期研究结果已证实,抑制CHI3L1表达能够抑制OC 细胞的增殖、迁移、侵袭、EMT 及肿瘤血管生成[22-24]。从以上研究结果可以看出,miR-211-5p 在多种肿瘤发生和发展过程中调控着肿瘤细胞的生物学功能,而且其对肿瘤细胞的生物学功能的调控可能与靶向调控CHI3L1有关。但至今,miR-211-5p在OC中的研究较少,并且作用机制尚不清楚。
本研究显示,miR-211-5p 在SKOV3、A2780、HO8910 细胞中的表达水平明显低于IOSE80 细胞,提示miR-211-5p 可能在OC 的发生发展过程中起着抑癌基因的作用;本研究还发现,上调SKOV3 细胞miR-211-5p 表达后,细胞增殖、迁移、侵袭能力均被明显抑制,进一步说明miR-211-5p 作为抑癌基因在OC 的发生发展过程中发挥作用;上调SKOV3 细胞miR-211-5p 表达后,SKOV3 细胞上皮源性标志物E-Cadherin 蛋白的表达明显升高,而间质源性标志物N-Cadherin 和Fibronectin 蛋白的表达水平明显降低,说明高表达miR-211-5p 能抑制SKOV3 细胞的EMT过程;进一步发现,上调SKOV3细胞miR-211-5p表达后,SKOV3 细胞中CHI3L1 蛋白的表达明显降低;miR-211-5p可以与CHI3L1的3'UTR 区特异性结合从而使其荧光素酶活性明显降低,证明miR-211-5p对CHI3L1 存在靶向调控关系;提示miR-211-5p对SKOV3 细胞增殖、迁移、侵袭及EMT 等肿瘤生物学特性的影响,可能与其对CHI3L1基因的靶向调控有关。
总之,miR-211-5p 在OC 细胞系中表达降低,高表达miR-211-5p 可抑制SKOV3 增殖、迁移、侵袭及EMT,其机制是通过负向调控CHI3L1表达实现的。

