不同供磷水平对香花油茶幼苗生理和叶绿素荧光特性的影响
余振东,吕 琪,马锦林,陈昱宇,谢伟东,莫维维,刘 凯
(1.广西大学 林学院,广西南宁 530004;2.广西壮族自治区林业科学研究院 广西特色经济林培育与利用重点实验室 广西油茶良种与栽培工程技术研究中心,广西南宁 530002)
磷是植物生长发育不可缺少的营养元素之一,它既是植物体内许多重要有机化合物的组分,同时又以多种方式参与植物体内各种代谢过程,磷缺乏或过量都会抑制植物的光合作用,影响植物生长[1]。石媛媛等[2]对广西油茶(Camelliaoleifera)林地的土壤肥力状况进行调查,发现土壤有效磷含量处于极低水平,磷是促进油茶果实膨大的重要元素,磷含量直接影响油茶的产量。
植物体内的过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、可溶性糖(SS)和可溶性蛋白(SP)等物质在逆境中会发生相应的变化。龚丝雨等[3]对烟草(Nicotianatabacum)的研究表明,当植物处于低磷胁迫时,烟草体内的SOD、POD 和CAT 活性显著增强,清除烟草受胁迫时产生的超氧自由基,维持细胞内外的氧化还原平衡,确保植物的正常生长;高乐等[4]研究表明,低磷胁迫可提高橡胶(Heveabrasiliensis)叶片MDA含量,引起叶片膜脂过氧化,通过提升CAT 和SOD活性可缓解叶片的膜脂过氧化。欧阳泽怡等[5]发现低磷胁迫使赤皮青冈(Cyclobalanopsisgilva)叶片可溶性蛋白合成受到抑制,细胞渗透调节能力下降,产生更多的MDA,刺激保护酶系统,清除自由基,削弱膜脂过氧化,进而降低植物体内MDA含量。孙小富等[6]发现低磷胁迫下宽叶雀稗(Paspalumwettsteinii)叶片SOD、POD和CAT活性均显著增强。
叶绿素荧光分析技术是研究植物光合特性与环境因子关系的探针,利用叶绿素荧光分析技术可以方便快捷地反映植物光合系统对光能的吸收和利用情况[7]。目前,有关植物在低磷胁迫下的叶绿素荧光特性响应机制已有报道。卫先伟等[8]发现低磷胁迫主要抑制紫花苜蓿(Medicagosativa)叶片受体侧及反应中心电子传递链性能,使光系统Ⅱ(PSⅡ)实际光化学量子效率(ΦPSⅡ)性能下降,光合电子传递受阻,最终导致生物量和磷利用效率降低;刘云等[9]研究发现山白兰(Paramicheliabaillonii)幼苗最大荧光(Fm)、最大光化学效率(Fv/Fm)及PSⅡ实际光化学效率Y (Ⅱ)均随磷水平降低而降低;袁继存等[10]发现苹果幼树叶片初始荧光(Fo)、Fm和可变荧光(Fv)在一定范围内随磷浓度升高而增加;叶思诚[11]研究表明,低磷胁迫使油茶叶片叶绿素含量、Fv/Fm和ΦPSⅡ下降。
香花油茶(Camelliaosmantha)是2012年在广西南宁被发现的山茶科(Theaceae)山茶属短柱茶组的1 个新物种,具有早熟、果量多、出籽率高和抗逆性强等特点,已逐步在广西、海南等地推广种植[12]。目前,针对香花油茶的研究主要集中在生物学特性[13]、种质评价与筛选[14]、抗逆性[15-17]、基因遗传[18]、苗木繁育[19]和综合利用[20]等方面。香花油茶主要栽培区多为热带、亚热带酸性土壤,土壤有效磷含量较低[2],是香花油茶生长的主要限制因子。本研究以香花油茶‘义禄’幼苗为试验材料,研究不同供磷水平对香花油茶幼苗生理指标和叶绿素荧光参数的影响,以了解香花油茶对磷胁迫的适应策略,为香花油茶的选育及推广提供理论依据。
1 材料与方法
1.1 试验地概况
试验地设在广西南宁市广西大学林学院苗圃(108°17′E,22°50′N),海拔84 m,属亚热带季风气候,年均气温21.8 ℃,冬季最冷月平均气温12.8 ℃;5—9月为雨季,其余时间为旱季,年均降水量1 304.2 mm,年均相对湿度80%;年均日照时长为1 501 h。
1.2 试验材料
2022年5月15日进行盆栽试验,材料为广西壮族自治区林业科学研究院育苗基地提供的长势良好、苗高和地径基本一致的2年生香花油茶‘义禄’幼苗。盆栽土壤基质由红壤土与河沙按照1∶1比例混合而成。红壤土有机质含量为21.46 g/kg,全氮含量为3.69 g/kg,全磷含量为0.18 g/kg,全钾含量为3.29 g/kg,速效氮含量为81.28×10-3g/kg,速效磷含量为0.66×10-3g/kg,速效钾含量为53.35×10-3g/kg。利用HH2 土壤水分速测仪(浙江托普云农科技股份有限公司)实时监测土壤水分含量。
1.3 方法
1.3.1 试验设计
采用塑料花盆种植香花油茶,塑料花盆规格为17.2 cm(直径)×17.3 cm(高);每盆装3.5 kg基质,底部垫托盘,防止肥料随水淋融流失。参照余平福等[21]的试验方法,以蒸馏水为对照(CK),设置1 个CK组(0 mg/kg))和3个不同供磷水平组(P1:4 mg/kg、P2:8 mg/kg和P3:16 mg/kg);使用KH2PO4作为磷源,除磷元素外,其他营养元素的浓度保持一致。每个处理3 个重复,每个重复5 株,共60 株。2022年6月,各处理组每隔7 天浇灌1 次150 mL 对应磷水平的Hoagland 营养液。试验期间,用蒸馏水保持土壤相对含水量为60%左右,以维持植物正常生长所需水分。培养90天后,测定各项指标。
1.3.2 指标测定
(a)叶绿素荧光特性测定:2022年9月15日,9:00~12:00 测定叶绿素荧光特性,每处理随机选取3 株植株,每株随机选择不同方向3 片成熟叶片(植株顶端第1 片叶片开始往下数第4~6 片叶片)。采用DUAL-PAM-2500(德国WALZ)测定叶绿素荧光参数;叶片测定前先暗适应20 min,测定Fo、Fm和Fv。采用活化光对黑暗处理的叶片进行光处理;在光适应状态下测量实际荧光产量(F'o)、最大荧光产量(F'm)、Y(Ⅱ)和电子传递效率(ETR)。根据测定参数计算Fv/Fm、光化学淬灭系数(qP)、ΦPSⅡ、非光化学猝灭系数(qN)。计算公式[22]为:
(b)生理指标测定:采集成熟叶片,用去离子水清洗干净,装入自封袋后迅速放入冷藏箱中,带回实验室,放入-80 ℃的超低温冰箱中冷藏,备用。采用核黄素-NBT 法测定SOD 活性;采用愈创木酚法测定POD 活性;采用紫外吸收法测定CAT 活性;采用硫代巴比妥酸法测定MDA含量;采用考马斯亮蓝G-250 染色法测定可溶性蛋白含量;采用蒽酮比色法测定可溶性糖含量[23-24]。
1.3.3 数据处理
采用Excel 2010 软件处理数据及绘制图表;采用Duncan's 新复极差法进行多重比较;采用隶属函数法[25]对各项指标进行综合分析。
隶属函数值计算公式为:
反隶属函数值计算公式为:
式中,U(Xi)为第X个因子的得分值;Xmax和Xmin为该指标最大和最小测定值。
指标与综合评判结果呈负相关,均使用公式(5)进行计算;指标与综合评判结果呈正相关,均使用公式(4)进行计算。
2 结果与分析
2.1 不同供磷水平对香花油茶幼苗叶片渗透物质的影响
不同供磷水平对可溶性糖含量影响不显著,对可溶性蛋白含量影响显著(P<0.05)(图1)。可溶性糖含量表现为P3 水平>P1 水平>CK>P2 水平。随供磷水平增加,可溶性蛋白含量呈波动变化,表现为P1水平>P3水平>CK>P2水平。
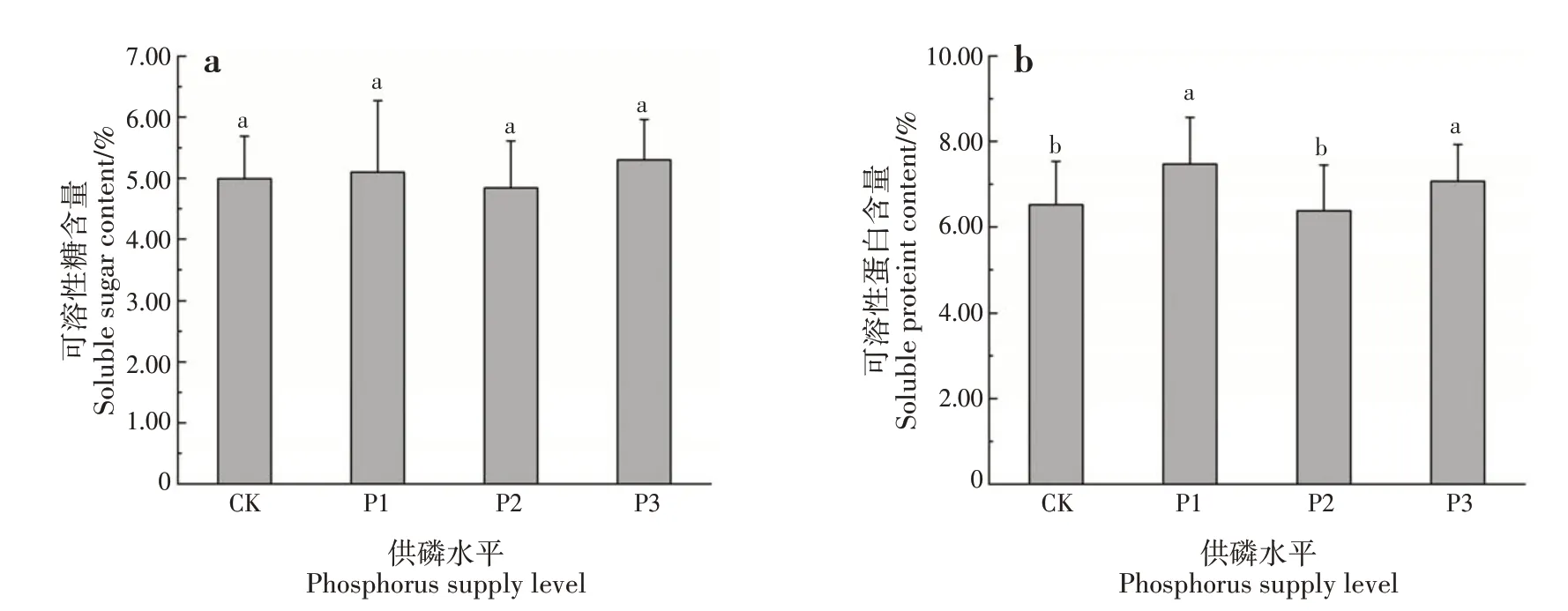
图1 不同供磷水平对香花油茶幼苗叶片渗透物质的影响Fig.1 Effects of different phosphorus supply levels on osmotic substances in leaves of C.osmantha seedlings
2.2 不同供磷水平对香花油茶幼苗叶片抗氧化酶活性及MDA含量的影响
不同供磷水平对SOD、POD 和CAT 活性及MDA含量均影响显著(P<0.05)(图2)。随供磷水平增加,SOD、POD 和CAT 活性均呈先升后降的趋势。SOD 活性表现为P1 水平>P2 水平>CK>P3 水平,P3水平下显著低于其他供磷水平;POD 活性表现为P2 水平>P3 水平>P1 水平>CK,P2 水平下显著高于CK 和P1 水平,P3 水平下显著高于CK;CAT 活性表现为P2水平>P1水平>CK>P3水平,P2水平下显著高于其他供磷水平;MDA 含量表现为P3 水平>P1 水平>CK>P2 水平,P2 水平下显著低于其他供磷水平,P3水平下显著高于其他供磷水平。
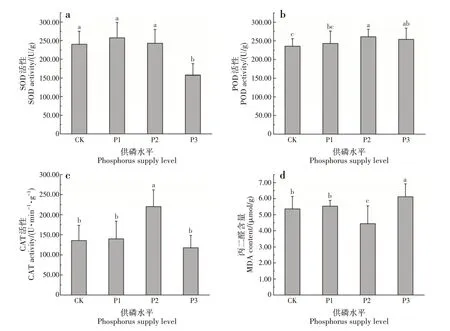
图2 不同供磷水平对香花油茶幼苗叶片抗氧化酶及MDA含量的影响Fig.2 Effects of different phosphorus supply levels on antioxidant enzymes and MDA contents in leaves of C.osmantha seedlings
2.3 不同供磷水平对香花油茶幼苗叶片叶绿素荧光参数的影响
随供磷水平增加,Fo、Fm、Fv和Fv/Fm均呈先升后降的趋势(表1)。Fo、Fm、Fv和Fv/Fm均表现为P2 水平>P1 水平>CK>P3 水平,P2 水平下显著高于其他供磷水平(P<0.05)。

表1 不同供磷水平对香花油茶幼苗叶片叶绿素荧光参数的影响Tab.1 Effects of different phosphorus supply levels on chlorophyll fluorescence parameters in leaves of C.osmantha seedlings
不同供磷水平对qP、qN、ETR和Y(Ⅱ)均影响显著(P<0.05)(表2)。qP表现为P2水平>P1水平>P3水平>CK,P2水平下最大(0.33),与CK和P3水平均差异显著。随供磷水平增加,qN呈先降后升的趋势,表现为P3水平>CK>P1水平>P2水平,P2水平下与其他供磷水平差异显著。随供磷水平升高,ETR和Y(Ⅱ)均呈先升后降的趋势,均表现为P2水平>P1水平>P3水平>CK,P2水平下ETR与其他供磷水平差异显著,Y(Ⅱ)与P3水平、CK差异显著。

表2 不同供磷水平对香花油茶幼苗叶片qP和qN的影响Tab.2 Effects of different phosphorus supply levels on qP and qN in leaves of C.osmantha seedlings
2.4 隶属函数综合分析
单项指标所得结果不同,不能反映不同供磷水平对香花油茶幼苗叶片生理及叶绿素荧光参数影响的总体情况,采用隶属函数法对香花油茶幼苗叶片各指标进行综合分析。不同供磷水平的隶属函数均值表现为P2 水平>P1 水平>P3 水平>CK,P2水平的隶属函数均值最大(0.85),CK 的隶属函数均值最小(0.22)(表3)。
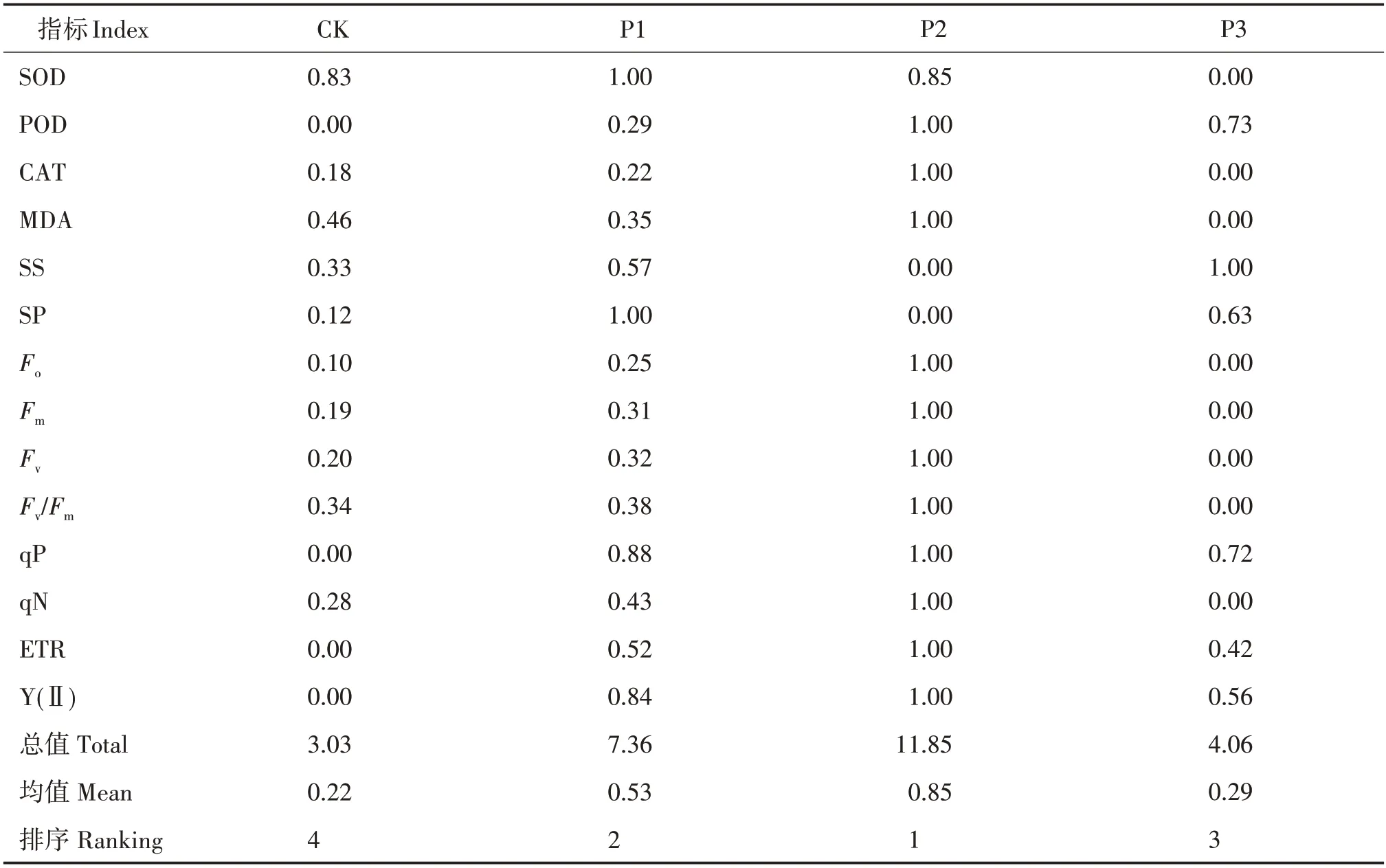
表3 香花油茶幼苗叶片各指标隶属函数值及综合评价Tab.3 Membership function values and comprehensive evaluation of different indexes in leaves of C.osmantha seedlings
3 讨论与结论
3.1 讨论
3.1.1 不同供磷水平对香花油茶幼苗叶片生理特性的影响
可溶性蛋白和可溶性糖含量的变化体现了植物抗逆性的强弱[26-27]。可溶性蛋白是重要的渗透调节物质和营养物质,其增加能提高细胞的保水能力;可溶性糖作为小分子物质参与渗透调节,其增加能提高细胞液浓度,降低水势[28]。本研究中,部分适宜的供磷水平下,可溶性糖和可溶性蛋白含量均增加,香花油茶幼苗抗逆能力增加。但在P2供磷水平下,可溶性糖和可溶性蛋白含量均较低,其原因有待进一步研究。
在逆境条件下,植物体内会产生大量活性氧,植物会通过提高抗氧化酶活性来分解活性氧以维持自身的正常代谢,其中主要包括SOD、CAT 和POD[29]。本研究中,3种抗氧化酶活性均随供磷水平增加呈先升后降的趋势,说明适当的供磷水平可提高香花油茶幼苗叶片的膜保护系统酶活性,有助于提高植株的抗性及对环境的适应性。在高磷环境中,SOD、POD 和CAT 活性均表现为下降趋势,说明磷水平过高时,会降低细胞清除和减少体内活性氧的能力。
MDA 是植物细胞膜脂过氧化的重要产物,其含量能体现细胞膜结构的损伤程度和膜脂过氧化水平[4]。本研究中,P1 供磷水平下,MDA 含量增加,说明香花油茶受到一定程度的胁迫,加快了植株叶片的膜脂过氧化反应的进程。P2供磷水平下,MDA含量最低。原因是POD、SOD 和CAT 活性均较高,清除较多体内活性氧,细胞膜结构损伤程度较小。P3供磷水平下,MDA 含量最高。原因是POD、SOD 和CAT活性均降低,体内活性氧增多,细胞膜结构损伤程度变大。
3.1.2 不同供磷水平对香花油茶幼苗叶片叶绿素荧光参数的影响
Fo、Fm和Fv等主要反映PSⅡ的光合电子传递速率和光化学活性,也是反映叶片光合能力强弱的重要指标[30]。本研究中,随供磷水平增加,各项叶绿素荧光参数均呈先升后降的趋势,P2 供磷水平下各指标均最高,说明适当的供磷水平下香花油茶幼苗体内电子传递较优,光能更好地被利用,促进光化学量子产额增加。
荧光猝灭即荧光产量下降的过程,分为光化学和非光化学猝灭两大类。qP 反映PSⅡ天线色素吸收光能用于光化学电子传递的份额,能够反映PSⅡ开放程度[31]。qN 反映PSⅡ天线色素吸收的光能不能用于光化学电子传递,以热的形式耗散掉的部分[31]。本研究中,CK 的qP 值最低、qN 值较大,表明缺磷会抑制香花油茶幼苗叶片PSⅡ光合电子传递活性;P2 水平时,qP 最大(0.33),qN 最小(0.54)。表明适宜的磷水平可促进叶片PSⅡ光合电子传递活性。
植物的ETR 反映植物吸收光能沿光合电子传递链的传递利用效率,很大程度上体现植物光合速率的大小[32]。Y(Ⅱ)可反映PSⅡ反应中心在有一部分关闭情况下的实际原初光能捕获效率,叶片不经过暗适应在光下直接测得,可作为体现植物光合电子传递速率快慢的相对指标[33]。本研究中,随供磷水平增加,ETR 和Y(Ⅱ)均呈先升后降的趋势;P2 水平时,ETR 最大(117.01),Y(Ⅱ)最大(0.21)。表明适宜的磷水平可促进叶片的光能捕获能力,并通过降低热耗散提高光合电子传递能力,提高叶片的光合性能。
3.2 结论
本研究对不同供磷水平下香花油茶幼苗生理和叶绿素荧光特性进行了初步研究,发现8 mg/kg供磷水平对香花油茶幼苗叶片的生理胁迫最低,幼苗光合能力最强,有利于幼苗生长发育。为更好地实现香花油茶推广引种工作,今后可针对香花油茶不同生长期、不同年龄阶段的生理特性及其生长发育、养分代谢和产量、品质等方面进行进一步研究。
利益冲突:所有作者声明无利益冲突。
作者贡献声明:余振东负责试验设计、指标测定、数据收集与分析和论文撰写;吕琪、陈昱宇和刘凯负责试验设计与调查;莫维维负责苗期管理、数据收集与分析;谢伟东、马锦林负责试验设计、数据收集和论文撰写指导与修改。

